Набор синтетических олигонуклеотидных проб для определения генотипа митохондриальной днк человека
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описан набор олигонуклеотидных проб для определения генотипа митохондриальной ДНК человека, характеризующийся тем, что данный набор позволяет определить генотип митохондриальной ДНК человека в 38 однонуклеотидных сайтах, расположенных в различных участках митохондриального генома и полиморфных в популяциях населения России различного этнического происхождения, с помощью метода ферментативного однонуклеотидного удлинения гибридизированной пробы, причем структура олигонуклеотидных проб учитывает вариабельность ДНК в близлежащих сайтах и группировку генотипируемых сайтов в 3 панели для мультиплексных реакций. 3 ил., 2 табл.
Реферат
Изобретение относится к области молекулярной генетики и может быть использовано для определения генотипа человека по совокупности однонуклеотидных полиморфизмов в митохондриальной ДНК с целью установления/исключения родства индивидов по материнской линии.
Полиморфизм митохондриальной ДНК (мтДНК) человека, обладающей высоким темпом мутирования и наследованием по материнской линии, широко изучается с целью решения задач популяционной и эволюционной генетики. В криминалистике митохондриальная ДНК используется чаще всего для установления вероятности родства индивидов по материнской линии или исключения такового. Преимущества мтДНК заключаются в большом числе ее копий в клетке (до нескольких тысяч, в отличие от дзух копий ядерных генов), вследствие чего генотипирование мтДНК возможно даже в образцах с высокой степенью деградации ДНК. В числе наиболее известных примеров идентификации личности с помощью изучения мтДНК - идентификация останков царской семьи Романовых [1].
В настоящее время для решения задач криминалистики и судебной медицины в нашей стране обычно проводят определение нуклеотидной последовательности только первого или первого и второго гипервариабельных сегментов (ГВС1 и ГВС2) главной некодирующей области мтДНК (D-петли) с помощью секвенирования. Данные участки, расположенные соответственно в 16024-16365 и 73-340 нуклеотидах, согласно нумерации референсной последовательности ДНК человека [2], отличаются наиболее высокой степенью полиморфизма. Существуют и этнические особенности полиморфизма этих участков. Тем не менее, их дискриминирующий потенциал не всегда оказывается достаточным для подтверждения или исключения родства: например, около 10% русских обладают последовательностью ГВС1, идентичной референсной последовательности, а около 10% тувинцев - последовательностью ГВС1, отличающейся от референсной по трем позициям (замены С16223Т, Т16298С, С16327Т) [3-4]. В целом, вероятность случайного совпадения последовательностей ГВС1 и ГВС2 у неродственных индивидов составляет 0,0234 для ГВС1, 0,0374 для ГВС2 и 0,0068 для объединенного генотипа ГВС1 и ГВС2 [5]. В то же время в остальной части мтДНК расположены полиморфные позиции, генотипирование которых может дифференцировать последовательности мтДНК, совпадающие в области ГВС1 [5-6].
Одним из подходов к мультиплексному генотипированию SNP в разных участках генома является мини-секвенирование (однонуклеотидное удлинение цепи): реакция, аналогичная полимеразной цепной реакции, в которой вместо дезоксинуклеозидтрифосфатов используются дидезоксинуклеозидтрифосфаты (это делает невозможным дальнейший синтез цепи). Располагая олигонуклеотидную пробу (праймер) непосредственно перед полиморфной позицией генома, можно затем определить, какой именно единственный нуклеотид присоединился к пробе. Способы детекции результатов мини-секвенирования могут различаться: это может быть детекция флюоресценции при твердофазном мини-секвенировании [7] или при капиллярном электрофорезе [8], а также масс-спектрометрия, основанная на различиях массы мономеров ДНК [9]. Для целей криминалистики наиболее часто используют метод, в котором генотипирование осуществляется по результатам регистрации флюоресценции в процессе капиллярного электрофореза - этот метод можно применять при наличии практически любого из массово производимых капиллярных ДНК-анализаторов. В основе метода лежит использование дидезоксинуклеотидов, меченых четырьмя различными флюоресцентными красителями, и олигонуклеотидных проб, различающихся по длине (это позволяет мультиплексировать реакцию). Существуют коммерческие наборы основных реагентов, позволяющие проводить этот анализ, используя наборы олигонуклеотидных проб, разработанных для конкретных задач. Технической задачей в этой области является разработка набора маркеров, подбираемых в зависимости от географической и этнической (популяционной) специфики населения территории, где планируется применение данного набора, а также подбор нуклеотидной последовательности используемых олигонуклеотидных проб, которые должны обеспечивать уверенное генотипирование и достаточное разделение продуктов реакции при капиллярном электрофорезе. В настоящее время имеются наборы полиморфизмов в мтДНК для этого метода, разработанные за рубежом, которые предназначены для исследования соответствующих популяций: например, населения Западной Европы [10-11] или Восточной Азии [12], в то время как население России имеет свою популяционную специфику полиморфизма мтДНК, которая заключается в высоком этническом разнообразии, наличии популяций как европеоидного, так и монголоидного и смешанного происхождения, а также распространенности специфичных именно для населения России линий мтДНК, особенно у представителей кавказских и сибирских этносов. Например, набор, предложенный в статье [13], позволяет определять лишь основные гаплогруппы; при этом он включает гаплогруппу Е, которая практически не встречается на территории России, не дифференцирует наиболее распространенные «европейские» гаплогруппы Н и U и не детектирует распространенные у коренных народностей Сибири гаплогруппы Y и Z. Набор полиморфизмов, предложенный в публикации [14], направлен на дифференциацию только гаплогруппы Н. Набор из 21 SNP, разработанный немецкими исследователями [11], определяет только те гаплогруппы, которые распространены в Западной Европе, и 18% исследованных образцов имеют одно и то же сочетание генотипов по исследованным сайтам. Генотипирование «азиатских» полиморфизмов в мтДНК было предложено китайскими исследователями [12] - набор содержит 23 SNP, характеризующих основные гаплогруппы, распространенные у населения Китая. Но в этот набор не входят SNP, определяющие гаплогруппы западноевразийского происхождения. Таким образом, наборы маркеров, используемые в зарубежных разработках, являются недостаточно информативными для населения России. В то же время отечественные разработки, использующие подход мультиплексного генотипирования однонуклеотидных полиморфизмов в мтДНК с помощью капиллярного электрофореза, фактически отсутствуют.
Новая техническая задача - подбор последовательности (структуры) олигонуклеотидных проб для генотипирования полиморфизмов мтДНК, выбранных с учетом этнической (популяционной) специфики населения России.
Данная задача решена путем разработки набора синтетических олигонуклеотидных проб для определения генотипа митохондриальной ДНК человека, который позволяет определить генотип митохондриальной ДНК человека в 38 однонуклеотидных сайтах, расположенных в различных участках митохондриального генома и полиморфных в популяциях населения России различного этнического происхождения, с помощью метода ферментативного однонуклеотидного удлинения гибридизированной пробы, причем структура олигонуклеотидных проб учитывает вариабельность ДНК в близлежащих сайтах и группировку генотипируемых сайтов в 3 панели для мультиплексных реакций.
Техническим результатом изобретения является повышение разрешающей способности митохондриальной ДНК при использовании в криминалистике. Применение разработанной системы маркеров позволяет в большинстве случаев дискриминировать индивидуальные мтДНК, имеющие одинаковую последовательность гипервариабельных сегментов D-петли, обычно используемых для криминалистики и установления родства.
Описание изобретения
Разработанный набор полиморфизмов мтДНК включает 38 сайтов, расположенных в различных участках митохондриального генома человека и обладающих минимум одной из следующих характеристик:
1) полиморфизм, маркирующий наиболее распространенные гаплогруппы мтДНК, характерные для населения России;
2) полиморфизм в гипервариабельных сайтах мтДНК, расположенных как в кодирующей, так и в некодирующей части мтДНК.
Выбор полиморфных сайтов проведен на основе анализа данных о популяционном полиморфизме мтДНК у населения России (собственные исследования и опубликованные данные). В качестве порогового значения популяционной частоты гаплогруппы мтДНК, т.е. минимального значения, при котором целесообразно введение полиморфизма в панель, было принято 5%.
Все полиморфизмы, исходя из ограничений возможностей мультиплексирования, организованы в 3 панели. Панель №1 содержит маркеры, определяющие «крупные» ветви филогенетического древа мтДНК и основные гаплогруппы (12 полиморфизмов). Панель №2 определяет генотип в гипервариабельных сайтах (12 полиморфизмов). Панель №3 генотипирует гаплогруппы и субгаплогруппы, наиболее распространенные на территории России (14 полиморфизмов).
Для каждой панели разработаны олигонуклеотидные пробы, структура которых учитывает следующие условия:
1) расчетная температура гибридизации пробы на матрицу (мтДНК) варьирует в пределах 55°C-60°C;
2) если известен популяционный полиморфизм, затрагивающий нуклеотиды, находящиеся в непосредственной близости от генотипируемого, разрабатываются дополнительные пробы, комплементарные вариантам последовательности, с целью обеспечить спефицичную гибридизацию в любом случае;
3) олигонуклеотидные пробы могут быть ориентированы как по прямой, так и по обратной цепи мтДНК;
4) длина проб, генотипирующих аналогичные нуклеотидные замены (например, A-G и G-A), должна различаться на несколько нуклеотидов, чтобы при анализе избежать перекрывания идентичных сигналов от разных полиморфизмов; различия в длине проб достигаются добавлением к последовательности пробы с 5'-конца повторяющейся некомплементарной последовательности "GACT";
5) Если пробы генотипируют различные нуклеотидные замены (например, A-G и С-Т), то их длина может быть одинаковой.
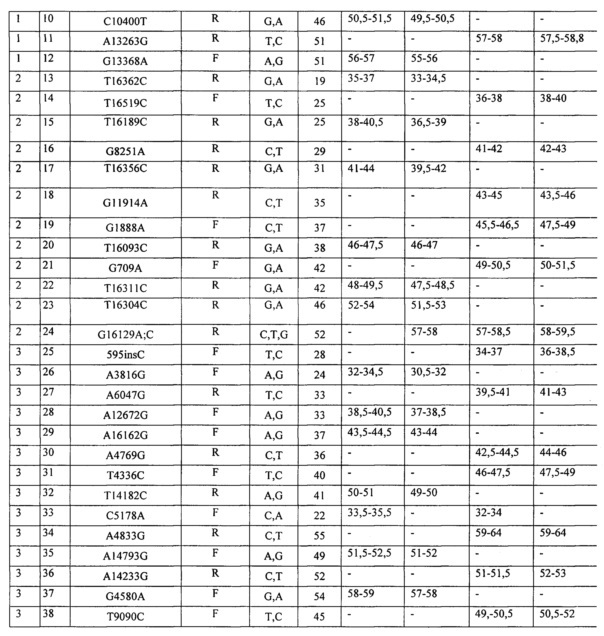
Структура разработанных олигонуклеотидных проб и их распределение по панелям представлены в таблице 1.
Для апробации набора было осуществлено генотипирование ДНК в двух выборках из популяций различного этнического происхождения: 60 русских и 65 хакасов. Кроме того, для этих образцов ДНК были также получены последовательности ГВС1 и ГВС2 мтДНК с целью сравнения дискриминирующей способности этих локусов с данной разработкой.
Генотипирование с помощью набора проб осуществляли по известному протоколу генотипирования методом SNaPshot (Applied Biosystems) следующим образом.
1. В качестве материала для исследования можно использовать препарат ДНК индивида, выделенный из любого биообразца любым способом, позволяющим использование ДНК в качестве матрицы в полимеразной цепной реакции. Участки митохондриальной ДНК, содержащие генотипируемые сайты и примыкающие к ним области (комплементарные последовательностям проб), амплифицируют с помощью полимеразной цепной реакции. Для этого можно использовать любые праймеры, удовлетворяющие этому условию. При апробации набора были использованы праймеры, амплифицирующие весь митохондриальный геном человека в 11 перекрывающихся ПЦР-продуктах [15].
2. ПЦР-продукты должны быть очищены от dNTP и праймеров, оставшихся неиспользованными в ходе реакции. Очистку можно проводить любым способом, эффективно удаляющим эти компоненты из реакционной смеси. При апробации набора использовали обработку термочувствительными ферментами щелочной фосфатазой и экзонуклеазой I, согласно протоколу к набору SNaPshot Multiplex kit (Applied Biosystems, США). Все ПЦР-продукты для каждого индивида смешивали в равных пропорциях.
3. Для каждой панели готовили смесь проб с концентрацией 0,2 мкМ каждой пробы (в т.ч. в случае двух или трех проб для одного полиморфизма - для каждой из этих проб).
4. Проводили реакцию мини-секвенирования, используя набор SNaPshot Multiplex kit (Applied Biosystems, США), в соответствии с протоколом производителя. В результате реакции мини-секвенирования флюоресцентно меченый дидезоксинуклеотид, комплементарный нуклеотиду в исследуемом полиморфном сайте, достраивает пробу, гибридизованную на ПЦР-продукт.
5. Удаляли неинкорпорированные флюоресцентно меченые дидезоксинуклеозидтрифосфаты путем инкубации с термочувствительной щелочной фосфатазой, согласно протоколу к набору SNaPshot Multiplex kit (Applied Biosystems, США).
6. Для каждого образца смешивали 0,3 мкл продукта реакции, 0,2 мкл стандарта длины LIZ-120 (Applied Biosystems, США) и 9,5 мкл деионизованного формамида. Полученную смесь денатурировали в течение 5 минут при 95°C с последующим охлаждением и выполняли электрофорез на автоматическом генетическом анализаторе GA 3730 (Applied Biosystems, США) в соответствии с руководством пользователя. Во время электрофореза пробы разделяются в капилляре в зависимости от длины, и происходит регистрация флюоресценции проб (сигналы различаются в зависимости от генотипа) и размерного стандарта.
7. Анализ образцов (оценка генотипа) был проведен в программе Fragment Analysis (Applied Biosystems, США). В результате анализа оцениваются длины фрагментов и показатели их флюоресценции. Генотип по каждому локусу определяли по присутствию соответствующего сигнала (пика) в экспериментально определенном диапазоне длин фрагмента, зависящем от длины пробы. Диапазоны локализации сигнала для всех проб набора приведены в таблице 2. Примеры генотипирования для панелей 1-3 приведены на фиг.1-3 соответственно.
В результате генотипирования были получены индивидуальные генотипы (гаплотипы) мтДНК по входящим в набор сайтам. На основании частот встречаемости этих гаплотипов в выборках был рассчитан показатель генного разнообразия (h), который представляет собой вероятность того, что два случайно выбранных индивида будут иметь различные гаплотипы мтДНК. Для выборки хакасов значение этого показателя составило 0,9679, для выборки русских - 0,9853. Для выборки русских значение h, рассчитанное по гаплотипам ГВС1, было практически равно полученному с помощью нашего набора: 0,9864; тот же показатель, рассчитанный по гаплотипам ГВС2, был ниже - 0,9503. В случае популяции хакасов, которая характеризуется более низким генетическим разнообразием, h по гаплотипам ГВС1 составил 0,9396, а по гаплотипам ГВС2 - 0,9005, что существенно ниже, чем величина, полученная с помощью нашего набора проб (0,9679). Таким образом, разработанный нами набор олигонуклеотидных проб для генотипирования мтДНК характеризуется высоким дискриминационным потенциалом, в некоторых случаях превышающим возможности традиционно используемого секвенирования ГВС1 мтДНК.
Источники информации
1. Gill P., Ivanov P.L., Kimpton С, Piercy R., Benson N.. Tully G., Evett I., Hagelberg E., Sullivan K. Identification of the remains of the Romanov family by DNA analysis // Nat. Genet. - 1994. - Vol. 6. - P. 130-135.
2. Andrews R.M., Kubacka I., Chinnery P.F., Lightowlers R.N., Turnbull D.M., Howell N. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA. Nat Genet. - 1999. - Vol. 23. - No. 2. - P. 147.
3. Морозова И.Ю. Полиморфизм митохондриальной ДНК у русских европейской части России. Дисс… канд. биол. наук. - Москва, 2007. - 148 с.
4. Деренко М.В. Молекулярная филогеография коренного населения Северной Азии по данным об изменчивости митохондриальной ДНК. Дисс. … доктора биологических наук. - Магадан, 2009. - 423 с.
5. Корниенко И.В. Непрямая молекулярно-генетическая идентификация личности при массовом поступлении неопознанных тел. Дисс… доктора биологических наук. - Санкт-Петербург, 2005. - 302 с.
6. Brandstatter A., Salas A., Niederstatter Н., Gassner С, Carracedo A., Parson W. Dissection of mitochondrial superhaplogroup H using coding region SNPs // Electrophoresis. - 2006. - Vol. 27. - P. 2541-2550.
7. Pastinen Т., Kurg A., Metspalu A., Peltonen L., Syvanen A. Minisequencing: A Specific Tool for DNA Analysis and Diagnostics on Oligonucleotide Arrays // Genome Research. - 1997. - Vol. 7. - No. 6. - P. 606-614.
8. Sanchez, JJ, Phillips, C, Borsting, С et al. (2006) A multiplex assay with 52 single nucleotide polymorphisms for human identification // Electrophoresis. 2006. V. 27, (9). P. 1713-1724.
9. Ikryannikova L.N., Shitikov E.A., Zhivankova D.G., IPina E.N., Edelstein M.V., Govorun V.M. A MALDI TOF MS-based minisequencing method for rapid detection of TEM-type extended-spectrum beta-lactamases in clinical strains of Enterobacteriaceae // Journal of Microbiological Methods. - 2008. - Vol. 75. - P. 385-391.
10. Quintans В., Alvarez-Iglesias V., Salas A., Lareu M., Carracedo A. Typing mtDNA SNPs of forensic and population interest with snapshot // International Congress Series. - 2004 - Vol. 1261. -P. 419-421.
11. Kohnemann S., Sibbing U., Pfeiffer H., Hohoff C. A rapid mtDNA assay of 22 SNPs in one multiplex reaction increases the power of forensic testing in European Caucasians // Int J Legal Med. - 2008. - Vol. 122. - P. 517-523.
12. Huang D., Gui C, Yi S., Yang Q., Yang R., Mei K. Typing of 24 mtDNA SNPs in a Chinese population using SNaPshot minisequencing // J Huazhong Univ Sci Technolog Med Sci. - 2010. - Vol. 30. - P. 291-298.
13. Nelson TM, Just RS, Loreille O, Schanfield MS, Podini D. Development of a multiplex single base extension assay for mitochondrial DNA haplogroup typing // Croat Med J. 2007. Vol. 48. P. 460-472.
14. Grignani P., Peloso G., Achilli A., Turchi C, Tagliabracci A., Alu M., Beduschi G., Ricci U., Giunti L., Robino C, Gino S., Previdere C. Subtyping mtDNA haplogroup H by SNaPshot minisequencing and its application in forensic individual identification // Int J Legal Med. - 2006. - Vol. 120. - P. 151-156.
15. Torroni A., Rengo C, Guida V., Cruciani F., Sellitto D., Coppa A., Calderon F.L., Simionati В., Valle G., Richards M., Macaulay V., Scozzari R. Do the four clades of the mtDNA haplogroup L2 evolve at different rates? // Am. J. Hum. Genet. 2001. Vol. 69. P. 1348-1356.
Приложение
Фиг. 1 - Пример генотипирования панели №1, 2 образца ДНК.
Фиг. 2 - Пример генотипирования панели №2, 2 образца ДНК.
Фиг. 3 - Пример генотипирования панели №3, 2 образца ДНК.
Набор синтетических олигонуклеотидных проб для определения генотипа митохондриальной ДНК человека, характеризующийся тем, что данный набор позволяет определить генотип митохондриальной ДНК человека в 38 однонуклеотидных сайтах, расположенных в различных участках митохондриального генома и полиморфных в популяциях населения России различного этнического происхождения, с помощью метода ферментативного однонуклеотидного удлинения гибридизированной пробы, причем структура олигонуклеотидных проб учитывает вариабельность ДНК в близлежащих сайтах и группировку генотипируемых сайтов в 3 панели для мультиплексных реакций и имеет следующие характеристики:
Панель 1:
| C3594T-F: | 5'-CCCATACCCAACCCCCTGGT-3' |
| G3010A-F: | 5'-TCGATGTTGGATCAGGACATCCC-3' |
| С14766T-F: | 5'-GАСТСАССAATGACCCCAATACGCAAAА-3' |
| A12308G-F: | 5'-GACTCTATCCATTGGTCTTAGGCCCCAA-3' |
| C7028T-F: | 5'-GACTCGTACTACACGACACGTACTACGTTGTAGC-3' |
| G15301A-F: | 5'-GACTTCACACGATTCTTTACCTTTCACTTCATCTT-3' |
| С12705T-F: | 5'-CTCAGACCCAAACATTAATCAGTTCTTCAAATATCTACTCAT-3' |
| A10398G-F1: | 5'-TAAGTCTGGCCTATGAGTGACTACAAAAAGGATTAGACTGA-3' |
| А10398G-F2: | 5'-ТАAGTCTGGCCTATGAGTGACTACAAAAAGGATTAGACTGG-3' |
| G13708A-R: | 5'-GACTGACTGACTGACTGACTGACTCTGCGAATAGGCTTCCGGCTG-3' |
| С10400T-R: | 5'-TTAATGAGTCGАААТСATTCGTTTTGTTTAAACTATATACCAATTC-3' |
| А13263G-R: | 5'-GACTGACTGACTGACTGACTTGATGCCGATTGTAACTATTATGAGTCCTAG-3' |
| G13368A-F: | 5'-GACTGACTGACTGACTGACTGACTCAAAGCCATACTATTTATGTGCTCCGG-3' |
Панель 2:
| T16362C-R: | 5'-AGGGGGGTCATCCATGGGG-3' |
| Т16519C-F: | 5'-CCGACATCTGGTTCCTACTTCAGGG-3' |
| Т16189C-R1: | 5'-GCTGTACTTGCTTGTAAGCATGGGG-3' |
| T16189C-R2: | 5'-GCTGTACTTGCTTGTAAGCATGAGG-3' |
| G8251A-R: | 5'-GACTGGGGGTGCTATAGGGTAAATACGGG-3' |
| T16356C-R1: | 5'-GACTGACTGACTGTCATCCATGGGGACGAGA-3' |
| T16356C-R2: | 5'-GACTGACTGACTGTCATCCATGGGGACGAGG-3' |
| G11914A-R: | 5'-CCTGTAAGTAGGAGAGTGATATTTGATCAGGAGAA-3' |
| G1888A-F: | 5'-GACTGACTGACTGAGGTTTCGGGGGTCTTAGCTTTGG-3' |
| T16093C-R: | 5'-GACTGACTGACTGAATGGTGGCTGGCAGTAATGTACGA-3' |
| G709A-F: | 5'-GACTGACTGACTGAGGTGATTTAGAGGGTGAACTCACTGGAA-3' |
| Т16311C-R: | 5'-GACTGACTGACTATGTGCTATGTACGGTAAATGGCTTTATGT-3' |
| T16304C-R1: | 5'-GACTGACTGACTTGCTATGTACGGTAAATGGCTTTATGTACTATGT-3' |
| T16304C-R2: | 5'-GACTGACTGACTTGCTATGTACGGTAAATGGCTTTATGTGCTATGT-3' |
| G16129A, C-R: | 5'-GACTGACTGACTGGGTTTTTATGTACTACAGGTGGTCAAGTATTTATGGTAC-3' |
Панель 3:
| 595insC-F: | 5'-CCCCCCACAGTTTATGTAGCTTACCTCC-3' |
| A3816G-F: | 5'-CTCCACCCTTATCACAACACAAGA-3' |
| A6047G-R: | 5'-TGACTCGATAACGTTGTAGATGTGGTCGTTACC-3' |
| A12672G-F: | 5'-AGAATTCTCACTGTGATATATAAACTCAGACCC-3' |
| A16162G-F: | 5'-GACTGGTACCATAAATACTTGACCACCTGTAGTACAT-3' |
| A4769G-R: | 5'-GACTGACTGGGCTATTCCTAGTTTTATTGCTATAGC-3' |
| T4336C-F: | 5'-GACTGACTGACTGGAGCTTAAACCCCCTTATTTCTAGGAC-3' |
| T14182C-R: | 5'-GACTGACTGACTGTTACTGGTTGAACATTGTTTGTTGGTGT-3' |
| C5178A-F: | 5'-ACTATCTCGCACCTGAAACAAG-3' |
| A4833G-R: | 5'-CTGACTGACTGACTGACTGACTGACTGACTGACTGAAGGCCGGATGTCAGAGGGG-3' |
| A14793G-F: | 5'-GACTGACTGACTGACTGCAAAACTAACCCCCTAATAAAATTAATTAACC-3' |
| A14233G-R: | 5'-GACTGACTGACTGACTGACTGACTGACTGACTGGTGCGGGGGCTTTGTATGA-3' |
| G4580A-F: | 5'-GACTGACTGACTGACTGACTGATTTTTTACCTGAGTAGGCCTAGAAATAAACAT-3' |
| T9090C-F: | 5'-GACTGACTGACTGACTCTAGCAATATCAACCATTAACCTTCCCTC-3' |