Соединения и композиции, активирующие ферменты
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы I:
, а также фармацевтическим композициям на их основе. Технический результат: получены новые соединения, активирующие прокаспазу-3, которые могут индуцировать гибель раковых клеток. 5 н. и 3 з.п. ф-лы, 2 табл., 3 пр., 10 ил.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Для настоящей заявки испрашивается приоритет в соответствии с положениями § 119 (е) Раздела 35 Свода законов США, по предварительной заявке на патент США №61/679,129, поданной 3 августа 2012 года, содержание которой полностью включено в данную заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Апоптоз означает процесс, используемый высшими организмами для поддержания гомеостаза путем удаления клеток, которые присутствуют в избытке, повреждены или потенциально опасны. Ферменты каспазы - это класс цистеиновых протеаз, которые расщепляют клеточные субстраты после распознавания последовательностей с С-терминальными остатками аспартата. Активация ферментов каспазы критична для апоптоза. Существуют два канонических сигнальных пути апоптоза, отличающиеся тем, что инициирующий апоптоз импульс является внутриклеточным (внутренний сигнальный путь) или внеклеточным (внешний сигнальный путь). Данные сигнальные пути приводят к расщеплению прокаспазы-3 с образованием активной каспазы-3, ключевой каспазы-«исполнителя», которая катализирует гидролиз сотен белковых субстратов, что приводит к гибели клетки.
Одна из особенностей рака - способность раковых клеток избегать апоптоза, допуская бесконтрольную пролиферацию. Как таковая, реактивация апоптоза в клетках с помощью дефектных сигнальных путей апоптоза - это перспективная противораковая стратегия. Все такие соединения, как деструкторы p53-MDM2 (нутлины), ингибиторы Bcl-2 (АВТ-737) и ингибиторы XIAP (SM-164) непосредственно воздействуют на белки в каскаде апоптоза, индуцируя апоптоз и приводя к гибели раковые клетки.
В дополнение к стратегиям, описанным выше: прямая активации прокаспазы-3 посредством малых молекул обладает потенциалом индивидуализации терапии рака. Уровни прокаспазы-3 повышаются при некоторых видах рака, в том числе - лимфомах, лейкозах, меланомах, раке поджелудочной железы, раке печени, раке легких, раке молочной железы, раке толстой кишки. Из-за повышенного уровня прокаспазы-3 в раковых клетках, существует необходимость активации каспазы-3 для апоптоза и относительное последующее расположение прокаспазы-3 в апоптотическом каскаде, а также индукция апоптоза путем прямой активации прокаспазы-3 в настоящее время активно изучается в качестве индивидуализированной противораковой стратегии. Соответственно, существует потребность в новых соединениях, которые моделируют активность прокаспазы-3, в частности, в соединениях, активирующих прокаспазу-3 и которые являются достаточно метаболически стабильными, чтобы эффективно применятся в клинической терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Активирующее прокаспазу соединение 1 (PAC-1) представляет собой орто-гидрокси N-ацилгидразон, который повышает ферментативную активность прокаспазы-3 in vitro и индуцирует апоптоз раковых клеток. Аналог PAC-1, называющийся S-PAC-1, оценили в ходе ветеринарных клинических испытаний на домашних собаках с лимфомой и обнаружили в нем значительный потенциал в качестве противоракового средства. С целью определения более мощных соединений в данном перспективном классе экспериментальных терапевтических средств была создана комбинаторная библиотека на основе PAC-1, и проведена оценка способности соединений индуцировать гибель раковых клеток в культуре. Соединения оценивали по их способности индуцировать апоптоз раковых клеток и по их метаболической стабильности. Вновь выявленные соединения могут стать основой терапевтических средств для лечения многих видов рака, которые характеризуются повышенным уровнем экспрессии прокаспазы-3.
Открыты соединения, способные активировать ферменты, которые часто демонстрируют гиперэкспрессию в своей неактивной форме в раковых клетках. Соединения могут индуцировать запрограммированную гибель клеток (апоптоз) в раковых клетках, в том числе тех, которые активируют прокаспазу-3. Многие виды рака устойчивы к стандартной химиотерапии. Соединения, описанные в данной заявке, могут использовать преимущество биологических мишеней, которые можно активировать в раковых клетках, и, таким образом, могут быть эффективными даже в клетках с дефектами в механизме апоптоза. Эти соединения также могут успешно применяться в направленной терапии рака, селективно убивая раковые клетки со сравнительно пониженными побочными реакциями на нераковые клетки, имеющие более низкие уровни прокаспазы-3. Эти побочные реакции могут включать в себя токсичность, в частности - нейротоксичность.
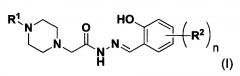
Таким образом, изобретение относится к соединениям Формулы I:
где
R1 представляет собой необязательно замещенный бензоил, фенил, (арил)метилен, или (арил)метин, где метиновый углерод необязательно замещен фенилом;
n имеет значения 1, 2, 3 или 4; и
каждый R2 независимо представляет собой H, алкил, алкокси, гидрокси, карбокси, гало, амино, алкиламино, диалкиламино, трифторметил, трифторметокси, бензил, бензилокси, нитро, циано (-CN), сульфонамид (-SO2NH2), 2-пропенил, ацетилен, N-алкил-триазол или N-бензил-триазол; или две группы R2 образуют орто-конденсированную бензогруппу;
или их фармацевтически приемлемой соли или сольвату.
В некоторых воплощениях R1 означает бензоил (Ph(C=O)-). В других воплощениях R1 означает замещенный бензоил. Бензоильную группу можно заместить 1, 2, 3 или 4 группами R2. Переменные R2 могут быть в орто-, мета- или пара- положениях, или их сочетаниях, по отношению к карбонилу бензоильной группы.
В некоторых воплощениях n имеет значения 1 или 2. В других воплощениях n имеет значения 3 или 4. Переменные R2 могут быть в орто-, мета- или пара- положениях по отношению к гидроксильной группе соединения Формулы I, или их комбинации.
В некоторых воплощениях R2 означает метил, трет-бутил, метокси, гидрокси, фтор, хлор, бром, йод, амино, этиламино, диэтиламино, трифторметил, трифторметокси, бензил, бензилокси, нитро, циано, сульфонамид, 2-пропенил, ацетилен, N-метил-триазол или N-бензил-триазол. В различных воплощениях n имеет значения 2, а две группы R2 образуют орто-конденсированную бензогруппу. В некоторых воплощениях заместителем фенильной группы R1 может быть заместитель R2. В различных воплощениях R2 может самостоятельно быть заместителем арильной группы R1, включая бензоильную группу, и эти группы могут иметь от одного до пяти заместителей R2.
В некоторых воплощениях n имеет значения 2, а каждый R2 представляет собой t-бутил.
В некоторых воплощениях n имеет значение 1, а R2 представляет собой 2-пропенил.
В некоторых воплощениях R1 представляет собой метокси-бензил; диметокси-бензил; бензилокси-бензил; mpem-бутил-бензил; нафтилметилен; или этил-бензил.
В некоторых конкретных воплощениях R1 представляет собой 4-метокси-бензил; 2,5-диметокси-бензил; 4-бензилокси-бензил; 4-трет-бутил-бензил; 2-нафтилметилен; или 4-этил-бензил.
В некоторых других конкретных воплощениях R1 представляет собой:
.
В различных конкретных воплощениях соединение означает одно или более соединений 1-45 из Примера 4, соединение Таблицы 1 или его фармацевтически приемлемую соль или сольват. В других воплощениях соединение означает соединение, описанное в данной заявке, где метиленовый углерод, присоединенный к дистальному азоту пиперазина, замещен оксогруппой, например:
и т.п., для каждого соединения, описанного или показанного в данной заявке, без оксогруппы при метиленовом углероде, прикрепленному к дистальному азоту пиперазина. Например, в одном воплощении соединение представляет собой соединение Формулы (X):
где
R10 представляет собой H, F, Cl, Br, -NO2, -CN, -CF3, -OCF3 или -SO2NH2;
R20 представляет собой H, F, Cl, Br, -NO2, -CN, -CF3, -OCF3 или -SO2NH2; и
R30 представляет собой H, (C1-C6)алкил, (C1-C6)алкенил или (C1-C6)алкокси;
или их фармацевтически приемлемую соль или сольват.
В некоторых воплощениях R10 представляет собой H.
В некоторых воплощениях R10 представляет собой F, Cl или Br.
В некоторых воплощениях R10 представляет собой -NO2 или -CN.
В некоторых воплощениях R10 представляет собой -CF3, -OCF3 или -SO2NH2.
В некоторых воплощениях R20 представляет собой H. В некоторых воплощениях R20 представляет собой F. В некоторых воплощениях R20 представляет собой H или F.
В некоторых воплощениях R20 представляет собой F, Cl или Br.
В некоторых воплощениях R20 представляет собой -NO2 или -CN.
В некоторых воплощениях R20 представляет собой -CF3, -OCF3 или -SO2NH2.
В некоторых воплощениях R30 представляет собой H.
В некоторых воплощениях R30 представляет собой н-пропил.
В некоторых воплощениях R30 представляет собой 2-пропенил (аллил).
В некоторых воплощениях R10 может быть R1, как описано выше, и наоборот.
В некоторых воплощениях R20 может быть R2, как описано выше, и наоборот.
В некоторых воплощениях R30 может быть R3, как описано выше, и наоборот.
Изобретение также относится к фармацевтической композиции, включающей соединение, описанное в настоящей заявке, и фармацевтически приемлемый разбавитель, наполнитель или носитель. В некоторых воплощениях соединение индуцирует гибель раковых клеток в культуре.
Настоящее изобретение также относится к способу лечения раковой клетки, который включает (а) идентификацию восприимчивости к лечению раковой клетки с помощью активирующего прокаспазу соединения; и (b) воздействие на раковую клетку эффективным количеством активирующего прокаспазу соединения; где активирующее прокаспазу соединение означает соединение, описанное в настоящей заявке.
Изобретение также относится к способу индукции апоптоза клетки, включающему введение в клетку эффективного количества соединения, описанного в данной заявке.
В некоторых воплощениях данное изобретение относится к соединениям и способам, связанным с такими эффективными концентрациями, как приблизительно от 10 нМ приблизительно до 100 мкМ соединения указанной структурной формулы. В некоторых воплощениях эффективные концентрации составляют приблизительно от 200 нМ приблизительно до 5 мкМ. В другом воплощении эффективная концентрация является таким значением, как 50% объемной активности в непосредственно активирующем прокаспазу аналитическом образце, индуцирующем апоптоз клетки аналитическом образце или в клинической терапевтической оценке на животных. В другом воплощении такие значения меньше, чем приблизительно 200 мкМ. В различных воплощениях значение меньше, чем приблизительно 10 мкм. В различных воплощениях соединение может иметь значительную метаболическую стабильность. Например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95% образца соединения могут оставаться после 3-часовой инкубации при проведении теста на определение стабильности в микросомах печени.
Таким образом, изобретение относится к соединениям, композициям и способам терапевтического лечения. В некоторых воплощениях, изобретения применимы в контексте различных раковых заболеваний и типов раковых клеток, таких как рак молочной железы, надпочечников, почек, меланома, лейкоз, лимфома, нейробластома, рак легких, мозга, среди прочих.
Изобретение относится к новым соединениям, описанным в данной заявке, и соединениям Формул, описанных в данной заявке, промежуточным продуктам для синтеза таких соединений, а также к способам получения этих соединений. Изобретение также относится к соединениям, которые полезны в качестве промежуточных продуктов в синтезе других полезных соединений.
Также изобретение относится к применению композиций, описанных в данной заявке, для использования в медицинской терапии. Медицинской терапией может быть лечение рака, например, лимфом, лейкозов, меланом, рака поджелудочной железы, рака печени, рака легких, рака молочной железы, рака толстой кишки. Настоящее изобретение также относится к применению препарата, описанного в данной заявке, для изготовления лекарственного средства для лечения заболевания у млекопитающего, например, рака у человека. Лекарственное средство может включать в себя фармацевтически приемлемый разбавитель, наполнитель или носитель.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Следующие фигуры являются частью описания и включены для дополнительной демонстрации некоторых вариантов осуществления или различных аспектов настоящего изобретения. В некоторых случаях варианты осуществления настоящего изобретения можно лучше понять, обратившись к прилагаемым чертежам в сочетании с подробным описанием, представленным в данной заявке. Описание и прилагаемые чертежи могут выделять определенный конкретный пример или определенный аспект настоящего изобретения. Тем не менее, специалистам в данной области техники будет понятно, что части примера или аспекта можно использовать в сочетании с другими примерами или аспектами настоящего изобретения.
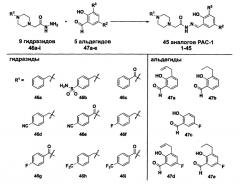
Фиг. 1. Гидразиды, использованные для построения комбинаторной библиотеки аналогов PAC-1. Каждый предшественник бензилгидразида R1 также может быть соответствующим соединением-предшественником бензоилгидразида R1 в различных воплощениях.
Фиг. 2. Альдегиды, использованные в комбинаторной библиотеке аналогов PAC-1 в соответствии с некоторыми воплощениями.
Фиг. 3. Активность культуры клеток. Клетки U-937 (лимфома человека), обработанные соединениями в концентрации 25 мкМ в течение 24 часов. Жизнеспособность клеток оценивается анализом с использованием красителя Аламарового синего. Пределы погрешности обозначают стандартное отклонение от среднего (n=3).
Фиг. 4. Тест на определение стабильности в микросомах печени. Соединения (10 мкМ), инкубированные с микросомами печени в течение 3 ч и экранированные MeCN, содержащей внутренний стандарт, анализируют с помощью ЖХ/МС (280 нм).
ПОДРОБНОЕ ОПИСАНИЕ
В 2006 году было объявлено об открытии Активирующего прокаспазу соединения 1 (PAC-1, Схема A) (Putt et al. Nat Chem Biol 2006. 2, 543-550). PAC-1 усиливает ферментативную активность прокаспазы-3 in vitro, индуцирует апоптотическую гибель раковых клеток и демонстрирует эффективность на множественных моделях мышиных опухолей. Исследования соотношения структура-активность показали, что активность PAC-1 in vitro и в культуре клеток зависит от присутствия фрагмента орто-гидрокси N-ацил-гидразона (схема А), функциональной группы, как известно участвующей в хелатировании металлов. В самом деле, цинк является мощным ингибитором ферментативной активности прокаспазы-3, а механизм, с помощью которого PAC-1 активирует прокаспазу-3 in vitro, заключается в хелатировании ингибирующего цинка из прокаспазы-3, что позволяет прокаспазе-3 преобразовываться в активную форму. Этот же основной механизм, по-видимому, функционирует также и в клеточной культуре: приблизительно 10% внутриклеточного цинка не связано прочно, но существует в виде «лабильного цинкового пула». Было показано, цинк из лабильного пула ко-локализуются с прокаспазой-3, и как оказалось, хелатирование PAC-1 указанного лабильного цинка внутри клеток повышает активность прокаспазы-3, что приводит к апоптозу.
Схема А: PAC-1 и S-PAC-1, с орто-гидрокси N-ацил-гидразоновым мотивом, и соответствующие бензоильные (Bz) производные.
PAC-1 можно безопасно вводить мышам и испытуемым собакам в дозах, которые дают концентрации сыворотки ~10 мкМ в течение 48 часов. Сульфонамидсодержащее производное PAC-1, называемое S-PAC-1 (схема А), можно безопасно вводить в дозах, которые обеспечивают очень высокие концентрации сыворотки у мышей (~3,5 мМ). Обнадеживает то, что ветеринарные клинические испытания S-PAC-1 (вводимого в виде 24- или 72-часовой непрерывной инфузии IV) на домашних собаках со спонтанно встречающимися лимфомами, показали, что это соединение безопасно для всех ветеринарных пациентов и эффективно для снижения или стабилизации роста опухоли у 4 из 6 пациентов. Этот результат является концептуальным подтверждением понятия того, что активация прокаспазы-3 путем хелатирования лабильного цинка малыми молекулами может быть безопасной и эффективной противораковой стратегией. В постоянном поиске более сильных производных PAC-1 мы сообщаем в данной заявке о синтезе новых аналогов PAC-1, оценке этих веществ на их способность индуцировать гибель раковых клеток в культуре, и далее характеризуем различные соединения с повышенной метаболической устойчивостью.
Дизайн и синтез комбинаторной библиотеки на основе PAC-1. Библиотеку аналогов PAC-1 разрабатывают с целью идентификации соединений, способных вызывать масштабную гибель раковых клеток в культуре. Так как максимальной цитотоксичности S-PAC-1 не достигалось по меньшей мере в течение вплоть до 24 часов, и так как PAC-1 и S-PAC-1 демонстрировали короткий период полураспада 1-2 часа in vivo, вторичной целью данного исследования была идентификация аналогов PAC-1, которые могут индуцировать апоптоз быстрее. Отмеченные синтетические пути к PAC-1 и S-PAC-1, а также другим аналогам PAC-1, используют конденсацию гидразида и альдегида в качестве конечной стадии в синтетической схеме, раскрытой в (заявке US 2007/0049602) (WO 2008/134474 (Hergenrother et al.)). Этот модульный характер синтеза PAC-1 дает возможность множеству разнообразных функциональных групп, быть легко включаемыми в остов PAC-1, существенно не изменяя ядро орто-гидрокси N-ацил-гидразонового мотива, необходимого для активации прокаспаза-3 и индукции апоптоза.
Как показано на Фиг. 1 и 2, 31 гидразид (1{1-31}) и 27 альдегидов (2{1-27}) были выбраны для создания библиотек из 837 аналогов PAC-1. Гидразиды были построены из коммерчески доступных бензилгалогенидных исходных соединений. Синтез гидразидов 1{1-6} был представлен ранее (Putt et al. Nat Chem Biol 2006, 2, 543-550; Peterson et al. J Med Chem 2009, 52, 5721-5731; Peterson и др., Cancer Res 2010, 70, 7232-41). Гидразиды 1{7-27} синтезируют согласно схеме 1. Замещенные бензилгалогениды 4{7-27} сначала подвергают взаимодействию с пиперазином с образованием замещенных бензилпиперазинов 5{7-27}. Последующее алкилирование пиперазинового кольца этилхлорацетатом дает дизамещенные пиперазины 6{7-27}, а сложные эфиры затем превращают в гидразиды 1{7-27} с помощью реакции с гидразином.
Схема 1: Синтез гидразидов 1{7-27}.
Синтетические пути для получения гидразидов 1{28-31} подробно описаны в схеме 2. Синтез гидразида 1{28} начинался с алкилирования пиперазина 4-винилбензилхлоридом (7) с образованием монозамещенного пиперазина 8 (схема 2, уравнение 1). Последующее алкилирование этилхлорацетатом дает сложный эфир 9, а реакция с гидразином образует гидразид и восстанавливает олефин, давая гидразид 1 {28}. Восстановление олефинов гидразином, как правило, предполагает добавление окислительного агента (Miller, С.Е., Hydrogenation with Diimide. J Chem Educ 1965, 42, 254), однако присутствие кислорода воздуха было достаточным для достижения этого превращения.
Схема 2: Синтез гидразидов ^{28-31}.
Синтез гидразида 1{29} (схема 2, уравнение 2) начался с реакции этил-2-(пиперазин-1-ил)ацетата (10) с бензилбромидом 4{29} с образованием промежуточного продукта 6{29}. Реакция соединения 6{29} с гидразином затем дает гидразид 1{29}. Синтез гидразида 1{30} (схема 2, уравнение 3) начался с реакции 1-фенилпиперазина (5{30}) с этилхлорацетатом, чтобы получить дизамещенный пиперазин 6{30}, и реакция с гидразином дает гидразид 1{30}. Гидразид 1{31} синтезируют путем первоначальной защиты 4-метилбензофенона (11) в виде этиленацеталя (12), как показано на схеме 2, уравнение 4. Это соединение бромируют в радикальных условиях с получением бензилбромида 13. Реакция с монозамещенным пиперазином 10 дает промежуточный продукт 14, а реакция с гидразином дает гидразид 15. Удаление ацетальной защитной группы водным раствором кислоты дает гидразид 1{31}.
Соотношение структура-активность PAC-1, выведенное на основе синтеза и оценки ~30 соединений, демонстрирует необходимость наличия орто-гидроксильной группы, поэтому для создания библиотеки было отобрано 27 салицилальдегидных строительных блоков. Альдегиды 2{1-23} были получены из коммерчески доступных исходных материалов, а синтез альдегидов 2{24-26} описывался ранее (Peterson et al., J Med Chem 2009, 52, 5721-5731; Peterson et al., Cancer Res 2010, 70, 7232-41; Chang et al., Dalton Trans 2004, 1731-8). Альдегид 2{27} синтезируют путем катализируемого медью циклоприсоединения альдегида 2{26} к бензилазиду, как показано на схеме 3.
Схема 3: Синтез альдегида 2{27}.
Используя параллельный синтезатор фирмы Büchi Syncore, каждый гидразид конденсируют с каждым альдегидом, при этом более 80 реакций выполняют одновременно. Каждый альдегид (5-15 мг) подвергают взаимодействию с избытком гидразида (1,7 экв.), и для контроля исчезновения альдегида из реакционной смеси используют масс-спектрометрию. Когда альдегид прореагировал полностью, добавляют полистирол-связанный бензальдегид в качестве поглотительной смолы, взаимодействия с избытком гидразида и его удаления. Когда масс-спектрометрия показала, что не осталось остатков гидразида, гранулы отфильтровывают, а растворы высушивают в высоком вакууме. Каждое из 837 соединений оценивают с помощью ВЭЖХ/МС. Чистота каждого соединения составила приблизительно 74-100%, со средней чистотой 91%.
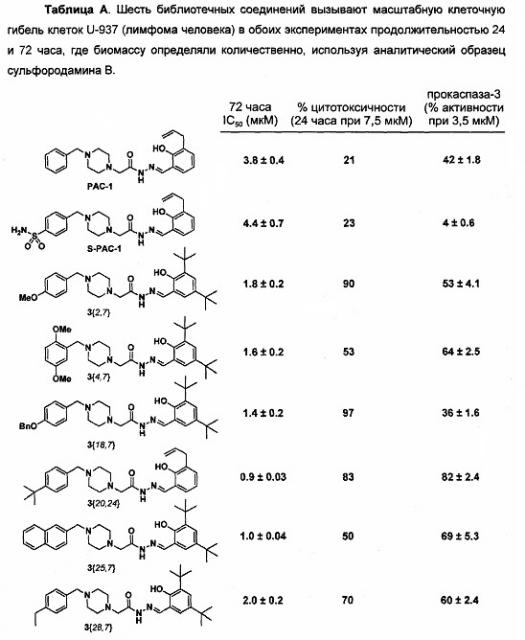
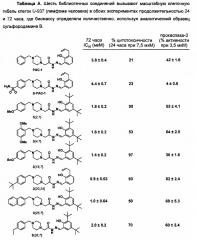
Оценка комбинаторной библиотеки PAC-1. Имея 837 аналогов PAC-1, соединения оценивают на их способность индуцировать апоптоз в культуре клеток. Клетки лимфомы человека U-937 подвергают воздействию соединений в течение 24 ч при концентрации 20 мкМ. И PAC-1 и S-PAC-1 демонстрируют умеренную активность (гибель ~50% клеток) в отношении этой клеточной линии в данных условиях. Гибель клеток путем апоптоза оценивают методом проточной цитометрии с использованием аннексина V-FITC и окрашивания йодидом пропидия. С помощью этого процесса скрининга было определено и подтверждено, что шесть соединений вызывают гибель >80% клеток в данных условиях.
Индукция гибели клеток и ослабление цинк-опосредованного ингибирования прокаспазы-3 найденными соединениями. После повторного синтеза найденных соединений (3{2,7}, 3{4,7}, 3{18,7}, 3{20,24}, 3{25,7}, и 3{28,7}) аналитически чистые образцы соединений оценивают в дальнейших биологических анализах. Эти структуры и биологические результаты приведены в Таблице А выше. Соединения оценивают в диапазоне концентраций, в отношении их способности индуцировать клеточную гибель клеток U-937, а также их способности активировать прокаспазу-3 in vitro. Все шесть из этих найденных соединений оказались в 2-4 раза более сильными в клеточной культуре, чем PAC-1 и S-PAC-1 при 72-часовой обработке.
Во втором эксперименте анализ проточной цитометрией с помощью аннексина V-FITC и йодида пропидия выполняют на клетках U-937, которые подвергали воздействию соединений одной концентрации (7,5 мкМ) в течение 24 часов (таблица А). В течение 24 часов большинство обработанных соединением клеток подверглись апоптозу (клетки в правом нижнем квадранте гистограммы - положительные по аннексину V, отрицательные по иодиду пропидия), или были в конце стадии апоптоза/некроза (верхний правый квадрант - положительные по аннексину V, положительные по иодиду пропидия) было установлено, что новые аналоги более мощные, чем PAC-1 в данных условиях продолжительностью 24 часа.
Шесть подтвержденных найденных соединений затем оценивали in vitro на их способность уменьшить цинк-опосредованное ингибирование прокаспазы-3 (Таблица А). В этом эксперименте прокаспазу-3 инкубируют с помощью ZnSO4, т.е. в условиях, в которых прокаспаза-3 не имеет ферментативной активности. Все соединения были способны усиливать ферментативную активность прокаспазы-3 в данных условиях (по оценке расщепления колориметрического субстрата каспазы-3 Ac-DEVD-pNA, синтезированного, как упоминалось ранее (Peterson et al., Nat Protoc 2010, 5, 294-302), a пять из шести найденных соединений показали большую активность, по сравнению с PAC-1 в этом анализе. Эти данные показывают, что соединения повышают активность прокаспазы-3 in vitro посредством хелатирования ингибирующего цинка, и предполагается, что в клетке соединения хелатируют цинк из лабильного пула, что позволяет прокаспазе-3 быть преобразованной в активную каспазу-3, что приводит к апоптотической гибели клеток.
Прямая модуляция апоптотических белков подставляет собой практическую противораковую стратегию. PAC-1 и его производное S-PAC-1, которые хелатируют лабильный клеточный цинк и индуцируют апоптоз раковых клеток, оказались эффективными в различных доклинических противоопухолевых моделях. Тем не менее, производные, которые вызывают гибель клеток более быстро и более мощно, будут еще более привлекательными в качестве терапевтических средств. Используя параллельный синтез и руководствуясь известным соотношением структура-активность, были синтезированы 837 аналогов PAC-1 и проведена их оценка по свойству индуцировать гибель клеток. Шесть соединений, показанные в таблице А, стали результатом этой работы. Эти соединения в два-четыре раза более мощные, чем PAC-1 в индукции гибели раковых клеток как при 24-часовом, так и при 72-часовом исследовании.
Учитывая общую гидрофобность найденных соединений по отношению к PAC-1, повышенная эффективность и повышенная скорость клеточной гибели может быть вызвана повышенной проницаемостью клеток. Указанные качества могут быть выгодными, поскольку соединения прошли исследования in vivo. Кроме того, другие элементы этой библиотеки, вероятно, станут жизнеспособными кандидатами для исследования in vivo, так как рассматриваются и альтернативные свойства (например, склонность пересечь гематоэнцефалический барьер, улучшенная метаболическая стабильность, улучшенная растворимость / состав для исследований in vivo и т.п.). Таким образом, указанная библиотека из 837 соединений может стать ценным источником для разработки соединений нового поколения, активирующих прокаспазу-3.
Дополнительные соединения и их анализ
Высокопроизводительный скрининг приблизительно 20000 соединений определил PAC-1 (1, схема А1) в качестве соединения, которое повышает расщепление прокаспазы-3 in vitro. Соединение вызывает апоптоз клеток в широком спектре линий раковых клеток в культуре и показывает противоопухолевую эффективность на множественных моделях мышиных опухолей.1 Дальнейшее изучение соотношений структура-активность (SAR) выявило орто-гидрокси-N-ацилгидразон в качестве ключевого фармакофора.2-3 Несколько производных PAC-1, содержащих этот мотив, проявляют сравнимую активность in vitro и в культуре клеток, но производные, имеющие модифицированное ядро, теряют активность.3 Орто-гидрокси-N-ацилгидразон, как известно, хелатирует металлы,4 многие из которых, как известно, ингибируют прокаспазу и ферменты каспазы.2, 5-7 В частности, цинк из лабильного цинкового пула, который слабо связан и не играет существенной роли в активности этих белков, как было показано, локализуется с прокаспазой-3 и ингибирует ее ферментативную активность. Механизм действия PAC-1, скорее всего, включает в себя хелатирование цинка из лабильного пула, уменьшая цинк-опосредованное ингибирование прокаспазы-3, и позволяет ферменту преобразовываться в активную форму.2-3
Схема А1. Структуры PAC-1 (1) и S-PAC-1 (2).
Фармакокинетические исследования PAC-1 показали, что концентрации в сыворотке приблизительно 10 мкМ можно достичь с минимальными побочными эффектами.8 Сульфонамидсодержащее производное PAC-1, называемое S-PAC-1 (2, схема А1), можно безопасно вводить в дозах 350 мг/кг или выше, с получением максимальной концентрации в плазме 3,5 мМ.9 Улучшенный профиль безопасности связан в значительной степени со снижением способности преодолевать гематоэнцефалический барьер (ГЭБ), по сравнению с PAC-1.10 Обнадеживает то, что S-PAC-1 является эффективным в снижении или стабилизации роста опухоли у четырех из шести собак, больных спонтанно возникающей лимфомой, и соединение хорошо переносится всеми шестью собаками.9 Этот результат демонстрирует потенциал активации прокаспазы в качестве безопасной и эффективной противораковой стратегии.
Результаты и обсуждение. Синтез соединения. Предыдущие синтезы PAC-1 и других производных включают в себя на последней стадии конденсацию гидразида с альдегидом с образованием ключевого орто-гидрокси-N-ацилгидразона.1, 3, 9, 11 Эта реакция была полезна для синтеза большого количества производных из сравнительно небольшого числа исходных веществ.11 В данной работе, аналоги PAC-1 1-45 были синтезированы путем конденсации девяти гидразидов (46a-i) с пятью альдегидами (47а-е), как показано на схеме А2.
Схема А2. Строительные блоки, использованные для построения библиотеки.
Гидразиды синтезируют в соответствии со схемой А3а-с. Синтез начинают с алкилирования пиперазина (48) этилхлорацетатом (49) с образованием монозамещенного пиперазина 50. Соединение 50 затем подвергают взаимодействию с замещенным бензил или бензоилгалогенидом с получением дизамещенных пиперазинов 51a-i с высокими выходами. Реакция сложных эфиров с гидразином затем дает гидразиды 46a-i.
Схема A3. Синтез аналогов PAC-1. (а) Синтез гидразидов (46a-i). (b) Синтез альдегидов (47а-е). (с) Конденсация гидразидов и альдегидов с образованием аналогов PAC-1 (1-45).
Синтез альдегидов показан на схеме A3b. Как салициловый альдегид (52), так и 5-фторсалицилальдегид (47с) алкилируют аллилбромидом с получением аллилоксибензальдегидов 53a-b с высокими выходами. Нагревание указанных соединений при 200°С позволило данным субстратам пройти перегруппировку Кляйзена, с образованием альдегидов 47а и 47d с выходом приблизительно 50%. Наконец, хемоселективная гидрогенизация дифенилсульфидом в качестве каталитического яда12 дает альдегиды 47b и 47е с высоким выходом. Как показано на схеме А3с, каждый из гидразидов (46a-i) конденсируют с каждым из альдегидов (47а-е) в присутствии каталитического количества HCl с получением производных PAC-1 1-45, структуры которых приведены в таблице 1 (см. также фиг. 3 и 4).
Оценка аналогов РАС-1. После завершения синтеза оценивают биологическую активность соединений. Сначала определяют 72-часовые значения 1С50 соединений
против клеток U-937 в культуре (таблица 1). Обнаруживают, что каждое из соединений заметно индуцирует дозозависимую гибель клеток в данных условиях, и большинство соединений было приблизительно таким же мощным, как PAC-1 и S-PAC-1.
Далее, метаболическую стабильность соединений оценивают в микросомах печени крыс. Соединения оценивают в течение 3 часов при концентрации 10 мкМ, и метаболиты обнаруживают с помощью ЖХ/МС. Результаты данного анализа представлены в таблице 1. Соединения, содержащие бензоильные заместители были значительно более стабильны, чем аналогичные соединения, содержащие бензильные группы. Неожиданно оказалось, что пропилсодержащие соединения были менее устойчивы, чем аллилсодержащие соединения, хотя дигидроксилированные метаболиты не наблюдались у пропиловых соединений. Кроме того, S-PAC-1 был достаточно стабильным в микросомах печени, несмотря на короткий период полураспада соединения in vivo, что указывает на то, что другие механизмы элиминирования играют большую роль в удалении S-PAC-1 из организма.
Наконец, прогнозируемое значение logBB рассчитывают для каждого соединения. Этот алгоритм, который включает в себя площадь полярной поверхности и ClogP, используется для прогнозирования проницаемости малых молекул через гематоэнцефалический барьер (ГЭБ).13 Соединения с более положительными значениями logBB будут иметь более высокие концентрации в головном мозге, в то время как соединения с более отрицательными значениями logBB будут иметь более высокие концентрации в крови. Значения приведены в таблице 1. Как и ожидалось, несколько соединений, содержащих гидрофобные заместители, прогнозируемо преодолеют гематоэнцефалический барьер в большей степени, чем те, которые содержат более полярные заместители.
Оценка токсичности in vivo. С целью идентификации соединения с улучшенной переносимостью, 32 из 45 аналогов PAC-1 оценивают в опытах на мышах. Результаты исследования токсичности приведены в Таблице 1. Уровень токсичности оценивают по шкале от 0 (без наблюдаемых неблагоприятных эффектов) до 3 (тяжелая токсичность, вплоть до летального исхода). Многие из соединений приводят к летальному исходу мышей, и мыши умерли либо в течение 24 часов лечения, либо по истечении более 72 часов после лечения; эти результаты также отмечены.
Библиография
1. Putt, K.S.; Chen, G.W.; Pearson, J.M.; Sandhorst, J.S.; Hoagland, M.S.; Kwon, J.Т.; Hwang, S.K.; Jin, H.; Churchwell, M.I.; Cho, M.H.; Doerge, D.R.; Helferich, W.G.; Hergenrother, P.J., Small-molecule activation of procaspase-3 to caspase-3 as a personalized anticancer strategy. Nat. Chem. Biol. 2006, 2, 543-550.
2. Peterson, Q.P.; Goode, D.R.; West, D.C.; Ramsey, K.N.; Lee, J.J.Y.; Hergenrother, P.J., PAC-1 Activates Procaspase-3 in Vitro through Relief of Zinc-Mediated Inhibition. J. Mol. Biol. 2009, 388, 144-158.
3. Peterson, Q.P.; Hsu, D.C.; Goode, D.R.; Novotny, C.J.; Totten, R.K.; Hergenrother, P.J., Procaspase-3 Activation as an Anti-Cancer Strategy: Structure-Activity Relationship of Procaspase-Activating Compound 1 (PAC-1) and Its Cellular Co-Localization with Caspase-3. J. Med. Chem. 2009, 52, 5721-5731.
4. Charkoudian, L.K.; Pham, D.М.; Franz, K.J., A pro-chelator triggered by hydrogen peroxide inhibits iron-promoted hydroxyl radical formation. J. Am. Chem. Soc. 2006, 128, 12424-12425.
5. Aiuchi, Т.; Mihara, S.; Nakaya, М.; Masuda, Y.; Nakajo, S.; Nakaya, K., Zinc ions prevent processing of caspase-3 during apoptosis induced by geranylgeraniol in HL-60 cells. J. Biochem. 1998, 124, 300-303.
6. Chai, F.; Truong-Tran, A.Q.; Ho, L.H.; Zalewski, P.D., Regulation of caspase activation and apoptosis by cellular zinc fluxes and zinc deprivation: A review. Immunol. Cell Biol. 1999, 77, 272-278.
7. Perry, D.K.; Smyth, М.J.; Stennicke, H.R.; Salvesen, G.S.; Duriez, P.; Poirier, G.G.; Hannun, Y.A., Zinc is a potent inhibitor of the apoptotic protease, caspase-3. A novel target for zinc in the inhibition of apoptosis. J. Biol. Chem. 1997, 272, 18530-18533.
8. Lucas, P.W.; Schmit, J.М.; Peterson, Q.P.; West, D.C.; Hsu, D.C.; Novotny, C.J.; Dirikolu, L.; Churchwell, М.I.; Doerge, D.R.; Garrett, L.D.; Hergenrother, P.J.; Fan, T.М., Pharmacokinetics and derivation of an anticancer dosing regimen for PAC-1, a preferential small molecule activator of procaspase-3, in healthy dogs. Invest. New Drugs 2011, 29, 901-911.
9. Peterson, Q.P.; Hsu, D.C.; Novotny, C.J.; West, D.C.; Kim, D.; Schmit, J.М.; Dirikolu, L.; Hergenrother, P.J.; Fan, T.М., Discovery and canine preclinical assessment of a nontoxic procaspase-3-activating compound. Cancer Res. 2010, 70, 7232-7241.
10. West, D.C.; Qin, Y.; Peterson, Q.P.; Thomas, D.L.; Palchaudhuri, R.; Morrison, K.C.; Lucas, P.W.; Palmer, A.E.; Fan, T.М.; Hergenrother, P.J., Differential effects of procaspase-3 activating compounds in the induction of cancer cell death. Mol. Pharmaceutics 2012, 9, 1425-1434.
11. Hsu, D.C.; Roth, H.S.; West, D.C.; Botham, R.C.; Novotny, C.J.; Schmid, S.C.; Hergenrother