Новое 2-стирилпроизводное 4-(2,6-диметил-4-оксо-5-фенил-4н-пиримидин-1-ил)-бензсульфамида, обладающее эндотелеопротекторной активностью
Иллюстрации
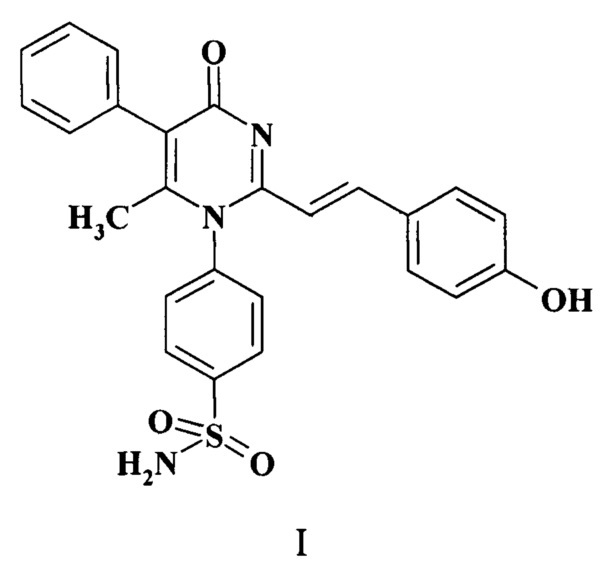
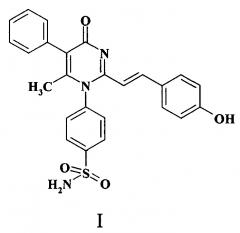
Показать всеИзобретение относится к новому 2-стирилпроизводному 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида формулы (I), обладающему эндотелиопротекторной активностью, и способу его получения. Соединение может найти применение в производстве лекарственных средств для кардиологии и эндокринологии. Соединение оказывает влияние на индуцированную вазодилатацию, скорость и степень агрегации тромбоцитов, уровень фактора фон Виллебранда, фибриногена, эндотелиальной синтазы оксида азота, ассиметрического диметиларгинина, матриксной металлопротеиназы-1 и протеинкиназы-С на фоне эндотелиальной дисфункции и превосходит по активности известный препарат сулодексид. Соединение соответствует формуле
Способ получения соединения формулы (I) заключается во взаимодействии 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида с салициловым альдегидом в смеси этанола и диметилсульфоксида в качестве реакционной среды. 2 н. и 1 з.п. ф-лы, 8 табл., 5 пр.
Реферат
Изобретение относится к области химико-фармацевтической промышленности и медицины и касается соединений, которые могут быть использованы для создания лекарственных средств эндотелиопротекторного действия. Получено новое 2-стирилпроизводное 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида, соединение формулы I, обладающее эндотелиопротекторной активностью. Также предложен способ его синтеза.
Несмотря на то что эндотелиопротекторные процессы сопряжены со многими заболеваниями, в настоящее время нет препаратов обладающих целенаправленным эндотелиопротекторным действием. Поэтому для коррекции нарушенных функций эндотелия используются лекарственные средства, применяемые в кардиологии и эндокринологии, влияние этих препаратов на эндотелий является побочным действием.
Таким образом, целенаправленное создание биологически активных соединений с эндотелиопротекторными свойствами для лечения сердечно-сосудистых заболеваний (ССЗ) и эндотелиальной дисфункции (ЭД), обладающих ингибирующим влиянием на активность протеинкиназа С (ПКС), является задачей данного изобретения [И.Н. Тюренков, А.В. Воронков, А.А. Слиецанс и др. // ВЕСТНИК РАМН. - 2012. - №7. - С. 54-57].
Известны ближайшие аналоги по структуре пиримидин-4(1Н)-она, среди которых имеются соединения, обладающие транквилизирующей, психотропной и антидепрессивной активностью [а.с. 1814291 СССР МКИ А61K 31/505], гипотензивной [а.с. 1822149 СССР МКИ А61K 31/505], антиоксидантной [Е.В. Петрова, Э.Т. Оганесян, И.П. Кодониди. Экспериментальная и клиническая фармакология. - 2013. - №6. - С. 38-40].
Известно производное 4-оксо-1,4-дигидропиримидина, обладающее антигипоксической, церебропротекторной и иммунотропной активностью [патент РФ 2179974], которое было принято за прототип предлагаемого биологически активного соединения.
В качестве ближайшего аналога по действию предлагается препарат «Сулодексид». Исходя из известных фармакологических свойств [Батюшин М.М., Пасечник Д.Г. Нефрология. 2014; 5: 52-58], «Сулодексид» оказывает наиболее выраженное эндотелиопротекторное действие по сравнению с другими лекарственными средствами, используемыми в медицине. Это позволяет рекомендовать его в качестве эталонного препарата сравнения при сопоставлении эндотелиотропных эффектов изучаемых веществ. Однако данный препарат нельзя назначать при заболеваниях, сопровождающихся нарушением свертываемости крови. Противопоказано лечение во время беременности и кормлении. Побочные действия могут наблюдаться со стороны пищеварительной системы, они проявляются в болях в эпигастрии, тошноте и рвоте.
Задача, на решение которой направленно заявляемое изобретение, заключается в разработке эффективной лекарственной субстанции, обладающей эндотелиопротекторными свойствами для лечения сердечно-сосудистых заболеваний и эндотелиальной дисфункции путем ингибирования протеинкиназа С.
Поставленная задача решается синтезом нового 2-стирилзамещенного N-арилсульфамидного 1Н-пиримидин-4-она с эндотелиопротекторными свойствами и низкой токсичностью.
Технический результат: получено новое 2-стирилпроизводное 1Н-пиримидин-4-она, обладающее выраженной эндотелиопротекторной активностью.
Заявляемый объект - 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид формулы (I), обладающий эндотелиопротерторной активностью.
Способ получения 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамида (I) основан на взаимодействии 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида с 4-гидроксибензальдегидом в смеси диметилсульфоксида и этанола.
Новое соединение проявляет эндотелиопротекторную активность.
Сущность изобретения поясняется следующими примерами.
Пример 1. Синтез 4-{2-[2-(4-Гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид (I)
Смесь 3,55 г (0,01 моль) 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида и 1,22 г (0,01 моль) 4-гидроксибензальдегида кипятят в среде 4 мл диметилсульфоксида и 2 мл этанола в течение 3 часов. Реакционную смесь охлаждают, продукт осаждают водой, осадок отфильтровывают, промывают эфиром диэтиловым. Выход 4,17 г (91%). Вещество представляет собой желтый кристаллический порошок без запаха, трудно растворим в этаноле, этилацетате, нерастворим в эфире. Т. пл. 326-327°C (из этилацетата).
Спектр 1Н ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,67 (с, 3H, СН3); 5,91-5,96 (д, 1Н, СН); 6,72-6,75 (д, 2Н, ArH); 7,19-7,43 (м, 7Н, ArH); 7,59 (с, 2Н, NH2); 7,61-7,85 (т, 3H, ArH+СН); 7,05-7,08 (д, 2Н, ArH); 9,98 (с, уш., 1Н, ОН).
Найдено (%): С 65.28; Н 4.24; N 9.14. C25H21N3O4S.
Вычислено (%): С 65.07; Н 4.56; N 9.03.
Изучение эндотелиопротекторных свойств нового 2-стирилпроизводного пиримидина (I) осуществлялось путем оценки его влияния на вазодилатирующую, антитромботическую, противоспалительную функции эндотелия. Представлялось интересным выявить предположительный механизм фармакологического действия заявляемого вещества.
Пример 2. Изучение вазодилатирующей функции 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид (I).
Вазодилатирующую функцию оценивали путем измерения скорости церебрального кровотока (СК) в теменной области головного мозга крыс допплерографическим методом. Для оценки функционального состояния эндотелия сосудистого русла среднемозговой артерии осуществлялось с помощью анализатора - ацетилхолина (АХ (sigma, США)), в дозе 0,1 мг/кг (таблица 1).
В группе №1 у ложнооперированных (ЛО)-животных скорость церебрального кровотока составляла 4,18±0,17 см/с. Введение ацетилхолина приводило к увеличению скорость церебрального кровотока до 6,1±0,23 см/м, что превышает исходные показатели на 46,77±4,74%.
В группе у животных с недостаточностью половых гормонов исходная скорость церебрального кровотока составляла 2,61±0,08 см/с, а введение ацетилхолина приводило к увеличению кровотока до 3,29±0,11 см/с, т.е. на 26,11±0,77%, что в 1,79 раза достоверно ниже такового прироста у ЛО-группы. Т.о., недостаточность половых гормонов (эстрогенов) у животных может приводить к нарушению вазодилатирующей функции эндотелия, выраженной в снижении скорости церебрального кровотока в ответ на введение ацетилхолина.
В группе животным с недостаточность половых гормонов, которым вводили препарат сравнения - Сулодексид, исходная скорость церебрального кровотока составляла 4,14±0,24 см/с, а кровоток, стимулированный введением ацетилхолина, составлял 5,7±0,34 см/с, т.е. на 37,6±2,5% превышает исходные показатели. Прирост кровотока в ответ на введение ацетилхолина у животных, которым вводили Сулодексид, достоверно выше в 1,44 раза, чем у негативного контроля (группа НПГ), что может говорить об эндотелиопротекторной активности препарата.
Животным, которым вводили вещество I, введение ацетилхолина привело к приросту кровотока на 40,83±2,9%, что достоверно превышает этот показатель у группы НПГ в 1,56 раз, и он несколько выше, чем у животных, которым вводили сулодексид.
Таким образом, НПГ приводит к снижению исходной и ацетилхолин-индуцированной скорости кровотока, а введение препарата сравнения и соединения I позволило нивелировать эти изменения, причем исследуемое вещество в 1,1 раза более активно, чем препарат сравнения.
Пример 3. Изучение антитромботической функции 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид (I).
Антитромботическую функцию оценивали путем анализа показателей агрегации тромбоцитов, полученных на двухканальном лазерном анализаторе агрегации тромбоцитов АЛАТ - 2 «БИОЛА» (НПФ «БИОЛА», Россия). В качестве индуктора агрегации добавляли динатриевую соль аденозин-5-дифосфорной кислоты (АДФ, НПО «Ренам») в конечной концентрации 5 мкМ.
Влияние на антитромботическую функцию эндотелия также оценивали путем изучения изменений параметров коагуляционного гемостаза и уровня фактора фон Виллебранда. Процессы коагуляции исследовали на анализаторе показателей гемостаза АПГ2-01 «МИНИЛАБ 701» хронометрическим методом. При этом регистрировались следующие показатели: активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), протромбиновое время (ПВ) концентрация фибриногена (реактивы производства НПО «Ренам»). Активность фактора фон Виллебранда (FW) определяли агглютинационным методом и регистрировали время от момента добавления Виллебранд - реагента до начала появления агглютинации и по калибровочному графику определяли активность фактора фон Виллебранда в %.
Оценку влияния исследуемого вещества на антиромботическую функции проводили путем измерения показателей тромбоцитарного, коагуляционного звеньев гемостаза и уровня фактора фон Виллебранда. Для начала проводился анализ количества тромбоцитов с помощью биохимического анализатора. Как видно из таблицы №2 и №3, уровень тромбоцитов всех групп достоверно не отличался между собой, что повышает достоверность данных по агрегации.
Анализируя данные, полученные при оценке аденозин-5-дифосфорной - индуцированной агрегации тромбоцитов, можно сделать вывод, что недостаточность половых гормонов у крыс-самок способствует повышению степени агрегации тромбоцитов в 2,1 раза (Р<0,01), относительно группы ложнооперированных (ЛО) животных. Также у крыс группы негативного контроля по сравнению с ЛО-группой животных отмечено увеличение скорости агрегации в 4,57 (Р<0,01) раза. Следует подчеркнуть, что показатель агрегации тромбоцитов во всех экспериментальных группах крыс значимо не отличался. Полученные результаты, вероятно, можно объяснить тем, что эстрогены играют важную роль в регуляции функциональной активности сосудистого эндотелия.
Курсовое введение сулодексида в значительной мере способствовало снижению агрегационного потенциала. Так степень агрегации тромбоцитов по сравнению с группой крыс негативного контроля уменьшилась в 1,6 раза, а скорость агрегации снижалась в 4,1 раза и статистически значимо не отличалась от показателей ложнооперированных крыс.
28-дневное внутрибрюшинное введение соединения I оказало наиболее выраженное влияние на показатели агрегации тромбоцитов. Степень и скорость агрегации тромбоцитов относительно группы крыс негативного контроля уменьшились в 2,16 (Р<0,01) и 5,13 (Р<0,01) раза соответственно. При этом данные показатели практически не отличались от таковых группы ложнооперированных животных.
Для подтверждения влияния исследуемых соединений на функцию эндотелия в процессах гемостаза проведено определение уровня фактора фон Виллебранда (фВ) - одного из специфических маркеров эндотелиальной дисфункции, способствующего адгезии тромбоцитов к субэндотелиальному коллагену с их последующей активацией (таблица №4).
У животных с моделируемой патологией, не подвергавшихся фармакотерапии, наблюдалось достоверное превышение фактора фон Виллебранда в 1,45 раза по сравнению с ЛО-группой, что может говорить о выраженной эндотелиальной дисфункции при недостаточности половых гормонов и объяснить усиление процессов агрегации.
Уровень фактора фон Виллебранда в сулодексид-группе крыс был достоверно ниже, чем у животных с недостаточности половых гормонов в 1,17 раза, а введение соединения 1 уменьшало этот показатель в 1,29 раз.
Для оценки влияния исследуемого соединения на процессы гемостаза определяли активированное частичное тромбопластиновое время (характеризует внутренний механизм активации протромбиназы - факторы XII, XI, VIII), протромбиновое время (характеризует внешний путь свертывания - факторы V, VII, X), тромбиновое время (характеризует стадию образования фибрина) и количество фибриногена, который также является маркером эндотелиальной дисфункции, в плазме крови животных с экспериментальной недостаточность половых гормонов (таблица №5).
У животных с моделью эндотелиальной дисфункции, вызванной недостаточность половых гормонов, наблюдались достоверные изменения показателей гемостаза относительно ЛО-группы. Так, активированное частичное тромбопластиновое время НПГ-группы было в 1,9 раза меньше, чем у ЛО-группы, что может говорить о повышении активности внутренней системы активации протромбина. Также протромбиновое время в группе негативного контроля в 1,79 раза было меньше такового у ЛО-крыс, что также говорит о смещении процессов свертывания в сторону гиперкоагуляции. Анализ тромбинового времени в данной экспериментальной группы показал его снижение в 1,6 раза при сравнении с ЛО-группой, что указывает на усиление процессов образования фибрина и снижения активности противосвертывающей системы. Количество фибриногена у овариоэктомизированных животных было в 1,67 раза достоверно выше показателей ЛО-группы, что свидетельствуя об ухудшении системы свертывания в сторону тромбообразования и возможном ухудшении функционирования эндотелиальных клеток.
Фармакотерапия животных с недостаточность половых гормонов с помощью препарата сулодексида приводило к достоверному снижению активности системы плазменного гемостаза в сравнении с НПГ-группой. Это выражалось в увеличении активированного частичного тромбопластинового время в 2,03 раза, протромбинового время - в 2,02 раза, тромбинового время - в 1,39 раза, а также в снижении количества фибриногена в 1,39 раза
Курсовое введение вещества I животным с недостаточность половых гормонов снижало активность процессов гиперкоагуляции, наблюдаемых в группе негативного контроля, что подтверждалось увеличением активированного частичного тромбопластинового время в 1,38 раза, протромбинового время - в 1,36 раза, тромбинового время - в 1,21 раза, а количество фибриногена уменьшается в 1,51 раза. Т.о., исследуемое вещество обладает антикоагулянтными свойствами у крыс с моделированной патологией, но активность его несколько меньше, чем у сулодексида.
Таким образом, установлено, что недостаточность половых гормонов вызывает смещение системы гемостаза в сторону гиперкоагуляции, а введение препарата сравнения и вещества I позволило уменьшить такие отклонения. Исследуемое вещество превосходило по активности сулодексид по влиянию на показатели скорости (в 1,25 раза) и степени агрегации (в 1,35 раза), уровня фактора фон Виллебранда (в 1,1 раза) и фибриногена (в 1,1 раза), а по другим показателям коагуляционного гемостаза несколько уступало препарату сравнения. Это, возможно, связано с различием в механизмах действия заявляемого вещества и препарата сравнения.
Пример 4. Оценка влияния 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид (I), на уровень С-реактивного белка и уровень лейкоцитов при экспериментальной недостаточности половых гормонов.
Анализ уровня лейкоцитов в экспериментальных группах животных (таблица №6) с помощью биохимического анализатора показал, что в группе животных с недостаточность половых гормонов количество лейкоцитов в 1,47 раза выше, чем у ЛО-группы, что указывает на развитие воспалительных процессов в организме животного.
Введение препарата сравнения сулодексида к изменению уровня лейкоцитов практически не привело, а введение вещества I немного снижало их количество, но с недостаточной степенью достоверности (Р≤0,1) по сравнению с НПГ-группой (таблица №7).
В группе негативного контроля (таблица №7) наблюдалось значительное увеличение уровня С-реактивного белка: в 3,7 раза больше, чем у ЛО-группы, что может говорить о развитии воспалительных процессов.
Введение препарата сравнения группе овариоэктомизированных крыс приводило к снижению концентрации С-реактивного белка в 1,54 раза по сравнению с НПГ-группой. Вещество I способствовало снижению уровня С-реактивного белка в 1,35 раза по сравнению с группой негативного контроля.
Следует отметить, что недостаточность половых гормонов приводит к усилению воспалительных процессов, что выражается в увеличении уровня С-реактивного белка, и введение препарата сравнения и исследуемого вещества I приводило к достоверному его снижению, причем действие сулодексида незначительно превышало активность вещества I.
Пример 5. Определение концентрации гормонов эстрадиола и фолликулостимулирующего гормона, асимметрического диметиларгинина, эндотелиальной синтазы оксида азота, нейрональной синтазы оксида азота, индуцибельной синтазы оксида азота, тромбоксана А2, протеинкиназы С и матриксной металлопротеиназы 1 методом иммуноферментный анализ в плазме крови животных с недостаточностью половых гормонов при экспериментальной терапии соединением 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамид (I).
С целью изучения механизма эндотелиопротекторного действия вещества I было целесообразно провести определение уровня протеинкиназы-С, асимметрического диметиларгинина, эндотелиальнаой синтазы оксида азота, нейрональной синтазы оксида азота, индуцибельной синтазы оксида азота, тромбоксана А2 и матриксной металлопротеиназы-1. Все они являются маркерами эндотелиальной дисфункции, агрегации тромбоцитов, процессов воспаления и пролиферации (таблица №8).
Как видно из таблицы №8, при сравнении показателей группы негативного контроля с абсолютными значениями ЛО-группы наблюдалось выраженное снижение уровня эстрадиола в 3,012 раза, и в то же время уровень фолликулостимулирующий гормон у НПГ-самок был достоверно выше в 6,45 раза, чем в группе положительного контроля. Это позволяет предположить, что повышенная работа системы гипоталамуса-гипофиза направлена на компенсацию сниженного уровня эстрогенов.
При определении эндотелиоспецифичных маркеров у животных с экспериментальной патологией наблюдалось статистически значимое снижение эндотелиальной синтазы оксида азота в 1,62 раза на фоне повышения уровней нейрональной синтазы оксида азота в 1,47 раз, индуцибельной синтазы оксида азота в 4,64 раз, асимметрического диметиларгинина в 2,5 раз относительно ЛО-группы. Следовательно, возможно приводит к развитию эндотелиальной дисфункции, так как наряду с уменьшением уровня эндотелиальной синтазы повышаются нейрональная синтаза и индуцибельная синтаза оксида азота. Эти процессы являются нежелательными из-за образования ими свободных радикалов и пероксинитрита.
Наряду с изменениями маркеров эндотелиальной дисфункции в НПГ-группе достоверно повышается уровень проагреганта тромбоцитов тромбоксана А2 в 6,69 раз относительно ЛО-группы, что подтверждает повышение тромбогенного потенциала при эндотелиальной дисфункции, вызванного недостаточностью половых гормонов.
Увеличение концентрации матриксной металлопротеиназы-1 в плазме крови животных группы негативного контроля в 13,07 раз при сравнении с ЛО-группой указывает на усиление воспалительно-пролиферативных процессов в условиях патологии.
Вместе с изменениями выше описанных маркеров в плазме крови овариоэктомизированных животных наблюдалось выраженное повышение уровня протеинкиназы-С (в 6,18 раз) относительно ЛО-группы, что является крайне нежелательным и может быть ключевым звеном нарушения основных функций эндотелия при гормональном дисбалансе и эндотелиальной дисфункции.
Введение препарата сравнения, обладающего выраженными эндотелиопротекторными свойствами, не приводит к изменению гормонального фона (фолликулостимулирующий гормон и эстрадиола). При применении сулодексида наблюдалось увеличение эндотелиальной синтазы оксида азота в 1,67 раз и снижение асимметрического диметиларгинина в 2,53 раза, снижение уровня тромбоксана А2 в 1,7 раз и уменьшение концентрации матриксной металлопротеиназы-1 в 1,46 раза при сравнении с НПГ-группой. Необходимо подчеркнуть, что изменение уровня протеинкиназы-С под действием сулодексида не происходит.
Экспериментальное введение животным с недостаточностью половых гормонов исследуемого соединения I не вызывает изменения уровня эстрадиола и количества фолликулостимулирующий гормона. Введение вещества I позволило уменьшить эндотелиальной дисфункции путем увеличения концентрации эндотелиальной синтазы оксида азота в 1,87 раз и снижению асимметрического диметиларгинина в 1,69 раз у крыс с овариэктомией. Интересно, что изменения эндотелиальных маркеров коррелируют со снижением агрегационного фактора тромбоцитов тромбоксана А2 в 1,61 раза, уменьшением матриксной металлопротеиназы-1 в 2,69 раз и уровня протеинкиназа С в 1,92 раза.
Препарат сравнения и вещество I показали высокую активность на состояние показателей, определяемых иммуноферментным анализом, причем вещество I превосходило сулодексид по влиянию на уровни эндотелиальной синтазы оксида азота (в 1,12 раз), асимметрического диметиларгинина (1,19 раз), и наиболее отчетливо - на матриксной металлопротеиназы-1 (в 1,86 раза) и протеинкиназы-С (1,81 раза). Судя по всему, это связано с различным механизмом эндотелиотропного действия препарата сравнения и вещества I.
Таким образом, исследуемое вещество I превосходило препарат сравнения по влиянию на индуцированную вазодилатацию, скорость и степень агрегации тромбоцитов, уровню фактора фон Виллебранда, фибриногена, эндотелиальной синтазы оксида азота, асимметрического диметиларгинина, матриксной металлопротеиназы-1 и протеинкиназы-С, на фоне эндотелиальной дисфункции, вызванной недостаточностью половых гормонов. Использование методов иммуногистохимического и иммуноферментного анализа позволило подтвердить более выраженное влияние вещества I на эндотелиальную синтазу оксида азота и протеинкиназу-С, причем препарат сравнения практически не оказывал влияния на уровень протеинкиназы-С. Все это позволяет предположить, что влияние на активность протеинкиназа-С соединения I является важным звеном в реализации его эндотелиопротекторного эффекта.
1. 2-Стирилпроизводное 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)бензсульфамида формулы I
2. Соединение по п. 1, обладающее выраженной эндотелиопротекторной активностью.
3. Способ получения 4-{2-[2-(4-гидроксифенил)-винил]-6-метил-4-оксо-5-фенил-4Н-пиримидин-1-ил}-бензсульфамида формулы (I), заключающийся во взаимодействии 4-(2,6-диметил-4-оксо-5-фенил-4Н-пиримидин-1-ил)-бензсульфамида с салициловым альдегидом в смеси этанола и диметилсульфоксида в качестве реакционной среды.