Получение полиплоидных растений березы
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения тетраплоидных растений березы, включающему обработку растительного материала антимитотическим агентом с последующей регенерацией растений. Способ отличается тем, что в качестве антимитотического агента используется оризалин, в качестве растительного материала используются пазушные почки in vitro, исходная культура растительного материала in vitro подвергается ювенилизации, в качестве среды для регенерации используется агаризованная питательная среда QL, а также использованием в период регенерации темновой фазы продолжительностью две недели. Изобретение позволяет эффективно создавать новые формы березы путем искусственного изменения плоидности. 2 з.п. ф-лы, 1 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к области биотехнологии растений и может быть использовано для создания новых форм березы путем искусственного изменения плоидности.
Уровень техники
Несмотря на то что по площади лесов Российская Федерация занимает в мире первое место (20,1% от общей площади лесов в мире), по объему заготовки древесины наша страна занимает только четвертое место. Такое различие связано в основном с труднодоступностью лесов и низкой рентабельностью лесоразработки в отдаленных регионах в связи с неразвитой инфраструктурой. Наиболее эффективным решением данной проблемы является активизация работ по лесовосстановлению с использованием высокопродуктивных генотипов различных пород деревьев. В то же время селекционная работа среди древесных видов растений практически не проводиться из-за длительного жизненного цикла деревьев. Повышение продуктивности возможно за счет применения современных биотехнологических методов, в числе которых искусственное изменение плоидности.
Береза является ценной породой и занимает третье место по площади занимаемых земель (около 116 млн. га) в России. Береза относится к культурам, малотребовательным к почвам и условиям окружающей среды, что немаловажно для нашей страны. Последние годы наблюдается снижение уровня производства в лесопромышленном комплексе и одним из путей интенсификации производства может быть выращивание высокопродуктивных форм различных видов деревьев, включая березу.
Задачей предлагаемого изобретения является получение полиплоидных растений березы с ускоренными темпами роста. Общеизвестно, что полиплоидные растения обладают повышенной продуктивностью по сравнению с исходными диплоидными формами. Наличие такой формы березы позволит ускорить выход целевой древесины. Себестоимость посадочного материала такой формы будет ниже традиционных за счет сокращения времени доращивания.
Поставленная задача достигается за счет нарушения процесса митоза в меристемных участках микропобегов березы с последующей регенерацией растений.
Общепринятым является способ изменения плоидности растений с помощью обработки колхицином. Например, известен способ получения полиплоидов березы путем обработки колхицином семян во время прорастания (Sarkilahti Е., Valanne Т. Induced polyploidy in Betula // Silva Fennica, 1990, 24: 227-234). Однако обработка колхицином вызывает у растений ряд нежелательных эффектов: стерильность, отклонения в росте, потери или перестановки хромосом (Luckett D. Colchicine mutagenesis is associated with substantial heritable variation in cotton // Euphytica, 1989, 42: 177-182). Кроме того, колхицин очень токсичен для человека (Morejohn L.C., Bureau Т.Е., Tocchi L.P., Fosket D.E. Tubulins from different higher-plant species are immunologically nonidentical and bind colchicine differentially. Proc Natl Acad Sci USA, 1984, 81: 1440-1444), что требует при работе с ним использования особых мер предосторожности. Недостатком вышеупомянутого способа является также использование семян, что исключает сохранение генетической идентичности исходному генотипу.
Наиболее близким к заявляемому изобретению является способ получения тетраплоидов тополя путем обработки колхицином растений in vitro (Ewald D., Ulrich K., Naujoks G., Schroder M.-B. Induction of tetraploid poplar and black locust plants using colchicine: chloroplast number as an early marker for selecting polyploids in vitro // Plant Cell Tiss Organ Cult, 2009, 99: 353-357). Недостатком ближайшего аналога является использование колхицина. Кроме того, использование в качестве эксплантов только кончиков побегов снижает эффективность использования имеющегося растительного материала in vitro.
Раскрытие изобретения
Задачей изобретения является повышение эффективности получения полиплоидных растений березы путем обработки антимитотическим агентом растительного материала in vitro.
Поставленная задача решается благодаря следующим изменениям в способе получения полиплоидных растений: а) в качестве антимитотического агента используется оризалин в концентрации 5 микромоль и продолжительностью обработки 24 ч; б) для регенерации полиплоидных растений используются пазушные почки микропобегов березы in vitro; в) увеличением числа активно делящихся клеток в микропобегах путем ювенилизации (омоложения) культуры березы in vitro путем сокращения периода субкультивации до 21 дня; г) использованием в качестве среды для регенерации агаризованной питательной среды QL (Quorin М., Lepoivre P. Elude de milieux adaptes aux cultures in vitro de Prunus // Acta Hort. 1977. 78: 437-442), содержащей 0.8 мг/л 6-БАП, 30 г/л сахарозы и витамины QL; д) использованием во время регенерации темновой фазы продолжительностью две недели.
Краткое описание чертежей
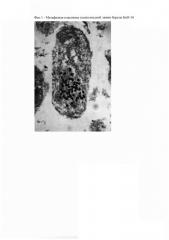
Фиг. 1 - Метафазная пластинка полиплоидной линии березы БпО-14.
Осуществление изобретения
Пример 1. Омоложение исходной культуры березы in vitro.
Получают ювенильные (омоложенные) микрорастения березы за счет сокращения длины субкультивирования до 21 дня в сочетании с активным черенкованием микропобегов.
Пример 2. Подготовка эксплантов.
Перед экспериментом растения извлекают из культуральных банок, отделяют от побегов листья и корни, и нарезают на отдельные сегменты, содержащие одну пару почек. Для предотвращения увядания побегов все процедуры по подготовке сегментов микрорастений проводят в чашках Петри, с добавлением жидкой питательной среды QL.
Пример 3. Обработка эксплантов антимитотическим агентом.
Сегменты микрорастений березы (примерно 50 шт.) помещают в лабораторный стакан вместимостью 150 мл, в который добавляют 25 мл раствора оризалина с концентрацией 5 микромоль. Стакан с сегментами герметично закрывают с помощью полиэтиленовой пленки и помещают на качалку со скоростью вращения 60 об/мин.
Пример 4. Регенерация полиплоидных растений.
Через 24 часа сегменты микрорастений извлекают, ополаскивают стерильной дистиллированной водой и горизонтально раскладывают на чашки Петри с агаризованной питательной средой QL, содержащей 6-БАП (6-бензиламинопурин) с концентрацией 0.8 мг/л, витамины по прописи QL и сахарозу с концентрацией 30 г/л. Чашки Петри помещают в термостат с температурой 26°C без освещения на 2 недели, после чего чашки перемещают на светокультуральный стеллаж с фотопериодом 16/8 часов и интенсивностью освещения около 2000 люкс. Регенерированные растения отделяют от исходного экспланта и рассаживают в отдельные культуральные емкости.
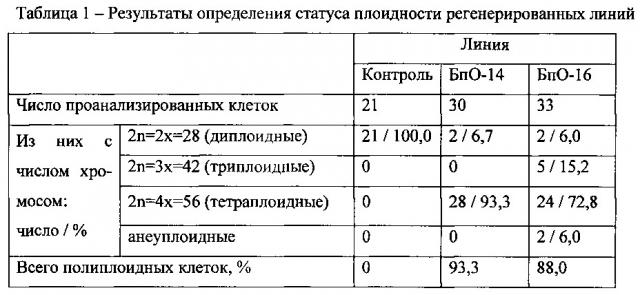
Пример 5. Оценка уровня плоидности.
Для анализа уровня плоидности регенерированных растений березы используют корневую меристему, которые подвергают предобработке 0,002 М раствором 8-оксихинолина утром в течение 3 часов с последующей их фиксацией спиртово-уксусной смесью (3:1). Давленые препараты, окрашенные ацетогематоксилином, изготавливают по методике (Топильская Л.А. Изучение соматических и мейотических хромосом смородины на ацетогематоксилиновых давленых препаратах / Л.А. Топильская, С.А. Лучникова, Н.П. Чувашина // Бюл. науч. информ. Центр. генет. лаб. им. И.В. Мичурина, 1975. - Вып. 22. - С. 107). Для каждого образца (линии) просматривают по 8-10 микропрепаратов.
Число хромосом подсчитывают на 20-30 метафазных пластинках. Основные этапы изготовления микропрепаратов: 1) Мацерация - материал отмывают от фиксатора дистиллированной водой и помещают в 1N раствор HCl на 10 минут, а затем в 18% раствор HCl на 20 минут; 2) Тщательно промывают материал в двух-трех сменах дистиллированной воды; 3) Ополаскивают в 45% уксусной кислоте и помещают в свежую порцию на 20 минут; 4) Окрашивают материал ацетогематоксилином в течение двух часов при температуре 25-28°C; 5) Промывают материал в 45% уксусной кислоте. Раздавливают объект на предметном стекле в капле жидкости Гойера. Просмотр микропрепаратов осуществляют на микроскопе Микмед 6 при увеличении 40×1,5×10 и 100×1.5×10. Микрофотосъемку проводят с использованием цифровой камеры окуляра DCM500 (USB 2.0; WEBBERS MYscope 500 М). Критерием для отнесения линии к тому или иному уровню плоидности является существенное преобладание (свыше 70%) клеток в корневой меристеме с определенным уровнем плоидности.
Результаты анализа представлены в таблице 1 и на Фиг. 1.
1. Способ получения тетраплоидных растений березы, включающий обработку растительного материала антимитотическим агентом с последующей регенерацией растений, отличающийся тем, что в качестве антимитотического агента используется оризалин в концентрации 5 микромоль и продолжительностью обработки 24 ч, в качестве растительного материала используются пазушные почки in vitro, исходная культура растительного материала in vitro подвергается ювенилизации (омоложению) путем сокращения периода субкультивирования до 21 дня, в качестве среды для регенерации используется агаризованная питательная среда QL, содержащая 0.8 мг/л 6-БАП, 30 г/л сахарозы и витамины QL, а также использованием в период регенерации темновой фазы продолжительностью две недели.
2. Способ по п. 1, отличающийся тем, что оценку уровня плоидности растений березы проводят путем подсчета количества хромосом в корневой меристеме растений.
3. Способ по п. 1, отличающийся тем, что критерием тетраплоидности растений березы является наличие свыше 70% тетраплоидных клеток в корневой меристеме растений.