Оптимизация растворимости иммуносвязывающих средств
Иллюстрации
Показать всеИзобретение относится к биохимии и биотехнологии. Описан фрагмент антитела для использования в качестве терапевтического средства, содержащий один из следующих повышающих растворимость мотивов в аминокислотных положениях 12, 103 и 144 тяжелой цепи (АНо нумерация): Серин (S) в аминокислотном положении 12 тяжелой цепи; Серин (S) в аминокислотном положении 103 тяжелой цепи; и Треонин (Т) в аминокислотном положении 144 тяжелой цепи; или Серин (S) в аминокислотном положении 12 тяжелой цепи; Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и Серин (S) в аминокислотном положении 144 тяжелой цепи; или Серин (S) в аминокислотном положении 12 тяжелой цепи; Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и Треонин (Т) в аминокислотном положении 144 тяжелой цепи. Изобретение позволяет улучшать растворимость иммуносвязывающих средств, в частности одноцепочечных антител (scFv). Представлена композиция для терапии, содержащая описанный фрагмент антитела. Также описан каркас. Способ повышения растворимости фрагмента антитела в нативном состоянии, содержащего вариабельную область (VH) тяжелой цепи или ее фрагмент, включающий выбор для мутации по меньшей мере трех аминокислотных положений в пределах области VH, и проведение мутации по меньшей мере в трех аминокислотных положениях, выбранных для мутации, где по меньшей мере три аминокислотных положения выбраны из группы аминокислотных положений тяжелой цепи, состоящей из положений 12, 103 и 144 (в соответствии с правилом нумерации АНо), и проведение мутации включает замещение аминокислоты в выбранном аминокислотном положении на гидрофильную аминокислоту. Также представлен соответствующий каркас вариабельного домена тяжелой цепи антитела для использования при получении терапевтического средства и композиция, содержащая такой каркас. 5 н. и 12 з.п. ф-лы, 6 ил., 14 табл., 4 пр.
Реферат
Родственные заявки
По настоящей заявке испрашивается приоритет заявки на патент США 61/075692, озаглавленной «Оптимизация растворимости имммуносвязывающих средств», поданной 25 июня 2008 г.
Предпосылки создания изобретения
Доказано, что антитела являются очень эффективными и успешными терапевтическими агентами при лечении рака, аутоиммунных заболеваний и других нарушений. Хотя клинически обычно используются полноразмерные антитела, применение фрагментов антитела может дать ряд преимуществ, таких как повышенная проникающая способность в ткани, отсутствие Fc-эффекторной функции в сочетании со способностью добавлять другие эффекторные функции и вероятностью меньшего системного побочного действия благодаря более короткому системному времени полужизни in vivo. Фармакокинетические свойства фрагментов антител показывают, что они могут быть особенно подходящими для локализованных терапевтических подходов. Кроме того, в некоторых системах экспрессии легче продуцировать фрагменты антител, чем полноразмерные антитела.
Одним типом фрагментов антител является одноцепочечное антитело (scFv), которое состоит из вариабельного домена тяжелой цепи (VH), связанного с вариабельным доменом легкой цепи (VL) линкерной последовательностью. Таким образом, scFv не содержит всех доменов константных областей антитела, и аминокислотные остатки исходной границы раздела вариабельный/константный домен (остатки поверхности раздела) становятся открытыми для растворителя. scFv можно получать из полноразмерного антитела (например, молекула IgG) c помощью разработанных методов рекомбинатной инженерии. Однако трансформация полноразмерного антитела в scFv часто приводит к плохой стабильности и растворимости белка, низким выходам при получении и высокой тенденции к агрегации, что повышает риск иммуногенности.
Соответственно предпринимались попытки для улучшения свойств scFv, таких как растворимость. Например, Nieba L. и др. (Prot. Eng. (1997) 10:435-444) выбрал три аминокислотных остатка, известных как остатки поверхности раздела, и осуществил их мутацию. Авторы наблюдали повышенную периплазматическую экспрессию мутированного scFv в бактериях, а также пониженную скорость термоиндуцированной агрегации, хотя термодинамическая стабильность и растворимость существенно не изменялись. Кроме того, в своей публикации, авторы ясно указывают, что они не наблюдали каких-либо улучшений растворимости структуры нативного белка сконструированных scFv, как было определено методом ПЭГ-осаждения. Также сообщалось о других исследованиях, в которых был проведен сайт-направленный мутагенез определенных аминокислотных остатков в scFv (см., например, Tan, P.H. et al. (1988) Biophys. J. 75:1473-1482; Worn, A. and Pluckthun, A. (1998) Biochem. 37:13120-13127; Worn, A. and Pluckthun, A. (1999) Biochem. 38:8739-8750). В данных разнообразных исследованиях аминокислотные остатки, выбранные для мутагенеза, были выбраны на основании их известных положений в структуре scFv (например, по данным исследований молекулярного моделирования).
В другом подходе, определяющие комплементарность области (CDR) очень плохо экспрессируемого scFv прививали на каркасные области scFv, для которого было продемонстрировано наличие подходящих свойств (Jung, S. and Pluckthun, A. (1997) Prot. Eng. 10:959-966). Полученный scFv показал повышенную экспрессию в растворе и термодинамическую стабильность.
Прогресс в инженерии scFv с целью улучшения их растворимости и других функциональных свойств систематизирован в виде обзора, например, Worn, A. and Pluckthun, A. (2001) J. MoI. Biol. 305:989-1010. Однако все еще сохраняется потребность в новых подходах, которые дают возможность рационального конструирования иммуносвязывающих средств, в частности, scFv с превосходной растворимостью. Более того, все еще необходимы способы инженерии scFv и других типов антител для придания им повышенной растворимости – в особенности растворимости нативного белка.
Краткое изложение сущности изобретения
Данное изобретение относится к иммуносвязывающему средству, содержащему мотив повышенной растворимости в вариабельной области тяжелой цепи VH, а также к способам инженерии иммуносвязывающих средств, таких как антитела scFv, для придания им повышенной растворимости. В конкретных вариантах осуществления способы по изобретению включают замещение аминокислот в последовательности вариабельной области тяжелой цепи и/или вариабельной области легкой цепи иммуносвязывающего средства, которые являются потенциально проблематичными с точки зрения растворимости, на предпочтительные аминокислотные остатки, которые придают повышенную растворимость. Например, в некоторых предпочтительных вариантах осуществления гидрофобный остаток заменяют на гидрофильный остаток.
Предпочтительно разработанное иммуносвязывающее средство, иммуносвязывающее средство, использованное или полученное с помощью способов инженерии по изобретению, представляет собой scFv, но другие иммуносвязывающие средства, такие как полноразмерные иммуноглобулины, Fab фрагменты, однодоменные антитела (например, Dab) и нанотела также могут быть сконструированы в соответствии с данным способом. Изобретение также охватывает иммуносвязывающие средства, полученные в соответствии со способом конструирования, а также композиции, содержащие иммуносвязывающие средства и фармацевтически приемлемый носитель.
В одном аспекте изобретение относится к иммуносвязывающему средству, содержащему один из следующих повышающих растворимость мотивов в аминокислотных положениях 12, 103 и 144 тяжелой цепи (АНо нумерация):
(а) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b) Серин (S) в аминокислотном положении 103 тяжелой цепи; и
(c) Треонин (Т) в аминокислотном положении 144 тяжелой цепи; или
(а1) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b1) Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и
(c1) Серин (S) в аминокислотном положении 144 тяжелой цепи; или
(а2) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b2) Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и
(c2) Треонин (Т) в аминокислотном положении 144 тяжелой цепи; или
(а3) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b3) Серин (S) в аминокислотном положении 103 тяжелой цепи; и
(c3) Серин (S) в аминокислотном положении 144 тяжелой цепи.
В другом аспекте изобретение относится к способу конструирования иммуносвязывающего средства, содержащего (i) вариабельную область тяжелой цепи или ее фрагмент, где вариабельная область тяжелой цепи содержит остатки каркасной области VH, и/или (ii) вариабельную область легкой цепи или ее фрагмент, где вариабельная область легкой цепи содержит остатки каркасной области VL, где указанный способ включает
А) выбор по меньшей мере двух аминокислотных положений в пределах остатков каркасной области VH, остатков каркасной области VL или остатков каркасной области VH и VL для мутации; и
В) проведение мутации по меньшей мере двух аминокислотных положений, выбранных для мутации,
где если по меньшей мере два аминокислотных положения, выбранных для мутации, находятся в пределах остатков каркасной области VH, то замещение протекает в одном или нескольких аминокислотных положениях тяжелой цепи, выбранных из группы, состоящей из положений 12, 103 и 144 (согласно правилам нумерации АНо), и/или
где если по меньшей мере одно или несколько аминокислотных положений, выбранных для мутации, находятся в пределах остатков каркасной области VL, то замещение протекает в аминокислотном положении легкой цепи, выбранном из группы, состоящей из положений 15, 52 и 147 (согласно правилам нумерации АНо; аминокислотного положения 15, 44 и 106 при использовании нумерации Кабата).
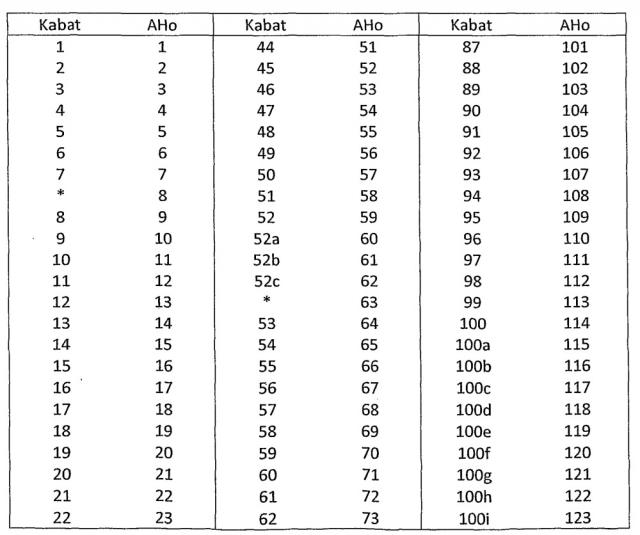
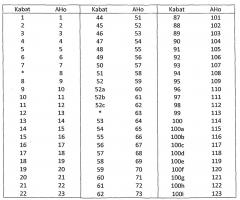
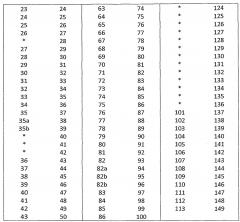
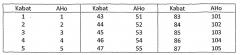
По меньшей мере два аминокислотных положения, выбранных для мутации, и аминокислотный(е) остаток(ки), вставленный(е) в выбранное(ые) положение(я), описаны далее более подробно. В нумерации аминокислотных положений, приведенной ниже, используется система нумерации АНо; соответствующие положения с использованием системы нумерации Кабата описаны далее в данном описании, и таблицы преобразования для систем нумераций АНо и Кабата приведены ниже в подробном описании. Аминокислотные остатки указаны с использованием стандартного однобуквенного обозначения.
Неожиданно было установлено, что присутствие указанных мутаций в указанных положениях повышает общую растворимость иммуносвязывающего средства, не оказывая отрицательного влияния на другие функциональные свойства белка. Например, в случае комбинации трех повышающих растворимость мутаций V12S, L144S и V103T в VH scFv было установлено, что указанные замещения отвечают за примерно 60% всей растворимости scFv. Это отличается от попыток, указанных в предшествующих результатах в данной области для повышения выхода экспрессии иммуносвязывающих средств. Например, в патенте США 6815540 описана модификация иммуносвязывающего средства за счет понижения гидрофобности во внутрицепочечной междоменной области раздела. Для этой цели было выявлено 16 положений вариабельного каркаса тяжелой цепи, которые могли быть индивидуально заменены одной или несколькими аминокислотами, выбранными из группы, состоящей из 10 аминокислот. Было установлено, что повышается выход экспрессии генерированных мутантов. Более того, та же группа исследователей опубликовала в 1999 г., т.е. тремя годами позднее даты приоритета указанного патента США, статью (см., Jung, S., Honegger, A. and Pluckthun, A. (1997) Prot. Eng. 10:959-966), указывающую, что в нескольких исследованиях сообщалось о том, что замена гидрофобных поверхностных остатков на более гидрофильные улучшает выход продуцирования. Согласно концепции данных авторов, повышение продуктивности связано с улучшенным кинетическим порционированием между правильной укладкой и агрегированием неуложенного вещества, тогда как растворимость нативного белка существенным образом даже не затрагивается, также как и термодинамическая стабильность. Таким образом квалифицированному специалисту ясно, что параметр растворимости Plückthun и др., относится только к экспрессии в растворе, а не к растворимости в целом нативного белка.
Краткое описание рисунков
Изобретение станет более понятно и задачи, отличающиеся от указанных выше, станут очевидными при рассмотрении следующего подробного описания. В данном описании приведены ссылки на прилагаемые рисунки, где
На фиг.1 показаны кривые растворимости при ПЭГ-осаждении для ESBA105 дикого типа (Е105) и его растворимых вариантов.
На фиг.2 показаны профили термической денатурации для ESBA105 дикого типа (Е105) и его растворимых вариантов, измеренные в термоисследовании в широком диапазоне температур (25-96°С).
На фиг.3 показаны результаты исследования методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), которые показывают поведение при деградации различных растворимых мутантов ESBA105 после инкубации в условиях теплового стресса.
На фиг.4 показаны кривые термической денатурации EP43max и его оптимизированных вариантов, определенные анализом методом инфракрасной спектроскопии с Фурье-преобразованием (FRIR).
На фиг.5 показана термическая стабильность 578min-max и 578min-max_DHP, в соответствии с измерениями методом FRIR.
Фиг.6а и 6b иллюстрируют растворимость 578min-max и 578min-max_DHP, определенную методом осаждения с помощью сульфата аммония.
Подробное описание изобретения
Данное изобретение относится к способам повышения растворимости иммуносвязывающих средств. Более конкретно, в настоящем изобретении раскрываются способы оптимизации иммуносвязывающих средств путем введения аминокислотных замещений в иммуносвязывающем средстве, которые улучшают растворимость иммуносвязывающего средства. Изобретение также относится к специализированным иммуносвязывающим средствам, например, scFv, полученным в соответствии со способами по изобретению.
Для того, чтобы изобретение можно было легче понять, первоначально будут определены некоторые термины. Если не определено другого, все технические и научные термины, использованные в данном описании, имеют такие же значения, какие обычно понимаются обычным специалистом в данной области, к которой принадлежит изобретение. Хотя для практической реализации или проверки изобретения можно использовать способы и материалы, аналогичные или эквивалентные приведенным в данном описании, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие отмеченные в описании ссылки включены в него путем ссылки во всей своей полноте. В случае конфликта, настоящее описание, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Термин «антитело», как он использован в данном описании, является синонимом «иммуноглобулина». Антитела согласно настоящему изобретению могут представлять собой полноразмерные иммуноглобулины или их фрагменты, включающие по меньшей мере один вариабельный домен иммуноглобулина, такой как одноцепочечные вариабельные домены, Fv (Skerra A. and Pluckthun, A. (1988) Science 240:1038-41), scFv (Bird, R.E. et al. (1988) Science 242:423-26; Huston, J.S. et al. (1988; Proc. Natl. Acad. Sci. USA 85:5879-83), Fab, (Fab')2 или другие фрагменты, хорошо известные специалисту в данной области.
Термин «каркасный участок антитела» или «каркасный участок», как он использован в данном описании, относится к части вариабельного домена, либо VL (вариабельная область легкой цепи), либо VH (вариабельная область тяжелой цепи), которая служит в качестве основы для антигенсвязывающих петлевых фрагментов данного вариабельного домена (Kabat, E.A. et al., (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242).
Термин «CDR антитела» или «CDR», как он использован в данном описании, относится к гипервариабельным участкам антитела, которые состоят из антигенсвязывающих петлевых фрагментов в соответствии с определением Kabat E.A. et al., (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242). Каждый из двух вариабельных доменов фрагмента Fv антитела содержит, например, три CDR.
Термин «одноцепочечное антитело» или «scFv» относится к молекуле, включающей вариабельную область тяжелой цепи антитела (VH) и вариабельную область легкой цепи антитела (VL), связанные линкером. Такие молекулы scFv могут иметь общие структуры: NH2-VL-линкер-VH-COOH или NH2-VH-линкер-VL-COOH.
В данном описании термин «идентичность» относится к сопоставлению последовательностей двух полипептидов, молекул или двух нуклеиновых кислот. Когда положение в обеих из двух сравниваемых последовательностей занимает одно и то же основание или мономерную субъединицу аминокислоты (например, если положение в каждой из двух молекул ДНК занимает аденин, или положение в каждом из двух полипептидов занимает лизин), то соответствующие молекулы являются идентичными по данному положению. «Процент идентичности» для двух последовательностей представляет собой функцию числа совместимых положений, используемых совместно в двух последовательностях, деленную на число сравниваемых положений × 100. Например, если 6 из 10 положений в двух последовательностях являются совместимыми, то две последовательности имеют 60% идентичность. В качестве примера, ДНК-последовательности CTGACT и CAGGTT имеют 50% идентичность (3 из 6 общих положений являются совместимыми (равноценными)). Обычно сравнение проводят, когда две последовательности совмещены для получения максимальной идентичности. Такое совмещение можно обеспечить с использованием, например, метода Needleman et al. (1970) J. Mol. Biol. 48: 443-453, легко осуществимого с помощью компьютерных программ, таких как программа Align (DNAstar, Inc.).
«Подобными» последовательностями являются те, которые при сопоставлении используют совместно идентичные и аналогичные остатки аминокислот, где подобные остатки представляют собой консервативные замещения для соответствующих аминокислотных остатков в сопоставленной ссылочной последовательности. В этом отношении «консервативное замещение» остатка в ссылочной последовательности представляет собой замещение остатком, который физически или функционально подобен соответствующему ссылочному остатку, например, имеет аналогичный размер, форму, электрический заряд, химические свойства, включая способность образовывать ковалентные или водородные связи и тому подобное. Таким образом, «консервативно замещенная модифицированная» последовательность представляет собой ту, которая отличается от ссылочной последовательности или последовательности дикого типа тем, что в ней присутствует одно или несколько консервативных замещений. «Процентом подобия» между двумя последовательностями является функция числа положений, которые содержат согласованные остатки или консервативные замещения, совместно занимаемые двумя последовательностями, деленного на число сравниваемых положений и умноженного на фактор 100. Например, если 6 из 10 положений в двух последовательностях согласуются, и 2 из 10 положений содержат консервативные замещения, то две последовательности имеют 80%-ное положительное подобие.
Термин «консенсусная аминокислотная последовательность», как он использован в данном описании, относится к аминокислотной последовательности, которая может быть генерирована с использованием матрицы из по меньшей мере двух и, предпочтительно, более, согласованных аминокислотных последовательностей, и давая пробелы в согласовании, такие, что возможно определить наиболее часто встречающийся остаток аминокислоты в каждом положении. Консенсусная последовательность представляет собой такую последовательность, которая включает аминокислоты, которые наиболее часто представлены в каждом положении. В том случае когда две или более аминокислот равным образом представлены для одного положения, консенсусная последовательность включает обе или все из данных аминокислот.
Аминокислотная последовательность белка может быть проанализирована на разных уровнях. Например, консервативность или вариабельность может проявляться на уровне единственного остатка, уровне множества остатков, уровне множества остатков с промежутками и т.д. Остатки могут проявлять сохранение идентичного остатка или могут сохраняться на уровне классов. Примеры классов аминокислот включают класс аминокислот с полярными, но незаряженными боковыми цепями или группами R (серин, треонин, аспарагин и глутамин); с положительно заряженными группами R (лизин, аргинин и гистидин); с отрицательно заряженными группами (глутаминовая кислота и аспарагиновая кислота); с гидрофобными группами R (аланин, изолейцин, лейцин, метионин, фенилаланин, триптофан, валин и тирозин); и класс специальных аминокислот (цистеин, глицин и пролин). Другие классы известны специалисту в данной области и могут быть определены с использованием структурных тенденций или других данных для оценки замещаемости. В этом смысле выражение «способная к замещению аминокислота» может относиться к любой аминокислоте, которая может быть замещена и поддерживает функциональную сохранность в данном положении.
Однако будет понятно, что аминокислоты одного и того же класса могут изменяться в определенной степени по их биофизическим свойствам. Например, будет понятно, что некоторые гидрофобные группы R (например, аланин, серин или треонин) являются более гидрофильными (т.е. обладают более высокой гидрофильностью или более низкой гидрофобностью), чем другие гидрофобные группы R (например, валин или лейцин). Относительная гидрофильность или гидрофобность могут быть определены с использованием известных в данной области методов (см., например, Rose et al., Science, 229: 834-838 (1985) и Cornette et al., J. Mol. Biol., 195: 659-685 (1987)).
В данном описании, когда одна аминокислотная последовательность (например, первая последовательность VH или VL) совмещена с одной или несколькими дополнительными аминокислотными последовательностями (например, одной или несколькими последовательностями VH или VL в базе данных), положение аминокислоты в одной последовательности (например, первой последовательности VH или VL) можно сравнить с «соответствующим положением» в одной или нескольких дополнительных аминокислотных последовательностях. В данном описании выражение «соответствующее положение» относится к эквивалентному положению в последовательности(ях) при сравнении, когда последовательности совмещены оптимальным образом, т.е. когда последовательности совмещены для достижения наиболее высокого процента идентичности или процента подобия.
В данном описании термин «база данных антител» относится к коллекции двух или более аминокислотных последовательностей антител («множество» последовательностей) и обычно относится к коллекции из десятков, сотен и даже тысяч аминокислотных последовательностей антител. База данных антител может хранить аминокислотные последовательности, например, состоящие из коллекции VH областей антител, VL областей антител или и тех, и других, или может хранить коллекцию последовательностей scFv, включающих области VH и VL. Предпочтительно, база данных хранится в доступной для поиска форме, фиксированной как, например, на компьютере с доступной для поиска компьютерной программой. В одном варианте осуществления база данных антител представляет собой базу данных, включающую или состоящую из последовательностей антител эмбрионального типа. В другом варианте осуществления база данных антител представляет собой базу данных, включающую или состоящую из последовательностей «созревших» антител (с полностью сформированной трехмерной структурой) (например, база данных Кабата последовательностей «созревших» антител, например, база данных KBD). Еще в одном варианте осуществления база данных антител представляет собой базу данных, включающую или состоящую из функционально отобранных последовательностей (например, последовательностей, отобранных по QC анализу).
Термин «иммуносвязывающее средство» относится к молекуле, которая содержит весь или часть антиген-связывающего сайта антитела, например, весь или часть вариабельного домена тяжелой и/или легкой цепи, так что иммуносвязывающее средство специфически распознает антиген-мишень. Неограничивающие примеры иммуносвязывающих средств включают полноразмерные молекулы иммуноглобулина и scFv, а также фрагменты антител, включая, но не ограничиваясь указанным, (i) Fab фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab)’ фрагмент, двухвалентный фрагмент, состоящий из двух Fab фрагментов, связанных с помощью дисульфидного мостика в шарнирном участке; (iii) Fab’ фрагмент, который по существу представляет собой Fab с частью шарнирной области (см., FUNDAMENTAL IMMUNOLOGY (Paul ed., 3.дополненное издание. 1993); (iv) Fd фрагмент, состоящий из доменов VH и CH1; (v) Fv фрагмент, включающий домены VH и VL одной цепи антитела, (vi) однодоменное антитело, такое как фрагмент Dab (Ward et al., (1989) Nature 341: 544-546), который состоит из VH или VL домена, антитело верблюдовых (см., Hamers-Casterman, et al., Nature 363: 446-448 (1993), and Dumoulin, et al., Protein Science 11: 500-515 (2002)) или антитело акулы (например, Ig-NARs акулы, Nanobodies®; и (vii) нанотело, вариабельная область тяжелой цепи, содержащая один вариабельный домен и два константных домена.
В данном описании термин «функциональное свойство» относится к свойству полипептида (например, иммуносвязывающего средства), для которого улучшение (например, относительно обычного полипептида) является желательным и/или выигрышным для специалиста в данной области, например, для улучшения свойств при получении или терапевтической эффективности полипептида. В одном варианте осуществления функциональное свойство представляет собой стабильность (например, термическую стабильность). В другом варианте осуществления функциональное свойство представляет собой растворимость (например, в условиях клетки). Еще в одном варианте осуществления функциональное свойство представляет собой поведение при агрегации. Еще в одном следующем варианте осуществления функциональное свойство представляет собой экспрессию белка (например, в прокариотической клетке). Еще в одном другом варианте осуществления функциональное свойство представляет собой эффективность рефолдинга (пересворачивание белка) после солюбилизации включения в соответствующем процессе очистки. В некоторых вариантах осуществления аффинность связывания антигена не является функциональным свойством, которое желательно улучшить. Еще в одном варианте осуществления улучшение функционального свойства не включает существенного изменения в аффинности связывания антигена.
Термин «растворимость», как он использован в данном описании, относится к растворимости нативного белка, т.е. мономерного, не агрегированного и функционального иммуносвязывающего средства. Выражение «повышенная растворимость» означает улучшение растворимости нативного белка, которое предпочтительно определяют с помощью по меньшей мере одного из следующих методов: ПЭГ-осаждение, осаждение сульфатом аммония, выход рефолдинга или любой другой способ для определения растворимости, известный специалисту в данной области. Метод ПЭГ-осаждения представляет собой способ в соответствии с описанным Atha и др., в "Mechanism of Precipitation of Proteins by Polyethylene Glycols", JBC, 256: 12108-12117 (1981). Осаждение сульфатом аммония может быть осуществлено, например, следующим образом: готовят 10 мкл аликвоты растворов белка с концентрацией 20 мг/мл, к каждой из которых добавляют 10 мкл раствора (NH4)2SO4 разной степени насыщенности (например, 35%, 33%, 31%, 29%, 25%, 20% и 15%) с последующим интенсивным перемешиванием в течение 5 секунд и 30-минутным инкубированием при комнатной температуре. После центрифугирования при 6000 об./мин при 4оС в течение 30 мин определяют концентрацию белка в супернатанте. В таком способе предметом сравнения для различных белков является значение V50, которое представляет собой процент насыщенности раствора (NH4)2SO4, при котором осаждается 50% белка. V50 определяют из графика содержания растворенного белка, определенного в супернатанте, относительно использованного процента насыщенности раствора (NH4)2SO4. Выход рефолдинга соответствует проценту правильно сложенного белка, полученного в присутствии солюбилизированных веществ включения в соответствующем способе получения/очистки. Термин «растворимость», как он использован в данном описании, не относится к растворимой экспрессии.
Иммуносвязывающие средства с улучшенной растворимостью
В первом аспекте разработано иммуносвязывающее средство, включающее один из следующих повышающих растворимость мотивов в аминокислотных положениях 12, 103 и 144 тяжелой цепи (АНо нумерация):
(а) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b) Серин (S) в аминокислотном положении 103 тяжелой цепи; и
(c) Треонин (Т) в аминокислотном положении 144 тяжелой цепи; или
(а1) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b1) Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и
(c1) Серин (S) в аминокислотном положении 144 тяжелой цепи; или
(а2) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b2) Треонин (Т) в аминокислотном положении 103 тяжелой цепи; и
(c2) Треонин (Т) в аминокислотном положении 144 тяжелой цепи; или
(а3) Серин (S) в аминокислотном положении 12 тяжелой цепи;
(b3) Серин (S) в аминокислотном положении 103 тяжелой цепи; и
(c3) Серин (S) в аминокислотном положении 144 тяжелой цепи; или
Неожиданно было установлено, что присутствие указанных аминокислот в указанных положениях повышает общую растворимость всего иммуносвязывающего средства. Например, в случае комбинации трех повышающих растворимость мутаций V12S, L133S и V103T в VH scFv было найдено, что указанные замещения ответственны примерно на 60% за общую растворимость scFv. Поскольку гидрофобные участки сохраняются в вариабельных доменах всех иммуносвязывающих средств, одно или несколько замещений в указанных положениях можно использовать для улучшения растворимости любого иммуносвязывающего средства.
Иммуносвязывающее средство предпочтительно представляет собой антитело scFv, полноразмерный иммуноглобулин, фрагмент Fab, Dab или нанотело.
В предпочтительном варианте осуществления иммуносвязывающее средство дополнительно включает одну или несколько аминокислот из группы, состоящей из (а) аспарагиновой кислоты (D) в аминокислотном положении 31 легкой цепи, (b) глутаминовой кислоты (Е) в аминокислотном положении 83 легкой цепи, (с) аргинина (R) в аминокислотном положении 43 тяжелой цепи, (d) лейцина (L) в аминокислотном положении 67 тяжелой цепи и (е) аланина (А) в аминокислотном положении 78 тяжелой цепи. Присутствие одной или нескольких указанных аминокислот в соответствующих положениях придает иммуносвязывающему средству повышенную растворимость.
Указанные здесь аминокислоты могут присутствовать в природных иммуносвязывающих средствах или их производных, или иммуносвязывающее средство может быть сконструировано таким образом, чтобы оно включало одну или несколько вышеуказанных аминокислот.
В предпочтительном варианте осуществления раскрытое в данном описании иммуносвязывающее средство специфически связывается с TNFα человека или VEGF человека.
Инженерия иммуносвязывающих средств с повышенной растворимостью
Как подробно описано в деталях, описанный здесь подход на основании последовательностей был успешно использован для идентификации определенных замещений аминокислотных остатков, которые придают повышенную растворимость. Примеры перечисляют иллюстративные и предпочтительные замещения аминокислот в определенных аминокислотных положениях в пределах VH областей и необязательно в VL области иммуносвязывающего средства (например, scFv). Иллюстративные замещения включают замещения проблематичных остатков аминокислот (например, открытых для растворителя гидрофобных остатков) в аминокислотных положениях, которые являются более гидрофильными, и которые существуют с большей частотой в базе данных (например, базе данных зрелого антитела (KDB)). Особенно предпочтительное замещение представляет собой наиболее часто встречающийся остаток, который является более гидрофильным, чем проблематичный остаток. В других вариантах осуществления более гидрофильную аминокислоту выбирают из группы, состоящей из аланина (А), серина (S) и треонина (Т).
Соответственно, изобретение относится к способам инженерии, в которых одно или несколько специфических замещений аминокислот проводят в иммуносвязывающем средстве, таком как антитело scFv. Такие замещения можно провести с использованием стандартных методов молекулярной биологии, таких как сайт-направленный мутагенез, ПЦР-опосредованный мутагенез и тому подобные.
Как указано в примерах, следующие аминокислотные положения были идентифицированы как проблематичные аминокислоты (т.е. так называемые «гидрофобные участки») для модификации указанных последовательностей VH или VL:
VH: аминокислотные положения 2, 4, 5, 12, 103 и 144; и
VL: аминокислотные положения 15, 52 и 147.
Использованная нумерация представляет собой систему нумерации АНо; таблицы преобразования для перевода нумерации АНо в систему нумерации Кабата приведены в таблицах 1 и 2.
Неожиданно было установлено, что замещения в двух или более положениях 12, 103, 144 VH (в соответствии с системой нумерации) влияет на общую растворимость иммуносвязывающего средства целиком. Поскольку гидрофобные участки сохраняются в вариабельных доменах всех иммуносвязывающих средств, по меньшей мере два замещения в указанных положениях можно использовать для улучшения растворимости любого иммуносвязывающего средства.
В одном варианте осуществления изобретение относится к способу конструирования иммуносвязывающего средства, такого как антитело scFv, в котором проводят по меньшей мере два аминокислотных замещения в одном или нескольких выявленных аминокислотных положениях, см. выше, получая тем самым вариантные (т.е. мутированные) формы иммуносвязывающих средств.
Таким образом, в другом аспекте изобретение относится к способу конструирования иммуносвязывающего средства, при этом способ включает
А) выбор для мутации по меньшей мере двух аминокислотных положений в пределах области VH, области VL или областей VH и VL; и
В) проведение мутации по меньшей мере в двух аминокислотных положениях, выбранных для мутации,
где если по меньшей мере два аминокислотных положения, выбранных для мутации, находятся в пределах области VH, замещение проводят по меньшей мере в двух аминокислотных положениях тяжелой цепи, выбранных из группы, состоящей из положений 12, 103 и 144 (в соответствии с правилом нумерации АНо; аминокислотных положений 11, 89 и 108 при использовании нумерации Кабата), и/или
где если по меньшей мере два аминокислотных положения, выбранных для мутации, находятся в пределах области VL, замещение проводят по меньшей мере в двух аминокислотных положениях легкой цепи, выбранных из группы, состоящей из положений 15, 52 и 147 (в соответствии с правилом нумерации АНо; аминокислотных положений 15, 44 и 106 при использовании нумерации Кабата).
В некоторых вариантах осуществления аминокислотное положение занято гидрофобной аминокислотой (например, лейцин (L) или валин (V)). В одном варианте осуществления аминокислота в аминокислотном положении 12 тяжелой цепи представляет собой валин (V). В другом варианте осуществления аминокислота в аминокислотном положении 103 тяжелой цепи представляет собой валин (V). В другом варианте осуществления аминокислота в аминокислотном положении 144 тяжелой цепи представляет собой лейцин (L). В другом варианте осуществления аминокислота в аминокислотном положении 15 легкой цепи представляет собой валин (V). В другом варианте осуществления аминокислота в аминокислотном положении 52 легкой цепи представляет собой фенилаланин (F). В другом варианте осуществления аминокислота в аминокислотном положении 147 легкой цепи представляет собой валин (V).
Предпочтительно мутация представляет собой замещение аминокислоты в выбранном аминокислотном положении на более гидрофильную аминокислоту. В других вариантах осуществления более гидрофильную аминокислоту выбирают из серина (S) или треонина (Т).
В некоторых вариантах осуществления способ включает а) выбор для мутации по меньшей мере двух аминокислотных положений в пределах иммуносвязывающего средства; и b) проведение мутации по меньшей мере в двух аминокислотных положениях, выбранных для мутации, где мутация включает по меньшей мере два замещения, выбранных из группы, состоящей из
(i) серин (S) в аминокислотном положении 12 тяжелой цепи при использовании нумерации АНо (положение 11 при использовании нумерации Кабата);
(ii) серин (S) или треонин (Т) в аминокислотном положении 103 тяжелой цепи при использовании нумерации АНо (положение 89 при использовании нумерации Кабата); и
(iii) серин (S) или треонин (Т) в аминокислотном положении 144 тяжелой цепи при использовании нумерации АНо (положение 108 при использовании нумерации Кабата).
В более предпочтительном варианте осуществления по меньшей мере в одном из аминокислотных положений 12, 103 и 144 тяжелой цепи находится треонин (Т).
В следующих вариантах осуществления мутация включает замещение на треонин (Т) в аминокислотном положении 15 легкой цепи при использовании нумерации АНо или нумерации Кабата и/или замещение на аланин (А) в аминокислотном положении 147 легкой цепи при использовании нумерации АНо (положение 106 по правилам нумерации Кабата).
В других вариантах осуществления мутация приводит по меньшей мере к 2-кратному увеличению растворимости (например, 2-кратному, 2,5-кратному, 3-кратному, 3,5-кратному, 4-кратному или большему увеличению растворимости).
В другом варианте осуществления мутация не оказывает неблагоприятного воздействия на термическую стабильность, рефолдинг, выход экспрессии, агрегацию и/или активность связывания иммуносвязывающего средства.
В некоторых вариантах осуществления мутация дополнительно включает одну или несколько стабилизирующих мутаций в аминокислотном положении (правило нумерации АНо), выбранном из группы, состоящей из (а) ас