Способ персонифицированного скрининга действия препаратов на лейкозные клетки ex vivo
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к способам скрининга чувствительности клеток лейкоза ex vivo к действию различных веществ, в частности препаратов и перспективных лекарственных субстанций, а также их сочетаний, что может быть использовано в медицине. Способ состоит в том, что из аспирата костного мозга больного выделяют лейкозные клетки, получают аутологичную сыворотку, формируют многоклеточные агрегаты путем культивирования полученных лейкозных клеток, используя питательную среду с добавлением указанной аутологичной сыворотки, и исследование действия препаратов выполняют в питательной среде с добавлением этой же аутологичной сыворотки. Изобретение позволяет приблизить условие in vitro к in situ, значительно усиливает лекарственную устойчивость лейкозных клеток, а также приближает специфическую реакцию лейкозных клеток к препаратам в условиях ex vivo к условиям in situ, что в свою очередь обеспечивает эффективную выработку стратегии терапевтического лечения с учетом специфических условий микроокружения лейкозных клеток in situ. 4 ил., 3 пр.
Реферат
Изобретение относится к области медицины, в частности к способам скрининга чувствительности клеток лейкоза ex vivo к действию различных веществ, в частности препаратов и перспективных лекарственных субстанция, их сочетаний, и направлено на приближение условий околоклеточного микроокружения лейкозных клеток при скрининге и, соответственно, лекарственной устойчивости этих клеток к условиям in situ.
Известно, что чувствительность клеток лейкозов разных типов к различным противоопухолевым препаратам отличается. По этой причине для лечения лейкозов разных типов используют различные препараты (Cancer Sci., 2015, 106(4):344-51; J Clin Med., 2015, 4(1): 127-49; Am J Hematol., 2015, 90(5):446-60; Curr Treat Options Oncol., 2014, 15(2): 187-209; Int J Clin Oncol., 2014, 19(1):10-5). Известно также, что клетки лейкозов способны приобретать резистентность к противоопухолевым препаратам в результате мутаций и элиминации чувствительных к химиотерапии клеток в процессе лечения. Известно, что чувствительность клеток к химиотерапии может зависеть от межклеточных взаимодействий. Например, лейкозные клетки in vitro становятся значительно устойчивее в агрегатах к действию препаратов и повреждающих субстанций, чем одиночные клетки, причем в разных типах лейкозных клеток этот эффект может существенно отличаться (Альманах клинической медицины, 2014, 31:11-16; Биологические мембраны: Журнал мембранной и клеточной биологии, 2015, 32(2):125-134; Биофизика, 2015, 60(6):1146-1150). Аналогичное появление резистентности к препаратам обнаруживается при агрегации клеток солидных опухолей, например клеток, полученных из различных карцином, сарком. Механизм повышения лекарственной устойчивости в многоклеточных агрегатах остается неясным. Есть основания предполагать, что эффект многоклеточной лекарственной устойчивости определяется многими механизмами, включая активацию системы транспорта ксенобиотиков из клеток (система ABC транспортеров, включая PgP, белки MRP1-MRP5 и др.), повышение активности внутриклеточных сигнальных путей выживания клеток при различных повреждающих воздействиях (химиотерапевтические препараты, рецептор опосредованная гибель клеток, физические факторы), что могут включаться сразу несколько механизмов защиты клеток в агрегатах, причем в разных клетках этот набор может иметь свою специфику. Однако ясного понимания механизмов включения защиты клеток в многоклеточных структурах нет, тем более понимания специфичности этих механизмов для разных типов клеток. Для тестирования чувствительности опухолевых клеток к препаратам in vitro разрабатываются различные способы, в которых учитывается повышение клеточной резистентности в многоклеточных агрегатах (Neoplasia, 2015, 17(1):1-15; Adv Drug Deliv Rev., 2014, 79-80:50-67; Adv Drug Deliv Rev., 2014, 79-80:3-18; Adv Drug Deliv Rev., 2014, 69-70:29-41; Adv Drag Deliv Rev., 2014, 74:95-103). Создание эффективного способа оценки чувствительности лейкозных клеток к действию препаратов с учетом особенностей повышения их устойчивости в зависимости от микроокружения имеет важнейшее значение для правильного выбора стратегии терапевтического лечения больных.
Известен способ тестирования клеток к действию лекарств (Европейский Патент ЕР 2138844 В1), включающий получение клеток из первично изолированных тканей или из биологических жидкостей, последующее их культивирование в условиях с инертным матриксом, обеспечивающих формирование сфероидов, и последующее использование этих сфероидов для скрининга эффективности действия препаратов и субстанций на клетки в сфероидах. В конечном счете изобретение обеспечивает метод персонифицированного определения стратегии выбора лекарства для лечения заболевания.
Недостатком способа является то, что он предполагает создание сфероидов и исследование чувствительности клеток к действию препаратов в сфероидах, что применимо для многих типов клеток, полученных из солидных опухолей, например карциномы, саркомы, глиомы, но неприменимо для лейкозных клеток. Сфероиды представляют собой сферические агрегаты слипшихся клеток. Количество клеток в сфероидах варьируют, как правило, в диапазоне 5 тысяч и более, а размер сфероида составляет 0,05-2 мм в зависимости от вида клеток и их количества. Для образования сфероидов важное значение имеет способность клеток к сильной межклеточной адгезии (прилипанию), которая характерна для многих клеток солидных опухолей и не характерна для лейкозных клеток. Лейкозные клетки обладают слабой межклеточной адгезией, не способны формировать сфероиды, и поэтому такой способ не применим для изучения чувствительности клеток лейкоза к действию противоопухолевых препаратов.
Известен способ получения многоклеточных агрегатов сфероидов для последующего их применения в изучении роста, дифференцировки клеток, а также действия цитотоксических веществ на клетки с учетом межклеточных взаимодействий (заявка на патент US 2014/0221225 А1). Этот способ включает инъекцию клеточной суспензии в гель, изготовленный из молекул внеклеточного матрикса (коллаген, фибронектин, ламинин, матригель и др.). После инъекции клетки культивируют, обеспечивая возможность их миграции в многоклеточные агрегаты - сфероиды, которые затем используют для изучения клеточных функций и выживаемости клеток.
Основным недостатком этого способа является то, что он применим только для клеток, обладающих способностью мигрировать и образовывать прочно слипшиеся клеточные агрегаты (сфероиды), и неприменим для формирования многоклеточных агрегатов клетками лейкоза, которые обладают слабой миграционной активностью и слабой межклеточной адгезией. По этой причине такой способ не может быть использован для скрининга эффективности действия различных препаратов на клетки лейкоза в многоклеточных агрегатах.
Наиболее близким, принятым за прототип является способ тестирования лейкозных клеток, согласно которому многоклеточные агрегаты формируют путем культивирования клеток в многолуночном планшете в питательной среде с добавлением эмбриональной телячьей сыворотки на слое геля, приготовленного на основе 1,5% агарозы, а после формирования многоклеточных агрегатов через 1 сутки после посева добавляют исследуемые вещества и через определенное время оценивают жизнеспособность клеток в культурах известными способами (Альманах клинической медицины, 2015, №31, с. 11-16). Формируемые агрегаты не являются сфероидами, клетки в них слабо связаны, и агрегаты могут распадаться на более мелкие даже при слабом движении среды около них.
Недостатком известного способа является то, что культивирование клеток лейкоза в среде с эмбриональной телячьей сывороткой является неадекватным набору сигнальных молекул в организме и тем самым способно значительно исказить чувствительность клеток лейкемии к повреждающим химическим субстанциям, препаратам в сравнении с условиями in situ и понизить ценность полученных результатов для практического применения.
Задачей настоящего изобретения является создание способа персонифицированного скрининга действия препаратов на клетки лейкоза ex vivo с учетом возможности повышения их лекарственной устойчивости в многоклеточных агрегатах, в котором сигнальное микроокружение клеток приближено к условиям in vivo.
Поставленная задача достигается тем, что в известном способе, включающем формирование многоклеточных агрегатов лейкозных клеток в многолуночных культуральных планшетах в питательной среде с добавлением сыворотки крови и последующий скрининг действия веществ на многоклеточные агрегаты лейкозных клеток, согласно предлагаемому изобретению из аспирата костного мозга больного получают аутологичную сыворотку, многоклеточные агрегаты формируют путем культивирования лейкозных клеток в питательной среде с добавлением указанной аутологичной сыворотки и исследование действия препаратов выполняют в питательной среде с добавлением этой же аутологичной сыворотки. В предпочтительном варианте для формирования агрегатов лейкозных клеток и для скрининга действия на них химических субстанций в среду добавляют 20% указанной аутологичной сыворотки без инактивации системы комплемента и формируют агрегаты, включающие 5000 клеток.
Применение аутологичной сыворотки, полученной из аспирата костного мозга, для тестирования чувствительности лейкозных клеток в агрегатах обеспечивает приближение микроокружения клеток по составу цитокинов и ростовых факторов к реальным условиям в костном мозге больного. Учитывая влияние этих цитокинов на резистентность клеток к препаратам, на возможности их дифференцировки, применение этой сыворотки является более адекватным приближением к условиям in situ в персонифицированном скрининге действия веществ на лейкозные клетки in vitro, чем использование гетерологической сыворотки крови или аутологичной сыворотки, полученной из периферической крови больного. Предлагаемое в данном изобретении решение основано на обнаруженных авторами фактах, согласно которым только применение не инактивированной по комплименту аутологичной сыворотки, полученной из аспирата костного мозга и используемой при скрининге чувствительности лейкозных клеток в многоклеточных агрегатах к действию таргетного препарата ритуксимаб, позволяет выявить его токсичность на эти клетки в агрегатах in vitro, что в присутствии этой аутологичной сыворотки лейкозные клетки более резистентны к действию химиотерапевтических препаратов и перспективных субстанций, чем в присутствии ксеногенной сыворотки, применяемой в способе, принятом за прототип.
Изобретение поясняется следующими примерами реализации предложенного способа персонифицированного скрининга действия препаратов на лейкозные клетки в культуре и его сравнения с прототипом.
Материалы и методика скрининга
Для получения аутологичной сыворотки, аспират костного мозга больного острым миеломонобластным лейкозом центрифугировали при 400g в течение 10 минут при 4°C. Надосадочную жидкость собирали в вакуумные пробирки с активатором свертывания производства APEXLAB (Россия), инкубировали в течение 10 минут при 37°C при встряхивании. Затем пробирки с образовавшемся сгустком центрифугировали при 400g в течение 10 минут. Надосадочную жидкость (сыворотку) использовали для проведения скрининга.
Для получения клеток аспират костного мозга разводили 1:1 раствором Хенкса (Sigma-Aldrich, США) и проводили центрифугирование на градиенте Histopaque-1077 (Sigma-Aldrich, США) при 800g в течение 30 минут. Далее клетки собирали стерильной серологической пипеткой на границе раздела Histopaque-1077 - плазма, ресуспендировали в среде IMDM (1:4) и центрифугировали при 400g в течение 5 минут. Оценку количества живых клеток после выделения проводили с помощью витального красителя трипанового синего. Процент живых клеток составлял не менее 95%. Полученные мононуклеарные клетки инкубировали 12 часов в полной ростовой среде (IMDM с добавлением 20% полученной аутологичной сыворотки) на культуральных чашках Петри при 37°C и 5% содержания CO2 в газовой фазе. Для скрининга использовали клетки, не прикрепившиеся к поверхности культурального флакона.
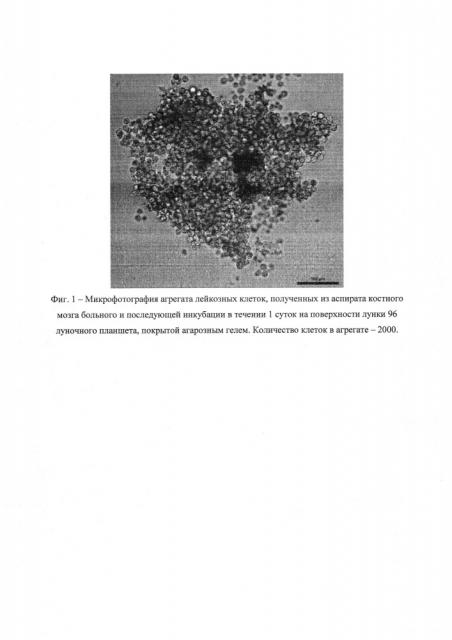
Для формирования многоклеточных агрегатов культуральные 96-луночные планшеты покрывали 1,5% раствором агарозы (Panreac, Испания). Для этого 1,5 грамма агарозы растворяли в 100 мл питательной среды IMDM при нагревании до 95°C в течение 5 минут. Затем раствор агарозы помещали в водяную баню при 60°C и выдерживали в течение 60 мин. Далее в каждую лунку культурального планшета добавляли по 75 микролитров 1,5% раствора агарозы и ставили в стерилизационную УФ-камеру на 2 часа. После этого проводили посев по 2×103, 5×103 и 10×103 клеток в лунку в 100 мкл полной инкубационной среды. Через 24 часа в каждой лунке формировался единичный агрегат клеток (Фиг. 1).
Для получения культуры одиночных клеток использовали питательную среду содержащую метилцеллюлозу. Для этого клетки инкубировали в течение 24 часов в 96-луночных планшетах, по 5×103 клеток в лунке в 100 мкл ростовой среды, указанной выше, с добавлением в нее 0,9% метилцеллюлозы (Sigma-Aldrich, США). Данная культуральная среда препятствует спонтанной агрегации клеток, которые в ней находятся в виде суспензии одиночных клеток.
Жизнеспособность клеток после инкубации с этопозидом оценивали по интенсивности восстановления метаболического индикатора AlamarBlue (Invitrogen, США). Для этого к клеткам через 24 часа после посева добавляли препараты, после 24 часа инкубации с препаратами добавляли индикатор AlamarBlue в концентрации 100 мкг/мл. Затем клетки инкубировали с индикатором в течение 4 часов при 37°C в условия 5% содержания CO2 в газовой фазе и после инкубации измеряли интенсивность флуоресценции при длине волны 595 нм с использованием планшетного спектрофлуориметра Infinity F 200 (Тесал, Австрия). Результаты измерения сравнивали относительно контроля. В качестве контроля для каждого из условий использовали культуры без добавления повреждающих агентов. Например, для культур одиночных клеток с добавлением этопозида контролем были культуры одиночных клеток без добавления этопозида, а для культур агрегатов по 5000 клеток каждом с добавлением к ним этопозида контролем были культуры в агрегатах по 5000 клеток без добавления этопозида и т.д.
Пример 1. Лейкозные клетки ex vivo в агрегатах многократно (на порядки) более резистентны к препарату этопозид, чем одиночные лейкозные клетки.
Проводили скрининг чувствительности первичных лейкозных клеток в агрегатах (по 5000 и по 2000 клеток в каждом) и чувствительности одиночных лейкозных клеток к препарату этопозид в среде с аутологичной сывороткой, полученной из аспирата костного мозга.
Представленные на фиг. 1 результаты показывают, что этопозид оказывает гораздо большее токсическое действие на одиночные лейкозные клетки, чем на эти же клетки в агрегатах. В частности, концентрация этопозида, при которой обнаруживали уменьшение количества живых клеток в 2 раза в сравнении с контролем (IC50), для культур одиночных клеток, посеянных по 5000 на лунку, составляла около 0,01 мкМ, для агрегатов по 2000 клеток на лунку - 0,1 мкМ (в 10 раз больше), а для агрегатов по 5000 - более 100 мкМ (в 10000 раз больше). Токсическое действие этопозида в агрегатах по 5000 и по 10000 клеток было одинаковым. Увеличение количества клеток в агрегатах нецелесообразно потому, что при количестве клеток в агрегате, большем чем 10000, наблюдается ухудшение условий околоклеточного микроокружения за счет диффузионных ограничений массопереноса и это приводит к торможению роста и к гибели клеток, а следовательно, к искажению результатов в контроле. Таким образом, токсические дозы этопозида для лейкозных клеток в агрегатах по 5000 клеток возросли в 10000 раз в сравнении с одиночными клетками. Учитывая тот факт, что костном мозге гемопоэтические, лимфоидные и лейкозные клетки достаточно плотно упакованы, находятся в агрегированном состоянии, представленные результаты указывают на то, что для корректного скрининга действия препаратов надо использовать лейкозные клетки в агрегатах, а не на первичные культуры одиночных клеток, в которых не включены механизмы защиты в такой степени, как в агрегатах.
Пример 2. Повышение резистентности лейкозных клеток ex vivo в агрегатах в присутствии аутологичной сыворотки, полученной из аспирата костного мозга больного
Выполняли скрининг действия препарата флудорабин на лейкозные клетки больного в агрегатах (5000 клеток) в присутствии аутологичной сыворотки, полученной из аспирата костного мозга, или в присутствии фетальной сыворотки крови крупного рогатого скота (прототип). Обнаружили (фиг. 3), что лейкозные клетки человека в агрегатах более резистенты к препарату флударабин в присутствии 20% аутологичной сыворотки, полученной из аспирата костного мозга (IC50 составляет около 5 мкМ), чем в присутствии 20% фетальной сыворотки крупного рогатого скота (IC50 составляет около 0,5 мкМ). Увеличение резистентности указывает на наличие в аутологичной сыворотке факторов, таких как интерлейкины (IL1, IL6 и др.), ростовые факторы (например, IGF-1), которые способны повышать резистентность лейкозных клеток. Реальный количественный эффект такого повышения резистентности (в десять раз), указывающий на целесообразность применения аутологичной сыворотки из аспирата костного мозга для персонифицированного скрининга действия препаратов на лейкозные клетки больного, можно оценить только на основе экспериментальных фактов, в частности представленного на фиг. 3. Возможно, для разных больных, для разных видов лейкоза этот эффект будет отличаться, но столь значительное увеличение резистентности указывает на необходимость использования аутологичной сыворотки из костного мозга для персонифицированного скрининга действия препаратов на лейкозные клетки больного.
Пример 3. Необходимость использования неинактивированной аутологичной сыворотки из аспирата костного мозга больного для скрининга действия терапевтических моноклональных антител
Выполняли скрининг токсического действия моноклонального антитела ритуксимаб на первичные лейкозные клетки в агрегатах (5000 клеток) в присутствии 20% неинактивированной аутологичной сыворотки из аспирата костного мозга или 20% фетальной сыворотки крупного рогатого скота. Обнаружили (фиг.4), что в среде с добавлением 20% фетальной сыворотки крупного рогатого скота ритуксимаб не оказывал токсического действия на лейкозные клетки даже при концентрациях 200 мкг/мл, а в среде, содержащей 20% аутологичной сыворотки, ритуксимаб начинал оказывать повреждающее действие на лейкозные клетки уже при концентрациях 1 мкг/мл. Это указывает на участие системы комплимента в цитотоксическом действии терапевтического моноклонального антитела ритуксимаб на лейкозные клетки. С другой стороны, данные на фиг. 4 свидетельствуют, что ритуксимаб вызывает токсическое действие только у 60% лейкозных клеток, а 40% остаются нечувствительными к этому таргетному препарату, и, следовательно, необходимо искать дополнительные возможности индуцировать гибель всех лейкозных клеток. Представленные результаты показывают, что для правильной оценки действия терапевтических моноклональных антител на первичные лейкозные клетки необходимо использовать неинактивированную аутологичную сыворотку из аспирата костного мозга больного.
Таким образом, приведенные результаты показывают, что выполнение персонифицированного скрининга действия противоопухолевых препаратов на лейкозные клетки больного ex vivo необходимо проводить на многоклеточных агрегатах, предпочтительно содержащих по 5000 клеток, а также в присутствии 20% аутологичной неинактивированной сыворотки, полученной из аспирата костного мозга больного, поскольку в этих условиях, приближенных к in situ, проявляется многократное увеличение лекарственной устойчивости лейкозных клеток, а также реализуется специфическая чувствительность лейкозных клеток, например, к действию терапевтических моноклональных антител.
Способ персонифицированного скрининга действия препаратов на лейкозные клетки ex vivo, включающий формирование многоклеточных агрегатов лейкозных клеток в многолуночных культуральных планшетах в питательной среде с добавлением сыворотки крови и последующий скрининг действия препаратов на многоклеточные агрегаты лейкозных клеток, отличающийся тем, что из аспирата костного мозга больного получают аутологичную сыворотку, многоклеточные агрегаты формируют путем культивирования лейкозных клеток, полученных от этого же больного, используя питательную среду с добавлением указанной аутологичной сыворотки, и исследование действия препаратов выполняют в питательной среде с добавлением этой же аутологичной сыворотки.