Система (варианты) и способ детектирования наличия аналита в жидком образце
Иллюстрации
Показать всеПредставленные изобретения касаются способа детектирования наличия аналита в жидком образце, способа детектирования наличия патогена в образце цельной крови, способа детектирования наличия вируса в образце цельной крови, способа детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, способа детектирования наличия организмов, относящихся к видам Candida в жидком образце, системы для детектирования одного или более аналитов нуклеиновой кислоты в жидком образце и сменного картриджа для размещения реагентов для анализа и расходных материалов в указанной системе. Представленные изобретения характеризуются тем, что при своем осуществлении используют магнитные частицы, имеющие средний диаметр в интервале от 700 нм до 950 нм, значение релаксивности Т2 на одну частицу, составляющее от 1х109 до 1х1012 ммоль-1сек-1, и имеют связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита. Изобретения обеспечивают мультиплексное детектирование нескольких типов различных молекул и могут быть использованы в клинической практике. 9 н. и 22 з.п. ф-лы, 29 ил., 13 табл., 19 пр.
Реферат
Область техники
Настоящее изобретение относится к анализам и устройствам для детектирования аналитов и к их применению в лечении и диагностике заболевания.
Уровень техники
Настоящее изобретение относится к анализам и устройствам для детектирования аналитов и к их применению в лечении и диагностике заболевания.
Магнитные сенсоры были разработаны для детектирования молекулярных взаимодействий в различных средах, включая, помимо других сред, биологические жидкости, продукты питания и образцы почвы. При связывании с мишенью данные сенсоры вызывают изменения в свойствах соседних молекул воды (или любой молекулы растворителя со свободными атомами водорода) образца, которые могут быть обнаружены с помощью методов магнитного резонанса (ЯМР/МРТ). Таким образом, при использовании данных сенсоров в жидком образце можно детектировать присутствие аналита (небольших молекул, ДНК, РНК, белков, углеводов, организмов, метаболитов и патогенов (например, вирусов)) и, потенциально, определить его количество при очень низкой концентрации, используя магнитные сенсоры.
В целом, магнитные сенсоры представляют собой магнитные частицы, которые связываются или иным образом присоединяются к их предполагаемой молекулярной мишени с образованием кластеров (агрегатов). Считается, что когда магнитные частицы собираются в кластеры и эффективное поперечное сечение увеличивается (а число кластеров на единицу объема уменьшается), то взаимодействия с молекулами воды или другого растворителя изменяются, что приводит к изменениям таких измеряемых параметров, как времена релаксации (например, T2, T1, T2*), восприимчивость, частота прецессии, а также к другим физическим изменениям. Дополнительно образование кластеров может быть устроено так, чтобы быть обратимым (например, в ответ на сдвиг температуры, разрыв химических связей, сдвиг значения pH и т.д.), так что для детектирования специфических аналитов могут быть разработаны как ʺпрямойʺ, так и ʺобратныйʺ (основанные как на конкурентных реакциях, так и на использовании ингибиторов) тесты. Прямой (основанный на кластеризации) и обратный (основанный на декластеризации) виды анализов могут быть использованы для детектирования широкого спектра относящихся к биологическим материалов. Явление переключения магнитного резонанса (MPS (magnetic resonance switch)) было описано ранее (см. публикацию патента США №20090029392).
Многие диагностические тесты должны быть чувствительны в пикомолярном или субпикомолярном диапазонах концентраций. В настоящее время для выявления инфекционных агентов, нуклеиновых кислот, малых молекул, агентов и организмов, использующихся в качестве биологического оружия, а также молекулярных мишеней (биомаркеров) или комбинации молекулярных и иммунологических мишеней обычно требуется предварительная подготовка образцов, время для анализа образца и проведение одиночных анализов на каждый из отдельных аналитов. Существует необходимость в быстром, коммерчески реализуемом, базирующемся на ЯМР устройстве для детектирования аналитов, подходящем для применения с магнитными наносенсорами, которое обладает четырьмя уникальными признаками и качествами: 1) практически полное отсутствие необходимости приготовления проб, 2) возможность мультиплексного детектирования нескольких типов различных молекул, 3) быстрый сбор диагностической информации и 4) получение точной информации для принятия клинических решений в пунктах оказания медицинской помощи.
Сущность изобретения
Настоящее изобретение относится к системам и способам детектирования аналитов.
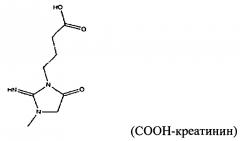
Настоящее изобретение относится к способу детектирования присутствия аналита в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 150 нм до 699 нм (например, от 150 до 250, от 200 до 350, от 250 до 450, от 300 до 500, от 450 до 650 или от 500 до 699 нм), значение релаксивности T2 (T2 relaxivity) на одну частицу, составляющее от 1×108 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита или поливалентного связывающего агента; (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и аналит, и имеет РЧ (радиочастотную) катушку (RF coil), расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) детектирование аналита на основании результата, полученного на стадии (d). В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Например, аналит может представлять собой креатинин, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты креатинина, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к креатинину. В другом варианте осуществления аналит может представлять собой такролимус, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты такролимуса, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к такролимусу. В определенных вариантах осуществления способа стадия (d) включает в себя измерение времени релаксации Т2 жидкого образца, причем увеличение агломерации в жидком образце приводит к увеличению наблюдаемой скорости релаксации T2 данного образца. В некоторых вариантах осуществления аналит представляет собой нуклеиновую кислоту-мишень (например, нуклеиновую кислоту-мишень, экстрагированную из лейкоцита или патогена). Настоящее изобретение относится к способу детектирования присутствия аналита в жидком образце, причем данный способ включает в себя: (a) контактирование раствора с магнитными частицами для получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и имеют на своей поверхности связывающие остатки, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии аналита или поливалентного связывающего агента, (b) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы, поливалентный связывающий агент и аналит, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (c) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (d) следующее за стадией (c) измерение сигнала; и (e) определение аналита на основании результата, полученного на стадии (d). В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Например, аналит может представлять собой креатинин, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты креатинина, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к креатинину. В другом варианте осуществления аналит может представлять собой такролимус, жидкий образец может включать в себя поливалентный связывающий агент, несущий многочисленные конъюгаты такролимуса, и магнитные частицы могут включать в себя поверхность, к которой присоединены антитела к такролимусу. В определенных вариантах осуществления способа стадия (d) включает в себя измерение релаксационного ответа T2 жидкого образца, и причем увеличение степени агрегирования в жидком образце приводит к увеличению наблюдаемой скорости релаксации T2 образца. В некоторых вариантах осуществления аналит представляет собой нуклеиновую кислоту-мишень (например, нуклеиновую кислоту-мишень, экстрагированную из лейкоцита или патогена). Настоящее изобретение дополнительно относится к способу детектирования наличия патогена в образце цельной крови, причем данный способ включает в себя: (a) предоставление образца цельной крови от испытуемого; (b) смешивание образца цельной крови с раствором агента лизиса эритроцитов для получения разрушенных красных кровяных клеток; (c) следующее за стадией (b) центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта и ресуспендирование осадка с образованием экстракта, необязательно промывание осадка (например, ТЕ-буфером) до ресуспендирования осадка и необязательно повторение стадии (c); (d) лизис клеток экстракта для образования лизата; (e) помещение лизата со стадии (d) в детекционную пробирку и амплифицирование нуклеиновой кислоты-мишени в лизате для образования раствора подвергшегося амплифицированию лизата, включающего в себя нуклеиновую кислоту-мишень, в котором данная нуклеиновая кислота-мишень является характерной для патогена, который должен быть обнаружен; (f) следующее за стадией (e) добавление к детекционной пробирке от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм) и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (g) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (h) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (i) следующую за стадией (h) стадию измерения сигнала от детекционной пробирки; и (j) детектирование патогена на основании результата, полученного на стадии (i). В некоторых вариантах осуществления стадии от (a) до (i) завершаются за время, быстрее 4 часов (например, в течение 3,5 часов, 3,0 часов, 2,5 часов, 2 часов, 1,5 часов или 1 часа). В другом варианте осуществления стадию (i) проводят без предварительной очистки раствора подвергшегося амплифицированию лизата (например, раствор лизата не подвергается фракционированию после того, как он образуется). В определенных вариантах осуществления стадия (c) включает в себя промывание осадка до ресуспендирования осадка с целью образования экстракта. В определенных вариантах осуществления стадия (d) включает в себя объединение экстракта с шариками (beads) с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, данный анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение относится к способу детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, причем данный способ включает в себя: (a) предоставление одной или более клеток из образца цельной крови от испытуемого; (b) лизис клеток с образованием лизата; (c) амплифицирование нуклеиновой кислоты-мишени в лизате для образования раствора подвергшегося амплифицированию лизата, содержащего нуклеиновую кислоту-мишень; (d) следующее за стадией (c) добавление к детекционной пробирке раствора подвергшегося амплифицированию лизата и от 1×106 до 1×1013 магнитных частиц на миллилитр раствора подвергшегося амплифицированию лизата, в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм и связывающие остатки на своей поверхности, причем связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (e) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (f) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (h) следующую за стадией (f) стадию измерения сигнала от детекционной пробирки; и (i) детектирование нуклеиновой кислоты-мишени на основании результата, полученного на стадии (h). В определенных вариантах осуществления нуклеиновую кислоту-мишень очищают до стадии (d). В определенных вариантах осуществления стадия (b) включает в себя объединение экстракта с шариками с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы необязательно включают в себя поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение дополнительно относится к способу детектирования присутствия нуклеиновой кислоты-мишени в образце цельной крови, причем данный способ включает в себя: (a) предоставление экстракта, получаемого лизисом красных кровяных клеток в образце цельной крови от испытуемого, центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта и ресуспендирование осадка с образованием экстракта, необязательно промывание осадка (например, ТЕ-буфером) до ресуспендирования осадка и необязательно повторение центрифугирования, отбрасывания и промывания со стадии (a); (b) лизис клеток в экстракте для образования лизата; (c) размещение лизата со стадии (b) в детекционной пробирке и амплифицирование нуклеиновых кислот в ней для образования раствора подвергшегося амплифицированию лизата, включающего в себя от 40% (масс./масс.) до 95% (масс./масс.) нуклеиновой кислоты-мишени (например, от 40 до 60%, от 60 до 80% или от 85 до 95% (масс./масс.) нуклеиновой кислоты-мишени) и от 5% (масс./масс.) до 60% (масс./масс.) нецелевой нуклеиновой кислоты (например, от 5 до 20%, от 20 до 40% или от 40 до 60% (масс./масс.) нецелевой нуклеиновой кислоты); (d) следующее за стадией (c) добавление к детекционной пробирке раствора подвергшегося амплифицированию лизата и от 1×106 до 1×1013 магнитных частиц на миллилитр раствора подвергшегося амплифицированию лизата, в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм и связывающие остатки на своей поверхности, причем связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии нуклеиновой кислоты-мишени или поливалентного связывающего агента; (e) размещение детекционной пробирки в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания детекционной пробирки, включающей в себя магнитные частицы и нуклеиновую кислоту-мишень, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (f) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (g) следующая за стадией (f) стадия измерения сигнала от детекционной пробирки; и (h) детектирование нуклеиновой кислоты-мишени на основании результата, полученного на стадии (g), причем стадию (g) проводят без предварительной очистки раствора подвергшегося амплифицированию лизата. В определенных вариантах осуществления стадия (b) включает в себя объединение экстракта с шариками с целью образования смеси и перемешивание смеси для образования лизата. Магнитные частицы могут включать в себя одну или более популяций частиц, имеющих, соответственно, первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом нуклеиновой кислоты-мишени, и второй зонд действует, связываясь со вторым сегментом нуклеиновой кислоты-мишени, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии нуклеиновой кислоты-мишени. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления лизат дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Лизат может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом.
Настоящее изобретение относится к способу детектирования присутствия вида Candida в жидком образце, причем данный способ включает в себя: (a) лизис клеток Candida в жидком образце; (b) амплифицирование нуклеиновой кислоты, которая должна быть определена, в присутствии прямого праймера и обратного праймера, каждый из которых является универсальным для нескольких видов Candida, с целью образования раствора, включающего в себя ампликон Candida; (c) контактирование раствора с магнитными частицами с целью получения жидкого образца, включающего в себя от 1×106 до 1×1013 магнитных частиц на миллилитр жидкого образца (например, от 1×106 до 1×108, от 1×107 до 1×108, от 1×107 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1013 магнитных частиц на миллилитр), в котором магнитные частицы имеют средний диаметр в интервале от 700 нм до 1200 нм (например, от 700 до 850, от 800 до 950, от 900 до 1050 или от 1000 до 1200 нм), значение релаксивности T2 на одну частицу, составляющее от 1×109 до 1×1012 ммоль-1сек-1 (например, от 1×108 до 1×109, от 1×108 до 1×1010, от 1×109 до 1×1010, от 1×109 до 1×1011 или от 1×1010 до 1×1012 ммоль-1сек-1), и связывающие остатки на своей поверхности, причем данные связывающие остатки действуют, изменяя агрегацию магнитных частиц в присутствии ампликона Candida или поливалентного связывающего агента, (d) размещение жидкого образца в устройстве, причем данное устройство включает в себя подложку, обеспечивающую углубление для удерживания жидкого образца, включающего в себя магнитные частицы и ампликон Candida, и имеет РЧ катушку, расположенную вокруг данного углубления, причем данная РЧ катушка настроена на детектирование сигнала, испускаемого при подвергании жидкого образца воздействию подмагничивающего поля, создаваемого с использованием одного или более магнитов, и последовательности РЧ импульсов; (e) подвергание образца воздействию подмагничивающего поля и последовательности РЧ импульсов; (f) следующую за стадией (e) стадию измерения сигнала; и (g) определение на основании результата, полученного на стадии (f), присутствия организмов вида Candida в образце. В некоторых вариантах осуществления магнитные частицы являются по существу монодисперсными; проявляют неспецифическую обратимость в отсутствие аналита и поливалентного связывающего агента; и/или магнитные частицы дополнительно имеют поверхность, покрытую блокирующим агентом, выбранным из альбумина, желатина рыбьей кожи, гамма-глобулина, лизоцима, казеина, пептидазы и несущего аминогруппу остатка (например, аминополиэтиленгликоля, глицина, этилендиамина или аминодекстрана). В определенных вариантах осуществления жидкий образец дополнительно включает в себя буфер, от 0,1% до 3% (масс./масс.) альбумина (например, от 0,1% до 0,5%, от 0,3% до 0,7%, от 0,5% до 1%, от 0,8% до 2% или от 1,5% до 3% (масс./масс.) альбумина), от 0,01% до 0,5% неионного сурфактанта (например, от 0,01% до 0,05%, от 0,05% до 0,1%, от 0,05% до 0,2%, от 0,1% до 0,3%, от 0,2% до 0,4% или от 0,3% до 0,5% неионного сурфактанта) или их комбинацию. В еще других вариантах осуществления магнитные частицы имеют поверхность, покрытую от 40 мкг до 100 мкг (например, от 40 мкг до 60 мкг, от 50 мкг до 70 мкг, от 60 мкг до 80 мкг или от 80 мкг до 100 мкг) одного или более белков на миллиграмм магнитных частиц. Жидкий образец может включать в себя поливалентный связывающий агент, несущий большое количество аналитов, конъюгированных с полимерным каркасом. Прямой праймер может включать в себя, например, последовательность (SEQ ID NO.1). Обратный праймер может включать в себя, например, последовательность (SEQ ID NO.2). В некоторых вариантах осуществления (i) вид Candida представляет собой Candida albicans, первый зонд включает в себя олигонуклеотидную последовательность (SEQ ID NO.3), и второй зонд включает в себя олигонуклеотидную последовательность (SEQ ID NO.4); (ii) вид Candida представляет собой Candida krusei, и первый зонд и второй зонд включают в себя олигонуклеотидную последовательность, выбранную из: (SEQ ID NO.5), (SEQ ID NO.6) и (SEQ ID NO.15); (iii) вид Candida представляет собой Candida glabrata, первый зонд включает в себя олигонуклеотидную последовательность: (SEQ ID NO.7), и второй зонд включает в себя олигонуклеотидную последовательность: (SEQ ID NO.8), и (iv) вид Candida представляет собой Candida parapsilosis или Candida tropicalis, и первый зонд и второй зонд включают в себя олигонуклеотидную последовательность, выбранную из: (SEQ ID NO.9), (SEQ ID NO.10), (SEQ ID NO.16), (SEQ ID NO.17), (SEQ ID NO.18) и (SEQ ID NO.19). В некоторых вариантах осуществления стадии от (a) до (h) завершаются за время, быстрее 4 часов (например, в течение 3,5 часов, 3,0 часов, 2,5 часов, 2 часов, 1,5 часов или 1 часа или менее). В определенных вариантах осуществления, магнитные частицы включают в себя две популяции, причем частицы первой популяции несут на своей поверхности первый зонд и частицы второй популяции несут на своей поверхности второй зонд. В другом варианте осуществления магнитные частицы представляют собой одну популяцию, несущую на своей поверхности как первый зонд, так и второй зонд. Магнитные частицы могут включать в себя одну или более популяций, частицы которых имеют первый зонд и второй зонд, конъюгированные с их поверхностью, причем первый зонд действует, связываясь с первым сегментом ампликона Candida, и второй зонд действует, связываясь со вторым сегментом ампликона Candida, причем магнитные частицы образуют агрегаты в присутствии нуклеиновой кислоты-мишени. Альтернативно, анализ может представлять собой анализ на дезагрегацию, в котором магнитные частицы включают в себя первую популяцию, на поверхности частиц которой имеется первый связывающий остаток, и вторую популяцию, на поверхности частиц которой имеется второй связывающий остаток, и поливалентный связывающий остаток включает в себя первый зонд и второй зонд, причем первый зонд действует, связываясь с первым связывающим остатком, и второй зонд действует, связываясь со вторым связывающим остатком, причем взаимодействие данных связывающих остатков и поливалентного связывающего остатка обеспечивает изменение степени агрегации магнитных частиц в присутствии ампликона Candida. В определенных вариантах осуществления данным способом можно получить (i) степень вариации значения T2, составляющую менее 20% в образцах с положительным результатом на Candida; (ii) по меньшей мере 95% правильного детектирования при количестве клеток, меньшем или равном 5 клеток/мл в образцах, вспрыснутых в 50 отдельные образцы крови здоровых пациентов; (iii) по меньшей мере 95% правильного детектирования при количестве клеток, меньшем или равном 5 клеток/мл в образцах, вспрыснутых в 50 отдельных образцов крови нездоровых пациентов; и/или (iv) больше чем или эквивалентно 80% правильного детектирования в полученных от пациентов клинически позитивных образцах (например, в которых позитивный результат на Candida был получен с помощью другой методики, такой как анализ на клеточных культурах), начиная с 2 мл крови.
Настоящее изобретение относится к способу детектирования присутствия вида Candida в образце, представляющем собой образец цельной крови, причем данный способ включает в себя: (a) предоставление экстракта, произведенного лизисом красных кровяных клеток в образце цельной крови от пациента; (b) центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества или всего супернатанта; (c) промывание осадка (например, ТЕ-буфером) смешиванием осадка с буфером, перемешивание образца (например, на аппарате для встряхивания типа ʺВортексʺ), центрифугирование образца для образования супернатанта и осадка, отбрасывание некоторого количества супернатанта или всего супернатанта; (d) необязательно повторение стадий (b) и (c); (e