Способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов
Иллюстрации
Показать всеИзобретение относится к медицине, биологии, биотехнологии, фармакологии и может быть использовано для оценки цитотоксичности компонентов, входящих в состав скаффолдов, используемых в тканевой инженерии, а именно при пластике или замещении дефектов тканей организма с обеспечением стимуляции их регенерации. Для этого из крови выделяют эритроциты, промывают их и инкубируют с компонентами материалов скаффолдов при 37оС в течение 30 мин. Затем эритроциты смешивают с аутологичной плазмой крови, помещают каплю на предметное стекло и проводят микрофотосъемку с объективом 100х. Цитотоксичность компонентов скаффолдов оценивают по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме крови. Изобретение позволяет оценивать цитотоксичность компонентов скаффолдов быстрым и доступным способом с высокой чувствительностью. 4 ил., 2 пр.
Реферат
Предлагаемое изобретение относится к медицине, биологии, биотехнологии, фармакологии и может быть использовано для микроскопической оценки цитотоксичности компонентов, входящих в состав скаффолдов, используемых в тканевой инженерии, а именно при пластике или замещении дефектов тканей организма с обеспечением стимуляции их регенерации.
В настоящее время в связи с увеличивающимся объемом разработок новых материалов и скаффолдов из них важное значение приобретает разработка методов оценки цитотоксичности компонентов скаффолдов, на заселение клетками которых влияет множество факторов, в частности цитотоксичность материалов скаффолда.
Известен способ оценки токсичности продукции из полимерных и текстильных материалов, включающий биосенсор на основе кислородного электрода, иммобилизацию целых клеток бактерий E.coliK-12 на поверхность кислородного электрода. После иммобилизации измеряют дыхательную активность микроорганизмов в присутствии пробы и стандартных образцов положительного и отрицательного контроля. Далее рассчитывают индекс токсичности (см. Пономарева О.Н. и др. Способ оценки токсичности продукции из полимерных и текстильных материалов. Патент 2518306 РФ, 2012).
Метод достаточно сложен, трудоемок, длителен и требует специального оборудования.
В настоящее время доказано, что эритроцит можно рассматривать как универсальную модель для изучения изменений цитоплазматических мембран и метаболизма клеток.
В качестве прототипа выбран способ определения цитотоксичности малорастворимых производственных пылей, включающий инкубацию эритроцитов человека с равными дозами различных пылей, регистрацию измерения в эталонном водном растворе окислительно-восстановительного потенциала (ОВП), где в качестве показателя цитотоксичности при действии определенной дозы на эритроциты является выраженное в процентах повышение среднего за период инкубации уровня ОВП в активированной эталонной воде при воздействии контрольной эритроцитарной суспензии без пыли (см. Петров С.Б., Петров Б.А. Способ определения цитотоксичности малорастворимых производственных пылей. Патент 2480751 РФ, 2013).
Однако этот способ является сложным, трудоемким и требует длительного времени.
Задача предлагаемого изобретения - усовершенствование способа.
Технический результат - упрощение и сокращение времени процесса определения цитотоксичности компонентов материалов скаффолдов.
Технический результат достигается за счет того, что в способе, включающем выделение эритроцитов из крови, их промывание и инкубирование с компонентами материалов скаффолдов, эритроциты смешивают с аутологичной плазмой крови, помещают на предметное стекло, опускают в каплю смеси объектив 100х, проводят микрофотосъемку. Оценивают цитотоксичность компонентов материалов скаффолдов по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме крови.
Способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов осуществляют следующим образом. Кровь от здоровых добровольцев забирают в вакуумные пробирки, содержащие 3.8% цитрат натрия (9:1). Пробирки центрифугируют при 3000 об/мин в течение 20 мин. Бестромбоцитарную плазму и клетки белой крови убирают, а эритроциты трижды промывают физиологическим раствором. К 1 мл забуференного физиологического раствора (10 мМ трис-HCI; 150 мМ NaCI) с pH, доведенной до 7,4, добавляют 50 мкл промытых эритроцитов и 0.1 мл исследуемого материала. Инкубируют при 37°C в течение 30 мин, центрифугируют при 3000 об/мин в течение 5 мин. Супернатант убирают, после чего бестромбоцитарную плазму смешивают с эритроцитами в соотношении 2:1, каплю смеси помещают на предметное стекло, опускают в нее объектив (100х) светового микроскопа и после достижения фокуса (×1000) проводят микрофотосъемку. После этого изучают морфологию клеток и их агрегатов.
Одним из наиболее часто используемых материалов, входящих в скаффолды, является коллаген, составляющий основу соединительной ткани организма и обеспечивающий ее прочность и эластичность. Коллаген имеет несколько преимуществ, которые позволяют использовать данный материал для получения скаффолдов в тканевой инженерии: биосовместимость, волокнистая структура, хорошая сочетаемость с другими материалами, биодеградируемость. Кроме того, коллаген обладает свойствами, обуславливающими высокую клеточную адгезию скаффолда.
Используя разные виды коллагена, проводилась проверка эффективности предполагаемого способа оценки цитотоксичности.
Способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов поясняется следующими чертежами.
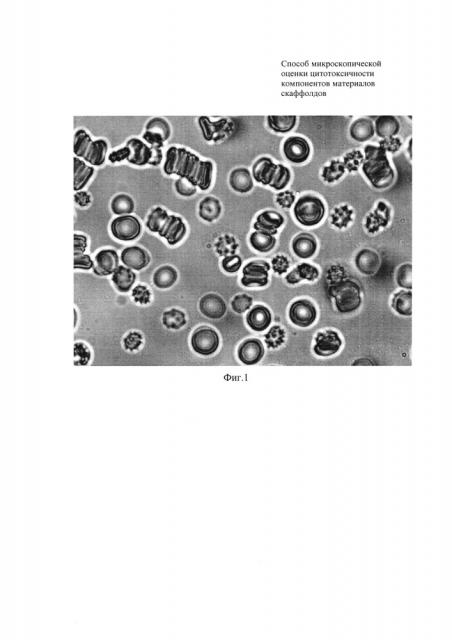
Фиг. 1 - Морфология эритроцитов и их агрегация при исследовании на цитотоксичность коллагена №1.
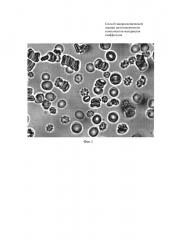
Фиг. 2 - Морфология эритроцитов и их агрегация при исследовании на цитотоксичность коллагена №2.
Фиг. 3 - ДФЧ в скаффолде с коллагеном №1, (6 сутки инкубации; ×100).
Фиг.4 - ДФЧ в скаффолде с коллагеном №2, (6 сутки инкубации; ×100).
Способ поясняется следующими примерами.
Пример 1. Промытые эритроциты здоровых людей инкубировали с образцом коллагена №1 в течение 30 мин при 37°C. Далее суспензию эритроцитов центрифугировали 5 мин при 3000 об/мин. Супернатант убирали, плазму крови смешивали с эритроцитами в соотношении 2:1, каплю смеси помещали на предметное стекло, опускали в нее объектив 100х и проводили микрофотосъемку. На фиг.1 видно, что коллаген №1 обладает токсическим действием на эритроциты. Об этом свидетельствует появление большого количества патологических форм эритроцитов (эхиноцитов). При этом наблюдается нарушение образования монетных столбиков в аутологичной плазме крови.
Пример 2. Промытые эритроциты здоровых людей инкубировали с образцом коллагена №2 в течение 30 мин при 37°C. Далее суспензию эритроцитов центрифугировали 5 мин при 3000 об/мин. Супернатант убирали, плазму крови смешивали с эритроцитами в соотношении 2:1, каплю смеси помещали на предметное стекло, опускали в нее объектив 100х и проводили микрофотосъемку. На фиг. 2 видно, что коллаген №2 не оказывает токсического действия на эритроциты. Об этом свидетельствует незначительное количество измененных эритроцитов. При этом сохраняется образование монетных столбиков в аутологичной плазме крови.
Для дополнительной проверки точности и чувствительности предложенного способа проводилось исследование заселения скаффолдов, в состав которых входили различные виды коллагена и дермальные фибробласты. Для этого уксуснокислый коллаген с pH, доведенной до 7,4, смешивали с плазмой крови. В полученный композитный раствор вводили суспензию фибробластов в культуральной среде DMEM, содержащей 10% эмбриональной телячьей сыворотки в объеме 0,5 мл. Количество клеток в суспензии составляло от 400 до 600 тыс. Композитный раствор, содержащий суспензию клеток, в объеме 2,5 мл заливали в форму для скаффолда. После завершения манипуляций к композитному раствору, содержащему суспензию клеток, немедленно добавляли тромбин-кальциевую смесь. Выдерживали полученный скаффолд в форме в течение 20 мин (для более полной полимеризации фибрина), затем перемещали его в пластиковую чашку Петри и заливали 5 мл культуральной среды DMEM, содержащей 10% эмбриональной телячьей сыворотки. Помещали чашку Петри с полученным скаффолдом в клеточный инкубатор с 5% содержанием CO2 и температурой 37°C. В течение последующих 3 часов происходила полная полимеризация содержащегося в скаффолде коллагена. Наблюдали формирование развития клеточной сети с 3D-структурой. В этих условиях установлено, что при использовании коллагена №1 заселение клетками скаффолда и развитие клеточной сети происходило значительно хуже (Фиг. 3), чем при использовании коллагена №2 (Фиг. 4).
Способ позволяет вести оценку цитотоксичности материалов различного происхождения по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме. Подтверждается высокая чувствительность предлагаемого способа, его доступность, информативность и быстрота выполнения.
Способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов, включающий выделение эритроцитов из крови, их промывание и инкубирование, отличающийся тем, что промытые эритроциты инкубируют с компонентами материалов скаффолдов в течение 30 мин при 37°С, центрифугируют 5 мин при 3000 об/мин, супернатант удаляют, бестромбоцитарную плазму крови смешивают с эритроцитами в соотношении 2:1, помещают на предметное стекло, опускают в каплю смеси объектив 100х, проводят микрофотосъемку, оценивают цитотоксичность компонентов материалов скаффолдов по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме крови.