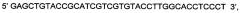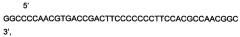Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена lif и/или уменьшением количества белка фактора, ингибирующего лейкемию, на основе генно-терапевтических субстанций с геном lif, способ получения и использования
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается средства для коррекции состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию, на основе генно-терапевтических субстанций с геном LIF, где клетки органов и тканей выбраны из фибробластов, клеток эндометрия матки, эпителиальных клеток; органы и ткани выбраны из кожи, слизистой оболочки рта или мышечной ткани, представляющего собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена LIF, с кодирующей последовательностью белка фактора, ингибирующего лейкемию, с делениями 5' и 3'-нетранслируемых областей, в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. Группа изобретений также касается способа получения указанного средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию; способа использования указанного средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию. Группа изобретений обеспечивает высокий и стабильный уровень целевого белка в клетках. 3 н. и 2 з.п. ф-лы, 20 ил., 18 пр.
Реферат
Область, к которой относится изобретение
Изобретение относится к молекулярной биологии, биотехнологии, генной инженерии и медицине и может быть использовано для коррекции патологических состояний клеток различных органов и тканей, а также собственно органов и тканей человека, связанных с уменьшением уровня экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию, в частности, в терапевтических целях.
Предшествующий уровень.
В организме человека присутствуют низкомолекулярные белки цитокины, которые осуществляют свое биологическое действие через взаимодействие со специфическими клеточными поверхностными рецепторами. Цитокины регулируют активацию, дифференцировку и пролиферацию иммунных и неиммунных клеток, участвуют в опосредовании как воспалительных, так и иммунных реакций, являются критическими элементами в ответе органов и тканей человека на повреждение или инфекционно-вирусное поражение.
Фактор, ингибирующий лейкемию ((leukemia inhibitory factor, ген LIF), представляет собой высокогликолизированный полипептид с молекулярной массой 45-56 кДа, который кодируется геном, локализованным у человека в хромосоме 22ql2. Он является цитокином из семейства интерлейкина-6 (IL-6), оказывающим свое действие путем связывания с трансмембранным рецептором, состоящим из 2-х субъединиц - рецептора LIF (LIFR) и гликопротеина др130. Этот белок оказывает влияние на пролиферацию, дифференцировку и выживание клеток в различных тканях, в том числе в тканях репродуктивного тракта, где он участвует во многих процессах, начиная с роста и развития гамет и заканчивая наступлением беременности.
Фактор, ингибирующий лейкемию - один из ключевых паракринных маркеров имплантации, имеющий важное значение во время аппозиции и адгезии бластоцисты. Этот белок обладает свойствами провоспалительного и гемопоэтического цитокина и частично дублирует биологические свойства IL-6, IL-11 и др. Концентрация фактора, ингибирующего лейкемию, в смывах из полости матки и образцах ткани эндометрия ниже у пациенток с бесплодием неясного генеза, а также у больных с безуспешными попытками ЭКО по сравнению с фертильными женщинами [Dimitriadis Е et al. // Hum. Reprod. 2005; 11 (6): 613-30.]. При этом у женщин с бесплодием с выраженной экспрессией гена LIF в середине лютеиновой фазы шансы на достижение беременности были в 6,4 раза выше, чем у пациенток со сниженной экспрессией гена LIF [Serafini Р et al. // Int J Gynecol Obstet 2008; 102: 23-7].
Фактор, ингибирующий лейкемию, выполняет следующие функции в организме человека: осуществляет поддержку роста и ингибирование дифференциации нормальных эмбриональных стволовых клеток, стимуляцию продукции белков острой фазы гепатоцитами; воздействует на свойство интерлейкина 3 усиливать мегакариоцитарную дифференцировку миелоидных клеток-предшественников и стимулировать костную резорбцию и формирование кости; при развитии нервной системы индуцирует и усиливает синтез нейропептидов и ацетилхолина в симпатической нервной системе и является нейротрофическим фактором выживания, влияет на гемопоэз, энергетический метаболизм. Растворимая форма белка фактора, ингибирующего лейкемию, может быть определена в таких биологических жидкостях человека, как сыворотка, цельная кровь, синовиальная жидкость и моча.
Количественная оценка данного белка у здоровых людей и у пациентов, страдающих различными заболеваниями, помогает получить полную картину при различных клинических ситуациях. Ключевое значение имеет определение гликозилированной формы белка фактора, ингибирующего лейкемию, с использованием антител, полученных к такой молекуле и гликозилированного стандарта. Было показано, что уровень этого белка в крови, моче и других биологических жидкостях повышается в патологичесских условиях, таких как гиперкальциемия, полицитемия, эритропоэтический криз, гипертромбоцитемия; при остром отторжении аллотрансплантата, особенно почки; при остеопорозе. У человека этот белок играет важную роль при воспалительных заболеваниях легких - в остром и хроническом воспалении, а также при пневмонии. При ревматоидном артрите количество белка повышено в сыворотке и синовиальной жидкости, также оно повышено при раке (аденокарциноме, мезотелиоме, меланоме), при перитонитах. Показано, что многие линии человеческих опухолевых клеток конститутивно продуцируют определяемые уровни фактора, ингибирующего лейкемию, тогда как обычно экспрессия этого белка индуцируется стимулирующими факторами. Концентрация фактора, ингибирующего лейкемию, в костном мозге значительно повышена у пациентов с онкогематологическими заболеваниями. Сильно повышен уровень этого белка в амниотической жидкости и ассоциирован с внутриутробными инфекциями.
Таким образом, повышение количества фактора, ингибирующего лейкемию, в организме человека может быть примером защитной функции при патологических состояниях.
В патенте US 5712156 показан метод повышения эффективности имплантации и выживаемости эмбрионов с использованием белка фактора, ингибирующего лейкемию (ген LIF), человека, полученного рекомбинантным способом. Бластоцисты культивировали 48 часов в среде с белком фактора, ингибирующего лейкемию, и имплантировали в матку овцы. Количество прижившихся бластоцист оказалось в 4 раза выше, чем в случае, когда бластоцисты культивировали в среде без белка фактора, ингибирующего лейкемию. При использовании рекомбинантного белка мыши, эффекта, повышающего выживаемость эмбрионов и эффективность имплантации, обнаружено не было. В заявке WO 2000001404 и патенте US 5962321 также предложено использовать препарат белка фактора, ингибирующего лейкемию, в качестве агента, повышающего вероятность имплантации эмбриона. Эффективность данного метода продемонстрирована на лабораторных животных. Недостатком данного подхода является высокая стоимость получения чистого рекомбинантного белка, а также неоднократное введение белка увеличивает стоимость лечения пациента.
Более эффективным и перспективным методом лечения является использование генно-терапевтических методов, в частности - введение непосредственно в эндометрий генетической конструкции, несущей кДНК гена LIF.
Известны исследования по получению генетических конструкций с геном LIF, которые осуществляли с помощью технологии ОТ-ПЦР с использованием в качестве матрицы мРНК, выделенной из плаценты. В ПЦР были использованы праймеры, позволяющие получить кДНК, кодирующую как зрелый белок, так и белок с сигнальным пептидом. После определения первичной последовательности продуктов ПЦР, клонированных в pUC28, фрагмент ДНК, кодирующий зрелый белок, был субклонирован в вектор экспрессии рЕТ24. Индукция IPTG приводила к синтезу в клетках E.coli белка - продукта гена LIF, который получен в рефолдированной форме, и его биологическая активность была проверена на культуре миелоидных лейкемических клеток мыши М1. Для экспрессии LIF в клетках млекопитающих были сконструированы две рекомбинантные плазмиды на основе вектора экспрессии для эукариотических клеток pCVU55763, в которых экспрессию рекомбинантного гена LIF, кодирующего белок с сигнальным пептидом, обеспечивает цитомегаловирусный промотор. Было показано, что генетически модифицированные клетки трех линий, полученных трансфекцией рекомбинантными плазмидами с геном LIF, экспрессируют гликозилированный белок, который секретируют в культуральную среду (С.Е. Рымарь с соавт. // "Журн. АМН ", 2010, т. 16, додаток. - С. 159-160.). При этом использования полученных генетических конструкций в качестве генно-терапевтического средства не проводилось.
В заявке WO 2002020609 А2, в которой говорится о применении белка интерлейкина 11, который сходен по структуре с белком фактора, ингибирующего лейкемию, и относится к одному с ним семейству IL-6 цитокинов, а также полинуклеотидов, кодирующих этот белок в терапии инсультов и нейропатии, а также- для выявления соединений-агонистов (лигандов), полезных при терапии. В частности, в заявке говорится о полинуклеотиде, который кодирует белок интерлейкина 11, для изготовления лекарственного средства для лечения инсульта или невропатии, а также - для генной терапии. Такая генная терапия включает введение полинуклеотидной последовательности гена IL-11 в соматические клетки методами генной инженерии для замены дефектного гена IL-11, или для повышения производства белка интерлейкина 11 при таком заболевании, как инсульт. В предпочтительном варианте реализации изобретения полинуклеотид включает нативную полинуклеотидную последовательность, кодирующую природный белок гена IL-11. Полинуклеотид может содержать некодирующие 5' и 3' последовательности - транскрибируемые, но нетранслируемые последовательности, сигналы сплайсинга и полиаденилирования, сайты связывания рибосом и последовательности, которые стабилизируют мРНК. Другие варианты осуществления настоящего изобретения включают в себя полинуклеотиды, кодирующие варианты полипептида, в котором аминокислотные остатки замещены, удалены или добавлены, в любой комбинации.
Недостатком данного подхода является то, что при создании генно-терапевтического средства в этом изобретении применены методы, которые приводят к делециям, заменам, вставкам аминокислот целевого белка, что может приводить к изменению его структуры и свойств, а также не учитываются индивидуальные характеристики пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
За прототип авторами был принята заявка WO 0194605, в которой раскрыты способы применения полинуклеотидов, кодирующих цитокин или рецептор цитокина, при получении трансформированных клеток-хозяев и трансгенных животных. В частности, описано использование векторных композиций на основе рекомбинантного аденоассоциированного вируса (Раав), содержащих полинуклеотидные последовательности, которые экспрессируют один или несколько цитокинов млекопитающих или полипептиды рецептора цитокина в клетке млекопитающего или человека. Заявленный вектор может содержать участок нуклеиновой кислоты, который кодирует цитокин, выбранный из группы, состоящей из интерлейкина, лептина, фактора, ингибирущего лейкемию (LIF), и нейротрофического фактора. Векторная композиция может дополнительно содержать наночастицы, а именно - нанокапсулы, липосомы, липид, или липидный комплекс.
Также раскрыты способы лечения и облегчения симптомов различных состояний и расстройств у животных, включая слепоту, пигментный ретинит, возрастная макулярная дегенерация, ожирение, анорексия, и связанные с ними расстройства пищевого поведения, а также неврологические и скелетно-мышечные нарушения, в том числе, например, боковой амиотрофический склероз, которые связаны с дефицитом цитокина или полипептида рецептора цитокина у млекопитающего или человека. Способ включает в себя введение генетической конструкции, которая кодирует один или более цитокин или полипептиды рецептора цитокина в фармацевтически приемлемом носителе животному в количестве и в течение периода времени, достаточного для лечения или уменьшения дефицита таких полипептидов как лептин (LEP), BDNF, LIF, BDNF рецептор, LIF-рецептор, рецептор лептина, цилиарного нейротрофического фактора (CNTF) и рецептора полипептида CNTF.
Недостатком данного подхода является то, что при создании генно-терапевтического средства в этом изобретении использован аденоассоциированный вирус, который может интегрироваться в хромосому клетки-хозяина, а также - не учитываются индивидуальные характеристики пациента, в связи с которыми может понадобиться группа вариаций для данного средства.
Раскрытие изобретения
Задачей данного изобретения является создание высокоэффективного средства для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию, на основе генно-терапевтических субстанций с геном LIF, представляющего собой группу генно-терапевтических субстанций, при использовании которых с учетом индивидуальных особенностей пациента, происходит повышение уровня экспрессии гена LIF и/или повышение количества белка фактора, ингибирующего лейкемию, в клетках органов и тканей и/или органах и тканях организма
Указанная задача решается за счет того, что создано средство для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию на основе генно-терапевтических субстанций с кДНК гена LIF, представляющее собой, по крайней мере, одну генно-терапевтическую субстанцию, выбранную из группы генно-терапевтических субстанций, каждая из которых представляет генетическую конструкцию на основе векторной плазмиды, включающей кДНК гена LIF, с кодирующей последовательностью белка фактора, ингибирующего лейкемию, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена LIF SEQ ID No: 1, или модифицированной кДНК гена LIF, при этом в качестве модифицированной кДНК гена LIF используют SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций, каждая из которых содержит также регуляторные элементы, обеспечивающие высокий уровень экспрессии гена LIF в эукариотических клетках, в частности в клетках органов и тканей человека, и способную увеличить количество белка фактора, ингибирующего лейкемию в клетках органов и тканей и/или органах и тканях человека, в частности в коре головного мозга, гиппокампе, в боковых желудочках головного мозга, мозжечке, щитовидной железе, паращитовидной железе, надпочечниках, аппендиксе, костном мозге, лимфатических узлах, миндалинах, селезенке, сердце, носоглотке, бронхах, легких, печени, желчном пузыре, печени, поджелудочной железе, слюнных железах, желудке, двенадцатиперстной кишке, тонкой кишке, толстой кишке, прямой кишке, почке, мочевом пузыре, семенниках, семенных канатиках, простате, семенных везикулах, молочных железах, шейке матки, фаллопиевых трубах, яичниках, плаценте, коже, в слизистой оболочке полости рта, сердечной мышечной ткани, скелетной мышечной ткани, гладкой мышечной ткани, эндометрии матки, жировой ткани, мягких тканях, в фибробластах, клетках эндометрия матки, эпителиальных и мышечных клетках в сочетании с транспортной молекулой или без нее при введении этих генно-терапевтических субстанций в органы и ткани человека. При этом каждая генетическая конструкция с модифицированной кДНК гена LIF содержит последовательность нуклеотидов, включающую в себя белок-кодирующую область кДНК гена LIF, которая несет модификации, не затрагивающие структуру белка фактора, ингибирующего лейкемию, а именно: нуклеотидные замены, не приводящие к аминокислотным заменам или обрыву аминокислотной цепи, или комбинации вышеперечисленных модификаций и, не влияющие на кодируемую этой последовательностью аминокислотную последовательность. В качестве транспортной молекулы используют липосомы, или дендримеры 5-го и выше поколений, или амфифильные блоксополимеры.
Способ получения средства для лечения состояний человеческого организма связанного с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию, по п. 1., заключается в получении каждой генно-терапевтической субстанции из группы генно-терапевтических субстанций по п. 1, при этом получают кДНК гена LIF, затем помещают кДНК в векторную плазмиду, способную обеспечить высокий уровень экспрессии этой кДНК в клетках различных органов и тканей человека, наращивают и выделяют необходимое количество генетической конструкции, затем комбинируют генетическую конструкцию с транспортной молекулой для трансфекции полученной генно-терапевтической субстанцией клеток органов и тканей и/или введения полученной генно-терапевтической субстанции в органы и ткани человека, при этом используют кДНК гена LIF с кодирующей последовательностью белка фактора, ингибирующего лейкемию, с делециями 5' и 3'-нетранслируемых областей, а именно, полученной на основе участка нативной немодифицированной кДНК гена LIF SEQ ID No: 1, или модифицированной кДНК гена LIF, при этом в качестве модифицированной кДНК гена LIF используют, или SEQ ID No: 2, или SEQ ID No: 3, или SEQ ID No: 4, или SEQ ID No: 5, или SEQ ID No: 6, или SEQ ID No: 7, или сочетание этих генетических конструкций.
Способ использования средства для лечения состояний человеческого организма, связанных с уменьшением экспрессии гена LIF и/или уменьшением количества белка фактора, ингибирующего лейкемию, в том числе женского бесплодия, заключается в трансфекции генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций по п. 1. клеток органов и тканей пациента и/или во введении в органы и ткани пациента аутологичных клеток пациента, трансфицированных генно-терапевтической субстанцией, выбранной из группы созданных генно-терапевтических субстанций по п. 1, и/или во введении в органы и ткани пациента генно-терапевтической субстанции или нескольких субстанций, выбранной/ выбранных из группы созданных генно-терапевтических субстанций по п. 1., или сочетанием обозначенных способов.
Перечень фигур
На фиг. 1
Представлена нуклеотидная последовательность немодифицированной кДНК гена LIF длиной 318 н.п. SEQ ID No: 1, которая имеет высокую гомологию с приводимой в базе данных GenBank под номером NM_002309 и кодирует белок фактора, ингибирующего лейкемию (GenBank NP_002300.1).
На фиг. 2
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 2, которая содержит 2 нуклеотидных замены G→C в позициях 171 и 219; не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 3
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 3, которая
содержит 2 нуклеотидных замены G→C в позициях 171 и 219; 2 нуклеотидных замены А→С в позициях 264 и 480, не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 4
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 4, которая
содержит 1 нуклеотидную замену A→G в позиции 399, 2 нуклеотидных замены G→C в позициях 171 и 219; 2 нуклеотидных замены А→С в позициях 264 и 480, не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 5
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 5, которая
содержит 1 нуклеотидную замену A→G в позиции 399, 4 нуклеотидных замены G→C в позициях 171, 219, 417, 426; 2 нуклеотидных замены А→С в позициях 264 и 480, не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 6
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 6, которая
содержит 1 нуклеотидную замену A→G в позиции 399, 5 нуклеотидных замен G→C в позициях 171, 219, 417, 426, 447; 2 нуклеотидных замены А-^С в позициях 264 и 480, не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 7
Представлена нуклеотидная последовательность модифицированной кДНК гена LIF, SEQ ID No: 7, которая
содержит 2 нуклеотидных замены A→G в позициях 399, 591; 6 нуклеотидных замен G→C в позициях 171, 219, 417, 426, 447, 675; 2 нуклеотидных замены А→С в позициях 264 и 480, не приводящих к изменениям в аминокислотной последовательности белка фактора, ингибирующего лейкемию.
На фиг. 8
С целью последующего корректного определения генно-терапевтического эффекта после трансфекции фибробластов генно-терапевтической субстанцей с кДНК гена LIF проводили анализ эндогенной экспрессии гена LIF в культуре первичных фибробластов. На фигуре представлены графики накопления продуктов полимеразной цепной реакции (ПЦР), соответствующих:
1 - кДНК гена LIF, фибробласты со сниженной экспрессией гена LIF,
2 - кДНК гена LIF, фибробласты с нормальной экспрессией гена LIF,
3 - кДНК гена В2М, фибробласты со сниженной экспрессией гена LIF,
4 - кДНК гена В2М, фибробласты с нормальной экспрессией гена LIF.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 9
С целью подтверждения увеличения экспрессии гена LIF в клеточной культуре фибробластов со сниженной экспрессией гена LIF при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена LIF с генетической конструкцией pCMV6-LIF SEQ ID No: 1 представлены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена LIF в фибробластах с нормальной экспрессией гена LIF,
2 - кДНК гена LIF в фибробластах со сниженной экспрессией гена LIF до трансфекции ГТС с кДНК гена LIF,
3 - кДНК гена LIF в фибробластах со сниженной экспрессией гена LIF после трансфекции ГТС с кДНК гена LIF,
4 - кДНК гена LIF в фибробластах со сниженной экспрессией гена LIF после трансфекции вектором без кДНК гена LIF,
5 - кДНК гена В2М в фибробластах с нормальной экспрессией гена LIF,
6 - кДНК гена В2М в фибробластах со сниженной экспрессией гена LIF до трансфекции ГТС с кДНК гена LIF,
7 - кДНК гена В2М в фибробластах со сниженной экспрессией гена LIF после трансфекции ГТС с кДНК гена LIF,
8 - кДНК гена В2М в фибробластах со сниженной экспрессией гена LIF после трансфекции вектором без кДНК гена LIF.
Из графиков следует, что в случае трансфекции вектором без вставки кДНК гена LIF уровень кДНК гена LIF в фибробластах не изменился, а в случае трансфекции вектором с кДНК гена LIF -уровень кДНК фибробластов со сниженной экспрессией гена LIF многократно увеличился (до уровня выше, чем уровень кДНК гена LIF в нормальных фибробластах).
На фиг. 10
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию, в клеточной культуре фибробластов с нормальной экспрессией гена LIF при трансфекции данных клеток генно-терапевтической субстанцией содержащей кДНК гена LIF представлен график изменения количества белка фактора, ингибирующего лейкемию, нетрансфицированных фибробластов (культура А), трансфицированных вектором pCDNA 3.1 (+) не содержащим кДНК гена LIF (культура В) и трансфицированных генно-терапевтической субстанцией с генетической конструкцией pCDNA 3.1-LIF SEQ ID No: 1 (культура С). Из графика следует, что при трансфекции фибробластов генно-терапевтической субстанцией с кДНК гена LIF происходит увеличение количества белка фактора, ингибирующего лейкемию, в клеточном лизате.
На фиг. 11
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию, в коже человека при введении в кожу клеточной культуры фибробластов, трансфицированной генно-терапевтической субстанцией, представлен анализ изменения количества белка фактора, ингибирующего лейкемию, в коже пациентов. При этом пациентам вводили три варианта культуры аутологичных фибробластов - нетрансфицированные (А), трансфицированные вектором pCMV6-XL5 (Б) и трансфицированные генно-терапевтической субстанцией с генетической конструкцией pCMV6- LIF SEQ ID No: 7 (С) - в кожу предплечья. Также анализировали количественный уровень белка фактора, ингибирующего лейкемию, в интактной коже. Показано повышение количества белка фактора, ингибирующего лейкемию, в коже пациента в области введения фибробластов, трансфицированных генно-терапевтической субстанцией кДНК гена LIF (С).
На фиг. 12
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию до различного индивидуального уровня в клеточных культурах фибробластов пациентов при трансфекции данных клеток генно-терапевтическими субстанциями с участком нативной немодифицированной «ДНК гена LIF и модифицированных кДНК гена LIF, представлен анализ изменения количественного уровня белка фактора, ингибирующего лейкемию, в культурах фибробластов кожи человека в зависимости от наличия и типа модификаций в кДНК гена LIF, используемой для трансфекции фибробластов.
Культуры фибробластов 18 пациентов делили на 8 частей каждую с (А) по (Н); первые части (А) клеточных культур пациентов трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 1, части (В) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 2, части (С) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 3, части (D) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 4, части (E) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 5, части (F) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 6, части (G) трансфицировали генно-терапевтической субстанцией pCMV6-LIF SEQ ID No: 7, части (H) трансфицировали векторной плазмидой, не содержащей кДНК гена LIF.
По итогам анализа количественного уровня белка фактора, ингибирующего лейкемию, выбрали показатели, касательно каждой части клеточной культуры от каждого пациента, продемонстрировавшие максимальное количество белка фактора, ингибирующего лейкемию, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 1,
в группе 2 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 2,
в группе 3 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 3,
в группе 4 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 4,
в группе 5 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 5,
в группе 6 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 6,
в группе 7 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при трансфекции pCMV6-LIF SEQ ID No: 7.
Ни в одной из клеточных культур не наблюдалось того, что максимальное количество белка фактора, ингибирующего лейкемию, присутствует при трансфекции вектором без вставки кДНК гена LIF.
На фигуре 12 для каждой группы клеточных культур приведены диаграммы показателей концентрации белка фактора, ингибирующего лейкемию, (усредненных в рамках группы, в случае, если в группу входит более одной клеточной культуры) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после трансфекции этих клеточных культур генно-терапевтическими субстанциями, содержащими модифицированные и нативную кДНК гена LIF.
Из фигуры следует, что достижение максимального количества белка фактора, ингибирующего лейкемию, в культурах фибробластов кожи различных пациентов при их трансфекции генно-терапевтическими субстанциями, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена LIF, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей необходимо предварительное персонализированное исследование пациента.
Обозначения:
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 1 (А)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 2 (В)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 3 (С)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 4 (D)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 5 (Е)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 6 (F)
части клеточных культур, трансфицированных ГТС LIF SEQ ID No: 7 (G)
части клеточных культур, трансфицированных плацебо (Н)
На фиг. 13
С целью подтверждения увеличения экспрессии гена LIF в клеточной культуре эндометрия матки человека при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена LIF в генетической конструкции pCMV6-Kan/Neo LIF SEQ ID No: 2 приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена LIF, клетки эндометрия до трансфекции
2 - кДНК гена LIF, клетки эндометрия после трансфекции
3 - кДНК гена В2М, клетки эндометрия до трансфекции
4 - кДНК гена В2М, клетки эндометрия после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена LIF в культуре клеток эндометрия матки человека многократно вырос.
На фиг. 14
С целью подтверждения увеличения экспрессии гена LIF в клеточной культуре эпителия слизистой оболочки полости рта при трансфекции данных клеток генно-терапевтической субстанцией с кДНК гена LIF приведены графики накопления ПЦР-продуктов, соответствующих:
1 - кДНК гена LIF, до трансфекции
2 - кДНК гена LIF, после трансфекции
3 - кДНК гена В2М, до трансфекции
4 - кДНК гена В2М, после трансфекции
Ген В2М использовали в качестве референтного.
Из фигуры следует, что в результате трансфекции уровень специфической кДНК гена LIF вырос многократно.
На фиг. 15
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию, в коже человека при введении в кожу генно-терапевтической субстанции представлен анализ изменения количественного уровня белка фактора, ингибирующего лейкемию, в коже. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена LIF pCMV6-LIF SEQ ID No: 4 (В) и параллельно вводили плацебо, представляющее собой комбинацию векторной плазмиды pCMV-XL5 не содержащей кДНК гена LIF с транспортной молекулой (А) - в кожу предплечья. Показано увеличение количества белка фактора, ингибирующего лейкемию, в биоптате кожи пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена LIF, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 16
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию в слизистой оболочке полости рта человека при введении в слизистую оболочку полости рта генно-терапевтической субстанции представлен анализ изменения количественного уровня белка фактора, ингибирующего лейкемию, в слизистой оболочке полости рта. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена LIF pCDNA 3.1 LIF SEQ ID No: 5 (В) и параллельно вводили плацебо pCDNA 3.1(+), представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена LIF с транспортной молекулой (А) - в слизистую оболочку полости рта.
Показано увеличение количественного уровня белка фактора, ингибирующего лейкемию, в лизате биоптата слизистой оболочки полости рта пациента 1 В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена LIF, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 17
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию, в мышечной ткани человека при введении в мышечную ткань генно-терапевтической субстанции представлен анализ изменения количества белка фактора, ингибирующего лейкемию, в мышечной ткани. При этом пациенту вводили генно-терапевтическую субстанцию, содержащую векторную плазмиду с кДНК гена LIF - pCMV6-Kan/Neo LIF SEQ ID No: 6 (В) и параллельно вводили плацебо pCMV6-Kan/Neo, представляющее собой комбинацию векторной плазмиды не содержащей кДНК гена LIF с транспортной молекулой (А) - в мышечную ткань в зоне предплечья. Показано увеличение количества белка фактора, ингибирующего лейкемию, в биоптате мышечной ткани пациента 1В, которому вводились генно-терапевтическая субстанция, содержащая генетическую конструкцию с кДНК гена LIF, что говорит об эффективности генно-терапевтической субстанции.
Обозначения:
пациент 1А
пациент 1В
пациент 1В до введения ГТС
На фиг. 18
С целью подтверждения увеличения количества белка фактора, ингибирующего лейкемию, до различного индивидуального уровня при введении в кожу пациентов генно-терапевтических субстанций с модифицированными кДНК гена LIF и участком нативной немодифицированной кДНК гена LIF анализировали количественный уровень белка фактора, ингибирующего лейкемию в коже человека в зависимости от наличия и типа модификаций в кДНК гена LIF.
Каждому из 21-го пациента, которые были отобраны в случайном порядке, вводили в кожу предплечья 7 генно-терапевтических субстанций pCMV6- SEQ ID No: 1, pCMV6- SEQ ID No: 2, pCMV6- SEQ ID No: 3, pCMV6- SEQ ID No: 4, pCMV6- SEQ ID No: 5, pCMV6- SEQ ID No: 6, pCMV6- SEQ ID No: 7, и плацебо pCMV6- XL5.
По итогам анализа количества белка фактора, ингибирующего лейкемию, в биоптатах выбрали показатели, касательно каждого биоптата от каждого пациента, продемонстрировавшие максимальные количественные уровни белка фактора, ингибирующего лейкемию, и объединили их в семь групп, исходя из следующего критерия:
В группе 1 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 1,
в группе 2 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 2,
в группе 3 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 3,
в группе 4 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 4,
в группе 5 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 5,
в группе 6 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 6,
в группе 7 максимальное количество белка фактора, ингибирующего лейкемию, наблюдалось при введении pCMV6-LIF SEQ ID No: 7.
Ни в одном из биоптатов не наблюдалось того, что максимальное количество белка фактора, ингибирующего лейкемию, присутствует в случае введения плацебо.
На фигуре 18 для каждой группы биоптатов приведены диаграммы показателей концентрации белка фактора, ингибирующего лейкемию, (усредненных в рамках группы, в случае, если в группу входит более одного биоптата) применительно ко всем, участвующим в эксперименте генно-терапевтическим субстанциям, после введения пациентам этих генно-терапевтических субстанций, содержащих модифицированные кДНК гена LIF и участок нативной немодифицированной кДНК гена LIF.
Из данного примера следует, что достижение максимального количества белка фактора, ингибирующего лейкемию, в биоптатах кожи различных пациентов при введении им в кожу генно-терапевтических субстанций, связано с индивидуальными особенностями пациентов и зависит от наличия и типа модификаций в кДНК гена LIF, входящих в генно-терапевтические субстанции.
Каждая генно-терапевтическая субстанция из группы генно-терапевтических субстанций является эффективной в некоторой значительной группе пациентов. Следовательно, для выбора наиболее эффективной генно-терапевтической субстанции из группы генно-терапевтических субстанций для терапевтических целей, необходимо предварительное персонализированное исследование пациента.
Обозначения: