Способ предсказания рецидива рака молочной железы при эндокринном лечении
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу предсказания исхода рака молочной железы в положительной по рецептору эстрогена и отрицательной по HER2 опухоли у пациента с раком молочной железы, предусматривающему определение в образце опухоли от указанного пациента величины уровня экспрессии РНК генов UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP или генов UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP, математическое комбинирование величин уровней экспрессии, где более высокий комбинированный показатель указывает на более худший прогноз у указанного пациента по сравнению с более низким комбинированным показателем. Изобретение позволяет эффективно предсказывать исход рака молочной железы. 2 н. и 8 з.п. ф-лы, 3 ил., 10 табл.
Реферат
Техническая область
Настоящее изобретение относится к способам, наборам и системам для прогнозирования исхода рака молочной железы. Более конкретно, настоящее изобретение относится к прогнозированию рака молочной железы на основе измерения уровней экспрессии маркерных генов в образцах опухоли пациентов с раком молочной железы.
Уровень техники, к которому относится изобретение
Рак молочной железы является одной из ведущих причин смертности от рака у женщин в западных странах. Более конкретно, только в США ежегодно рак молочной железы уносит жизни приблизительно 40000 женщин, и его диагностируют приблизительно у 200000 женщин. В течение последних нескольких десятилетий адъювантная системная терапия привела к значительному увеличению выживаемости при раннем раке молочной железы. Этот клинический опыт привел к согласованным рекомендациям, предлагающим адъювантную системную терапию для подавляющего большинства пациентов с раком молочной железы (EBCAG). При раке молочной железы доступно множество вариантов лечения, которые можно применять в дополнение к обычно проводимому хирургическому удалению опухоли и последующему облучению ложа опухоли. Три основных и принципиально различных стратегии представляют собой эндокринное лечение, химиотерапию и лечение нацеленной терапией. Предпосылкой для лечения эндокринными средствами является экспрессия рецепторов гормонов в опухолевой ткани, т.е. либо рецептора эстрогена, либо рецептора прогестерона, либо обоих из них. Доступно несколько эндокринных средств с различным способом действия и различиями в исходе заболевания при тестировании в больших группах пациентов. Тамоксифен является основой эндокринного лечения на протяжении последних трех десятилетий. Крупные клинические испытания продемонстрировали, что тамоксифен значительно снижает риск рецидива опухоли. Дополнительный вариант лечения основан на ингибиторах ароматазы, которые относятся к новому классу эндокринных лекарственных средств. В противоположность тамоксифену, который является конкурентным ингибитором связывания эстрогена, ингибиторы ароматазы блокируют продуцирование самого эстрогена, тем самым снижая стимул к росту для положительных по рецептору эстрогена опухолевых клеток. Кроме того, у некоторых пациентов возникает рецидив, несмотря на эндокринное лечение, и конкретно для этих пациентов могут быть полезны дополнительные терапевтические лекарственные средства. Было показано, что химиотерапия антрациклинами, таксанами и другими средствами является эффективной для подавления рецидива заболевания как у положительных по рецептору эстрогена пациентов, так и у отрицательных по рецептору эстрогена пациентов. В исследовании NSABP-20 сравнивали тамоксифен отдельно с тамоксифеном плюс химиотерапия у отрицательных по узлам положительных по рецептору эстрогена пациентов и показали, что комбинированное лечение было более эффективным, чем лечение тамоксифеном отдельно. Однако исследование IBCSG IX, в котором сравнивали тамоксифен отдельно с тамоксифеном плюс химиотерапия, не показало какой-либо пользы добавления цитотоксических средств. Недавно было показано, что вводимое системно антитело, направленное против антигена HER2/neu на поверхности опухолевых клеток, снижает риск рецидива в несколько раз у пациентов со сверхэкспрессирующими Her2neu опухолями. Однако большинство, если не все, из различных способов медикаментозного лечения имеют многочисленные побочные действия, которые могут значительно ухудшить качество жизни пациентов (Shapiro and Recht, 2001; Ganz et al., 2002). Это делает обязательным выбор стратегии лечения на основе тщательной оценки риска у конкретного пациента, чтобы избежать избыточного, а также недостаточного лечения. Поскольку польза химиотерапии является относительно большой в случае положительных по HER2/neu опухолей и опухолей, характеризующихся отсутствием экспрессии HER2/neu и рецепторов эстрогена (базальный тип), по сравнению с отрицательными по HER2/neu и положительными по рецепторам эстрогена опухолями (люминальный тип), наиболее трудное принятие решения о лечении касается люминальных опухолей, для которых классические клинические факторы, такие как степень, размер опухоли или вовлечение лимфатических узлов, не обеспечивают четкого ответа на вопрос об использовании химиотерапии. Для удовлетворения этой медицинской потребности были разработаны более новые молекулярные инструменты, такие как анализ 21 гена, анализ геномного показателя степени и другие анализы.
Методические рекомендации по лечению обычно разрабатываются известными в данной области экспертами. В Европе методические рекомендации St Gallen 2009 года рекомендовали химиотерапию у пациентов с положительным по HER2 раком молочной железы, а также у пациентов с отрицательным по HER2 и отрицательным по ER заболеванием. Неясность о пользе химиотерапии возникает в случае пациентов с отрицательным по HER2 и положительным по ER заболеванием. Чтобы принять сбалансированное решение для субъекта в качестве наиболее полезного критерия используют вероятность рецидива рака. Клинические критерии, такие как состояние лимфатических узлов, степень опухоли, размер опухоли и прочие, являются полезными, поскольку они обеспечивают информацию о риске рецидива. Позднее было показано, что мультигенные анализы обеспечивают информацию лучше или дополнительно к стандартным клиническим факторам риска. Является общепризнанным, что маркеры пролиферации, по-видимому, обеспечивают основную прогностическую информацию. Известными примерами этих прогностических средств являются тест Mammaprint от Agendia, показатель рецидива от Veridex и геномный индекс степени, разработанный в институте Jules Bordet и лицензированный для Ipsogen. Все из этих анализов основаны на определении уровней экспрессии по меньшей мере 70 генов и все из них были разработаны для РНК, не деградированной значительно фиксацией формалином и погружением в парафин, а выделенной из свежей ткани (транспортированной в RNALaterTM). Другим важным мультигенным анализом является тест показателя рецидива от Genomic Health Inc. Этот тест определяет уровень экспрессии 16 связанных с раком генов и 5 эталонных генов после экстракции РНК из фиксированных в формалине и погруженных в парафин образцов ткани.
Однако современные инструменты имеют недостаток отсутствия клинической надежности и применимости в наиболее важной клинической группе риска, т.е. у тех пациентов с раком молочной железы, имеющих промежуточный риск рецидива на основе стандартного клинического параметра. Таким образом, требуются лучшие инструменты для оптимизации принятия решения о лечении на основе прогноза для пациента. Для клинической пользы, состоящей в избегании химиотерапии, требуется тест с высокой чувствительностью и высокой отрицательной прогностической силой, чтобы не подвергнуть пациента недостаточному лечению, у которого в конечном итоге разовьется отдаленный метастаз после хирургической операции. Что касается остающейся потребности в материалах и способах, пригодных для принятия клинических решений в отношении адъювантной терапии, настоящее изобретение удовлетворяет потребность в перспективных способах прогнозирования рака молочной железы на основе хорошо доступных клинических и экспериментальных данных.
Определения
Если не определено иначе, технические и научные термины, используемые в настоящем документе, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение.
Термин "рак" не ограничивается какой-либо стадией, степенью, гистохимической степенью, агрессивностью или злокачественностью пораженной ткани или клеточного агрегата.
Термин "предсказание исхода" заболевания, как используют в рамках изобретения, означает как предсказание исхода у пациента, подвергаемого данной терапии, так и прогноз у пациента, которого не подвергают лечению. Термин "предсказание исхода", в частности, может относиться к риску развития у пациента метастаза, локального рецидива или гибели.
Термин "предсказание", как используют в рамках изобретения, относится к индивидуальной оценке рака или к ожидаемой выживаемости (OAS, общая выживаемость или DFS, выживание без заболевания) пациента, если опухоль лечат данной терапией. В противоположность этому, термин "прогноз" относится к индивидуальной оценке рака, или к ожидаемой выживаемости (OAS, общая выживаемость или DFS, выживание без заболевания) у пациента, если опухоль остается без лечения.
"Исход" в рамках настоящего изобретения представляет собой определенное состояние, достигаемое в ходе заболевания. Этот исход заболевания может представлять собой, например, клиническое состояние, такое как "рецидив заболевания", "развитие метастаза", "развитие узлового метастаза", "развитие отдаленного метастаза", "выживание", "гибель", "показатель ремиссии опухоли", стадия или степень заболевания или сходные с ними.
Под "риском" подразумевают число, связанное с вероятностью развития у субъекта или пациента или достижения субъектом или пациентом определенного исхода заболевания. Термин "риск" в контексте настоящего изобретения не подразумевает наличия какого-либо положительного или отрицательного подразумеваемого значения в отношении благополучия пациента, а относится только к возможности или вероятности возникновения или развития данного состояния.
Термин "клинические данные" относится к полноте доступных данных и информации, касающихся состояния здоровья пациента, включая, но не ограничиваясь ими, возраст, пол, массу тела, менопаузальный/гормональный статус, этиопатологические данные, данные анамнеза, данные, полученные с помощью диагностических способов in vitro, таких как гистопатология, анализы мочи или крови, данные, полученные способами визуализации, такими как рентген, компьютерная томография, MRI, PET, spect, ультразвуковое исследование, электрофизиологические данные, генетический анализ, анализ экспрессии генов, оценка с помощью биопсии, внутриоперационные данные.
Термин "положительный по узлам", "диагностированный как положительный по узлам", "вовлечение узлов" или "вовлечение лимфатических узлов" означает пациента, у которого ранее были диагностированы метастазы в лимфатических узлах. Это охватывает метастаз как в дренирующий лимфатический узел, близкорасположенный лимфатический узел, так и в отдаленный лимфатический узел. Этот предшествующий диагноз не составляет часть способа по изобретению. Вместо этого, он является предпосылкой для выбора пациентов, образцы которых можно использовать для одного из вариантов осуществления настоящего изобретения. Этот предшествующий диагноз может быть поставлен любым пригодным способом, известным в данной области, включая, но не ограничиваясь ими, удаление лимфатических узлов и патологический анализ, анализ с помощью биопсии, анализ биомаркеров in vitro, указывающих на метастаз, способы визуализации (например, компьютерная томография, рентген, магнитно-резонансная томография, ультразвуковое исследование) и внутриоперационные данные.
В контексте настоящего изобретения "биологический образец" представляет собой образец, полученный из биологического организма или находившийся в контакте с биологическим организмом. Примерами биологических образцов являются: клетки, ткань, жидкости организма, смывная жидкость, мазки, биоптаты, кровь, моча, слюна, мокрота, плазма, сыворотка, супернатант клеточной культуры и другие.
"Образец опухоли" представляет собой биологический образец, содержащий опухолевые клетки, либо целые, либо разрушенные. Образец может представлять собой образец любой биологической ткани или жидкости. Такие образцы включают, но не ограничиваются ими, мокроту, кровь, сыворотку, плазму, клетки крови (например, лейкоциты), ткань, образцы центральной или тонкоигольной биопсии, содержащие клетки жидкости организма, мочу, жидкость брюшной полости и плевральную жидкость, спинномозговую жидкость, слезную жидкость или клетки, выделенные из них. Также они могут включать срезы тканей, такие как замороженные или фиксированные срезы, взятые для гистологических целей или подвергнутые микродиссекции клетки или их внеклеточные части. Образец опухоли, подлежащий анализу, может представлять собой тканевой материал из неопластического очага повреждения, взятого аспирированием или пункцией, вырезанием или любым другим хирургическим способом, обеспечивающим полученный биопсией или резекцией клеточный материал. Такой образец содержит опухолевые клетки или фрагменты опухолевых клеток, полученные от пациента. Клетки могут быть найдены в клеточном "мазке", взятом, например, путем аспирирования через соски, лаважа протоков, тонкоигольной биопсии или путем стимулированного или самопроизвольного выделения из сосков. В другом варианте осуществления образец представляет собой жидкость организма. Такие жидкости включают, например, жидкости крови, сыворотку, плазму, лимфу, асцитические жидкости, гинекологические жидкости или мочу, но не ограничиваясь этими жидкостями.
"Ген" представляет собой набор сегментов нуклеиновой кислоты, который содержит информацию, необходимую для получения функционального РНК-продукта. "Продукт гена" представляет собой биологическую молекулу, продуцируемую путем транскрипции или экспрессии гена, например мРНК, кДНК или транслированного белка.
"мРНК" представляет собой транскрибированный продукт гена и этот термин имеет обычное значение, подразумеваемое специалистом в данной области. "Молекула, происходящая из мРНК" представляет собой молекулу, которая химически или ферментативно получена из мРНК-матрицы, такую как кДНК.
Термин "уровень экспрессии" относится к определенному уровню экспрессии гена. Это может быть определенный уровень экспрессии гена в качестве абсолютной величины или по сравнению с эталонным геном (например, геном домашнего хозяйства), со средним значением для двух или более эталонных генов, или с вычисленной средней величиной экспрессии (например, в анализе с ДНК-чипом) или с другими информативным геном без применения эталонного образца. Уровень экспрессии гена можно измерять прямо, например, путем получения сигнала, где сила сигнала коррелирует с количеством мРНК-транскриптов этого гена, или он может быть получен непрямо на белковом уровне, например, с помощью способов иммуногистохимии, CISH, ELISA или RIA. Уровень экспрессии также можно получать с помощью конкурентной реакции с эталонным образцом. Величине экспрессии, которую определяют путем измерения некоторого физического параметра в анализе, например, испускания флуоресценции, можно присваивать числовое значение, которое можно использовать для дальнейшей обработки информации.
"Эталонный профиль уровней экспрессии" в рамках изобретения означает любой профиль уровней экспрессии, который можно использовать для сравнения с другим профилем уровней экспрессии. В предпочтительном варианте осуществления изобретения эталонный профиль уровней экспрессии представляет собой, например, средний профиль уровней экспрессии, наблюдаемый в группе здоровых субъектов, субъектов с заболеванием или субъектов с заболеванием, которым проводили конкретный тип терапии, служащих в качестве эталонной группы, или субъектов с хорошим или плохим исходом.
Термин "математическое комбинирование уровней экспрессии" в рамках настоящего изобретения означает получение числовой величины из определенного уровня экспрессии гена и применение алгоритма к одной или нескольким таким числовым величинам для получения комбинированной величины или комбинированного показателя.
"Алгоритм" представляет собой процесс, который осуществляет некоторую последовательность действий для вырабатывания информации.
"Показатель" представляет собой числовую величину, которая получена математическим комбинированием уровней экспрессии с использованием алгоритма. Также она может быть получена из уровней экспрессии и другой информации, например, клинических данных. Показатель может быть связан с исходом заболевания пациента.
"Дискриминантная функция" представляет собой функцию набора переменных, используемых для классификации объекта или события. Таким образом, дискриминантная функция позволяет классификацию пациента, образца или события в категорию или множество категорий согласно доступным данным или параметрам от указанного пациента, образца или события. Такая классификация является стандартным инструментом статистического анализа, хорошо известным квалифицированному специалисту. Например, пациента можно классифицировать как "имеющего высокий риск" или "имеющего низкий риск", "имеющего высокую вероятность метастаза" или "имеющего низкую вероятность метастаза", "нуждающегося в лечении" или "не нуждающегося в лечении" согласно данным, полученным от указанного пациента, образца или события. Классификация не ограничивается "высоким против низкого", а может осуществляться на множество категорий, степеней или сходных с ними. Классификацию также следует понимать в более широком смысле как отличающий показатель, где, например, более высокий показатель соответствует более высокой вероятности отдаленного метастаза, например, (общий) риск отдаленного метастаза. Примеры дискриминантных функций, которые позволяют классификацию, включают, но не ограничиваются ими, функции, определяемые методом опорных векторов (SVM), методом k-ближайших соседей (kNN), (наивные) байесовские модели, модели линейной регрессии или фрагментарно определяемые функции, например, такие как при выявлении подгрупп, в древовидной схеме решений, в логическом анализе данных (LAD) и т.п. В более широком значении, примерами для целей иллюстрации являются величины непрерывных показателей математических методов или алгоритмов, таких как коэффициенты корреляции, проекции, показатели метода опорных векторов, другие способы на основе сходства, их комбинации и т.п.
Термин "методика лечения", "порядок лечения", "режим", а также "режим лечения" относится к последовательному или одновременному по времени проведению введения противоопухолевых, и/или антиваскулярных, и/или стимулирующих иммунную систему средств, и/или средств, обеспечивающих пролиферацию клеток крови, и/или лучевой терапии, и/или гипертермии, и/или гипертермии для лечения рака. Их введение можно проводить в адъювантном и/или неоадъювантном порядке. Состав такого "протокола" может варьировать с точки зрения дозы одного средства, временных рамок применения и частоты введения в пределах определенного терапевтического диапазона. В настоящее время проводятся исследования различных комбинаций различных лекарственных средств и/или физических способов, и различных схем.
Термин "цитотоксическая химиотерапия" относится к различным методикам лечения, воздействующим на пролиферацию и/или выживание клеток. Лечение может включать введение алкилирующих средств, антиметаболитов, антрациклинов, алкалоидов растений, ингибиторов топоизомеразы и других противоопухолевых средств, включая моноклональные антитела и ингибиторы киназы. В частности, цитотоксическое лечение может относиться к лечению таксанами. Таксаны представляют собой алкалоиды растений, которые блокируют деление клеток путем препятствования функционированию микротрубочек. Прототипным таксаном является природный продукт паклитаксел, исходно известный как таксол и впервые полученный из коры тиса тихого.
Доцетаксел представляет собой полусинтетический аналог паклитаксела. Таксаны повышают стабильность микротрубочек, препятствуя расхождению хромосом в ходе анафазы.
Термин "эндокринное лечение" или "гормональное лечение" (также иногда называемое "антигормональным лечением") означает лечение, которое нацелено на передачу сигнала гормонами, например, ингибирование гормонов, ингибирование рецепторов гормонов, использование агонистов или антагонистов рецепторов гормонов, использование рецепторов-мусорщиков или сиротских рецепторов, использование производных гормонов и препятствование продуцированию гормонов. Конкретным примером является терапия тамоксифеном, которая модулирует передачу сигнала рецептором эстрогена, или ароматазное лечение, которое препятствует продуцированию стероидных гормонов.
Тамоксифен представляет собой перорально активный селективный модулятор рецепторов эстрогена (SERM), который применяют для лечения рака молочной железы, и в настоящее время он является наиболее продаваемым в мире лекарственным средством для этой цели. Тамоксифен продается под торговыми названиями Nolvadex, Istubal и Valodex. Однако это лекарственное средство, даже до истечения действия патента на него, было и остается широко упоминаемым по его непатентованному наименованию "тамоксифен". Тамоксифен и производные тамоксифена конкурентно связываются с рецепторами эстрогена на опухолях и других тканевых мишенях, образуя ядерный комплекс, который снижает синтез РНК и ингибирует эффекты эстрогена.
Рецепторы стероидов представляют собой внутриклеточные рецепторы (как правило, цитоплазматические), которые осуществляют передачу сигнала стероидных гормонов. Их примеры включают рецепторы типа I, в частности, рецепторы половых гормонов, например, рецептор андрогенов, рецептор эстрогена, рецептор прогестерона; рецептор глюкокортикоидов, рецептор минералокортикоидов; и рецепторы типа II, например, рецептор витамина A, рецептор витамина D, рецептор ретиноидов, рецептор гормона щитовидной железы.
Термин "способ на основе гибридизации", как используют в рамках изобретения, относится к способам, вовлекающим процесс объединения комплементарных одноцепочечных нуклеиновых кислот или нуклеотидных аналогов в одну двухцепочечную молекулу. Нуклеотиды или нуклеотидные аналоги связываются с комплементарными им молекулами в нормальных условиях, так что две абсолютно комплементарных нити легко связываются друг с другом. В биоанализах очень часто используют меченые одноцепочечные зонды для поиска комплементарных последовательностей-мишеней. Если такие последовательности существуют в образце, зонды гибридизуются с указанными последовательностями, которые затем можно выявлять благодаря метке. Другие способы на основе гибридизации включают способы на микроматрицах и/или биочипах. В этих способах зонды иммобилизуют на твердой фазе, которую затем контактируют с образцом. Если в образце существуют комплементарные нуклеиновые кислоты, они гибридизуются с зондами, и, таким образом, их можно выявить. Эти подходы также известны как "способы на основе чипов". Другим способом на основе гибридизации является ПЦР, которая описана ниже. Когда требуется определение уровней экспрессии, способы на основе гибридизации, например, можно использовать для определения количества мРНК данного гена.
Олигонуклеотид, способный специфично связываться с последовательностями гена или их фрагментами, относится к олигонуклеотиду, который специфично гибридизуется с геном или продуктом гена, таким как мРНК или кДНК гена, или с его фрагментом. Для специфической детекции гена или продукта гена необязательно выявлять всю последовательность гена. Фрагмент размером приблизительно 20-150 оснований содержит достаточную специфическую информацию о последовательности для обеспечения специфической гибридизации.
Термин "способ на основе ПЦР", как используют в рамках изобретения, относится к способам, включающим полимеразную цепную реакцию (ПЦР). Она представляет собой способ экспоненциальной амплификации нуклеиновых кислот, например ДНК, путем ферментативной репликации in vitro. Поскольку ПЦР является технологией in vitro, ее можно проводить без ограничений формы ДНК, и ее можно широко модифицировать для проведения широкого набора генетических манипуляций. Когда требуется определить уровни экспрессии, способ на основе ПЦР можно использовать, например, для детекции присутствия данной мРНК путем (1) обратной транскрипции полного набора мРНК (так называемого транскриптома) в кДНК с помощью фермента обратной транскриптазы, и (2) детекции присутствия данной кДНК с помощью соответствующих праймеров. Этот подход широко известен как ПЦР с обратной транскриптазой (ОТ-ПЦР). Более того, способы на основе ПЦР включают, например, ПЦР в реальном времени, и, в частности, пригодны для анализа уровней экспрессии, кинетической или количественной ПЦР (q-ПЦР).
Термин "количественная ПЦР" (q-ПЦР)" относится к любому типу способа ПЦР, который позволяет количественное определение матрицы в образце. Количественная ПЦР в реальном времени включает различные способы исполнения или детекции продуктов, как например, способ TaqMan или способ LightCycler. Например, в способе TaqMan используется флуорогенный зонд с двойным мечением. В ПЦР в реальном времени TaqMan измеряется накопление продукта через флуорофор на экспоненциальных стадиях ПЦР, а не на конечной стадии, как в общепринятой ПЦР. Экспоненциальное увеличение продукта используют для определения порогового цикла, CT, т.е. количества циклов ПЦР, при котором выявляется значительное экспоненциальное увеличение флуоресценции, и которое прямо коррелирует с количеством копий ДНК-матрицы, присутствующих в реакции. Условия реакции в высокой степени сходны с общепринятой ПЦР, однако ее проводят в термоблоке для анализа в реальном времени, который позволяет измерение флуоресцентных молекул в пробирках для ПЦР. В отличие от обычной ПЦР, в ПЦР в реальном времени TaqMan в реакционную смесь добавляют зонд, т.е. одноцепочечный олигонуклеотид, комплементарный сегменту из 20-60 нуклеотидов в ДНК-матрице и располагающийся между двумя праймерами. С 5'- и 3'-концами зонда связаны флуоресцентный репортер или флуорофор (например, 6-карбоксифлуоресцеин, сокращенное название: FAM, или тетрахлорфлуоресцеин, сокращенное название: TET) и тушитель (например, тетраметилродамин, сокращенное название: TAMRA, или дигидроциклопирролоиндолтрипептидный "тушитель black hole" сокращенное название: BHQ), соответственно [2]. Близкое расположение флуорофора и тушителя, связанных с зондом, ингибирует флуоресценцию флуорофора. В процессе ПЦР, по мере начала синтеза ДНК, 5'-3' экзонуклеазная активность Taq-полимеразы нарушает это соотношение в зонде, который подвергся отжигу с матрицей. Деградация зонда высвобождает флуорофор из него и нарушает близкое расположение к тушителю, таким образом, устраняя эффект тушения и обеспечивая флуоресценцию флуорофора. Таким образом, флуоресценция, выявляемая в термоблоке ПЦР в реальном времени, прямо пропорциональна высвобожденному флуорофору и количеству ДНК-матрицы, присутствующей в ПЦР.
Под "матрицей" или "упорядоченной системой" подразумевают расположение адресуемых областей или "адресов" на устройстве. Положения могут быть организованы в виде двухмерных матриц, трехмерных матриц или других форматов упорядоченных систем. Количество положений может находиться в диапазоне от нескольких до по меньшей мере сотен тысяч. Наиболее важно, каждое расположение представляет собой полностью независимый реакционный участок. Матрицы включают, но не ограничиваются ими, матрицы нуклеиновых кислот, матрицы белков и матрицы антител. "Матрица нуклеиновых кислот" относится к матрице, содержащей зонды нуклеиновых кислот, такие как олигонуклеотиды, нуклеотидные аналоги, полинуклеотиды, полимеры нуклеотидных аналогов, morpholinos или более крупные части генов. Нуклеиновая кислота и/или аналог на матрице предпочтительно являются одноцепочечными. Матрицы, где зонды представляют собой олигонуклеотиды, называют "олигонуклеотидными матрицами" или "олигонуклеотидными чипами". "Микроматрица" в настоящем описании также относится к "биочипу" или "биологическому чипу", матрице из участков, имеющей плотность отдельных участков по меньшей мере приблизительно 100/см2, и предпочтительно по меньшей мере приблизительно 1000/см2.
"Пары праймеров" и "зонды" в рамках изобретения имеют обычное значение этого термина, которое хорошо известно специалисту в области молекулярной биологии. В предпочтительном варианте осуществления изобретения "пары праймеров" и "зонды" означают полинуклеотидные молекулы, имеющие последовательность, идентичную, комплементарную, гомологичную областям полинуклеотида-мишени, или гомологичную комплементарной последовательности областей полинуклеотида-мишени, который подлежит детекции или количественному определению. Другой вариант осуществления также включает нуклеотидные аналоги для применения в качестве праймеров и/или зондов. Технологии зондов, используемые для применения в кинетической ПЦР или ПЦР в реальном времени, могут представлять собой, например, системы TaqMan®, получаемые от Applied Biosystems, зонды для удлинения, такие как Scorpion® Primers, двойные гибридизационные зонды Amplifluor®, получаемые от Chemicon International, Inc, или малобороздочные лиганды.
"Индивидуально меченные зонды" в рамках изобретения означают молекулярные зонды, содержащие полинуклеотид, олигонуклеотид или нуклеотидный аналог и метку, способствующую детекции или количественному определению зонда. Предпочтительными метками являются флуоресцентные молекулы, люминесцентные молекулы, радиоактивные молекулы, ферментные молекулы и/или молекулы тушителей.
"Размещенные зонды" в рамках изобретения означает набор иммобилизованных зондов, предпочтительно в упорядоченном расположении. В предпочтительном варианте осуществления изобретения отдельные "размещенные зонды" могут быть идентифицированы по их соответствующему положению на твердой подложке, например, на "чипе".
При использовании в отношении последовательности одноцепочечной нуклеиновой кислоты, термин "по существу гомологичный" относится к любому зонду, который может гибридизоваться (т.е. он является комплементарной последовательностью для) с последовательностью одноцепочечной нуклеиновой кислоты в условиях низкой жесткости, как описано выше.
Сущность изобретения
В общих чертах, настоящее изобретение относится к способу оценки риска рецидива у пациента с отрицательным или положительным по узлам, положительным по рецептору эстрогена и отрицательным по HER2/NEU раком молочной железы, в частности, у пациентов, которым проводят эндокринную терапию, например, при лечении тамоксифеном. Статус рецепторов эстрогена, как правило, определяют с использованием иммуногистохимии, статус HER2/NEU (ERBB2), как правило, определяют с использованием иммуногистохимии и флуоресцентной гибридизации in situ.
Однако для целей изобретения статус рецепторов эстрогена и статус HER2/NEU (ERBB2) можно определять с помощью любого пригодного способа, например, иммуногистохимии, флуоресцентной гибридизации in situ (FISH) или анализа экспрессии РНК.
Настоящее изобретение относится к способу предсказания исхода рака молочной железы у пациента с раком молочной железы, имеющему положительную по рецептору эстрогена и отрицательную по HER2 опухоль, причем указанный способ включает:
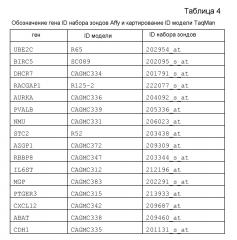
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК по меньшей мере 2 из следующих 9 генов: UBE2C, BIRC5, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента. В одном варианте осуществления выбирают по меньшей мере 3, 4, 5 или 6 генов.
В следующем варианте осуществления изобретения способ включает:
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК следующих 8 генов: UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента.
В следующем варианте осуществления способ по изобретению включает:
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК следующих 8 генов: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента.
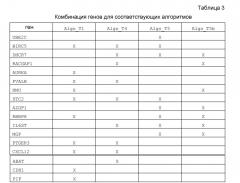
В другом варианте осуществления изобретения BIRC5 может быть заменен UBE2C, или TOP2A, или RACGAP1, или AURKA, или NEK2, или E2F8, или PCNA, или CYBRD1, или DCN, или ADRA2A, или SQLE, или CXCL12, или EPHX2, или ASPH, или PRSS16, или EGFR, или CCND1, или TRIM29, или DHCR7, или PIP, или TFAP2B, или WNT5A, или APOD, или PTPRT, при условии, что после замены выбирают 8 различных генов; и
UBE2C может быть заменен BIRC5, или RACGAP1, или TOP2A, или AURKA, или NEK2, или E2F8, или PCNA, или CYBRD1, или ADRA2A, или DCN, или SQLE, или CCND1, или ASPH, или CXCL12, или PIP, или PRSS16, или EGFR, или DHCR7, или EPHX2, или TRIM29 при условии, что после замены выбирают 8 различных генов; и
DHCR7 может быть заменен AURKA, BIRC5, UBE2C или любым другим геном, который может заменять BIRC5 или UBE2C, при условии, что после замены выбирают 8 различных генов; и
STC2 может быть заменен INPP4B, или IL6ST, или SEC14L2, или MAPT, или CHPT1, или ABAT, или SCUBE2, или ESR1, или RBBP8, или PGR, или PTPRT, или HSPA2, или PTGER3, при условии, что после замены выбирают 8 различных генов; и
AZGP1 может быть заменен PIP, или EPHX2, или PLAT, или SEC14L2, или SCUBE2, или PGR при условии, что после замены выбирают 8 различных генов; и
RBBP8 может быть заменен CELSR2, или PGR, или STC2, или ABAT, или IL6ST при условии, что после замены выбирают 8 различных генов; и
IL6ST может быть заменен INPP4B, или STC2, или MAPT, или SCUBE2, или ABAT, или PGR, или SEC14L2, или ESR1, или GJA1, или MGP, или EPHX2, или RBBP8, или PTPRT, или PLAT при условии, что после замены выбирают 8 различных генов; и
MGP может быть заменен APOD, или IL6ST, или EGFR при условии, что после замены выбирают 8 различных генов.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный комбинированный показатель указывает на пользу цитотоксической химиотерапии.
Использование способа по изобретению до проведения у пациента эндокринной терапии позволяет предсказание эффективности эндокринной терапии.
В таблице 2 ниже показано, указывает ли сверхэкспрессия каждого из представленных выше маркерных генов на хороший исход или на плохой исход у пациента, которому проводят эндокринную терапию. Таким образом, квалифицированный специалист может сконструировать математическую комбинацию, т.е. алгоритм, учитывая эффект данных генов. Например, суммирование или взвешенное суммирование генов, сверхэкспрессия которых указывает на хороший исход, обеспечивает алгоритм, где высокий показатель риска указывает на хороший исход. Надежность алгоритма можно исследовать путем анализа образцов опухолей пациентов с историей болезни, где, например, показатель для пациентов с хорошим исходом и для пациентов с плохим исходом можно определять по отдельности и сравнивать. Квалифицированному специалисту, биостатистику, известно применение других математических методов, таких как дискриминантные функции, для получения оптимизированных алгоритмов. Алгоритмы можно оптимизировать, например, для чувствительности или специфичности. Алгоритмы можно адаптировать для конкретной аналитической платформы, используемой для измерения экспрессии маркерных генов, такой как количественная ПЦР.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанная эндокринная терапия включает тамоксифен или ингибитор ароматазы.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где предсказывают риск развития рецидива.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют как уровень небелковой экспрессии.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют как уровень экспрессии РНК.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют с помощью по ме