Штамм бактерий pantoea brenneri, обладающий фосфатмобилизующей и фунгицидной активностью
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к производству микробиологических средств защиты растений от болезней. Предлагается штамм бактерий Pantoea brenneri ВКПМ В-12911, обладающий фосфатмобилизующей активностью к неорганическим и органическим фосфатам почвы и фунгицидной активностью. Штамм бактерий Pantoea brenneri ВКПМ В-12911 способен стимулировать рост растений за счет мобилизации нерастворимых в воде фосфорных соединений, имеющихся в изобилии в почвах, и ингибировать рост фитопатогенных грибов. Изобретение позволяет расширить арсенал средств благотворного воздействия на растения. 6 ил., 2 табл., 4 пр.
Реферат
Предлагаемое изобретение относится к биотехнологии, в частности к производству микробиологических средств защиты растений от болезней, и касается нового штамма бактерий Pantoea brenneri, обладающего способностью стимулировать рост растений за счет мобилизации нерастворимых в воде фосфорных соединений, имеющихся в изобилии в почвах, и ингибировать рост фитопатогенных грибов, таким образом, защищая сельскохозяйственные культуры от заболеваний.
Фосфор, как известно из уровня техники, контролирует обменные процессы в растениях, является жизненно важным макроэлементом и входит в состав соединений, являющихся источником энергии, например АТФ. На дату представления заявленного технического решения во всем мире существует проблема усвоения фосфора сельскохозяйственными растениями из почвы. Указанная проблема заключается в том, что собственно фосфора в почве имеется в достаточном количестве, однако, несмотря на это, в почвах он (Р) находится преимущественно в малоподвижных, труднодоступных для растений формах. Минеральные фосфатные удобрения, вносимые в почву, усваиваются растениями с низкой эффективностью (с одной стороны). Например, на дату представления заявки объем использования растениями фосфора из минеральных удобрений находится в диапазоне 10-25%. То есть из 100% вносимого объема фосфорных удобрений от 90 до 75% не принимают участие в качестве источника фосфора для растений, при этом они способствуют бесконтрольному загрязнению окружающей среды.
Низкая усваиваемость растениями фосфора обусловлена способностью окислов кальция, железа, алюминия и других элементов, имеющихся в почвах, связывать и удерживать ионы фосфатов, которые обладают природной высокой реакционной способностью. В то же время, (с другой стороны) производство и применение минеральных фосфорных удобрений для растениеводства лимитируется ограниченностью природных запасов фосфатных руд, используемых для их создания. Так, например, в интернет источнике (http://www.iimes.ru/?p=27724) цитата «…спрос на фосфаты, используемые в качестве сырья для производства значительной части удобрений, будет значительно расти с годами. А в виду отсутствия категоричных альтернатив этому минералу наличие доступа к нему станет важной составляющей продовольственной безопасности многих стран. «Белое золото», как стали называть фосфаты в последние годы, может даже стать причиной войн на Земле, как это сегодня происходит с нефтью».
Валовое содержание фосфора в пахотном слое черноземов составляет 0,1-0,25%, при этом лишь 10-20% от общего его количества, присутствующего в почве, является относительно доступными для растений соединениями (см. ФОСФОР В ЗЕМЛЕДЕЛИИ ЦЕНТРАЛЬНО-ЧЕРНОЗЕМНОГО РАЙОНА П.А. ЧЕКМАРЕВ, член-корреспондент РАСХН, директор Департамент Министерства сельского хозяйства РФ С.В. ЛУКИН, доктор сельскохозяйственных наук, директор ФГУ «ЦАС «Белгородский» Ю.И. СИСКЕВИЧ, кандидат географических наук, директор ФГУ «ЦАС «Липецкий» Н.П. Юмашев, кандидат сельскохозяйственных наук, директор ФГУ «ЦАС «Тамбовский» А.Н. ХИЖНЯКОВ, директор ФГУ «САС «Курская»).
Тогда как 80-90% от общего почвенного фосфора представлено в недоступной для растений форме - в виде нерастворимых минеральных фосфатов и органических соединений – например, солей фитиновой кислоты (далее по тексту - фитатов). Среди многочисленных видов почвенных бактерий, исследованных заявителем на дату представления заявочным материалов, лишь малая часть (менее 1%) выделяет биологически активные вторичные метаболиты и обладает способностью высвобождать фосфор, содержащийся в таких недоступных для растений формах. Образуемые при этом фосфаты (под действием бактерий) становятся доступными для вовлечения в питание растений. Действие фосфат мобилизующих бактерий основано, главным образом, на их способности к образованию органических кислот, благодаря которым происходит растворение труднодоступных соединений фосфора с образованием доступных для растений солей фосфорной кислоты. Известны микроорганизмы, способные к мобилизации фосфатов и способствующие повышению усвояемости фосфорсодержащих удобрений растениями, например, Pseudomonas, Azotobacter Enterbacter, Bacterium, Pseudomonas, Bacillus, Agrobacterium, Burkholderia, Pantoea.
В России, на дату представления заявочных материалов широко известны и используется бактериальное удобрения, одним из которых является «Фосфоробактерин» на основе штамма бактерии Bacillus megaterium phosphaticum, позволяющий уменьшить нормы вносимых фосфорных удобрений, из исследованного уровня техники заявителем не выявлен механизм его действия, однако можно предположить, что указанный штамм секретирует органические кислоты (т.е. в данном случае осуществляется подкисление почвы), что обеспечивает достижение повышенной урожайности при его применении. Однако описанное выше подкисление - не единственный механизм биологической мобилизации почвенных фосфатов. В случае наиболее распространенных органофосфатов почвы - фитатов одного подкисления недостаточно, поскольку ортофосфат должен быть отщеплен от органической части мио-инозитола - шестиатомного спирта (https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BE%D0%B8%D0%BD%D0%BE%D0%B7%D0%B8%D1%82%D0%BE%D0%BB).
Этот процесс в природе осуществляется ферментами - фитазами, присутствующими у специфических групп микроорганизмов. Принимая во внимание общеизвестный факт способности высвобождать неорганический ортофосфат от фитата некоторыми изолятами (отдельными видами бактерий) родов Pseudomonas, Enterobacter, Pantoea, Burkholderia, Bacillus и некоторыми микромицетами, использование живых бактерий продуцентов фитаз в качестве биоудобрения является экономически выгодным и экологичным способом увеличения биодоступности почвенного фосфора который обеспечивает сокращение использования неорганических фосфорных удобрений. Однако коммерческие препараты на основе микробных фитаз, готовые к применению на дату предоставления настоящей заявки заявителем не выявлены.
Развитие сельского хозяйства во многом зависит от разработки новых технологий, способствующих снижению норм внесения удобрений и средств защиты растений на единицу сельскохозяйственной продукции при сохранении высокой урожайности. Следует обратить внимание на то, что не менее важной проблемой растениеводства, помимо обеспечения растений питательными веществами, также является защита культур от природных фитопатогенных (болезнетворных для растений) микроорганизмов и вредителей, ущерб от действий которых приводит к потере до 30% урожая в мировом сельскохозяйственном производстве. Таким образом, альтернативой использованию химических пестицидов является применение микроорганизмов в качестве биоудобрений, которые дополнительно являются и агентами биологического контроля, т.к. обладают антимикробной активностью против фитопатогенов.
Основываясь на изложенном выше, представляется возможным сделать общий вывод о том, что создание комплексного биофосфорного удобрения, превращающего недоступные для питания растений соединения фосфора в доступные для растений соединения и, одновременно, обладающего фунгицидной активностью, способной защитить растения от патогенных микроорганизмов, позволит эффективнее использовать внутренние ресурсы почвы, значительно снизить необходимость внесение минеральных удобрений, при одновременном снятии пестицидной нагрузки на сельскохозяйственную продукцию.
Кроме указанного, заявленное техническое решение позволяет повысить экологическую безопасность за счет значительного снижения загрязнения окружающей среды, т.к. избыточное внесение фосфатных удобрений в почву приводит к эвтрофикации водоемов и, как следствие, негативно сказывается на водном биоценозе. А так же позволит снизить пестицидную нагрузку на биосферу, что положительно сказывается на здоровье человека в силу изложенного выше.
Далее заявителем приведены используемые в описании термины для обеспечения корректного и однозначного понимания экспертизой представленных заявочных материалов.
Фосфатмобилизация основана на способности микроорганизмов, в том числе - бактерий, к превращению труднодоступных соединений фосфора в легкоусвояемую растениями форму, например - в легкорастворимые соли фосфорной кислоты.
Фитаты - органические соединения, соли фитиновой кислоты, насыщенной циклической кислоты, являющейся основной формой хранения фосфора в семенах растений.
Гидролиз - реакция обменного разложения между различными веществами и водой.
Фунгициды - средства защиты растений от грибковых болезней.
Эвтрофикация - насыщение водоемов биогенными элементами, сопровождающееся ростом биологической продуктивности водных бассейнов.
Из исследованного уровня техники, заявителем выявлено изобретение по патенту РФ №2451068, штамм бактерий Acinetobacter species 305. Сущностью является фосфатрастворяющий штамм бактерий Acinetobacter species с фунгицидными свойствами, применяемый для защиты растений от болезней, вызываемых грибами рода Fusarium, и повышения урожайности. Штамм обладает способностью мобилизовать фосфаты из нерастворимого минерального сырья (неорганического происхождения), стимулировать рост растений, повышать урожайность, активен против грибов рода Fusarium.
Недостатком является ограниченность способности перевода фосфатов в доступную для растений форму - штамм не способен мобилизовать фосфаты органического происхождения (фитаты), что ограничивает область применения.
Другим недостатком также является лимитированность антагонизма штамма Acinetobacter species 305 в отношении фитопатогенных грибов, т.к. штамм проявляет фунгицидную активность лишь против микромицетов рода Fusarium: F. graminearum Schwabe 1838 К-33, F. culmorum (W.G. Smith 1884) Saccardo 1895, F. oxysporum Schlecht №6 (см. пример 4), т.е проявляет фунгицидную активность против трех видов грибов, тогда как у заявленного технического решения наблюдается антагонистическая активность против 7 видов фитопатогенных грибов (см. Фиг. 6, табл. 2).
Из исследованного уровня техники, заявителем выявлено изобретение по патенту РФ №2323967, штамм бактерий Pseudomonas aureofaciens BKM В-2390. Сущностью является препарат для очистки почв от мышьяка и защиты растений от болезней, вызываемых фитопатогенными грибами, включающий суспензию клеток штамма бактерии Pseudomonas aureofaciens ВКМ В-2390 Д (последний абзац). Штамм предназначен для очистки почв от мышьяка, мобилизации фосфатов и подавления роста фитопатогенных грибов родов Alternaria, Fusarium, Rhizoctonia, Phytophthora, Gaeumannomyces. Согласно описанию патента наличие заявленных активностей штамма характеризуется только качественно, отсутствуют необходимые для применения штамма сведения о количественных характеристиках активностей.
Недостатком является отсутствие количественной оценки антагонистического действия штамма (см. таблица 2, таблица 3 описания) и отсутствие количественных характеристик фосфат мобилизующей активности этого штамма в примере 4, а также неспособность штамма производить гидролиз фитатов, превращать их в усваиваемые растениями соединения фосфора, что существенно ограничивает область применения в сельскохозяйственном растениеводстве.
Из исследованного уровня техники, заявителем выявлена группа изобретении по заявке РСТ WO 2010/037072. МПК C12N 1/20 (2006.1); C12N 1/38 (2006.1); A01N 63/00 (2006.1). Сущностью является изолят Pseudomonas Spp, DSM 21663 представляющий собой ростостимулирующие ризобактерии (PGPR), который синтезирует антибиотики, фитогормон ауксин, обладает фосфатмобилизующей и фунгицидной активностью. Штамм люминесцентный, оксидаза-положительный, и имеет способность подавлять как грибковые, так и бактериальные фитопатогены. Выявленное изобретение так же относится к способу увеличения роста растений, включающему применение к растениям, семенам растений или почве, окружающей растения или семена растений, композиции, содержащей выделенную бактерию Pseudomonas в соответствии с изобретением.
Недостатком известного технического решения является отсутствие в описании штамма охарактеризованной количественными показателями способности гидролизовать фосфаты органического происхождения (фитаты), ограниченность определения фосфат мобилизующей способности штамма только качественно - а именно, по диаметру зоны просветления среды, содержащей нерастворимый Са3(PO4)2, вокруг бактериальной колонии (пример 3). Отсутствие необходимых для разработки способа применения штамма количественных показателей делает затруднительным промышленное получение препаратов с использованием известного штамма и его применение в сельскохозяйственной деятельности.
Наиболее близким по большему количеству совпадающих признаков и назначению к заявленному техническому решению, выбранным заявителем в качестве прототипа, является изобретение по патенту РФ №2451069 - штамм бактерий Pseudomonas species 181а. Сущностью является фосфатрастворяющий штамм бактерий Pseudomonas species 181а для защиты растений от болезней, вызываемых грибами рода Fusarium и повышения урожайности, депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером В-6646. Штамм Pseudomonas species 181а обладает высокими фосфат-мобилизующими свойствами: переводит в раствор до 2620 мкг/мл фосфата и проявляет антагонистическую активность в отношении грибных фитопатогенов рода Fusarium, а именно - угнетает рост грибов Fusarium oxysporum, Fusarium graminearum, Fusarium culmorum, чем способствует повышению урожайности сельскохозяйственных растений.
Недостатками прототипа является неспособность штамма гидролизовать всегда присутствующие в почве органические соединения фосфора - фитаты. Кроме того, как следует из описания патента, по примеру 4, штамм проявляет антагонистическую активность в весьма ограниченных пределах - в отношении лишь трех видов грибных фитопатогенов рода Fusarium: для F. graminearum зона угнетения роста составляет 1,0 мм, для F. culmorum - 1,5 мм, для F. oxysporum - 2,5 мм. Недостатки существенно ограничивают область применения прототипа.
Общим недостатком аналогов и прототипа является ограниченность области их (штаммов) применения - они применимы лишь для мобилизации (превращения в усвояемую растениями форму) фосфатов из нерастворимого минерального сырья и не пригодны для высвобождения фосфатов из органических фосфорсодержащих соединений (фитатов). Кроме указанного не менее важным является отсутствие активности в отношении более широкого спектра фитопатогенов, в то время как заявленное техническое решение проявляет активность в отношении большего количества микромицетов, при одновременной более высокой способности к высвобождению фосфатов как из органических, так и неорганических фосфорных соединений почвы.
Целью заявленного технического решения является устранение недостатков, присущих прототипу, обеспечение расширения арсенала средств благотворного воздействия на растения на базе штамма Pantoea brenneri AS3, одновременно обладающего как высокой фосфат-мобизилующей активностью по растворению минеральных и органических почвенных соединений фосфора, так и способностью к подавлению роста фитопатогенных грибов, при этом, он должен быть пригоден для использования в биотехнологиях промышленного производства биоудобрений (то есть обладать свойством накапливать высокий уровень биомассы и не обладать фитопатогенностью).
Заявленное техническое решение поясняется следующими материалами.
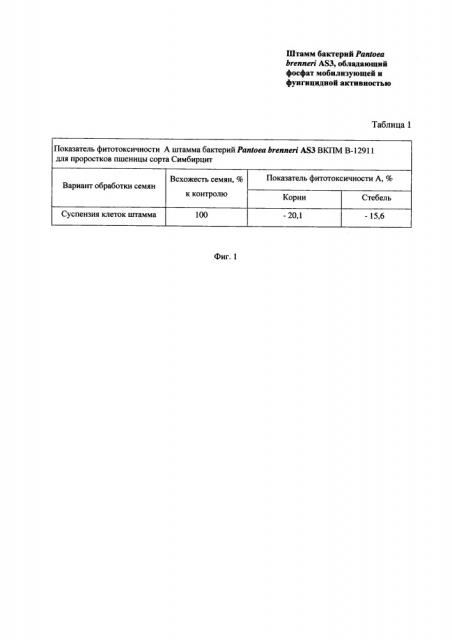
На Фиг. 1 представлена таблица, демонстрирующая отсутствие фитотоксичности у штамма Pantoea brenneri AS3.
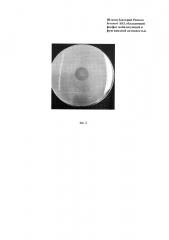
На Фиг. 2 представлен рисунок, подтверждающий наличие фитат-гидролизующей активности штамма Pantoea brenneri AS3. Потемнение в центре чашки Петри - зона гидролиза фитата кальция бактерией Pantoea brenneri AS3 на среде PSM.
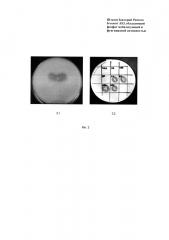
На Фиг. 3 представлен рисунок, на котором отражены зоны гидролиза (потемнение на среде в чашки Петри) фосфата кальция на среде NBRIP (А) и фосфорита (В) штаммом Pantoea brenneri AS3.
На Фиг. 4 представлен график, отражающий динамику высвобождения фосфатов в процессе культивирования штамма P. brenneri AS3 на среде NBRIP, содержащей фосфата кальция в качестве единственного источника фосфора.
На Фиг. 5 представлен рисунок с результатами культивирования штаммов на агаризованной среде LB, слева в качестве отрицательного контроля использовали среду с микромицетом без бактериального роста P. brenneri AS3; справа опыт - подавления роста микромицетов штаммом P. brenneri AS3.
На Фиг. 6 представлена таблица с результатами ингибирования штаммом P.brenneri AS3 роста микромицетов
Сущностью заявленного технического решения является штамм бактерий Pantoea brenneri AS3 обладающий фосфат мобилизующей активностью к неорганическим и органическим фосфатам почвы и фунгицидной активностью.
Более точно, штамм бактерий Pantoea brenneri AS3 обладающий фосфат мобилизующей активностью к неорганическим и органическим фосфатам почвы и фунгицидной активностью выделенный из образцов почвы Республики Татарстан по признаку максимальной фитазной активности, следствием чего является стимуляция роста растений, способности подавления роста фитопатогенных микроорганизмов и безвредности для теплокровных организмов. Штамм депонирован под номером В-12911 в Национальном биоресурсном центре «Всероссийская коллекция промышленных микроорганизмов ФГБУ «ГосНИИгенетика» Минобрнауки России (117545, Москва,1-й Дорожный проезд, дом 1, ФГБУ «ГосНИИгенетика», ВКПМ).
Штамм бактерий Pantoea brenneri AS3 характеризуется следующими признаками (Справка №12911 от 11.04.2017 г.о депонировании штамма микроорганизма).
Штамм бактерий Pantoea brenneri AS3 выделен в сентябре 2009 г. сотрудниками Казанского государственного университета им. В.И. Ульянова-Ленина (КГУ) из образцов почвы Республики Татарстан.
Культурально-морфологические признаки штамма
Величина клеток односуточной культуры на жидкой питательной среде Лурия-Бертани (далее по тексту - LB) 0,5-1,0 мкм. Клетки культуры - палочковидные, одиночные, грамотрицательные, подвижные. Споры не образуют.
Культуральные признаки: При росте на агаризованной среде LB (24 часа, плюс 37°C) колонии имеют круглую форму, гладкую блестящую поверхность и ровные края, консистенцию мягкую, через 2…3 дня инкубации образуют желтоватый пигмент. При росте на LB-бульоне (24 часа или 1 сутки, +37°C) - в процессе роста среда LB-бульон мутнеет, появляется осадок. Пленка на поверхности среды не образуется.
Штамм бактерий Pantoea brenneri AS3 обладает резистентностью к антибиотикам: тетрациклину, хлорамфениколу и эритромицину. Это свойство штамма позволяет сохранить культуру от посторонней контаминации чужеродной микрофлорой в период хранения и подготовки инокулята в ходе работы со штаммом.
Штамм бактерий Pantoea brenneri AS3 не обладает фитопатогенной активностью, то есть не вызывает заболевания растений.
Физиолого-биохимическая характеристика штамма.
Штамм Pantoea brenneri AS3 хорошо растет при температуре плюс 37°C на жидкой и/или твердой питательной среде Лурия-Бертани (далее по тексту - LB/LB-агар). Состав среды LB (г/л): триптон - 10 г/л, дрожжевой экстракт - 5 г/л, NaCl - 10 г/л, рН 8,5; агар - 2%. Культивирование на жидкой питательной среде проводят с использованием вибростенда (при частоте колебаний 2…3 с-1) при температуре +37°C. Оптимальное соотношение в колбе среда : воздух равно 1,0:7,5.
Длительное время хранения (до трех лет) осуществляется замораживанием культуры с 50% глицерином при минус 80°C. По истечении трех лет осуществляют пересев культуры.
При хранении до года: 1,2 мл 0,7% агара заливают в пробирки столбиком, посев делают уколом, после выращивания в течении суток при плюс 37°C заливают сверху стерильным вазелиновым маслом (2 мл) и культуру хранят в темноте при комнатной температуре.
Штамм бактерий Pantoea brenneri AS3 ферментирует глюкозу, лактозу, маннит и мальтозу без образования газа. В процессе жизнедеятельности не образует сероводород и не обладает уреазной активностью.
Возможность осуществления предполагаемого изобретения подтверждается приведенными ниже примерами, но не ограничивается ими.
Пример 1. Получение культуры бактерий Pantoea brenneri AS3
Штамм выделен в сентябре 2009 г. сотрудниками Казанского государственного университета им. В.И. Ульянова-Ленина из образцов почвы Республики Татарстан по признаку максимальной фитазной активности (активности фермента фитазы при расщеплении фосфорсодержащих органических соединений - фитатов) - штамм способен расти и образовывать зоны гидролиза на селективной среде PSM, содержащий фитат кальция в качестве единственного источника фосфора. Культивирование бактерий проводят в колбах на среде LB объемом 100 мл при соотношении объема среды к объему колбы 1:5 на лабораторных качалках с интенсивностью качания 200 об/мин при температуре плюс 37°C. Посевным материалом служит 12-часовой инокулят штамма. Контроль за ростом культуры осуществляют, определяя изменение оптической плотности (Dопт) культуры, например - в кювете толщиной 1 см. Прирост биомассы определяют нефелометрически (метод количественного анализа, основанный на измерении интенсивности света, рассеянного частицами мутной среды; причиной помутнения являются размножающиеся со временем в среде бактерии Pantoea brenneri AS3) при длине волны излучения λ=590 нм.
Пример 2. Демонстрация отсутствия фитотоксичности у штамма Pantoea brenneri AS3
Из культуральной жидкости, полученной по Примеру 1, готовят 1% суспензию клеток Pantoea brenneri AS3 в стерильной дистиллированной воде (0,5…1,0)×108 кл./мл. В полученной суспензии замачивают предварительно простерилизованные семена пшеницы сорта Симбирцит (стандарт республики Татарстан, сорт получен в Татарском НИИ сельского хозяйства - ТатНИИСХ) в течение 2 час. В контрольном опыте семена замачивают в стерильной дистиллированной воде.
В опытах по 50 семян каждого варианта раскладывают на листы фильтровальной бумаги, увлажненные культуральной жидкостью с клетками штамма бактерий Pantoea brenneri AS3 (опыт) и дистиллированной водой (контроль). Листы с разложенными на них семенами помещают в чашки Петри и, постоянно увлажняя, выдерживают в термостате при плюс 28°C в течение 5 суток. Через 1 сутки оценивают всхожесть семян (Таблица 1), а еще через 4 суток проростки морфометрируют, измеряя длину всех корней и стебля.
Фитотоксическую активность А штамма рассчитывают по формуле:
А=(100-До/Дк×100)%,
где: А - показатель фитотоксичности;
До - средний показатель параметра в опыте - длина всех корней и стебля (см);
Дк - средний показатель параметра в контроле - длина всех корней и стебля (см);.
Результат определения фитотоксической активности А штамма представлен Фиг. 1 (Таблица 1), демонстрирующей отсутствие фитотоксичности (проявления ядовитости по отношению к растениям) у штамма Pantoea brenneri AS3, что подтверждают отрицательные значения показателя фитотоксичности А и свидетельствуют о наличии у штамма Pantoea brenneri AS3 стимулирующего эффекта.
Пример 3. Определение фитазной активности
Для улучшения фосфорного питания растений микроорганизмы - продуценты фитат-гидролизующих ферментов (фитаз) являются идеальными кандидатами - расщепляя органические фосфорсодержащие соединения - фитаты, они обеспечивают растениям должное питание фосфором.
Известно, что бактериальные фитазы способны последовательно отщеплять неорганический фосфат из нерастворимых органических комплексов - фитатов.
Фитазную актисность штамма бактерий Pantoea brenneri AS3 определяют известным способом (Sasirekha, В. Optimization and partial purification of extracellular phytase from Pseudomonas aeruginosa р6/ B. Sasirekha, T. Bedashree, K.L. Champa // Euro. J. Exp.Bi. - 2012. - V. 2. - №1. - P. 95-104), на агаризованной среде Phytase Screening Medium (далее по тексту - PSM): (г/л dH2O): CaCl2 - 2; NH4NO3 - 5; KCl - 0,5; MgSO4⋅7H2O - 0,5; FeSO4⋅7Η2O - 0,01; MnSO4⋅H2O - 0,01; глюкоза - 20; фитат натрия - 4; агар - 2, рН 6,8…7,0.
Среда PSM содержит нерастворимый фитат кальция в качестве единственного источника фосфора. Осуществляют посев бактерий Pantoea brenneri AS3 на чашки Петри со средой PSM, инкубируют 5 суток при температуре плюс 37°C и оценивают образование зон просветления среды вокруг бактериальной колонии. Известно, что фитат кальция нерастворим и выпадает в осадок в среде PSM, вследствие чего среда (PSM) мутнеет. При культивировании штамма на среде PSM с фитатом кальция происходят изменения - в результате расщепления фитата кальция бактериями среда вокруг колонии становится прозрачной, образуются так называемые гало-зоны вокруг колонии. Поскольку фосфор в среде представлен лишь в виде фитата кальция, бактериальный рост и образование прозрачных гало-зон вокруг колонии бактерий означает, что растущие на этой среде бактерии Pantoea brenneri AS3 гидролизуют фитаты и получают из них (фитатов) фосфор для собственного роста, Фиг. 2, где потемнение в центре чашки Петри - зона гидролиза фитата кальция бактерией Pantoea brenneri AS3 на среде PSM.
Количественную оценку активности фермента фитазы определяют по количеству высвободившегося при гидролизе фитата натрия фосфора по методу Грайнера (Greiner) [R. Greiner, U. Konietzny, K.D. Jany, Arch. Biochem. Biophys., 303, 107-113 (1993)]. Контрольная смесь содержит 250 мкл 0,1М ацетата натрия и 100 мкл субстрата, после инкубации 30 мин при +37°C вносят 10 мкл клеточного экстракта штамма, в данном (контрольном) случае реакция не идет. Реакционная смесь включает 250 мкл 0,1М ацетата натрия рН 4,5 и 100 мкл субстрата (10 мМ фитат натрия в 0,1М ацетате натрия рН 4,5) и 10 мкл клеточного экстракта штамма, содержащего фермент - фитазу. Смесь инкубируют 30 мин при температуре плюс 37°C, затем реакцию останавливают добавлением 1,5 мл свежеприготовленного раствора, содержащего ацетон, 5-ти нормальный H2SO4 и 10 мМ молибдат аммония в соотношении 2:1:1. Далее в смесь вносят по 100 мкл 1М раствора лимонной кислоты и измеряют оптическую плотность растворов в кювете толщиной 1 см на спектрофотометре, например - SmartSpec Plus (BioRad, США-USA), опытной (реакционной) и контрольной пробы при длине волны излучения λ=355 нм в 1 см кювете.
Активность фитазы Ед/мл рассчитывают по формуле:
Ед/мл=(Ea-Eb)×F
F=1/Т×(1/(d×К)×Vобщий/Vфермента, где
Ед/мл - активность фитазы;
Vобщий - общий объем реакционной смеси;
Vфермента - объем добавленного к реакционной смеси раствора фермента - фитазы;
Ea - оптическая плотность опытной пробы;
Eb - оптическая плотность контрольной пробы;
d - разведение фермента;
К - коэффициент, учитывающий молярную экстинкцию субстрата;
T - время инкубации, мин.
Пример расчета активности фитазы Ед/мл с использованием полученных в опыте значений:
Ед/мл=(Ea-Eb)×F
F=1/30×1/(1×8,7)×1960/10=0,033×0,115×196=0,744
Ед/мл=(0,402-0,348)×0,744=0,04.
За единицу активности принимают количество фермента, расщепляющего фитат натрия с образованием 1 мкмоля неорганического фосфата за одну минуту.
Продуцируемый штаммом бактерий Pantoea brenneri AS3 фермент фитаза гидролизует фитат с высвобождением свободных фосфатов, которые используемы для питания как самих микроорганизмов, так и растений.
Расчетная активность фитазы Ед/мл периплазматическая и составляет 0,04 Ед/мл, то есть заявляемый штамм бактерий Pantoea brenneri AS3 расщепляет фосфорсодержащие соединения, чем может обеспечить растениям должное питание фосфором.
В отличие от заявляемого штамма, прототип фитазной активностью не обладает, вследствие чего не расщепляет фосфорсодержащие фитаты, что существенно ограничивает применение прототипа в качестве биоудобрения.
Пример 3. Демонстрация фосфатмобилизующей активности штамма
Для определения способности штамма бактерий Pantoea brenneri AS3 преобразовывать распространенные в почве, но труднодоступные для растений соединения фосфора - фосфат кальция (Ca3PO4) и фосфорит (осадочное соединение, состоящее из кальциевых фосфатов, относящихся к группе фторапатита) используют агаризованную дифференцированную среду NBRIP, содержащую нерастворимый фосфат кальция (Ca3PO4) или фосфорит в качестве единственного источника фосфора. Состав агаризованной дифференцированной среды следующий: среда NBRIP (National Botanical Research Institute's Phosphate growth medium) [Nautiyal, C.S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms/ C.S. Nautiyal // FEMS Microbiol Lett. - 1999. - V. 170. - P. 265-270.] (г/л dH2O): глюкоза - 10,0; (Ca3PO4)2 или фосфорит - 5,0; MgCl2⋅6H2O - 5,0; MgSO4⋅7 H2O - 0,25; KCl - 2,0; (NH4)2SO4 - 0,1; агар - 2, рН 6,8…7,0.
Осуществляют посев бактерий на агаризованную среду NBRIP на чашки Петри, инкубируют 5 суток при температуре плюс 37°C и оценивают образование зон просветления вокруг бактериальной колонии.
Установлено, что помимо фитат-гидролизующей активности (Фиг. 2), штамм Pantoea brenneri AS3 способен расти и образовывать зоны гидролиза на средах NBRIP, содержащих нерастворимые фосфат кальция (Фиг. 3.1) и фосфорит (Фиг. 3.2), в качестве единственного источника фосфора, что указывает на широкий спектр фосфатмобилизующей активности штамма Pantoea brenneri AS3, то есть бактерии переводят (превращают) труднодоступные соединения почвенного фосфора в растворимые соединения фосфора, обеспечивая собственное питание и питание растений. На рисунках (Фиг. 3.1 и Фиг. 3.2) представлены результаты опытов с определением зоны гидролиза (потемнение на питательной среде в чашке Петри) штаммом Pantoea brenneri AS3 на средах с нерастворимыми фосфорными соединениями - с фосфатом кальция (Фиг 3.1) и фосфоритом (Фиг. 3.2, выделено пунктирной рамкой).
Способность к высвобождению фосфатов из нерастворимых фосфорных соединений лежит в основе создания новых агробиотехнологий. Изучали изменение концентрации свободных фосфатов в процессе культивирования штаммов на жидкой среде NBRIP в течение 4 суток культивирования с интервалом в 24 часа. Стерильную питательную среду использовали в качестве отрицательного контроля.
Определение содержания свободных фосфатов с образованием фосфорномолибденовокислого аммония осуществляют, например, по методу Грайнера [R. Greiner, U. Konietzny, K.D. Jany, Arch. Biochem. Biophys., 303, 107-113 (1993)]. Метод основан на способности неорганических фосфатов в кислой среде образовывать с молибдатом аммония соединение желтого цвета - фосфорномолибденовокислый аммоний.
В две опытные пробирки вносят по 100 мкл культуральной жидкости штамма бактерий Pantoea brenneri AS3, выращенные на жидкой среде NBRIP. В качестве контроля используют стерильную питательную среду NBRIP. Во все пробирки вносят по 750 мкл свежеприготовленного реагента ААМ (10 мМ гептамолибдат аммония, раствор 5-ти нормального H2SO4 и ацетон в соотношении 1:1:2). Затем в пробирки добавляют по 50 мкл 1М лимонной кислоты. Пробирки центрифугируют в течение 5 мин при 8000 об/мин.
Оптическую плотность проб измеряют на спектрофотометре в сравнении с плотностью дистиллированной воды при длине волны излучения λ=355 нм в 1 см кювете. Для определения концентрации свободных фосфатов строят градуировочный график, из основного стандартного раствора фосфорнокислого калия, молярная концентрация фосфатов в котором составляет 5 мкмоль/мл, готовили серию разведений. При внесении штамма Pantoea brenneri AS3 в питательную среду, концентрация С фосфатов в среде составляла около 100 мкмоль/мл. Это значение взято за исходный показатель для оценки активности штамма. Через 94 часа культивирования при плюс 37°C концентрация свободных фосфатов в среде с культурой штамма Pantoea brenneri AS3 достигла значения максимума 592 мкмоль/мл (Фиг. 4), что свидетельствует о 5,9 кратном (от 100 до 592) увеличении концентрации свободных фосфатов в среде под действием штамма бактерий Pantoea brenneri AS3, по сравнению с контролем - стерильная питательная среда NBRIP. На Фиг. 4 показана динамика фосфат-мобилизации в процессе культивирования штамма Pantoea brenneri AS3, где по горизонтальной оси координат отложена продолжительность времени культивирования t (час), вертикальной оси - концентрация С фосфатов (мкмоль/мл).
Исходя из опыта установлено (Фиг. 4), что штамм бактерий P. brenneri AS3 обладает фосфатмобилизующей активностью и увеличивает количество свободных фосфатов в среде не менее чем в 5,9 раз за 94 часа культивирования. Через 48 часов (двое суток) культивирования концентрация свободного, доступного для растений фосфата составляет 18050 мкг/мл, что более чем в 6 раз выше, чем у прототипа (2620 мкг/мл (абзац 16 с конца описания патента) 18050:2620=6,89.
Пример 4. Демонстрация антагонизма штамма в отношении фитопатогенных грибов рода Fusarium
В качестве тест-объектов используют следующие штаммы фитопатогенных грибов рода Fusarium, в скобках указано вызываемое патогенном заболевание: F. solani (корневая гниль и трахеомикозное увядание) F. tricinctum (поражение колоса зерновых культур), Fusarium sp. 1.5 (фузариоз), F. oxysporum (вилт, увядание), F. avenaceum (дерматит у человека, фузариоз зерна), а так же Alternaria alternata (аллергический альвеолит у человека, у растений - ранняя пятнистость, альтернариоз) и Bipolaris sorokiniana (корневая гниль, темно-бурая пятнистость листьев, загнивание всходов и так называемый «черный зародыш» семян)
Для определения супрессивных (подавляющих фитопатогены) свойств продуцируемых бактерией Pantoea brenneri AS3 веществ используют метод лунок Petatan-Sagahon [Petatan-Sagahon I. Isolation of Bacteria with Antifungal Activity against the Phytopathogenic Fungi Stenocarpella maydis and Stenocarpella macrospora [Text] / I. Petatan-Sagahon, M.A. Anducho-Reyes, H.V. Silva-Rojas, A. Arana-Cuenca, A. Tellez-Jurado, I.O. Cardenas-Alvarez, Y. Mercado-Flores, Int J Mol Sci. 2011-PMC3189730]. Ha агаризованной среде LB в стерильных условиях в центре чашки Петри стерильным сверлом вырезают лунку диаметром 0,8 см. Готовят суспензии фитопатогенных грибов (105 КОЕ/мл), стерильной средой LB смывая мицелиальную и споровую массу с газонов фитопатогенных грибов на среде Чапека.
На чашку Петри сеют газоном 100 мкл инокулята бактерии Pantoea brenneri AS3. Культивирование проводят при плюс 37°C в течение 12 час, затем в лунку вносят 200 мкл спор фитопатогенных грибов в среде LB. Культивирование проводят в термостате при температуре плюс 28°C. Результаты оценивают поочередно - через 72 час (3 суток), 168 час (7 суток), 240 час (10 суток). Для контроля сеют аналогичным способом по 200 мкл спор фитопатогенных грибов в лунку в стерильных условиях на агаризованной среде LB и аналогично же оценивают результаты.
Луночным методом Petatan-Sagahon на агаризованной среде LB изучена фунгицидная активность штамма Pantoea brenneri AS3 и установлено, что штамм обладает способностью к ингибированию (замедлению или полному прекращению) роста микромицетов (грибов и грибообразных организмов микроскопических размеров, в том числе возбудителей фузариоза), по сравнению с контролем (Фиг. 5). На Фиг. 5 показаны результаты культивирования штаммов на чашках Петри на агаризованной среде LB, где: К - среда с микромицетом без бактериального роста P. brenneri AS3; О - подавление роста микромицетов штаммом бактерий P. brenneri AS3. Как видно из Фиг. 5 (фото чашек Петри), опытным путем установлено, что по сравнению с контролем штамм Р. brenneri AS3 обладает способностью к ингибированию (замедлению или полному прекращению) роста микромицетов (грибов и грибообразных организмов микроскопических размеров, в том числе возбудителей фузариоза).
Примеры с результатами экспериментального определения способности штамма бактерий Pantoea (далее - P.) brenneri AS3 ингибировать (подавлять) рост приносящих наибольший урон в растениеводстве микромицетов показывает Фиг. 6 (Таблица 2). Как видно из Фиг. 6, во всех опытах выявлена способность штамма бактерий P. brenneri AS3 подавлять рост приведенных в примере микромицетов, приносящих наибольший ущерб в сельскохозяйственной деятельности
Максимальный ингибирующий эффект P. brenneri AS3 проявлен по отношению к штамму Fusarium solani - рост микромицета ингибируется на 87% (Фиг. 6, Таблица 2). Высокую степень ингибирования роста (от 58% до 87%) заявляемым бактериальным штаммом P. brenneri AS3 проявлен по отношению ко всем исследуемым представителям рода Fusarium, а также рода Alternaria alternata (71%). Минимальная способность к ингибированию роста гриба наблюдалась по отношению к роду Bipolyaris sorokiniana - 33%.
Экспериментально установлено и доказано, что штамм бактерий P. brenneri AS3. в процессе роста образует соединения, оказывающие фунгицидное действие по отношению к микромицетам: к 7 (семи) видам фитопатогенов рода Fusarium (Фиг. 6, Табл. 2) и к фитопатогенам родов Alternaria и Bipolyaris. Прототип же обладает меньшей фунгицидной активностью и только против трех разновидностей штаммов рода Fusarium (F. graminearum, F. culmorum, F. Oxysporum).
Сравнение заявляемого технического решения с прототипом показывает, что заявляемый штамм оказывает существенно большее фунгицидное действие по отношению к фитопатогенам, проявляет фосфатмобилизующее действие как на неорганические, так и органические почвенные соединения фосфора, и поэтому обладает существенно большей, по сравнению с прототипом, областью применения.
Наличие фунгицидной активности у штамма бактерий Pantoea brenne