Бактериальная целлюлоза и продуцирующая ее бактерия
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Штамм Gluconacetobacter intermedius, продуцирующий бактериальную целлюлозу, депонирован в Национальном Институте передовой промышленной науки и технологии (Япония) под регистрационным номером SIID 9587. Предложены способ получения бактериальной целлюлозы, включающий культивирование штамма Gluconacetobacter intermedius SIID 9587, и бактериальная целлюлоза с коэффициентом пропускания света 35% при длине волны 500 нм в случае воды, содержащей бактериальную целлюлозу в конечной концентрации 0,1±0,006% (масс./масс.). Изобретения обеспечивают получение бактериальной целлюлозы, обладающей высокой диспергируемостью. 3 н. и 4 з.п. ф-лы, 13 ил., 3 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к бактериальной целлюлозе и продуцирующей ее бактерии и, в частности, к бактериальной целлюлозе, которая обладает превосходной диспергируемостью в жидкостях, и к продуцирующей ее бактерии.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Бактериальная целлюлоза обычно состоит из тонкого волокна (нановолокна) диаметром приблизительно 50 нм и привлекла внимание в качестве материала, который может быть использован в различных отраслях промышленности, поскольку она обладает такими свойствами, как высокая механическая прочность и биосовместимость, и способность к биологическому разложению. Бактериальную целлюлозу обычно получают в виде пленки, состоящей из гелеобразного вещества (далее называемого «пленкой в гелеобразной форме»), на поверхности культуральной среды посредством подвергания бактерии, такой как уксуснокислая бактерия, стационарному культивированию; однако пленка в гелеобразной форме обладает недостатком, таким как недостаточное применение в качестве практического материала из-за ее низкой формуемости и плохой смешиваемости с другими веществами при использовании материалов и высокая стоимость из-за низкой эффективности продукции.
Для решения этой проблемы требуется бактериальная целлюлоза, находящаяся не в форме гелеобразной пленки, а диспергируемая в жидкостях и, следовательно, имеющая превосходную применимость. Например, в непатентном документе 1 описывается бактериальная целлюлоза, полученная посредством подвергания Acetobacter xylinum подвида sucrofermentans культивированию при аэрировании и перемешивании, а в непатентном документе 2 также описывается бактериальная целлюлоза, полученная посредством подвергания Gluconacetobacter xylinum штамма JCM10150 культивированию на ротационном шейкере в среде для культивирования, содержащей карбоксиметилцеллюлозу (CMC).
СПИСОК ПРОТИВОПОСТАВЛЕННЫХ МАТЕРИАЛОВ
Непатентный документ 1: Yoshinaga et al., Kagaku To Seibutsu (Chemistry and Biology), vol. 35, no. 11, p. 7-14, 1997.
Непатентный документ 2: Warashina et al., 2010 Cellulose R&D Abstracts at the 17th Annual Meeting of the Cellulose Society, p. 98, 2010.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая трудность
Однако бактериальная целлюлоза, описанная в непатентном документе 1, не обладает высокой диспергируемостью в воде, как следует из описания, что она не является целлюлозой, продуцируемой с использованием содержащей СМС культуральной среды, с эффектом увеличения диспергируемости бактериальной целлюлозы, и что она диспергируется «в виде очень маленьких частиц или волокон» в воде (тот же документ, страница 9, правый столбец). Следовательно, бактериальная целлюлоза является неудовлетворительной по показателю формуемости и смешиваемости с другими веществами для практического использования. Бактериальная целлюлоза, описанная в непатентном документе 2, также не обладает высокой диспергируемостью в воде, поскольку содержащая бактериальную целлюлозу вода имеет большую мутность белого цвета на дне, чем наверху, и в ней отмечается осадок, и частицы целлюлозы являются явно большими (тот же документ, фиг. 1) в любом из случаев, когда добавленное в культуральную среду количество СМС составляет 0,5%, 1% и 2%. Следовательно, эта бактериальная целлюлоза является неудовлетворительной по показателю формуемости и смешиваемости с другими веществами, которые необходимы для практического использования.
Таким образом, бактериальная целлюлоза, описанная и в непатентном документе 1, и в непатентный документ 2, является неудовлетворительной по формуемости в качестве материала и смешиваемости с другими веществами, а также имеет недостаточную применимость, исходя из эффективности продукции материала. Для решения этих проблем было сделано настоящее изобретение, и его задачей является обеспечение бактериальной целлюлозы, обладающей высокой диспергируемостью в жидкостях, подходящей по формуемости и смешиваемости с другими материалами при практическом использовании и имеющей превосходную применимость в качестве фактического материала, и продуцирующей бактериальную целлюлозу бактерии.
Решение проблемы
В результате обширных исследований авторы настоящего изобретения установили, что в высокой степени диспергируемой в воде является бактериальная целлюлоза, которая получена посредством подвергания штамма SIID9587 в качестве нового штамма Gluconacetobacter intermedius (номер доступа NITE BP-01495) (ниже иногда называемого «штаммом NEDO-01 (штаммом SIID9587 G. intermedius») культивированию при перемешивании в содержащей СМС культуральной среде, используя содержащий глицерин побочный продукт при производстве биодизельного топлива из растительных масел (Bio Diesel Fuel By-product; BDF-B, отработанный глицерин), реагент глицерин или мелассу в качестве источника углерода, совершив тем самым следующие изобретения.
(1) Бактериальная целлюлоза в соответствии с настоящим изобретением обладает физическим свойством - составляющим 35% или более коэффициентом пропускания света с длиной волны 500 нм в случае воды, содержащей бактериальную целлюлозу в конечной концентрации, составляющей 0,1±0,006% (масс./масс.).
(2) Бактериальная целлюлоза в соответствии с настоящим изобретением обладает, кроме того, физическим свойством - составляющим от 2,5 мл включительно до 3,0 мл исключительно удерживаемым объемом, необходимым для получения максимума пика хроматограммы при гельпроникающей хроматографии при ее проведении в следующих условиях i)-vi):
i) колонка: колонка с внутренним диаметром 6,0 мм и длиной 15 см, заполненная метакрилатом с диаметром частиц = 9 мкм, ii) защитная колонка: внутренний диаметр 4,6 мм и длина 3,5 см, iii) температура колонки: 35°C; iv) скорость подачи: 0,07 мл/мин; v) элюент: 40-42% (масс./масс.) раствор гидроксида тетрабутилфосфония в воде, и vi) конечная концентрация бактериальной целлюлозы в элюенте: 0,2% (масс./масс.).
(3) Бактериальная целлюлоза в соответствии с настоящим изобретением предпочтительно продуцируется в результате ассимиляции BDF-B.
(4) Бактериальная целлюлоза в соответствии с настоящим изобретением предпочтительно продуцируется в результате ассимиляции 1 или 2 или более веществ, выбираемых из группы, состоящей из сахара, содержащего сахарозу побочного продукта, образуемого при производстве сахара, и их гидролизатов, и изомеризованного сахара.
(5) Предпочтительно побочным продуктом является меласса, когда бактериальная целлюлоза в соответствии с настоящим изобретением продуцируется в результате ассимиляции содержащего сахарозу побочного продукта, образуемого при производстве сахара.
(6) Бактериальная целлюлоза в соответствии с настоящим изобретением может представлять собой бактериальную целлюлозу, продуцированную Gluconacetobacter intermedius.
(7) Бактериальная целлюлоза в соответствии с настоящим изобретением может представлять собой бактериальную целлюлозу, продуцированную штаммом SIID9587 Gluconacetobacter intermedius (штаммом NEDO-01) (номер доступа NITE BP-01495).
(8) Бактерия в соответствии с настоящим изобретением характеризуется тем, что она продуцирует бактериальную целлюлозу по любому из пп.(1)-(5) выше.
(9) Бактерия в соответствии с настоящим изобретением может представлять собой штамм SIID9587 Gluconacetobacter intermedius (штамм NEDO-01) (номер доступа NITE BP-01495), продуцирующий бактериальную целлюлозу по любому из пп.(1)-(5) выше.
ПОЛЕЗНЫЕ ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Бактериальной целлюлозой в соответствии с настоящим изобретением может являться бактериальная целлюлоза, почти равномерно диспергируемая в жидкостях, таких как вода, и она может вносить вклад в улучшение качества конечного продукта и увеличение эффективности продукции или снижение стоимости продукции, поскольку эта бактериальная целлюлоза обладает превосходной формуемостью и смешиваемостью с другими веществами. Настоящим изобретением может обеспечиваться бактериальная целлюлоза, почти равномерно диспергируемая в жидкостях, в результате очистки в мягких условиях без необходимости стадии очистки с использованием смесителя и т.п., и может обеспечиваться бактериальная целлюлоза, обладающая относительно большей средней молекулярной массой. Кроме того, настоящее изобретение может вносить вклад в эффективное использование ресурсов в результате использования содержащего сахарозу побочного продукта, образуемого в ходе производства сахара, такого как BDF-B или меласса, в качестве источника углерода, и позволяет достичь снижения себестоимости бактериальной целлюлозы. Кроме того, настоящим изобретением может эффективно обеспечиваться большое количество бактериальной целлюлозы путем продукции с использованием Gluconacetobacter intermedius или штамма SIID9587 Gluconacetobacter intermedius (штамма NEDO-01).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой схему, иллюстрирующую протокол выделения бактерии, продуцирующей бактериальную целлюлозу, в результате ассимиляции BDF-B.
Фиг. 2-1 представляет собой схему, демонстрирующую идентичные и различные позиции при сравнении между нуклеотидными последовательностями 16S рДНК штамма SIID9587 и штамма TF2 G. intermedius. На этой фигуре идентичные позиции в нуклеотидных последовательностях отмечены звездочками, а различные позиции показаны прямоугольниками. На этой фигуре G. intermedius означает штамм TF2 G. intermedius.
Фиг. 2-2 представляет собой схему, демонстрирующую идентичные и различные позиции при сравнении между нуклеотидными последовательностями 16S рДНК штамма SIID9587 и штамма TF2 G. intermedius. На этой фигуре идентичные позиции в нуклеотидных последовательностях отмечены звездочками, а различные позиции показаны прямоугольниками. На этой фигуре G. intermedius означает штамм TF2 G. intermedius.
Фиг. 3 представляет собой пару таблиц, демонстрирующих бактериологические свойства штамма SIID9587.
Фиг. 4 представляет собой ряд графиков, демонстрирующих ИК-спектры бактериальной целлюлозы, полученной посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) стационарному культивированию (верхний график), и продуктов, полученных путем культивирования при аэрировании и перемешивании, используя BDF-B и реагент глицерин в качестве источников углерода (графики посередине и внизу).
Фиг. 5 представляет собой ряд фотографий, демонстрирующих внешний вид каждой из вод, содержащих бактериальные целлюлозы, полученные посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию при аэрировании и перемешивании и стационарному культивированию (слева и посередине), и бактериальное целлюлозное нановолокно, происходящее из целлюлозной массы (справа).
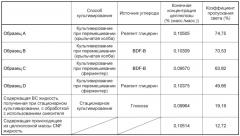
Фиг. 6 представляет собой ряд чертежей, показывающих коэффициент пропускания света с длиной волны 500 нм в случае вод, содержащих бактериальные целлюлозы, полученные посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию при аэрировании и перемешивании, используя мелассу и реагент глицерин в качестве источников углерода, соответственно, и количество продуцированной бактериальной целлюлозы (количество продуцированной ВС), и скорость ее продукции (скорость продукции ВС).
Фиг. 7 представляет собой ряд чертежей, показывающих коэффициент пропускания света с длиной волны 500 нм в случае вод, содержащих бактериальные целлюлозы, полученные посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) и известных продуцирующих бактериальные целлюлозы бактерий: штамма ATCC23769 G. hansenii, штамма ATCC53582 G. xylinus, штамма ATCC700178 (BPR2001) G. xylinus, штамма JCM10150 xylinus, штамма DSM11804 G. intermedius и штамма KCCM40274 G. xylinus культивированию при аэрировании и перемешивании, и количество продуцированной ВС, скорость продукции ВС и отношение скоростей продукции ВС.
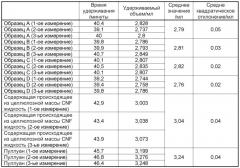
Фиг. 8 представляет собой график, на котором представлены хроматограммы гельпроникающей хроматографии бактериальной целлюлозы, полученной посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию на ротационном шейкере, используя BDF-B в качестве источника углерода (образца B), происходящего из целлюлозной массы целлюлозного нановолокна (содержащей происходящее из целлюлозной массы CNF жидкости) и пуллулана.
Фиг. 9 представляет собой пару фотографий, демонстрирующих диаметры волокон и полученные с помощью просвечивающего электронного микроскопа изображения бактериальных целлюлоз, полученных путем подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию при аэрировании и перемешивании (содержащей ВС жидкости, полученной при культивировании при перемешивании), и стационарному культивированию (содержащей ВС жидкости, полученной при стационарном культивировании, с обработкой с использованием смесителя).
Фиг. 10 представляет собой пару фотографий, демонстрирующих полученные с помощью просвечивающего электронного микроскопа изображения бактериальной целлюлозы, полученной путем подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию при аэрировании и перемешивании (содержащей ВС жидкости, полученной при культивировании при перемешивании), и происходящего из целлюлозной массы целлюлозного нановолокна (содержащей происходящее из целлюлозной массы CNF жидкости).
Фиг. 11 представляет собой пару фотографий, демонстрирующих полученные с помощью поляризационного микроскопа изображения бактериальной целлюлозы, полученной путем подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) культивированию при аэрировании и перемешивании (содержащей ВС жидкости, полученной при культивировании при перемешивании), и происходящего из целлюлозной массы целлюлозного нановолокна (содержащей происходящее из целлюлозной массы CNF жидкости).
Фиг. 12 представляет собой диаграмму, демонстрирующую количество бактериальных целлюлоз, полученных посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) и известных продуцирующих бактериальные целлюлозы бактерий: штамма ATCC23769 G. hansenii, штамма ATCC53582 G. xylinus и штамма ATCC700178 (BPR2001) G. xylinus стационарному культивированию, используя реагент глицерин или BDF-B в качестве источника углерода.
Фиг. 13 представляет собой диаграмму, демонстрирующую количество бактериальных целлюлоз, полученных посредством подвергания штамма NEDO-01 (штамма SIID9587 G. intermedius) и известных продуцирующих бактериальные целлюлозы бактерий, штамма ATCC53582 и штамма ATCC23769, культивирование на качалке, используя реагент глицерин или BDF-B в качестве источника углерода.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Ниже будет подробно описана бактериальная целлюлоза в соответствии с настоящим изобретением и продуцирующая ее бактерия. Бактериальная целлюлоза в соответствии с настоящим изобретением относится к целлюлозе, продуцируемой бактерией.
С целью настоящего изобретения бактериальная целлюлоза, «диспергированная» в жидкости, такой как вода, относится к бактериальной целлюлозе, плавающей или суспендированной в жидкости. Высокая диспергируемость относится, например, к диаметру частиц или диаметру волокна бактериальной целлюлозы в качестве дисперсной частицы, являющейся относительно небольшой в жидкости, или бактериальной целлюлозы в качестве дисперсной частицы, относительно равномерно плавающей или суспендированной в жидкости.
Бактериальная целлюлоза в соответствии с настоящим изобретением обладает высокой диспергируемостью в такой степени, что она почти равномерно диспергируется в жидкости. Здесь жидкостью для диспергирования бактериальной целлюлозы может быть любой органический растворитель и водный растворитель, однако предпочтительным является водный растворитель.
Насколько высокой или низкой является диспергируемость бактериальной целлюлозы, можно определить, например, используя коэффициент пропускания света в качестве показателя; сохраняет силу взаимосвязь: более высокая диспергируемость имеет следствием большее значение коэффициента пропускания света, а более низкая диспергируемость имеет следствием меньшее значение коэффициента пропускания света. Коэффициент пропускания света можно определить посредством доставки воды, содержащей бактериальную целлюлозу в заранее заданной концентрации, в спектрофотометр, облучения воды светом с заданной длиной волны и измерения величины пропускаемого света.
Бактериальная целлюлоза в соответствии с настоящим изобретением обладает физическим свойством - составляющим 35% или более коэффициентом пропускания света с длиной волны 500 нм в случае воды, содержащей бактериальную целлюлозу в конечной концентрации, составляющей 0,1±0,006% (масс./масс.). Здесь примеры коэффициента пропускания света с длиной волны 500 нм в случае воды, содержащей бактериальную целлюлозу в конечной концентрации, составляющей 0,1±0,006% (масс./масс.), в соответствии с настоящим изобретением могут включать 35% или более, а также 36% или более, 37% или более, 38% или более, 39% или более, 40% или более, от 35% до 99% (включая оба значения), от 36% до 99% (включая оба значения), от 37% до 99% (включая оба значения), от 38% до 99% (включая оба значения), от 40% до 99% (включая оба значения), от 35% до 95% (включая оба значения), от 36% до 95% (включая оба значения), от 37% до 95% (включая оба значения), от 38% до 95% (включая оба значения), от 40% до 95% (включая оба значения), от 35% до 90% (включая оба значения), от 36% до 90% (включая оба значения), от 37% до 90% (включая оба значения), от 38% до 90% (включая оба значения), от 40% до 90% (включая оба значения), от 35% до 85% (включая оба значения), от 36% до 85% (включая оба значения), от 37% до 85% (включая оба значения), 38% до 85% (включая оба значения), от 40% до 85% (включая оба значения), от 35% до 80% (включая оба значения), от 36% до 80% (включая оба значения), от 37% до 80% (включая оба значения), от 38% до 80% (включая оба значения) и от 40% до 80% (включая оба значения).
Бактериальная целлюлоза в соответствии с настоящим изобретением может также иметь большую среднюю молекулярную массу по сравнению с целлюлозой растительного происхождения, такой как происходящее из целлюлозной массы целлюлозное нановолокно. Среднюю молекулярную массу целлюлозы можно определить, используя, например, хроматограмму гельпроникающей хроматографии в качестве показателя; сохраняет силу взаимосвязь: меньшая молекулярная масса имеет следствием больший удерживаемый объем, необходимый для получения максимума пика такой хроматограммы, а более большая молекулярная масса имеет следствием меньший удерживаемый объем. В частности, бактериальная целлюлоза в соответствии с настоящим изобретением может обладать физическим свойством - составляющим от 2,5 мл включительно до 3,0 мл исключительно удерживаемым объемом, необходимым для получения максимума пика хроматограммы при гельпроникающей хроматографии при ее проведении в следующих условиях i)-vi): i) колонкой является колонка с внутренним диаметром 6,0 мм и длиной 15 см, заполненная метакрилатом с диаметром частиц = 9 мкм; ii) защитная колонка имеет внутренний диаметр 4,6 мм и длину 3,5 см, iii) температура колонки составляет 35°C, iv) скорость подачи составляет 0,07 мл/мин; v) элюентом является 40-42% (масс./масс.) раствор гидроксида тетрабутилфосфония в воде, и vi) конечная концентрация бактериальной целлюлозы в элюенте составляет 0,2% (масс./масс.).
Бактериальную целлюлозу в соответствии с настоящим изобретением можно продуцировать, например, заставляя бактерию продуцировать бактериальную целлюлозу путем культивирования в среде для культивирования, содержащей подходящий источник углерода.
Здесь примеры источника углерода могут включать моносахариды, такие как глюкоза и фруктоза, дисахариды, такие как сахароза, мальтоза и лактоза; олигосахариды, сахар, содержащие сахарозу побочные продукты, образуемые в процессе производства сахара, их гидролизаты и изомеризованный сахар; сахариды, такие как гидролизат крахмала, маннит, этанол, уксусную кислоту, лимонную кислоту, глицерин и BDF-B. Источник углерода может быть правильно задан в зависимости от типа бактерии, условий культивирования, стоимости продукции и т.п. BDF-B состоит из глицерина 41,5%, жирной кислоты 21,4%, метанола 12,4%, зольного остатка 6,3% и прочего 18,4% (Japan Food Research Laboratories) в качестве типичной композиции и представляет собой композицию, содержащую большое количество глицерина, доступного в качестве источника углерода для бактерии.
Здесь сахар означает подсластитель, состоящий в основном из сахарозы (Kojien, 6th Ed.), и с целью настоящего изобретения может быть сахаром, который является химически синтезированным, или сахаром, полученным с использованием природного продукта, такого как сахарный тростник, сахарная свекла (сахарный буряк), кленовый сахар, аренга (Borassus flabellifer) и сахарное сорго (Sorghum bicolor dulciusculum) в качестве сырья. Примеры сахара в соответствии с настоящим изобретении могут включать сахар не с центрифуги, такой как неочищенный тростниковый сахар, shiroshita-to, casonade (коричневый сахар), Wasanbon или кленовый сахар, и сахар с центрифуг, такой как сахар-сырец и рафинированный сахар. Примеры рафинированного сахара могут включать твердый сахар, такой как shiroshita-to, крупнокристаллический среднемягкий сахар или гранулированный сахар; мягкий сахар, такой как белый мягкий сахар высокого качества или желтый мягкий сахар, подвергнутый обработке сахар, такой как прессованный сахар, кристаллический сахар, сахарный песок или сахарная глазурь, и жидкий сахар.
Содержащий сахарозу побочный продукт, образуемый в ходе производства сахара, относится к побочному продукту, содержащему сахарозу, среди побочных продуктов, образующихся на стадии производства сахара, и его конкретные примеры могут включать жмых природных исходных материалов, таких как сахарный тростник и сахарная свекла, которые описаны выше; мелассу и отходы, образующиеся на стадии очистки с использованием фильтрации или ионообменной смолы.
Гидролизат дисахарида, олигосахарида, сахара или содержащего сахарозу побочного продукта, образуемого в процессе производства сахара, относится к гидролизату, полученному путем подвергания дисахарида, олигосахарида, сахара и содержащего сахарозу побочного продукта, образуемого в процессе производства сахара, гидролитической обработке, такой как нагревание в кислотном растворе.
Компоненты среды для культивирования, отличные от источника углерода, могут быть такими же, как и компоненты хорошо известных сред для культивирования, используемых для культивирования бактерий, и предпочтительно содержат СМС. Конкретные примеры такой среды для культивирования могут включать общепринятые питательные среды для культивирования, содержащие СМС, источники азота, неорганические соли и, при необходимости, органические питательные микроэлементы, такие как аминокислоты и витамины. Примеры источника азота могут включать органические или неорганические источники азота, такие как аммониевые соли (например сульфат аммония, хлорид аммония и фосфат аммония), нитраты, мочевину или пептон. Примеры неорганической соли могут также включать фосфаты, соли магния, соли кальция, соли железа и соли марганца. Примеры органического питательного микроэлемента могут включать аминокислоты, витамины, жирные кислоты, нуклеиновые кислоты и, кроме того, пептон, казаминовые кислоты, дрожжевые экстракты и соевые белковые гидролизаты, содержащие питательные вещества. При использовании ауксотрофного мутанта, для роста которого требуются аминокислоты, могут дополнительно добавляться необходимые питательные вещества.
Бактерия особенно не ограничивается при условии, что она может продуцировать бактериальную целлюлозу; однако предпочтительной является бактерия, способная продуцировать бактериальную целлюлозу при культивировании при перемешивании или культивировании при аэрировании, более предпочтительна бактерия, ассимилирующая BDF-B. Ее конкретные примеры могут включать бактерии рода Acetobacter, рода Gluconacetobacter, рода Pseudomonas, рода Agrobacterium, рода Rhizobium и рода Enterobacter. Ее более конкретные примеры могут включать Gluconacetobacter intermedius, Gluconacetobacter hansenii, Gluconacetobacter swingsii, Acetobacter pasteurianus, Acetobacter aceti, Acetobacter xylinum, Acetobacter xylinum subsp. sucrofermentans, Acetobacter xylinum subs. nonacetoxidans, Acetobacter ransens, Sarcina ventriculi, Bacterium xyloides и Enterobacter sp.; однако среди них Gluconacetobacter intermedius является предпочтительной. Ее еще более конкретные примеры могут включать Gluconacetobacter intermedius штамм SIID9587 (штамм NEDO-01) (номер доступа NITE BP-01495), Gluconacetobacter xylinus штамм ATCC53582, Gluconacetobacter hansenii штамм ATCC23769, Gluconacetobacter xylinus штамм ATCC700178 (BPR2001), Gluconacetobacter swingsii штамм BPR3001E, Acetobacter xylinum штамм JCM10150 и Enterobacter sp. штамм CJF-002; среди них предпочтительным является Gluconacetobacter intermedius штамм SIID9587 (штамм NEDO-01) (номер доступа NITE BP-01495).
Способы культивирования могут включать, например, культивирование при перемешивании и культивирование при аэрировании. Конкретные примеры культивирования при перемешивании могут включать культивирование с использованием ферментера, не включающее аэрирование (культивирование при перемешивании и без аэрирования), культивирование с использованием ферментера, включающее аэрирование (культивирование при перемешивании и аэрировании), культивирование при качании из стороны в сторону, используя крыльчатую колбу (культивирование на качалке), и культивирование на ротационном шейкере, используя крыльчатую колбу (культивирование с вращением). Условия культивирования могут быть хорошо известными условиями культивирования, используемыми для культивирования вышеуказанных бактерий; их примеры могут включать следующие условия культивирования: величина аэрирования 1-10 л/мин, число вращений 100-800 оборотов в минуту, температура 20-40°C и период культивирования от 1 дня до 7 дней.
При продукции бактериальной целлюлозы в соответствии с настоящим изобретением может выполняться, в случае необходимости, стадия предварительной обработки источника углерода, стадия пре-прекультивирования, стадия очистки, сушки и суспендирования бактериальной целлюлозы, и т.п.
Бактериальная целлюлоза в соответствии с настоящим изобретением может использоваться, например, в качестве добавки к средствам для упрочнения бумаги, загустителям для пищевых продуктов, стабилизаторам суспензий и т.п.
Исходя из изложенного выше, бактерия в соответствии с настоящим изобретением продуцирует вышеописанную бактериальную целлюлозу. В случае бактерий, которые продуцируют бактериальную целлюлозу в соответствии с настоящим изобретением, компоненты, идентичные или соответствующие таковым бактериальной целлюлозы в соответствии с настоящим изобретением, не будут описываться снова.
Бактериальная целлюлоза в соответствии с настоящим изобретением и продуцирующая ее бактерия будут описаны ниже, основываясь на примерах. Однако технический объем настоящего изобретения, как предполагается, не ограничивается признаками, которые демонстрируют эти примеры.
ПРИМЕРЫ
Пример 1: выделение и идентификация бактерий
(1) Выделение бактерий
Были выделены бактерии, продуцирующие бактериальную целлюлозу в результате ассимиляции BDF-B. А именно используя представленный на фиг. 1 протокол, сначала выполняли обогатительное культивирование с использованием среды для культивирования, содержащей 2% (масс./об.) реагента глицерина (чистого для анализа реагента от Wako Pure Chemical Industries Ltd.) вместо глюкозы в стандартной среде для культивирования Hestrin-Schramm (имеющей состав: бактопептон - 0,5% (масс./об.), дрожжевой экстракт - 0,5% (масс./об.), Na2HPO4 - 0,27% (масс./об.), лимонная кислота - 0,115% (масс./об.), глюкоза - 2% (масс./об.); среде для культивирования HS) (среде для культивирования HS/с глицерином), используя яблоко и чернослив в качестве источников выделения. Получающиеся в результате бактерии засевали в среду для культивирования HS/с глицерином, содержащую реагент для окрашивания целлюлозы, и подвергали культивированию на чашках при 30°C, и отбирали 15 бактериальных штаммов, продуцирующих бактериальные целлюлозы. Впоследствии эти штаммы засевали в среду для культивирования LB (имеющую состав: трипсин - 1% (масс./об.), дрожжевой экстракт - 0,5% (масс./об.) и хлорид натрия - 0,5% (масс./об.)), содержащую 2% (масс./об.) реагента глицерина (чистого для анализа реагента от Wako Pure Chemical Industries Ltd.), и подвергали стационарному культивированию при 30°C, с образованием пленок в гелеобразной форме. Определяли сухую массу пленок в гелеобразной форме (ниже называемую «сухой массой пленки»), и в качестве бактерий, ассимилирующих глицерин и обладающих высокой способностью к продуцированию бактериальной целлюлозы, были отобраны 8 штаммов, в случае которых сухая масса пленки была большей. Затем эти штаммы засевали в среду для культивирования LB, содержащую BDF-B, и подвергали культивированию на чашках при 30°C, а в дальнейшем засевали в среду для культивирования HS и подвергали стационарному культивированию при 30°C, с образованием пленок в гелеобразной форме. Процесс отбора среди указанных бактерий бактериального штамма, в случае которого сухая масса пленки была большей, культивирование на чашках с использованием содержащей глицерин среды для культивирования LB или среды для культивирования HS/с глицерином и затем подвергание результирующего продукта стационарному культивированию в среде для культивирования HS повторяли для отбора одного бактериального штамма, обладающего способностью к ассимиляции BDF-B и обладающего высокой способностью к продуцированию бактериальной целлюлозы, который был назван штаммом SIID9587.
(2) Идентификация бактерий
Секвенирование выполняли в соответствии с обычным способом для штамма SIID9587 1(1) этого примера для определения нуклеотидной последовательности полноразмерной 16S рДНК (1367 п.о.; SEQ ID NO: 1). Впоследствии анализ нуклеотидной последовательности 16S рДНК и исследование бактериологических свойств проводили в TechnoSuruga Laboratory Co., Ltd.
[2-1] Анализ нуклеотидной последовательности 16S рДНК
Анализ нуклеотидной последовательности 16S рДНК проводили с использованием Aporon 2.0 (TechnoSuruga Laboratory Co., Ltd) в качестве программного обеспечения и Aporon DB-BA 6.0 (TechnoSuruga Laboratory Co., Ltd) и International Nucleotide Sequence Databases (GenBank/DDBJ/EMBL) в качестве баз данных. В результате поиска гомологии с использованием Aporon DB-BA 6.0 было установлено, что нуклеотидная последовательность 16S рДНК для штамма SIID9587 (SEQ ID NO: 1) обладает высокой степенью гомологии с нуклеотидной последовательности 16S рДНК для рода Gluconacetobacter и обладает наибольшей степенью гомологии с нуклеотидной последовательностью 16S рДНК для штамма TF2 G. intermedius (номер доступа: Y14694) (степень гомологии: 99,8%). В результате поиска гомологии с использованием GenBank/DDBJ/EMBL было также установлено, что нуклеотидная последовательность 16S рДНК для штамма SIID9587 (SEQ ID NO: 1) обладает высокой степенью гомологии с нуклеотидной последовательности 16S рДНК для рода Gluconacetobacter, и такая нуклеотидная последовательность для этого штамма, как было установлено, обладает высокой степенью гомологии с нуклеотидной последовательности 16S рДНК для штамма TF2 G. intermedius (номер доступа: Y14694) (степень гомологии: 99,8%). Последовательность с номером доступа Y14694 идентична последовательности с номером доступа NR_026435. Результаты сравнения между нуклеотидной последовательностью 16S рДНК для штамма SIID9587 и таковой для штамма TF2 G. intermedius (номер доступа: Y14694 или NR_026435) представлены на фиг. 2-1 и 2-2. Как показано на фиг. 2-1 и 2-2, обе последовательности отличались 4 нуклеотидами. При поиске гомологии с использованием Aporon DB-BA 6.0, в результате упрощенного молекулярного филогенетического анализа на основе нуклеотидных последовательностей 16S рДНК для верхних 15 штаммов, обладающих высокой степенью гомологии, было установлено, что штамм SIID9587 содержится в кластере, образованном видами рода Gluconacetobacter.
[2-2] Исследование бактериологических свойств
Результаты исследования бактериологических свойств представлены на фиг. 3. Как следует из фиг. 3, штамм SIID9587 отличался по свойству, касающемуся отсутствия роста в содержащей 5% уксусную кислоту среде для культивирования, от известного G. intermedius и не отличался по другим свойствам от него (BRENNER et al., Bergey’s manual of Systematic Bacteriology. Vol. 2. The Proteobacteria, Part C The Alpha-, Beta-, Delta-, and Epsilonproteobacteria. 2005. Springer. p. 72-77).
Вышеприведенные результаты (2) [2-1] и [2-2] этого примера 1 показали, что штамм SIID9587 относится к Gluconacetobacter intermedius. С другой стороны, было установлено, что штамм SIID9587 является новым штаммом G. intermedius, поскольку существуют различия по нуклеотидной последовательности 16S рДНК и бактериологическим свойствам между штаммом SIID9587 и штаммом TF2 Gluconacetobacter intermedius в качестве типового штамма для G. intermedius, описанного выше. Соответственно, этот бактериальный штамм был депонирован в National Institute of Technology and Evaluation, Patent Microorganisms Depositary (NITE-IPOD; #122, 2-5-8 Kazusakamatari, Kisarazu-shi, Chiba 292-0818, Япония) под входящим номером NITE BP-01495 21 декабря 2012 года.
(3) Определение продукта
Штамм NEDO-01 (штамм SIID9587 G. intermedius) подвергали предкультивированию для пролиферации бактериальных клеток. Впоследствии культуральную жидкость, полученную при прекультивировании (прекультуральную жидкость), добавляли в среду для культивирования HS (источник углерода: глюкоза), которую затем подвергали стационарному культивированию при 30°C в течение приблизительно 8 дней для выполнения основного культивирования с образованием пленки в гелеобразной форме на поверхности среды для культивирования. Спектр, полученный с использованием инфракрасной (ИК) спектроскопии, и рентгенодифракционный профиль пленки в гелеобразной форме получали и анализировали в соответствии с обычным способом. В результате было установлено, что пленкой в гелеобразной форме является целлюлоза с кристаллической структурой I типа. В результате получения и анализа изображения, полученного с помощью сканирующей электронной микроскопии в соответствии с обычным способом, было установлено, что целлюлозные волокна диаметром нанопорядка (целлюлозные нановолокна) образуют сетчатую структуру в пленке в гелеобразной форме. Исходя из этих результатов было подтверждено, что штамм NEDO-01 (штамм SIID9587 G. intermedius) продуцирует целлюлозу.
Пример 2: оценка продукта, полученного с помощью культивирования при аэрировании и перемешивании
(1) Приготовление продукта с помощью культивирования при аэрировании и перемешивании
BDF-B подвергали обработке для нейтрализации и в дальнейшем подвергали автоклавированию для обеспечения предварительно обработанного BDF-B.
Были приготовлены среды для культивирования, в которых реагент глицерин (чистый для анализа реагент от Wako Pure Chemical Industries Ltd.) добавляли вместо глюкозы в качестве источника углерода в среде для культивирования HS, содержащей 2% (масс./об.) СМС (со степенью чистоты химических реактивов от Wako Pure Chemical Industries Ltd.), и в которых предварительно обработанный BDF-B добавляли до концентрации, составляющей 2% (масс./об.) вместо глюкозы в содержащей СМС среде для культивирования HS, и они были названы средой для основного культивирования с глицерином и средой для основного культивирования с BDF-B, соответственно. Штамм NEDO-01 (G. intermedius штамм SIID9587) сначала подвергали прекультивированию для пролиферации бактериальных клеток. Затем прекультуральную жидкость засевали в 5 л каждой из среды для основного культивирования с глицерином и среды для основного культивирования с BDF-B и, используя ферментер, подвергали культивированию при аэрировании и перемешивании в течение 4 дней в следующих условиях: величина аэрирования 7-10 л/мин, число вращений 200-800 оборотов в минуту и температура 30°C для выполнения основного культивирования. Водный 1% (масс./об.) раствор NaOH добавляли к культуральной жидкости, полученной при основном культивировании (основной культуральной жидкости), которую затем встряхивали при 60°C и 80 оборотов в минуту в течение 4-5 часов для лизиса бактериальных клеток. После подвергания результирующего продукта центрифугированию супернатант удаляли с получением осадка для удаления водорастворимых компонентов бактериальных клеток. Процесс добавления к нему воды сверхвысокой чистоты, выполнения центрифугирования, а затем удаления супернатанта повторяли до тех пор, пока рН осадка во влажном состоянии не достигал 7 или менее, для очистки продукта, и результирующий продукт был назван содержащей ВС жидкостью, полученной при культивировании при перемешивании.
(2) Приготовление бактериальной целлюлозы с помощью стационарного культивирования
Пленку в гелеобразной форме получали с помощью способа, описанного в (3) примера 1 и отрезали часть размером приблизительно 1×1 см. Впоследствии к ней добавляли 1% (масс./об.) раствор NaOH в воде, который затем встряхивали при 60°C и 80 ударов/мин в течение 4-5 часов, а затем встряхивали в течение ночи при 20°C. Жидкость удаляли с помощью фильтрования, используя металлическую сетку для извлечения пленки в гелеобразной форме. Процесс добавления к ней воды сверхвысокой чистоты и встряхи