Способ лазерной абляции патологической области сердца
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к сердечно-сосудистой хирургии, и может быть использовано для абляции области патологического возбуждения сердечной мышцы. Вводят пространственно-управляемый катетер во внутреннюю область правого или левого предсердия или желудочков сердца через бедренную или подключичную вену под рентгеновской или МРТ визуализацией. Осуществляют пространственное электрофизиологическое картирование внутренней поверхности сердца для обнаружения областей аритмий с помощью управляемого извне наконечника катетера с электродом. Осуществляют контактное измерение локальных электрических потенциалов сердечной мышцы и облучение области патологического возбуждения сердечной мышцы электромагнитным излучением. В качестве электромагнитного излучения используют лазерное излучение в области прозрачности сердечной биоткани, соответствующей ближнему ИК диапазону от 700 нм до 1350 нм. Излучение вводят в кварцевый оптический световод, вставленный в пространственно- управляемый катетер. Уровень вводимой лазерной энергии определяют по исчезновению локальной области патологических электрических пульсаций сердечной мышцы. Используют непрерывный лазерный режим с мощностью на выходном торце катетера не более 1 Вт или импульсный лазерный режим со средней оптической мощностью, соответствующей непрерывному режиму. Длительность лазерного импульса не более 10 наносекунд при скважности не менее десяти. Время облучения не более одной минуты. Способ обеспечивает управляемое подавление локальных областей самовозбуждающихся миоцитов при минимальном повреждении нормальных клеток миокарда. 6 ил.
Реферат
Изобретение относится к медицине, в частности к сердечно-сосудистой хирургии для подавления локальных пространственных аритмий в клетках миокарда с помощью управляемой лазерной абляции патологических самовозбуждающихся клеток миокарда при введении катетера с оптическим волокном через бедренную или ключичную вену во внутреннюю полость сердца и облучении лазерным излучением с определенной длиной волны с выбранным уровнем мощности и времени облучения из выходного торца катетера предварительно определенной с помощью электрофизиологического катетера локальной патологической области сердечной мышцы до подавления источника возникновения локальной аритмии.
Известен способ подавления аритмии на основе криотехнологии при использовании жестких многоразовых электродов на основе закиси азота (охлаждение -89,5°C) или гибких одноразовых на основе аргона (охлаждение до -185,7°C), (см. патент РФ на ИЗ № 2197917, МПК A61B18/12, A61B18/18, опубликован 10.02.2003 г.; Бокерия Л.А., Бокерия О.Л., Биниашвили М.Б. «Случай успешного хирургического лечения фибрилляции предсердий с помощью криомодификации операции «Лабиринт»» // Бюллетень медицинских Интернет-конференций (ISSN 2224‐6150) 2013. Том 3. № 3; Tse H._F., Sin P._Y., Siu C._W., Tsang V., Lam C.L.K.,Lau C._P. Successful pulmonary vein isolation using transvenous catheter cryoablation improves quality of life in patients with atrial fibrillation // PACE. 2005. V. 28. P. 421–424).
Однако для локального повреждающего действия, необходимое время аппликации составляет 2-3 минуты, при этом на работающем сердце эпикардиальное криовоздействие имеет низкую пенетрирующую способность, ввиду согревающего эффекта циркулирующей крови. Кроме того, операция выполняется на открытом сердце.
Известен способ подавления фибрилляции предсердий, основанный на подведении к сердечному устью легочной вены через нижнюю полую вену специального ультразвукового катетера. Основными компонентами указанного катетера являются цилиндрический пьезопреобразователь и надувной параболический рефлектор. Действие устройства основано на создании фокусированного пучка высокоинтенсивного ультразвука с фокальной областью в виде кольца, совмещенного со стенкой легочной вены в месте ее входа в сердце. В результате ультразвукового воздействия возникает тепловое разрушение стенки сосуда и, как следствие, устраняется паразитная электрическая проводимость ткани, благодаря чему подавляется источник возникновения аритмий (Е.Д. Синельников, Т. Филд, О.А. Сапожников, «Закономерности формирования зоны термического разрушения при лечении фибрилляции предсердий катетерным методом ультразвуковой абляции» // Акустический журнал, 2009, том 55, № 4–5, с. 641–652).
Однако возникающая ультразвуковая кавитация, вследствие нелинейности процесса, может приводить к трудно контролируемой области нагрева сердечных биотканей несмотря на технологию сфокусированного ультразвукового пучка.
Известен способ чрескожной стереотаксической ризотомии. Технология заключается во введении в вену катетера, содержащего изолированный проводник электрического тока, и под рентгеновской визуализацией подведение катетера в область к локальной области центра возбуждения сердечной мышцы. Под воздействием импульсов тока локальная область сердечной мышцы деструктурируется и происходит подавление локальной аритмии («Аритмия сердца» // Под.ред. В.Дж. Мандела. М.: Медицина,1996, том 3. Глава 9. С. 301-315).
Однако при таком способе подавления сердечных аритмий, как показывает медицинская практика, возможно неконтролируемое патологическое возбуждение других областей сердечной мышцы, вызывающее трепетание предсердий или желудочков сердца и требующее введение искусственного водителя ритма.
Известен способ микроволновой абляции биотканей сердца, основанный на воздействии излучения электромагнитных волн на частоте 915 МГц или 2450 МГц, вызывающих осцилляцию молекулярных диполей в биоткани, приводящую к диэлектрическому нагреванию ткани. Однако на данных частотах невозможно осуществить локальный нагрев тканей сердца, так как длина волны излучения составляет 30-10 см. Электромагнитные волн от внешнего СВЧ генератора можно доставить с помощью волноводов или коаксиальных электрических кабелей, но только при операциях на открытом сердце.
Известны способы радиочастотной катетерной абляции патологических клеток миокарда (Haines D.E. «The biophysics of radiofrequency catheter ablation in the heart: the importance of temperature monitoring» // Pacing Clin Electrophysiol 1993. Mar. 16(3 Pt 2):586-91; Dong, J. «Initial experience in the use of integrated electroanatomic mapping with three-dimensional MR/CT images to guide catheter ablation of atrial fibrillation» / J. Dong, T. Dickfeld, D. Dalal et al. // J. Cardiovasc. Electrophysiol. – 2006. – Vol. 17. – P. 459–466; Ардашев А.В., Желяков Е.Г., Долгушина Е.А. «Радиочастотная катетерная абляция хронической формы фибрилляции предсердий методом изоляции легочных вен и анатомической модификации субстрата аритмии» // М.С.Кардиология, 2008, № 12, с. 40-48; патент РФ № 2443390, МПК A61B5/00, опубликован 27.02.2012 г.).
Наиболее близким к заявляемому решению является способ катетерной радиочастотной абляции патологических клеток миокарда, вызывающих локальные аритмии в сердечной мышце, описанный в статье «Диагностика и лечение фибрилляций предсердий. Рекомендации Российского кардиологического общества» // Российский кардиологический журнал, 2013, № 4, Приложение с. 1-99. Способ включает введение гибкого катетера через бедренную или ключичную вену при рентгеновской или МРТ визуализации катетера во внутреннюю область предсердия, пространственное электрофизиологическое картирование внутренней поверхности сердца для обнаружения областей аритмий с помощью пространственно-управляемого наконечника катетера с микроэлектродом для контактного измерения локальных потенциалов возбуждения, поиск и обнаружение областей локальных аритмий, облучение этих пространственных областей патологического возбуждения сердечной мышцы непрерывным электромагнитным излучением, выбранным из диапазона от 100 кГц до 3 МГц с типичным уровнем ВЧ мощности 30-40 Вт, повышающим локальную температуру облучаемых клеток миокарда до 50-56 градусов Цельсия и вызывающих коагуляционный некроз с образованием рубца, не обладающего свойством электрической проводимости в облучаемых клетках миокарда.
Радиочастотная энергия вызывает разрушение клеток миокарда в месте воздействия высокочастотного переменного электрического тока через резистивную среду (миокард). Тканевое сопротивление приводит к рассеянию энергии с образованием тепла, пассивно диффундирующего в более глубокие слои сердечной биоткани.
Однако резистивный нагрев тканей возникает только в непосредственной близости от излучающего конца катетера при монополярном высокочастотном (ВЧ) воздействии с характерной пространственной областью около одного кубического миллиметра, а более глубокие ткани нагреваются посредством трудно контролируемой диффузной теплопроводности в сердечной биоткани. Ограничение ВЧ мощности и соответственно температуры воздействия, контроль за образованием микропузырьков пара на конце катетера посредством внутрисердечной эхокардиографии и охлаждение в зоне воздействия посредством применения катетеров, орошаемых физраствором, позволяют минимизировать тромбообразование и обугливание электродов и тканей в месте контакта («Экспертный консенсусный документ Общества нарушений сердечного ритма (HRS/EHRA/ECAS) по катетерной и хирургической абляции фибрилляций предсердий», 2012).
В случае биполярного радиочастотного воздействия ткань нагревается только между двумя электродами без риска воздействия на окружающие ткани, однако данный метод применяется только на открытом сердце.
Катетерная радиочастотная абляция сформировалась как метод подавления сердечных аритмий в начале 90 годов прошлого века, а в настоящее время является наиболее эффективным методом, который позволяет успешно лечить практически все виды аритмии, включая мерцательную аритмию, трепетание и фибрилляцию предсердий и желудочков сердца. Однако эта процедура является довольно продолжительной (4–8 часов) и, как любая длительная операция на сердце, потенциально опасной для жизни пациента. Кроме того, при проведении указанной процедуры требуется задействовать разнообразные навигационные технические средства для точной ориентации катетера в сердце. Одним из наиболее опасных осложнений при радиочастотной абляции является стеноз легочной вены из-за трудноконтролируемого термического воздействия, что в конечном итоге приводит к сердечной недостаточности и инсульту. По этим причинам радиочастотная абляция как пароксизмальной, так и хронической фибрилляции в наши дни проводится лишь в ограниченном числе ведущих клиник США и других развитых стран.
Задачей изобретения является создание лазерной технологии управляемой локальной абляции патологических клеток миокарда, которые являются источником аритмий и предлагаемая технология может быть использована для локального необратимого подавления центров электрического самовозбуждения клеток миокарда на основе локального лазерного облучения не только внутренней поверхности сердца, но при выборе длины волны излучения лазера из окна прозрачности биотканей, реализация возможности контролируемым образом изменять температуру в объеме сердечной биоткани, включая миоциты на внешней поверхности сердца. Кроме того, нагрев миоцитов можно осуществлять не только при непрерывном лазерном воздействии, но и используя импульсные режимы облучения, вызывающие большую пространственную локальность при функциональной инактивации патологических миоцитов. При этом лазерное излучение доставляется к патологической области сердца через оптический световод, вставленный в стандартный катетер, используемый в технологии ВЧ абляции, который вводится в бедренную или ключичную вену, что делает операцию малоинвазивной.
Технический результат заключается в возможности управляемого подавления локальных областей самовозбуждающихся миоцитов, ответственных за возникновение аритмий в объеме сердечной мышцы, вследствие лазерного фототермолиза этих патологических клеток при минимальном повреждении нормальных клеток миокарда при использовании недорогой лазерной волоконно-оптической технологии.
Поставленная задача решается тем, что в способе катетерной абляции патологических клеток сердца, вызывающих локальные пространственные аритмии, включающем введение катетера через бедренную или ключичную вену при рентгеновской или МРТ визуализации пространственно-управляемого катетера во внутреннюю область правого или левого предсердия или желудочков сердца, пространственное электрофизиологическое картирование внутренней поверхности сердца для обнаружения областей аритмий с помощью управляемого извне наконечника катетера с электродом, определяемое с помощью контактного измерения локальных электрических потенциалов миокарда, и облучение области патологического возбуждения сердечной мышцы электромагнитным излучением, согласно изобретению, в качестве электромагнитного излучения выбирается лазерное излучение в области прозрачности сердечной биоткани, соответствующей ближнему ИК диапазону (700 нм-1550 нм), в зависимости от требуемой глубины фототермолиза патологических клеток миокарда в сердечной мышце, которое вводят в кварцевый оптический световод, вставленный в пространственно-управляемый катетер, а уровень вводимой лазерной энергии определяют по исчезновению локального центра патологических электрических пульсаций клеток миокарда, при этом лазерная мощность на выходном торце катетера не превышает 1 Вт, а время локального облучения не более одной минуты.
Для уменьшения локального пространственного 3D облучения по глубине нормальных клеток миокарда используют импульсный лазерный режим со средней оптической мощностью, соответствующей непрерывному режиму, и длительностью лазерного импульса не более 10 наносекунд при скважности не менее десяти.
Изобретение поясняется чертежами:
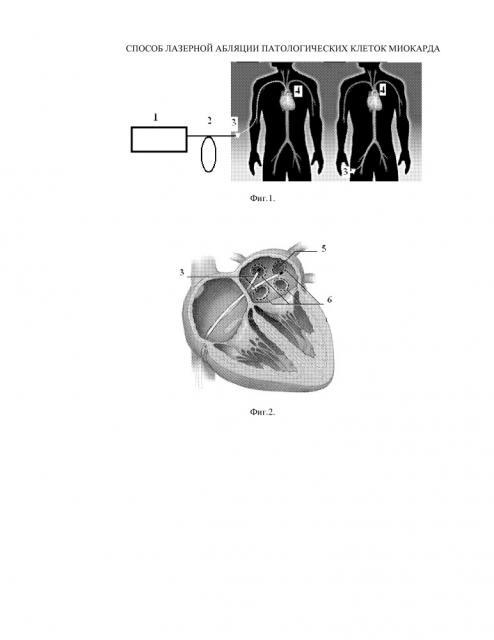
На фиг.1. показана блок-схема установки для подавления локальных пространственных аритмий в клетках миокарда с помощью управляемой лазерной абляции патологических самовозбуждающихся клеток миокарда, где:
1 - полупроводниковый или твердотельный лазер;
2 - кварцевый оптический световод;
3 - пространственно-управляемый катетер, содержащий внутри себя дополнительный кварцевый оптический световод;
4 - сердце пациента с введенными в предсердие или желудочки катетерами 3;
5 - устье легочной вены;
6 - пространственная зона патологической пульсации миоцитов.
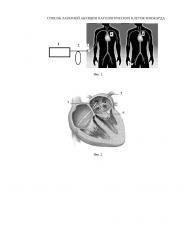
Фиг.2. Внутренняя структура сердца с введенными в предсердие или пространственно-управляемыми катетерами, содержащими внутри кварцевый оптический световод.
Фиг.3. 2D термограммы динамики температурных полей при облучении ИК лазерным излучением полупроводникового лазера с длиной волны 810 нм, работающим в непрерывном режиме с выходной оптической мощностью на торце световода 1 Вт и расстоянии 1 см до сердечной мышцы крысы in vivo: а - до облучения; б – спустя 5 сек; в - спустя 40 сек; (масштаб по оси ординат 3 см).
Фиг.4. Динамика максимального лазерного нагрева сердечной мышцы крысы in vivo при облучении ИК излучением 1 Вт 810 нм, работающим в непрерывном режиме (расстояние от торца световода до поверхности сердца 2 см).
Фиг.5. Динамика температурных полей по глубине сердечной мышцы крысы in vitro при облучении ИК лазерным излучением с длиной волны 810 нм, работающим в непрерывном режиме с выходной оптической мощностью на торце световода 1 Вт, находящейся на расстоянии 1 см от сердечной мышцы: г - 0; д - 10 сек; е - 20 сек; ж – 1 мин.
Фиг.6. Динамика максимального лазерного нагрева и остывания сердечной мышцы крысы in vitro при облучении ИК излучением 1 Вт 810 нм, работающим в непрерывном режиме.
Устройство содержит полупроводниковый или твердотельный лазер 1, соединенный с кварцевым оптическим световодом 2. Выход оптического световода 2 через оптический разъем соединен с гибким пространственно-управляемый катетером 3, традиционно используемым в технологии радиочастотной катетерной абляции, но содержащим внутри себя дополнительный кварцевый оптический световод (на чертеже не показан).
Способ осуществляется следующим образом.
Человеку или животному через бедренную или ключичную вену вводят гибкий пространственно-управляемый катетер 3 (стандартная биомедицинская технология, как при радиочастотной катетерной абляции). С помощью рентгеновской или МРТ визуализации пространственно-управляемый катетер 3 вводят во внутреннюю область правого или левого предсердия 4 или желудочков сердца. Выполняют пространственное электрофизиологическое картирование внутренней поверхности сердца для обнаружения областей аритмий 6 с помощью управляемого извне наконечника катетера 3 с электродом, определяемое с помощью контактного измерения локальных электрических потенциалов миокард. Типичным пространственным местом в сердечной мышце, где возникают источники нерегулярных самовозбуждающихся волн в 3 D объеме сердечной биоткани, является устье легочной вены 5. Затем через оптический разъем присоединяют оптический световод 2, во входной конец которого вводят оптическое излучение лазера 1 с длиной волны, выбранной из ближнего ИК диапазона (700-1550 нм). Далее устанавливают уровень лазерной мощности не более 1 Вт, облучают область патологического возбуждения сердечной мышцы лазерным излучением в течение времени, соответствующего исчезновению аритмии в локально облучаемой области. Исчезновение аритмии обусловлено пространственным повышением температуры клеток миокарда до температуры выше 44, но не более 56 градусов Цельсия, вызывающей функциональное подавление проводимости облученных клеток миокарда при минимальном поражении сердечной мышцы.
Основное преимущество предлагаемого способа над наиболее эффективным способом радиочастотной абляции подавления локальных аритмий заключается в возможности управления 3D температурными полями в облучаемой области с помощью лазерного излучения из торца оптического световода, расположенного в пространственно-управляемом катетере, введенном во внутренние полости сердца.
Для подтверждения заявляемых положений нами были проведены эксперименты на сердце лабораторных крыс для определения 2D температурных полей по поверхности сердечной мышцы, подверженной лазерному облучению с конца оптического световода in vivo, а также распределение 3D температурных полей в сердечной мышце in vitro (фиг.3-6). Анализ проведенных и частично представленных экспериментальных результатов показывает, что выбором режимов излучения лазера, в частности: выходной лазерной мощности, плотности мощности, времени облучения, возможно управление динамикой 3D локального пространственного нагрева миоцитов, в то время как в методе радиочастотной абляции возможно регулирование только выходной мощности радиочастотного генератора не более 30 Вт и времени облучения типично не более 1 минуты на одну пространственную точку внутри области сердца, при этом максимальная температура возникает на металлическом конце зонда, который касается внутренней полости сердца, а далее температурные поля устанавливаются за счет термодиффузии. Однако в современной электрофизиологии сердца известно, что самовозбуждающиеся миоциты, являющиеся источником аритмий, возникают на внешней поверхности сердца. Использование лазерного излучения из так называемого окна прозрачности биотканей в ближней ИК области (700-1550 нм), где слабое поглощение гемоглобина эритроцитов возможно эффективное проникновение лазерного излучения до одного сантиметра, позволяет управлять температурой сердечной мышцы и в глубине. При этом важно, что процесс остывания составляет менее нескольких секунд, в отличие от теплового нагрева при радиочастотной абляции. Спектральная область ограничена снизу сильным поглощением в сине-зеленой области молекулами гемоглобина крови, а сверху резонансными колебаниями молекулы воды и их гармониками. Как показали эксперименты при использовании импульсных лазерных режимов облучения, можно добиться большей пространственной локальности температурных полей и соответственно более щадящего режима фототермолиза миоцитов.
Параметры лазерного непрерывного и импульсного воздействия определялись экспериментально на фантомах биоткани сердца и in vivo на открытом сердце крысы, при последующем гистологическом анализе. Необходимая лазерная энергия, время облучения каждой пространственной области патологических миоцитов и минимальная длительность лазерного импульса ограничивались условиями, указанными в формуле изобретения.
Таким образом, лазерная абляция обладает управляемым локальным нагревом не только 2D поверхности клеток сердца, но и локальным фототермолизом сердечных патологических 3D миоцитов при минимальном повреждении нормальных миоцитов в сердечной мышце.
Способ абляции патологической области сердца, включающий введение катетера через бедренную или подключичную вену при рентгеновской или МРТ визуализации пространственно-управляемого катетера во внутреннюю область правого или левого предсердия или желудочков сердца, пространственное электрофизиологическое картирование внутренней поверхности сердца для обнаружения областей аритмий с помощью управляемого извне наконечника катетера с электродом, определяемое с помощью контактного измерения локальных электрических потенциалов сердечной мышцы, и облучение области патологического возбуждения сердечной мышцы электромагнитным излучением, отличающийся тем, что в качестве электромагнитного излучения используют лазерное излучение в области прозрачности сердечной биоткани, соответствующей ближнему ИК диапазону от 700 нм до 1350 нм, которое вводят в кварцевый оптический световод, вставленный в пространственно-управляемый катетер, при уровне вводимой лазерной энергии, определяемой по исчезновению локальной области патологических электрических пульсаций сердечной мышцы, при этом используют непрерывный лазерный режим с лазерной мощностью на выходном торце катетера не более 1 Вт, или импульсный лазерный режим со средней оптической мощностью, соответствующей непрерывному режиму, и с длительностью лазерного импульса не более 10 наносекунд при скважности не менее десяти, а время облучения не более одной минуты.