Способ определения жесткости природных вод
Иллюстрации
Показать всеИзобретение относится к физико-химическим способам анализа природных вод. Способ определения жесткости природных вод включает этапы, на которых осуществляют определение концентрации мг⋅экв/л ионов Са2+, Mg2+, при этом процесс определения концентрации ионов кальция, магния предусматривает измерение удельной электропроводности от 3 до 20 мкА/см3 сильно разбавленных природных вод с содержанием ионов кальция, магния меньше 0,3 мг⋅экв/л с использованием градуировочного графика, с которого считывается концентрация ионов кальция, магния по численному значению удельной электропроводности природных вод. Технический результат – повышение точности, исключение использования химических реактивов, значительное ускорение и упрощение определения концентрации ионов Са2+, Mg2+ в природных водах. 3 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к физико-химическим методам анализа природных вод в водоканалах при подготовке питьевых вод.
Уровень техники
Природные воды характеризуются содержанием в них ионов Са2+, Mg2+, Na+, НСО3-, CO32-, Cl-, SO42- и др. газов О2, N2, CO2 и др. Жесткость природных вод обусловлена содержанием в них ионов Са2+ и Mg2+.
Растворенный в воде углекислый газ в зависимости от рН среды находится в равновесии с ионами HCO3- и ионами CO32-. В природных водах устанавливается динамическое равновесие, которое описывается обратимой реакцией
.
Значение рН 6,5-8,5 большинства природных вод обусловлено содержанием в них ионов HCO3-. Ионы НСО3- содержатся во всех водах, кроме вод с рН ниже 4.
Для устойчивости ионов НСО3- в воде необходимо содержание равновесного CO2. Содержание ионов СО32- в природных водах при наличии ионов Са2+ невелико вследствие малой растворимости CaCO3 (ПР=5⋅10-9). Ион Са2+ главный ион в маломинерализованных природных водах.
Жесткость природных вод выражают числом миллиграммов или миллиграмм эквивалентов ионов Са2+ и Mg2+ в 1 л воды. Различают карбонатную (временную) и некарбонатную (постоянную) жесткость, сумма которых равна общей жесткости воды.
Карбонатная жесткость обусловлена содержанием в воде гидрокарбонатов кальция и магния, т.е. карбонатная жесткость - это количество ионов Са2+ и Mg2+, связанное HCO3- ионами. Эквивалентная концентрация ионов HCO3- равна сумме эквивалентных концентраций катионов Са2+ и Mg2+.
Некарбонатная жесткость воды обусловлена содержанием в природных водах солей хлоридов и сульфатов кальция и магния.
По величине общей жесткости Ho природные воды характеризуют следующим образом:
В природных водах концентрация магниевых солей обычно меньше концентрации кальциевых солей. Общая жесткость природной питьевой воды должна быть не более 8 мг⋅экв/л.
Для определения концентрации ионов кальция и магния в природных водах используют комплексонометрический метод и метод атомной спектрометрии. Комплексонометрический метод основан на образовании ионами Са2+ и Mg2+ прочных этилендиаминтетраацетатных (ЭДТА) комплексов.
Недостатки метода: определению могут мешать некоторые органические вещества и ионы других металлов. Требуется приготовление титровянного раствора ЭДТА и использование индикаторов эриохрома и мурексида. Погрешность определения концентрации ионов Са2+, Mg2+ составляет ±10%.
Методом атомной спектрометрии определяют поглощение каждого элемента при аналитической длине волны для кальция 422,7 нм, для магния 285,2 нм.
Недостатки метода: высокая стоимость определения концентрации ионов кальция, магния, ограниченная возможность широкого использования метода.
Раскрытие изобретения
Технической задачей предлагаемого изобретения является создание нового амперометрического способа определения концентрации ионов Са2+, Mg2+ в природных водах. Амперометрический способ основан на измерении удельной электропроводимости сильно разбавленных природных вод.
Поставленная задача решается при использовании постоянного электрического тока. В данном случае способность природных вод проводить электрический ток характеризуется концентрацией электрического тока, т.е. концентрацией электронов, переносимых через 1 см3 воды при напряжении электрического поля в 1 В при 20°C.
выражается в А/см3. Следовательно, концентрация электрического тока, т.е. плотность электрического тока А/см3, является единицей измерения удельной электропроводности δ, которая соответствует физической природе электропроводности воды, δ А/см3.
Описание чертежей
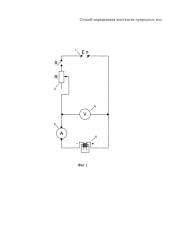
На фиг. 1 представлена схема установки для измерения электропроводности природных вод на постоянном электрическом токе:
1 - батарея на 4 В;
2 - магазин электрического сопротивления на 1000 Ом;
3 - микроамперметр постоянного тока на 50 мкА;
4 - вольтметр постоянного тока на 3 В;
5 - электролитическая ячейка из стекла со съемными медными электродами.
При этом использовали электролитическую ячейку из стекла со съемными медными электродами, изготовленными из гладкой листовой меди. Площадь поверхности электрода S=1 см2, расстояние между электродами L=1 см, постоянная ячейки С=1 см-1.
Погрешность измерения электропроводности в ячейке ±2,5%. Электролитическая ячейка работает в режиме электронной электропроводности воды. Электронную электропроводность следует характеризовать концентрацией электронов, переносимых через 1 см3 воды, заключенной между электродами в ячейке, т.е. концентрацией электрического тока при напряженности электрического поля в 1 В при 20°C. Единица измерения удельной электропроводности δ, мкА/см3.
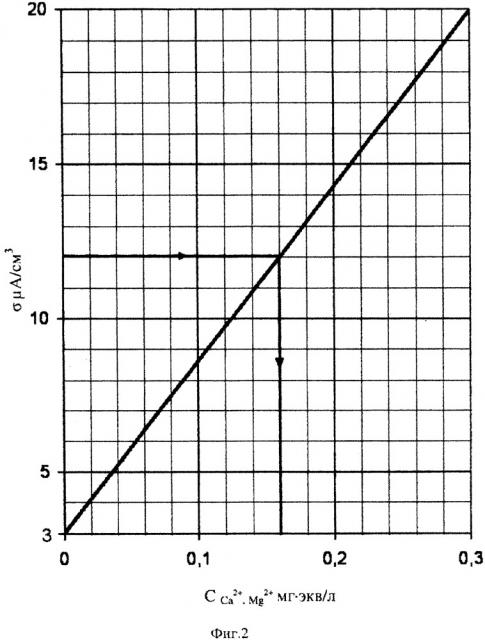
На фиг. 2 представлен градуировочный график измеренной удельной электропроводности стандартных водных растворов солей CaCl2 и MgSO4. Эквивалентная концентрация ионов Са2+, ионов Mg2+ и суммы Σ(1/2 Са2++1/2 Mg2+) в приготовленных стандартных водных растворах составила, мг⋅экв/л: 0,1; 02; 0,3.
Для данных сильно разбавленных водных растворов с ионной силой J<10-4 М коэффициент активности fi равен 1. Следовательно, активность ионов Са2+ и Mg2+ равна аналитической концентрации ионов:
ai=ci.
В водных растворах соли, содержащие ионы Са2+, Mg2+ не подвергаются гидролизу.
Для измерения электропроводности водных растворов использовали амперометрический способ.
Из фиг. 2 видно, что под воздействием приложенного электрического поля в 1В при 20°C для ячейки (-)Cu (раствор) Cu(+) с увеличением концентрации ионов Са2+, Mg2+ до 0,3 мг⋅экв/л удельная электропроводность повышается прямолинейно от 3 до 20 мкА/см3.
При этом удельная электропроводность дистиллированной воды равна 3 мкА/см3.
Таким образом, построенный градуировочный график можно использовать для амперометрического определения эквивалентной концентрации мг⋅экв/л, ионов Са2+, Mg2+ с содержанием их в сильно разбавленной природной воде меньше 0,3 мг⋅экв/л.
На фиг. 3 представлен фрагмент структуры цепи молекул H2O с атомом кальция и атомом магния. В исследуемых природных водах вследствие энергии электростатического взаимодействия все ионы кальция и магния присоединяются к цепям молекул H2O. В цепях молекул H2O на атомах H, Ca, Mg сосредоточены положительные электрические заряды с пониженной непрерывной электронной плотностью.
Разрешенный объем, занятый атомами Н, Са, Mg в цепях молекул H2O, является зоной проводимости электронов. Такая структура допускает свободный перенос электронов от источника постоянного электрического тока через атомы Н, Са, Mg в приложенном электрическом поле природной воды.
Осуществление изобретения
Ход определения жесткости природных вод.
Перед анализом измеряют рН природной воды, чтобы определить кислотно-основные свойства, которые обусловлены содержанием НСО3- ионов. В природных водах в области рН 6,5-7,5 основными компонентами являются CO2 и НСО-3 - ионы, в области рН 7,5-8,5 присутствуют, главным образом НСО-3 - ионы.
Пробу воды разбавляют дистиллированной водой до тех пор пока удельная электропроводность не окажется меньше 20 мкА/см3. При этом эквивалентная концентрация ионов Са2+, Mg2+ должна быть меньше 0,3 мг⋅экв/л (см. фиг. 2). Величина разбавления воды может быть от 1:10 до 1:100 и более.
Перед каждым измерением электроды промывают дистиллированной водой и протирают фильтровальной бумагой. Поверхность электродов должна быть чистой и сухой. Зачищать электроды наждачной бумагой запрещено, чтобы не нарушить оксидную фазовую пленку меди (эвтектику Cu-Cu2O).
Продолжительность измерения удельной электропроводности после погружения электродов в воду 10 мин. Это время упорядоченного, параллельного расположения цепей молекул H2O вдоль силовых линий приложенного электрического поля.
Через 10 мин от начала измерения считывают концентрацию ССа2+, Mg2+ мг⋅экв/л с градуировочного графика по измеренному значению удельной электропроводности δ, мкА/см3 (см. фиг. 2). Далее определяют общую жесткость воды по формуле
Ho=С Са2+, Mg2+⋅D мг⋅экв/л,
где D - величина разбавления пробы воды.
Определению концентрации ионов Са2+, Mg2+ не мешает ничтожно малое содержание ионов других металлов.
Определение карбонатной жесткости Нк природных вод по содержанию ионов
НСО3-.
При анализе воды в расчетах обычно пользуются следующими соотношениями: 100 мл воды титруют 0,1 N раствором HCl (индикатор - метиловый оранжевый) 1 мл 0,1 N раствора HCl соответствует 1 мг⋅экв/л HCO3-. Число мл 0,1 N раствора HCl=Нк мг⋅экв/л.
Некарбонатная жесткость Нн воды обусловлена содержанием в воде других солей кальция и магния, например сульфатов, хлоридов и др.
Некарбонатную жесткость природной воды определяют по формуле
Нн=Но-Нк мг⋅экв/л.
Способ определения жесткости природных вод, включающий определение концентрации мг⋅экв/л ионов Са2+, Mg2+, отличающийся тем, что процесс определения концентрации ионов кальция, магния предусматривает измерение удельной электропроводности от 3 до 20 мкА/см3 сильно разбавленных природных вод с содержанием ионов кальция, магния меньше 0,3 мг⋅экв/л с использованием градуировочного графика, с которого считывается концентрация ионов кальция, магния по численному значению удельной электропроводности природных вод.