Соли и кристаллические формы
Иллюстрации
Показать всеИзобретение относится к солям и кристаллическим формам (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты, где соль выбрана из группы, состоящей из калевой соли и меглюминовой соли, а также к фармацевтической композиции на основе этих соединений для лечения заболеваний, опосредованных ингибитором циклооксигеназы-2, способу ее получения и ее применению. Эти соединения показывают хорошие свойства, такие как высокая растворимость в воде, хорошая истинная растворимость, хорошая степень кристалличности, хорошая термостабильность и низкая гигроскопичность. 6 н. и 5 з.п. ф-лы, 10 ил., 1 табл., 12 пр.
Реферат
Область техники
Настоящее изобретение относится к солям и кристаллическим формам (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты, являющейся ингибитором циклооксигеназы-2, где в настоящем описании соединение может называться соединением A.
Уровень техники
Простагландины играют основную роль в воспалительном процессе, и ингибирование производства простагландина, в особенности производства PGG2, PGH2 и PGE2, является общей целью исследования противовоспалительного лекарственного средства. Однако типичные нестероидные противовоспалительные средства (НПВС), проявляющие активность по ослаблению простагландин-индуцированной боли и отека, связанного с воспалительным процессом, также играют активную роль в оказании воздействия на другие регулируемые простагландином процессы, не связанные с воспалительным процессом. Таким образом, использование высоких доз общеизвестных НПВС может вызвать тяжелые побочные эффекты, включая опасные для жизни язвы, что ограничивает их терапевтический потенциал. Альтернативой НПВС является использование кортикостероидов, которые оказывают еще более существенные побочные эффекты, в особенности при проведении длительной терапии.
НПВС предотвращают производство простагландинов посредством ингибирования ферментов в пути обмена арахидоновой кислоты/простагландина человека, включая фермент циклооксигеназы (COX). Экспрессия циклооксигеназы-2 (COX-2) в особенности индуцируется при патологических состояниях, таких как воспаление, боль и злокачественная опухоль, и участвует в образовании и поддержании этих условий. В соответствии с этим направлением была разработана серия лекарственных средств под названием коксибы, такие как целекоксиб, рофекоксиб, валдекоксиб, парекоксиб и эторикоксиб.
Соединение A описано в патентной литературе 1 и избирательно ингибирует циклооксигеназу-2, нежели циклооксигеназу-1. Соединение A обеспечивает более сильнодействующую анальгезию, чем ибупрофен, являющийся наиболее оптимальным из числа общепринятых лекарственных средств. Кроме того, в ходе доклинических исследований подтвердилось, что соединение A вызывает меньше проблем с почками, которые являются волнующим вопросом при использовании общепринятых ингибиторов COX-2 и НПВС.
Лекарственные средства коксибы пригодны для лечения заболеваний, опосредованных циклооксигеназой-2, таких как воспаление, боль, злокачественная опухоль, лихорадка, остеоартрит, ревматоидный артрит, мигрень, нейродегенеративные заболевания, сердечно-сосудистое заболевание, остеопороз, астма, волчанка и псориаз, дисменорея, преждевременные роды, глаукома, подагра, анкилозирующий спондилит, бурсит, термический ожог, растяжение связок и закрытая травма.
В основном, активные ингредиенты, включенные в состав коксибов, имеют сульфонамидную группу, в то время как соединение A имеет уникальную химическую структуру, в которой отсутствует как сульфонамидная группа, так и алкилсульфонильная группа, но в которой присутствует группа карбоновой кислоты. Далее в настоящем описании такие препараты-коксибы или соединения-коксибы, не имеющие ни сульфонамидной группы, ни алкилсульфонильной группы, но имеющие группу карбоновой кислоты, именуются препаратами-коксибами третьего поколения или соединениями-коксибами третьего поколения. Так как соединение A имеет в своей химической структуре группу карбоновой кислоты, его растворимость в среде с низким уровнем pH ниже, чем в нейтральных или щелочных условиях. Таким образом, в зависимости от периода нахождения в желудке, проблема растворимости может вызвать осаждение соединения с последующей недостаточной абсорбцией, приводя к уменьшению концентрации в крови и биодоступности. Эти нежелательные явления наблюдают при общеизвестных препаратах-коксибах третьего поколения или соединениях-коксибах третьего поколения, указанных в настоящем описании.
Фактически, согласно полученным результатам клинических исследований, при введении соединения A по настоящему описанию в стандартной таблетированной форме, первоначальная концентрация в крови после введения была низкой по сравнению с введением в виде раствора (в форме порошка для приготовления раствора для перорального применения, в котором легко растворяется активный ингредиент).
Исходя из этих данных, было проведено исследование способа обеспечения фармацевтической композиции, содержащей ингибитор циклооксигеназы-2, при котором стабильность и/или растворимость повышаются. А именно, в патентной литературе 2 описана «новая инъекционная фармацевтическая композиция, содержащая по меньшей мере один ингибитор COX-2 или НПВС или ингибитор COX/LOX или его таутомерные формы, или его аналоги, изомеры, полиморфы, сольваты, пролекарственные средства или соли в качестве активного ингредиента, составляющего от 0,1% до 80% масс./об., и систему растворителей, содержащую смесь гликолей, составляющую от 1% до 80% об./об.; необязательно с другими фармацевтически приемлемыми эксципиентами», и также описана «композиция по п.1, где указанная композиция дополнительно содержит по меньшей мере один подщелачивающий агент, составляющий от 0,2% до 60% об./об.». Однако этот фармацевтический состав представлен в качестве инъекционного лекарственного средства, и, следовательно, для решения этих задач необходимо эффективное средство в виде состава для перорального применения. Кроме того, также существует необходимость в других технологиях решения таких задач.
В качестве способа подержания щелочности препаратов-коксибов третьего поколения испытывали способ добавления основания, такого как карбонат кальция, гидроксид кальция, карбонат магния, силикат магния и алюминат магния, в качестве эксципиента, но при добавлении такой основной соли щелочноземельного металла к соединению A не получили предпочтительных результатов.
Список ссылок
Патентная литература
{PL 1} Патент Японии № 4577534
{PL 2} Публикация нерассмотренной патентной заявки Японии (перевод заявки PCT) № 2008-542260 в каталоге
Сущность изобретения
Задачи, подлежащие решению посредством изобретения
Целью настоящего изобретения является обеспечение соли соединения A, ее кристаллической формы и фармацевтической композиции, содержащей соль, проявляющей хорошие свойства при составлении, с недопущением при этом вышеуказанных недостатков. Кроме того, целью является способ получения указанной соли и ее фармацевтической композиции, и ее применение.
Средства решения задачи
Принимая во внимание вышеуказанные обстоятельства, после проведения исчерпывающего и тщательного исследования, цель которого заключалась в определении солей и/или сокристаллов соединения A с хорошими свойствами при составлении, такими как высокая растворимость в воде, хорошая степень кристалличности, хорошая термостабильность или низкая гигроскопичность, неожиданным образом авторам настоящего изобретения удалось обнаружить меглюминовую соль и калиевую соль. Настоящее изобретение также относится к ее кристаллической форме, способу получения указанной соли и ее фармацевтической композиции и ее применению.
При проведении испытания различных противоположных оснований в отношении соединения A в качестве эксципиента, не получили предпочтительных результатов. Примеры противоположных оснований включают гидроксид натрия, карбонат кальция, гидроксид кальция, карбонат магния, силикат магния, алюминат магния, как указано в уровне техники. Кроме того, аммиак, L-аргинин, бензатин, бетаин, гидроксид кальция, гидроксид холина, диэтиламин, никотинамид, L-винная кислота и т.п. не являются ни подходящими для образования соли, ни подходящими для получения состава.
В настоящем изобретении две соли соединения A, меглюминовая соль и калиевая соль, являются в большей степени подходящими для получения состава, чем любая другая соль в отношении кристаллизации выбранных солей, испытаний, касающихся технологичности (стабильности при различных температурах и влажности, экспериментов шламообразования) или испытаний, касающихся биодоступности (растворимости и скорости растворения).
Меглюминовая соль
Меглюминовую соль легко получали посредством экспериментов по кристаллизации в этаноле и изопропаноле. Твердые вещества выпадали в осадок сразу после добавления растворителей. Все проведенные испытания на стабильность при различной температуре и влажности, эксперименты порошковой рентгеновской дифракции, а также эксперименты по шламообразованию показали то, что меглюминовая соль стабильна как физически, так и химически, при этом ее хиральная чистота практически осталась без изменений. Таким образом, с точки зрения получения, меглюминовая соль является очень подходящей возможной солью, и из числа протестированных солей она показала наилучшие показатели.
С точки зрения растворимости/скорости растворения, растворимость и скорость растворения меглюминовой соли соединения A выше по сравнению со свободной кислотой соединения A. Таким образом, по вопросу, связанному с растворимостью/скоростью растворения, меглюминовая соль является подходящей в качестве активного фармацевтического ингредиента фармацевтической композиции соединения A. С использованием меглюминовой соли повышается биодоступность соединения A. Настоящее изобретение основывается на вышеизложенных неожиданных открытиях. Кроме того, по сравнению со случаем введения свободной карбоновой кислоты соединения A, в случае введения меглюминовой соли наблюдают более быстрое начало наступления эффекта и длительность действия при фармакокинетических исследованиях собак, как показано на фиг. 10.
Калиевая соль
Калиевую соль соединения A получали из смеси водных растворителей. Несмотря на легкость получения калиевой соли соединения A, представляет трудности получение стабильной и единичной кристаллической формы калиевой соли, так как в процессе кристаллизации содержание воды в смеси растворителей оказывает критическое влияние на кристаллообразование. Таким образом, контроль содержания воды имеет важное значение при получении стабильной и единичной кристаллической формы, и избыток воды необходимо удалять при азеотропных условиях с помощью подходящего растворителя, такого как толуол, этилацетат и этанол. Содержание воды составляет от 1 до 1,5 эквивалента по отношению к свободной кислоте, предпочтительно, содержание воды составляет от 1 до 1,2 эквивалента, более предпочтительно содержание воды составляет от 1 до 1,1 эквивалента, наиболее предпочтительно содержание воды составляет от 1 до 1,05 эквивалента. Если содержание воды составляет более 1,5 эквивалента по отношению к свободной кислоте, получение целевой единичной кристаллической формы не представляется невозможным. Калиевая соль показала хорошую стабильность как химически, так и энантиомерно после проведения испытаний стабильности в твердом состоянии.
Растворимость калиевой соли составляет более 120 мг/мл в среде от нейтральной до щелочной. По скорости растворения калиевая соль полностью растворилась в нейтральной среде в течение 15 минут, в частности, растворилась в воде в течение 5 минут, в то время как свободная кислота соединения A показала крайне ограниченную растворимость. Настоящее изобретение основано на вышеизложенных неожиданных открытиях. Кроме того, по сравнению со случаем введения свободной карбоновой кислоты соединения A, в случае введения калиевой соли наблюдают более быстрое начало наступления эффекта, длительность действия и улучшенную биодоступность при фармакокинетических исследованиях собак, как показано на фиг. 10.
Более конкретно, в настоящем изобретении описаны:
[1] соль (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты; где соль выбрана из группы, состоящей из меглюминовой соли и калиевой соли;
[2] соль в соответствии с [1], где калиевой солью является гидрат;
[3] соль в соответствии с [1], где калиевой солью является моногидрат;
[4] кристаллическая форма меглюминовой соли в соответствии с [1], которая характеризуется порошковой рентгеновской дифрактограммой (PXRD), полученной с применением излучения Cu-Kα, включающей основные пики при углах дифракции 2-тета 4,6, 8,9, 10,1, 13,8, 16,0, 16,7, 17,3, 18,0, 19,5, 22,4 и 23,2(°), и допустимый предел погрешности каждого пика составляет +/- 0,2(°);
[5] кристаллическая форма калиевой соли в соответствии с [1]-[3], которая характеризуется порошковой рентгеновской дифрактограммой (PXRD), полученной с применением излучения Cu-Kα, включающей основные пики при углах дифракции 2-тета 3,8, 11,4, 12,7, 14,7, 15,8, 16,5, 17,4, 18,9, 19,5 и 21,8(°), и допустимый предел погрешности каждого пика составляет +/- 0,2(°);
[6] фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и количество соли, как указано в любом из [1]-[5];
[7] способ получения фармацевтической композиции, где способ включает стадию сочетания соли, как указано в любом из [1]-[5] с фармацевтически приемлемым носителем;
[8] способ получения фармацевтической композиции в соответствии с [7], где способ включает сочетание соли, как указано в любом из [1]-[5] с по меньшей мере одним носителем; и подвергание этой комбинации измельчению или размолу, просеиванию, введению добавок, сушке или грануляции;
[9] способ в соответствии с [7] или [8], где способ дополнительно включает прессование фармацевтической композиции в твердую лекарственную форму;
[10] способ получения калиевой соли, как указано в любом из [1], [3], [4] и [5], где способ включает содержание воды менее 1,5 эквивалента в смеси растворителей для кристаллизации в отношении свободной (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты;
[11] способ в соответствии с [10], где содержание воды выбрано из группы, состоящей из
a) от 1 до 1,5,
b) от 1 до 1,2,
c) от 1 до 1,1 и
d) от 1 до 1,05;
[12] применение фармацевтической композиции, как указано в [6], для получения лекарственного средства для лечения и/или профилактики заболевания, опосредованного циклооксигеназой-2, у пациента; и
[13] применение в соответствии с [12], где заболеванием является одно или несколько из заболеваний, выбранных из группы, состоящей из воспаления, боли, злокачественной опухоли, лихорадки, остеоартрита, ревматоидного артрита, мигрени, нейродегенеративных заболеваний, сердечно-сосудистых заболеваний, остеопороза, астмы, волчанки и псориаза, дисменореи, преждевременных родов, глаукомы, подагры, анкилозирующего спондилита, бурсита, термического ожога, растяжения связок и закрытой травмы.
Эффект изобретения
Настоящее изобретение относится к соли соединения A, ее полиморфной форме, способу получения указанной соли и ее фармацевтической композиции, и ее применению. Соли и/или сокристаллы соединения A по настоящему изобретению показывают хорошие свойства при составлении, такие как высокая растворимость в воде, хорошая истинная растворимость, хорошая степени кристалличности, хорошая термостабильность или низкая гигроскопичность.
Краткое описание чертежей
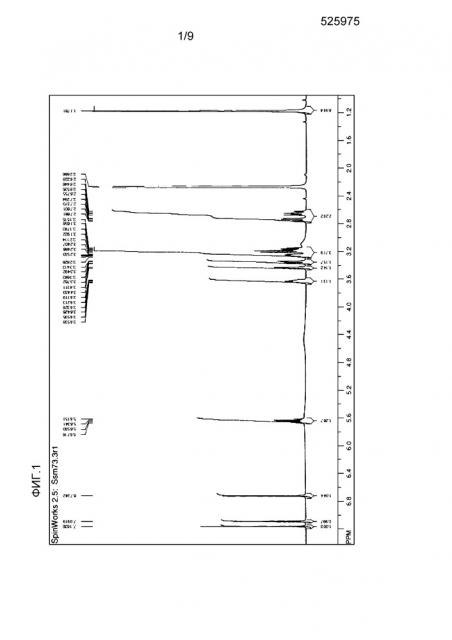
[Фиг.1] На фиг. 1 представлен спектр ЯМР меглюминовой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.2] На фиг. 2 представлена порошковая дифракционная картина меглюминовой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.3] На фиг. 3 представлен ИК-спектр на основе преобразования Фурье меглюминовой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.4] На фиг. 4 представлен спектр ЯМР калиевой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.5] На фиг. 5 представлена порошковая дифракционная картина калиевой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.6] На фиг. 6 представлен ИК-спектр на основе преобразования Фурье калиевой соли (S)-6-хлор-7-(1,1-диметилэтил)-2-трифторметил-2H-1-бензопиран-3-карбоновой кислоты.
[Фиг.7] На фиг. 7 представлена растворимость солей.
[Фиг.8] На фиг. 8 представлена зависимость концентрации от времени всех твердых веществ, измеренных в буфере с уровнем pH 6,8.
[Фиг.9] На фиг. 9 представлена зависимость концентрации от времени всех твердых веществ, измеренных в воде.
[Фиг.10] На фиг. 10 представлена зависимость от времени средней концентрации в плазме после перорального введения капсулированного состава API (свободной кислоты), калиевой соли и меглюминовой соли самцам собак породы бигль.
Подробное описание изобретения
(Соединение A)
Соединение A можно получать по существу известным способом.
Например, соединение A описано в патентной литературе 1, патенте Японии № 4577534 и т.д.
По настоящему изобретению конкретно не ограничено количество соли, содержащейся в фармацевтической композиции, для лечения сердечно-сосудистых заболеваний по настоящему изобретению, однако предпочтительно, чтобы доза была достаточной для лечения, улучшения состояния или ослабления симптомов, связанных с сердечно-сосудистым заболеванием. Дозировка фармацевтической композиции для лечения сердечно-сосудистых заболеваний по настоящему изобретению зависит от способа применения, возраста, пола и состояния пациента. Например, лекарственная форма может содержать от приблизительно 1 мг до 1000 мг соли по настоящему изобретению. Предпочтительно, содержание соли по настоящему изобретению может составлять от приблизительно 5 мг до 500 мг.
(Способ получения фармацевтической композиции)
Фармацевтическую композицию по настоящему изобретению можно получать посредством любого общепринятого способа, такого как, но не ограничиваясь им, влажная или сухая грануляция и прямое прессование.
Способ получения фармацевтической композиции по настоящему изобретению характеризуется тем, что включает процесс сочетания меглюмина или гидроксида калия с активным фармацевтическим ингредиентом, соединением A.
В процессе прямого прессования способ получения фармацевтической композиции включает сочетание соли по настоящему изобретению с по меньшей мере одним носителем, где носитель тщательно перемешан с солью по настоящему изобретению. Необязательно к фармацевтической композиции добавляют один или несколько других эксципиентов, и полученную в результате комбинацию прессуют в твердую фармацевтическую композицию, такую как таблетки, пилюли, гранулы и т.д. Предпочтительно, твердую фармацевтическую композицию прессуют в таблетку.
Аналогично способу прямого прессования, способ влажной грануляции включает добавление и смешивание соответствующего количества воды к фармацевтической композиции для составления, и прохождение дополнительного подходящего процесса. Гранулированную фармацевтическую композицию сушат при подходящих условиях и подвергают компрессионному формованию в таблетку и т.д. после установления размера частиц.
Затем аналогично способу прямого прессования, способ сухой грануляции включает компрессионное формование, которое включает прессование фармацевтической композиции для составления в форму пластины с подходящим компрессором, дробление полученной в результате пластины с помощью дробилки, последовательное регулирование размера частиц, а затем компрессионное формование в таблетку и т.д.
Вещества, такие как гидроксид натрия, гидроксид калия, карбонат кальция, гидроксид кальция, карбонат магния, силикат магния, алюминат магния, аммиак, L-аргинин, бензатин, бетаин, гидроксид кальция, гидроксид холина, диэтиламин, гидроксид калия, меглюмин, никотинамид и L-винная кислота, которые используют в настоящем описании, являются коммерчески доступными.
Соль по настоящему изобретению можно использовать в отдельности или в комбинации с одним или двумя или более видами солей соединения A. Вещество гидроксида меглюмина или калия добавляют в форме жидкости, твердого вещества или суспензии.
В фармацевтической композиции для перорального применения по настоящему изобретению содержание соли по настоящему изобретению, как правило, варьируется от приблизительно 1 до 60% (масс./масс.) в указанной композиции.
Фармацевтическая композиция по изобретению может принимать любую форму, но предпочтительно она является твердой композицией. Более предпочтительно, фармацевтическую композицию по изобретению прессуют в твердую композицию посредством формования (например, грануляции и опрессовки). Подходящие твердые лекарственные формы в качестве неограничивающих примеров включают таблетки, пилюли, гранулы, капсулы, порошки и саше и т.п. В особенности предпочтительными являются таблетки.
Когда фармацевтическая композиция представлена в твердой лекарственной форме, лекарственную форму можно получать посредством включения в состав соли по настоящему изобретению, с последующим формованием смеси. Включение в состав осуществляют посредством способа, который общепринято используют в области фармацевтических препаратов, такого как смешивание, перемешивание, грануляция массы, просеивание, взбалтывание и т.п. Например, фармацевтически приемлемый носитель можно непосредственно смешивать с солью по настоящему изобретению (при добавлении в порошковом состоянии), или растворитель можно добавлять к смеси, с последующим общепринятым перемешиванием, грануляцией и сушкой. Альтернативно, носитель растворяют в подходящем растворителе, затем раствор равномерно смешивают с активным ингредиентом, с последующим общепринятым перемешиванием, грануляцией и сушкой (при добавлении в жидком состоянии). В случае добавления в жидком состоянии можно использовать любой растворитель, не оказывающий необходимого воздействия на активный ингредиент, например, воду, диметилформамид, ацетон, этанол, пропиловый спирт, изопропиловый спирт, бутиловый спирт, метиленхлорид, трихлорэтан и т.д. После завершения смешивания материал подвергают общепринятому процессу формования под давлением для получения таблеток, содержащих активный ингредиент. Формование под давлением означает, что материал прессуют под давлением в необходимую форму, которая в большинстве случаев относится к таблетированию.
Также возможно добавление различных носителей, используемых для получения препарата, к фармацевтической композиции (например, твердых препаратов) по настоящему изобретению на соответствующей стадии. Примеры включают, но не ограничиваются ими, наполнители, разбавители, дезинтегранты, способствующие скольжению средства, эксципиенты, связывающие средства, смазочные средства, краситель, ароматизаторы, средства, улучшающие аромат, средства для смачивания, и т.п.
Подходящие наполнители и разбавители в качестве неограничивающих примеров включают полученные из целлюлозы материалы, такие как порошковая целлюлоза, микрокристаллическая целлюлоза (например, Avicel (зарегистрированный товарный знак)), микротонкая целлюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, соли карбоксиметилцеллюлозы и другие замещенные и незамещенные целлюлозы; крахмал; пептизированный крахмал; лактоза; тальк; воск; сахара; сахарные спирты, такие как маннит и сорбит; акрилатные полимеры и сополимеры; декстраты; декстрин; декстроза; мальтодекстрин; пектин; желатин; неорганические разбавители, такие как карбонат кальция, дигидрат гидрофосфата кальция, трикальцийфосфат, карбонат магния, оксид магния, хлорид натрия и другие разбавители, известные в фармацевтической промышленности.
Подходящие дезинтегранты в качестве неограничивающих примеров включают кроскармеллозу натрия (например, Ac Di Sol (зарегистрированный товарный знак), Primellose (зарегистрированный товарный знак)), кросповидон (например, Kollidon (зарегистрированный товарный знак), Polyplasdone (зарегистрированный товарный знак)), микрокристаллическую целлюлоза, полакрилин калия, порошковую целлюлозу, пептизированный крахмал, крахмалгликолят натрия (например, Explotab (зарегистрированный товарный знак), Primoljel (зарегистрированный товарный знак)) и крахмал и т.п.
Способствующие скольжению средства можно добавлять для улучшения текучести твердой композиции перед прессованием и для повышения точности дозирования, в особенности во время прессования и наполнения капсул. Эксципиенты, которые могут выполнять функцию способствующих скольжению средств, в качестве неограничивающих примеров включают коллоидный диоксид кремния, трисиликат магния, порошковую целлюлозу, тальк и т.п.
Подходящие эксципиенты, которые можно включать в состав, в качестве неограничивающих примеров включают микрокристаллическую целлюлозу (например, Avicel PH101, PH101 (производства Asahi Kasei Corporation)), карбоксиметилцеллюлозу кальция, кукурузный крахмал, пшеничный крахмал, лактозу, сахарозу, глюкозу, сульфат кальция, фосфат кальция, хлорид натрия и т.д. Кроме того, такие эксципиенты включают консерванты, поверхностно-активные вещества, антиоксиданты или любой другой эксципиент, широко используемый в фармацевтической промышленности.
Подходящие связывающие средства, которые можно включать в состав, в качестве неограничивающих примеров включают воду, этанол, пропанол, сахарный сироп, растворы глюкозы, крахмальные растворы, растворы желатина, гуммиарабик, желатин, альгинат натрия, метилцеллюлозу, карбоксиметилцеллюлозу, шеллак, поливинилпирролидон, кросповидон, гидроксипропилцеллюлозу (которая далее в настоящем документе может быть обозначена как HPC), гидроксипропилметилцеллюлозу и т.п. Кроме того, такие связывающие средства включают другие связывающие средства, используемые при влажной или сухой грануляции и в процессах таблетирования прямым прессованием.
Подходящие смазочные средства, которые можно включать в состав, в качестве неограничивающих примеров включают стеарат магния, тальк, синтетический силикат алюминия, лаурилсульфат натрия, борную кислоту, оксид магния, парафин и т.п. Кроме того, можно добавлять краситель, ароматизаторы, средства, улучшающие запах, средства для смачивания, и т.п.
В частности, в случае использования кристаллического соединения с относительно малой удельной плотностью в качестве активного фармацевтического ингредиента, необходимо предварительное диспергирование соединения в густой жидкости, содержащей такое связывающее средство, как HPC и вода. Кроме того, твердую фармацевтическую композицию по настоящему изобретению можно получать в виде покрытых таблеток.
Покрытие можно наносить посредством по существу известного способа. В качестве покрывающих средств, общепринятые покрывающие средства (например, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, поливинилпирролидон и т.д.), и в качестве вспомогательных веществ для покрытия используют, например, полиэтиленгликоль 6000, полисорбат (например, Tween 80 и т.д.), оксид титана, и пигменты, такие как красный оксид железа и т.п.
В случае использования фармацевтической композиции по настоящему изобретению для лечения заболеваний, опосредованных циклооксигеназой-2 у млекопитающих (например, человека, собаки, кролика или крысы), ее можно вводить перорально в виде таблеток и т.д. Дозировка варьируется от 0,0075 до 15 мгA/кг в сутки, предпочтительно от 0,07 до 7,2 мгA/кг в сутки в отношении активного фармацевтического ингредиента (где мгA означает массу в мг активного фармацевтического ингредиента с учетом свободной кислоты). Доза может быть увеличена или уменьшена в зависимости от заболевания или состояния.
Соединения по настоящему изобретению можно использовать в комбинации с одним или несколькими другими лекарственными средствами в лечении, профилактике, контроле, улучшении состояния или уменьшения риска возникновения заболеваний или состояний, для которых могут быть пригодны соединения по настоящему изобретению или другие лекарственные средства, где комбинация взятых вместе лекарственных средств является более безопасной или более эффективной, чем лекарственное средство, используемое в отдельности. Такое(ие) другое(ие) лекарственное(ые) средство(а) можно вводить способом и в количестве, широко используемом таким образом, одновременно или последовательно с соединением по настоящему изобретению. При использовании соединения по настоящему изобретению одновременно с одним или несколькими другими лекарственными средствами предполагается фармацевтическая композиция в стандартной лекарственной форме, содержащей такие другие лекарственные средства и соединение по настоящему изобретению. Однако комбинированное лечение также может включать терапию, в которой соединение по настоящему изобретению и один или несколько других лекарственных средств вводят при различных совместно применяемых схемах. Также предусмотрено, что при использовании в комбинации с одним или несколькими другими активными ингредиентами соединения по настоящему изобретению и другие активные ингредиенты можно использовать в более низких дозах, чем при использовании каждого из них по отдельности.
Таким образом, фармацевтические композиции по настоящему изобретению включают те, которые содержат одно или несколько других активных ингредиентов, в дополнение к соединению по настоящему изобретению. Вышеуказанные комбинации включают комбинации соединения по настоящему изобретению не только с одним другим активным соединением, но также с двумя или более другими активными соединениями.
Аналогичным образом, соединения по настоящему изобретению можно использовать в комбинации с другими лекарственными средствами, которые используют в профилактике, лечении, контроле, улучшении состояния или снижении риска возникновения заболеваний или состояний, для которых пригодны соединения по настоящему изобретению. Такие другие лекарственные средства можно вводить способом и в количестве, широко используемом таким образом, одновременно или последовательно с соединением по настоящему изобретению. При использовании соединения по настоящему изобретению одновременно с одним или несколькими другими лекарственными средствами предполагается фармацевтическая композиция, содержащая такие другие лекарственные средства в дополнение к соединению по настоящему изобретению. Таким образом, фармацевтические композиции по настоящему изобретению включают те, которые также содержат один или несколько других активных ингредиентов в дополнение к соединению по настоящему изобретению.
Массовое соотношении соединения по настоящему изобретению ко второму активному ингредиенту может варьироваться и зависит от эффективной дозы каждого ингредиента. Как правило, используют эффективную дозу каждого. Таким образом, например, при сочетании соединения по настоящему изобретению с другим агентом массовое соотношение соединения по настоящему изобретению к другому агенту, как правило, варьируется от приблизительно 1000:1 до приблизительно 1:1000, включая от приблизительно 200:1 до приблизительно 1:200. Комбинации соединения по настоящему изобретению и других активных ингредиентов, как правило, также находятся в пределах вышеуказанного диапазона, но в каждом случае следует использовать эффективную дозу каждого активного ингредиента. В таких комбинациях соединение по настоящему изобретению и другие активные средства можно вводить раздельно или совместно. Кроме того, возможно введение одного элемента перед, одновременно с или после введения другого(их) агента(ов).
Соль или ее кристаллические формы, как определено выше, можно вводить одномоментно, последовательно или раздельно в комбинации с одним или несколькими агентами, выбранными из:
- опиоидного аналгетика, например, морфина, героина, гидроморфона, оксиморфона, леворфанола, левалорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина;
- нестероидного противовоспалительного средства (НПВС), например, аспирина, диклофенака, дифлузинала, этодолака, фенбуфена, фенопрофена, флуфенизала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, мелоксикама, набуметона, напроксена, нимесулида, нитрофлурбипрофена, олсалазина, оксапрозина, фенилбутазона, пироксикама, сульфасалазина, сулиндака, толметина или зомепирака;
- барбитуратного седативного средства, например, амобарбитала, апробарбитала, бутабарбитала, бутабитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, теамилала или тиопентала;
- бензодиазепина, обладающего седативным действием, например, хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама;
- H1-антагониста, обладающего седативным действием, например, дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина;
- седативного средства, такого как глютетимид, мепробамат, метаквалон или дихлоралфеназон;
- миорелаксанта скелетных мышц, например баклофена, каризопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфренадина;
- антагониста NMDA-рецептора, например, декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрофана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирролохинолинхинина, цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты, будипина, EN-3231 (MorphiDex (зарегистрированный товарный знак), комбинированного препарата морфина и декстрометорфана), топирамата, нерамексана или перзинфотела, включая NR2B-антагониста, например, ифенпродил, траксопродил или (-)-(R)-6-{2-[4-(3-фторфенил)-4-гидрокси-1-пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1H)хинолинон;
- альфа-адренергического средства, например доксазозина, тамсулозина, клонидина, кванфацина, дексметатомидина, модафинила или 4-амино-6,7-диметокси-2-(5-метан-сульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолина;
- трициклического антидепрессанта, например, дезипрамина, имипрамина, амитриптилина или нортриптилина;
- противосудорожного средства, например, карбамазепина, ламотригина, топиратмата или вальпроата;
- тахикининового (NK) антагониста, в частности антагониста NK-3, NK-2 или NK-1, например, альфаR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]нафтиридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), апрепитанта, ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S);
- мускаринового антагониста, например, оксибутинина, толтеродина, пропиверина, хлорида тропсия, дарифенацина, солифенацина, темиверина и ипратропия;
- селективного ингибитора COX-2, например, целекоксиба, рофекоксиба, парекоксиба, валдекоксиба, деракоксиба, эторикоксиба или люмиракоксиба;
- анальгетика из каменноугольной смолы, в частности, парацетамола;
- нейролептического средства, такого как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипрасидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, азенапин, луразидон, амисульприд, балаперидон, палиндор, эпливансерин, осанетант, римонабант, меклинертант, Miraxion (зарегистрированный товарный знак) или саризотан;
- агониста (например, резинфератоксина) или антагониста (например, капсазепина) ванилоидного рецептора);
- агониста или антагониста подтипа катионных каналов с транзиторным рецепторным потенциалом (V1, V2, V3, V4, M8, M2, A1);
- бета-адренергического средства, такого как пропранолол;
- местного анестетика, такого как мексилетин;
- кортикостероида, такого как дексаметазон;
- агониста или антагониста 5-HT-рецептора, в частности, агониста 5-HT1B/1D, такого как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан;
- антагониста рецептора 5-HT2A, такого как R(+)-альфа-(2,3-диметокси-фенил)-1-[2-(4-фторфенилэтил)]-4-пиперидинметанол (MDL-100907);
- холинергического (никотинового) анальгетика, такого как испрониклин (TC-1734), (E)-N-метил-4-(3-пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (ABT-594