Фармацевтически активные соединения
Иллюстрации
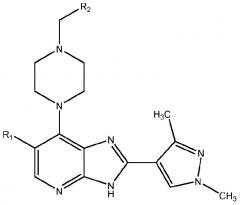
Показать всеИзобретение относится к области органической химии, а именно к гетероциклическому соединению формулы I или его фармацевтически приемлемой соли, где R2 выбран из формулы II или формулы III, где Ra представляет собой водород или метил. Также изобретение относится к фармацевтической композиции на основе соединения формулы I и способу лечения пролиферативных расстройств и острого миелоидного лейкоза, основанного на использование соединения формулы I. Технический результат: получены новые производные имидазопиридина, обладающие полезными биологическими свойствами. 4 н. и 5 з.п. ф-лы, 2 ил., 5 табл., 3 пр.
I ,
Реферат
ВВЕДЕНИЕ
[0001] Настоящее изобретение относится к фармацевтически активным соединениям. Более конкретно, настоящее изобретение относится к соединениям, которые являются ингибиторами ферментативной активности Aurora киназ. Соединения по изобретению являются также ингибиторами активности FMS-подобной тирозинкиназы-3 (FLT3). Настоящее изобретение также относится к способам получения этих соединений, содержащим их фармацевтическим композициям и к их применению при лечении пролиферативных заболеваний, таких как злокачественное новообразование, а также других заболеваний или состояний, в которых вовлечена активность Aurora киназы и/или FLT3.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Пролиферативные заболевания, такие как злокачественное новообразование, характеризуются неконтролируемой и нерегулируемой клеточной пролиферацией. Именно то, что заставляет клетки пролиферировать неконтролируемым и нерегулируемым образом, было объектом интенсивных исследований на протяжении последних десятилетий.
[0003] Aurora киназы, семейство из трех серин-треониновых киназ, обозначаемых как A, B и C, играют ключевую и явную роли на различных стадиях митоза.1,3 На ранних стадиях митоза Aurora-A образует комплекс с белком, связывающимся с моторным белком Xklp2 (TPX2), который регулирует созревание центросом и формирование митотического веретена.4,5 Aurora-B образует комплексы с внутренним центромерным белком (INCENP), сурвивином и бореалином, тем самым регулируя конденсацию хромосом, выравнивание хромосом, контрольную точку митотического цикла и цитокинез.6-9 О сверхэкспрессии Aurora-A и Aurora-B сообщалось для широкого спектра злокачественных новообразований у человека, включая рак молочной железы, рак толстой кишки, рак яичников, глиому, рак щитовидной железы, семиному.10-16 Функция Aurora-C в процессе митоза менее понятна. Однако сообщалось о высокой экспрессии Aurora-C в семенниках.17,18
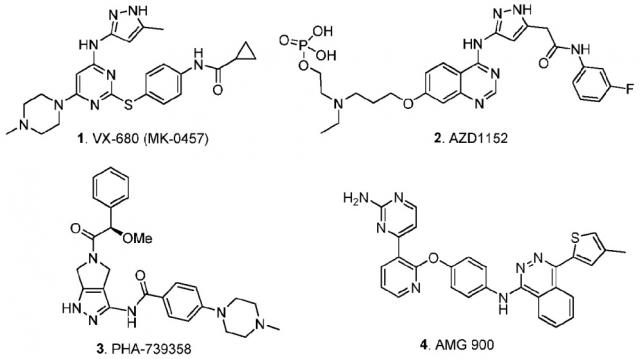
[0004] В последние годы небольшие молекулы, нацеленные на Aurora киназы, стали общей стратегией разработки новых химиотерапевтических средств при злокачественных новообразованиях, и был описан ряд структурно разнообразных ингибиторов активности Aurora,18-20 включая 1 (VX-680 (МК-0457)),21 2 (AZD1152),22 3 (PHA-739358)23,24 и 4 (AMG 900)25 (смотри далее).
[0005] Однако остается потребность выявления дополнительных терапевтических агентов, способных ингибировать активность Aurora киназ.
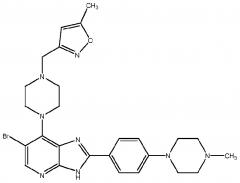
[0006] В международных патентных публикациях №№ WO 2007/072017 и WO 2009/001021, в обоих описана серия имидазо[4,5-b]производных пиридина, которые функционируют как ингибиторы активности Aurora киназ, и которые, следовательно, являются потенциально полезными терапевтическими агентами для лечения злокачественного новообразования. Одно конкретное соединение, описанное в WO 2009/001021, показано далее.
[0007] Конкретное соединение (известное как CCT137690) является мощным и биодоступным при пероральном приеме ингибитором Aurora киназ, которое ингибирует in vivo рост ксенотрансплантата карциномы толстой кишки SW620 человека с сопутствующей модуляцией биомаркера, соответствующей поражению цели.26 Однако доклиническая разработка этого соединения была ограничена ввиду его узкой широты терапевтического диапазона в отношении hERG43 (IC50=3,0 мкМ)26 и его низкой стабильности в микросомах печени человека (86% метаболизируется после 30 мин инкубации, неопубликованные данные).
[0008] Таким образом, объектом настоящего изобретения является обеспечение биодоступности при пероральном приеме ингибиторов ферментативной активности Aurora киназ, пригодных для доклинической и клинической оценки.
[0009] Таким образом, объектом настоящего изобретения является обеспечение биодоступности при пероральном приеме ингибиторов ферментативной активности Aurora киназ, которые обладают приемлемой стабильностью в микросомах человека, пониженным ингибированием активности цитохрома P450 и, в случае некоторых соединений, широким терапевтическим индексом в отношении hERG.
[0010] FLT3 представляет собой транс-мембранную киназу, которая относится к классу III семейства рецепторных тирозинкиназ (RTK). Связывание FLT3-лиганда (FL) с его рецептором приводит к димеризациии, аутофосфорилированию и последующей активации нижележащих сигнальных путей.37 Высокий уровень экспрессии FLT3 был обнаружен в бластных клетках при острой миелоидной лейкемии (AML), и у больных AML были выявлены два основных класса мутаций, т.е. внутренние тандемные дупликации (ITD) и точковые мутации тирозинкиназного домена (TKD).37,38 Внутренние тандемные дупликации были определены у 20-25% больных AML, и точковые мутации тирозинкиназного домена у 5-10% больных AML.37,38 Ряд низкомолекулярных ингибиторов FLT3 были оценены в клинических испытаниях.38,39
[0011] Таким образом, существует потребность в соединениях, которые имеют двойную функцию ингибирования как киназ Aurora, так и FLT3. Такие соединения могли бы быть использованы при лечении заболеваний и/или состояний, в которые вовлечены Aurora и/или FLT3, такие как, например, AML.
[0012] Поэтому следующим объектом настоящего изобретения является разработка соединений, обладающих этой двойной активностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0013] В одном аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли или сольвату, как определено в настоящем документе.
[0014] В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение по изобретению, как определено в настоящем документе, или его фармацевтически приемлемую соль или сольват и один или несколько фармацевтически приемлемых инертных наполнителей.
[0015] В другом аспекте настоящее изобретение относится к соединению по изобретению, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвату, или фармацевтической композиции, как определено в настоящем документе, для применения в терапии.
[0016] В другом аспекте настоящее изобретение относится к соединению по изобретению, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвату, или фармацевтической композиции, как определено в настоящем документе, для применения при лечении заболеваний или состояний, в которых вовлечена активность Aurora киназы и/или FLT3.
[0017] В другом аспекте настоящее изобретение относится к применению соединения по изобретению, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвата, при получении лекарственного средства для применения в лечении заболеваний или состояний, в которых вовлечена активность Aurora киназы и/или FLT3.
[0018] В другом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которые вовлечена активность Aurora киназы и/или FLT3, где указанный способ включает введение субъекту при необходимости такого лечения терапевтически эффективного количества соединения по изобретению, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, как определено в настоящем документе.
[0019] В другом аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли или сольвату, или фармацевтической композиции, как определено в настоящем документе, для применения в лечении пролиферативных расстройств, таких как злокачественное новообразование. В конкретном варианте злокачественным новообразованием является рак у человека.
[0020] В другом аспекте настоящее изобретение относится к применению соединения или его фармацевтически приемлемой соли или сольвата при получении лекарственного средства для применения в лечении пролиферативных расстройств, таких как злокачественное новообразование. В конкретном варианте злокачественным новообразованием является рак у человека.
[0021] В другом аспекте настоящее изобретение относится к способу лечения пролиферативного расстройства, такого как злокачественное новообразование, где указанный способ включает введение субъекту при необходимости такого лечения терапевтически эффективного количества соединения или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, как определено в настоящем документе. В конкретном варианте злокачественным новообразованием является рак у человека.
[0022] В другом аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли или сольвату, или фармацевтической композиции, как определено в настоящем документе, для использования в продуцировании ингибирующего действия Aurora киназы и/или FLT3.
[0023] В другом аспекте настоящее изобретение относится к применению соединения или его фармацевтически приемлемой соли или сольвата при получении лекарственного средства для использования в продуцировании ингибирующего действия Aurora киназы и/или FLT3.
[0024] В другом аспекте настоящее изобретение относится к способу продуцирования in vitro ингибирующего действия Aurora киназы и/или FLT3, где указанный способ включает введение эффективного количества соединения или его фармацевтически приемлемой соли или сольвата.
[0025] В другом аспекте настоящее изобретение относится к способу продуцирования in vivo ингибирующего действия Aurora киназы и/или FLT3, где указанный способ включает введение эффективного количества соединения или его фармацевтически приемлемой соли или сольвата.
[0026] В другом аспекте настоящее изобретение относится к способу ингибирования пролиферации клеток in vitro или in vivo, где указанный способ включает контактирование клетки с эффективным количеством соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
[0027] Настоящее изобретение далее относится к способу синтеза соединения или его фармацевтически приемлемой соли или сольвата, как определено в настоящем документе.
[0028] В другом аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли или сольвату, которые могут быть получены, либо получены, либо непосредственно получают, описанным в настоящем документе.
[0029] В другом аспекте настоящее изобретение относится к новым промежуточным соединениям, описанным в настоящем документе, которые пригодны для использования в любом из способов синтеза, описанных в настоящем документе.
[0030] Предпочтительные, подходящие и дополнительные признаки какого-либо конкретного аспекта настоящего изобретения являются также предпочтительными, подходящими и дополнительными признаками любого другого аспекта.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0031] Если не указано иное, термины, используемые в описании и в формуле изобретения, имеют следующие значения, указанные далее.
[0032] Должно быть понятно, что ссылки на «лечить» или «лечение» включают в себя профилактику, а также смягчение установленных симптомов заболевания. Термины «лечить» или «лечение» состояния, расстройства или заболевания, следовательно, включают: (1) предупреждение или задержку появления клинических симптомов состояния, расстройства или заболевания, развивающихся у человека, который может страдать или быть предрасположенным к состоянию, расстройству или заболеванию, но еще не ощущает или у которого не проявляются клинические или субклинические симптомы состояния, расстройства или заболевания, (2) подавление состояния, расстройства или заболевания, то есть, остановку, уменьшение или замедление развития заболевания или его рецидива (в случае поддерживающей терапии) или, по крайней мере, одного его клинического или субклинического признака, или (3) снятие или ослабление болезни, то есть, вызывание регресса состояния, расстройства или заболевания, или, по крайней мере, одного из его клинических или субклинических симптомов.
[0033] Термин «терапевтически эффективное количество» означает количество соединения, которое при введении млекопитающему для лечения заболевания, является достаточным, чтобы осуществить такое лечение заболевания. «Терапевтически эффективное количество» будет варьироваться в зависимости от соединения, заболевания и его тяжести, возраста, веса и др. млекопитающего, подвергаемого лечения.
[0034] Фраза «соединение по изобретению» означает соединения, которые описаны в настоящем документе, как в общем, так и в частности.
Соединения по изобретению
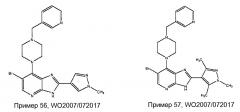
[0035] Как отмечалось ранее, в международной патентной публикации № WO 2007/072017 описана серия производных имидазо[4,5-b]пиридина, которые действуют как ингибиторы активности Aurora киназы. Двумя конкретными соединениями, описанными в WO 2007/072017, являются 6-бром-2-(1-метил-1H-пиразол-4-ил)-7-(4-(пиридин-3-илметил)пиперазин-1-ил)-3H-имидазо[4,5-b]пиридин (пример 56) и 6-бром-7-(4-(пиридин-3-илметил)пиперазин-1-ил)-2-(1,3,5-триметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (пример 57). Структуры этих соединений показаны ниже.
[0036] В первом аспекте настоящее изобретение относится к соединению формулы (I), представленной далее:
I
где:
R1 представляет собой Br или Cl;
R2 выбран из формулы II или формулы III, показанных далее:
где Ra представляет собой водород или метил;
или его фармацевтически приемлемой соли или сольвату.
[0037] В определении R2 группы выше символ ~~~~ обозначает точку присоединения группы R2 к радикалу -CH2-, имеющемуся в соединениях формулы I.
[0038] Соединения по настоящему изобретению демонстрируют уменьшение ингибирования активности цитохрома P450 по сравнению с соединениями по примерам 56 и 57 в WO 2007/072017. Некоторые соединения по настоящему изобретению также обладают более широким терапевтическим индексом в отношении hERG по сравнению с соединениями по примерам 56 и 57 в WO 2007/072017.
[0039] В частности, соединения по изобретению включают, например, соединения формулы I или их фармацевтически приемлемые соли, где, если не указано иное, каждый из R1 и R2 имеет любое из значений, определенных выше, или в любом из пунктов (1)-(5) здесь далее:
(1) R1 представляет собой Br;
(2) R1 представляет собой Cl;
(3) R2 имеет формулу II;
(4) R2 имеет формулу III, как определено в настоящем документе;
(5) R2 имеет формулу III, как определено в настоящем документе, и Ra представляет собой водород;
(6) R2 имеет формулу III, как определено в настоящем документе, и Ra представляет собой метил;
[0040] Целесообразно, когда R1 представляет собой хлор.
[0041] Целесообразно, когда R2 имеет формулу II (т.е. пара-хлорфенил). В конкретной группе соединений по изобретению, таким образом, соединения имеют структурную формулу Ia, показанную далее:
где R1 имеет значения, определенные выше, или их фармацевтически приемлемые соли или сольваты.
[0042] В следующей группе соединений по изобретению R2 имеет формулу III, т.е. соединения имеют структурную формулу Ib, показанную далее:
где R1 и Ra, оба имеют значения, определенные выше, или их фармацевтически приемлемые соли или сольваты.
[0043] Конкретные соединения по настоящему изобретению включают следующие:
6-хлор-7-(4-(4-хлорбензил)пиперазин-1-ил)-2-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин;
3-((4-(6-хлор-2-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиперазин-1-ил)метил)-1,2,4-оксадиазол;
3-((4-(6-хлор-2-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиперазин-1-ил)метил)-5-метил-1,2,4-оксадиазол;
или их фармацевтически приемлемые соли или сольваты.
[0044] Подходящей фармацевтически приемлемой солью соединения по изобретению является, например, кислотно-аддитивная соль соединения по изобретению, которое является достаточно основным, например, кислотно-аддитивная соль добавления, например, неорганической или органической кислоты, например, хлористоводородной, бромистоводородной, серной, фосфорной, трифторуксусной, муравьиной, лимонной или малеиновой кислоты.
[0045] Настоящее изобретение также охватывает соединения по изобретению, как определено в настоящем документе, которые включают один или несколько изотопных заместителей. Например, H может быть в любой изотопной форме, в том числе 1H, 2H(D) и 3H (T); C может быть в любой изотопной форме, в том числе 12C, 13C и 14C; и тому подобное.
[0046] Следует также учитывать, что некоторые соединения по изобретению могут существовать в сольватированной, а также несольватированной формах, таких как, например, гидратированные формы. Следует также учитывать, что изобретение охватывает все такие сольватированные формы, которые обладают ингибирующей Aurora киназу и/или FLT3 активностью.
[0047] Также следует учитывать, что некоторые соединения по изобретению могут проявлять полиморфизм, и что изобретение охватывает все такие формы, которые обладают ингибирующей Aurora киназу и/или FLT3 активностью.
[0048] Соединения по изобретению могут существовать в виде различных таутомерных форм, и ссылки на соединения по изобретению включают все такие формы. Во избежание сомнений следует учесть, что, когда соединение может существовать в нескольких таутомерных формах, и только одна конкретно описана или показана, все другие, тем не менее, охватываются соединениями по изобретению. Примеры таутомерных форм соединений по настоящему изобретению включают соединения в форме, показанной формулой I выше, а также таутомеры формул (IV) и (V), показанных далее.
где R1 и R2 имеют значения, определенные выше.
[0049] Соединения по изобретению, содержащие функциональные аминогруппы, также могут образовывать N-оксиды. Отсылка в настоящем документе к соединению формулы I, которое содержит функциональную аминогруппу, также включает N-оксид. Когда соединение содержит несколько функциональных аминогрупп, один или несколько атомов азота могут быть окислены с образованием N-оксида. Конкретные примеры N-оксидов представляют собой N-оксиды по атому азота гетероцикла, содержащего атом азота. N-Оксиды могут быть образованы путем обработки соответствующего амина окисляющим агентом, таким как пероксид водорода или перкислота (например, пероксикарбоновая кислота), см., например, Advanced Organic Chemistry, by Jerry March, 4ой Edition, Wiley Interscience, страницы. Более конкретно, N-оксиды могут быть получены способом, описанным L. W. Deady (Syn. Comm. 1977, 7, 509-514), по которому соединение амина взаимодействует с м-хлорпероксибензойной кислотой (MCPBA), например, в инертном растворителе, таком как дихлорметан.
[0050] Соединения по изобретению могут быть введены в виде пролекарства, которое расщепляется в организме человека или животного, чтобы высвободить соединение по изобретению. Пролекарство может быть использовано для того, чтобы изменить физические свойства и/или фармакокинетические свойства соединения по изобретению. Пролекарство может быть получено, когда соединение по изобретению содержит подходящую группу или заместитель, к которому может быть присоединена модифицирующая свойства группа. Примеры пролекарства in vivo включают расщепляемые амидные производные, которые могут быть образованы по аминогруппе соединения по изобретению.
[0051] Соответственно, настоящее изобретение включает соединения формулы I, как определено выше, которые могут быть получены путем органического синтеза, и которые могут образовываться в организме человека или животного путем расщепления его пролекарства. Соответственно, настоящее изобретение включает соединения формулы I, которые получают путем органического синтеза, а также такие соединения, которые образуются в организме человека или животного путем метаболизма соединения-предшественника, то есть соединение формулы I может быть синтетически полученным соединением или метаболически образованным соединением.
[0052] Подходящее фармацевтически приемлемое пролекарство соединения формулы I представляет собой такое, которое основано на разумном медицинском заключении как подходящее для введения в организм человека или животного без нежелательных фармакологических активностей и без чрезмерной токсичности.
[0053] Различные формы пролекарств были описаны, например, в следующих документах:
a) Methods in Enzymology, Vol. 42, p. 309-396, edited by K. Widder, et al. (Academic Press, 1985);
b) Design of Pro-drugs, edited by H. Bundgaard, (Elsevier, 1985);
c) A Textbook of Drug Design and Development, edited by Krogsgaard-Larsen and H. Bundgaard, Chapter 5 «Design and Application of Pro-drugs», by H. Bundgaard p. 113-191 (1991);
d) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992);
e) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77, 285 (1988);
f) N. Kakeya, et al., Chem. Pharm. Bull.. 32, 692 (1984);
g) T. Higuchi and V. Stella, «Pro-Drugs as Novel Delivery Systems», A.C.S. Symposium Series, Volume 14; и
h) E. Roche (editor), «Bioreversible Carriers in Drug Design», Pergamon Press, 1987.
[0054] Действие in vivo соединения формулы I может проявляться частично одним или более метаболитами, которые образуются в организме человека или животного после введения соединения формулы I. Как указано выше, действие in vivo соединения формулы I также может проявляться при метаболизме соединения-предшественника (пролекарства).
[0055] Следует также иметь в виду, что соединения формулы (I) также могут быть ковалентно присоединены (в любом подходящем положении) к другим группам, таким как, например, солюбилизирующие группы (например, полимеры PEG), группы, которые позволяют им быть связанными с твердой подложкой (такие, как, например, биотин-содержащие группы) и мишеневые лиганды (например, антитела или фрагменты антител).
Синтез
[0056] При рассмотрении описания синтетических способов, представленных далее, и указанных методов синтеза, которые используются для получения исходных продуктов, следует учитывать, что все предлагаемые условия реакции, включая выбор растворителя, атмосферу реакции, температуру реакции, продолжительность эксперимента и способы обработки, могут быть выбраны специалистом в данной области техники.
[0057] Как понятно специалисту в области органического синтеза, функциональные группы, имеющиеся в различных частях молекулы, должны быть совместимы с используемыми реагентами и условиями реакции.
[0058] Необходимые исходные продукты могут быть получены с помощью стандартных способов органической химии. Получение таких исходных продуктов описано в связи со следующими представительными вариантами способа и в прилагаемых примерах. Кроме того, необходимые исходные продукты могут быть получены способами, аналогичными проиллюстрированным, которые находятся в рамках знаний обычного химика-органика.
[0059] Следует иметь в виду, что в ходе синтеза соединений по изобретению в способах, описанных далее, или в процессе синтеза некоторых исходных продуктов может быть желательным защитить некоторые группы заместителей, чтобы предотвратить их от нежелательных взаимодействий. Опытный химик сможет оценить, когда такая защита необходима и как такие защитные группы могут быть введены, а позже удалены.
[0060] В качестве примеров защитных групп смотри один из многих обзоров на эту тему, например, «Protective Groups in Organic Synthesis» by Theodora Green (publisher: John Wiley & Sons). Защитные группы могут быть удалены любым удобным способом, описанным в литературе или известным квалифицированному химику, как необходимые для удаления защитных групп, такие способы выбирают так, чтобы осуществить удаление защитной группы с минимальным затрагиванием других групп в молекуле.
[0061] Таким образом, если реагенты включают, например, такие группы, как амино, карбокси или гидрокси, может быть желательным защитить группу в некоторых реакциях, упомянутых в данном документе.
[0062] В качестве примера подходящая защитная группа для амино или алкиламино группы представляет собой, например, ацильную группу, например, алканоильную группу, такую как ацетил, алкоксикарбонильную группу, например, метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группы, арилметоксикарбонильную группу, например, бензилоксикарбонил, или ароильную группу, например, бензоил. Условия удаления указанных выше защитных групп обязательно изменяются в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или алкоксикарбонильная группа или ароильная группа, может быть удалена, например, путем гидролиза с помощью подходящего основания, например, гидроксида щелочного металла, например, гидроксида лития или натрия. Альтернативно ацильная группа, такая как трет-бутоксикарбонильная группа, может быть удалена, например, путем обработки подходящей кислотой, такой как соляная, серная или фосфорная кислоты, или в среде трифторуксусной кислоты, и арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть удалена, например, путем гидрирования над катализатором, таким как палладий-на-углероде, или путем обработки кислотой Льюиса, например BF3⋅OEt2. Соответствующей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которая может быть удалена путем обработки алкиламином, например диметиламинопропиламином, или гидразином.
[0063] Соединения по настоящему изобретению могут быть получены, используя общие способы синтеза, описанные в WO 2007/072017 и WO 2009/001021, полное содержание которых включено в настоящий документ посредством ссылки.
[0064] В конкретном аспекте настоящее изобретение относится к способу синтеза соединения формулы I или его фармацевтически приемлемой соли или сольвата, где способ включает:
a) взаимодействие соединения формулы A:
где R1 и R2, каждый, имеют одно из значений, приведенных выше;
с 1,3-диметил-1H-пиразол-4-карбальдегидом в присутствии подходящего восстанавливающего агента; и
b) далее необязательно и если необходимо:
i) удаление любых имеющихся защитных групп;
ii) преобразование соединения формулы I в другое соединение формулы I; и/или
iii) получение его фармацевтически приемлемой соли или сольвата.
[0065] Целесообразно, когда реакция между соединением формулы A и 1,3-диметил-1H-пиразол-4-карбальдегидом имеет место в присутствии подходящего растворителя. В этой реакции могут быть использованы любой подходящий растворитель или смесь растворителей. Примеры подходящих растворителей включают ДМСО, воду, ДМФА и спирты, например, EtOH.
[0066] Целесообразно, когда реакция протекает в присутствии подходящего восстановителя, такого как водный раствор Na2S2O4.26
[0067] Специалист в данной области сможет также подобрать подходящие условия реакции с целью облегчения этого взаимодействия.
[0068] Реакцию также можно проводить при повышенной температуре, например, может использоваться температура в диапазоне от 50 до 190°C (в зависимости от природы растворителя).
[0069] Полученное соединение формулы I может быть выделено и очищено с использованием способов, хорошо известных в данной области техники.
[0070] Способ, описанный в настоящем документе, может дополнительно включать стадию, в которой соединение формулы I подвергают солевому обмену, особенно в ситуациях, когда соединение формулы I образуется в виде смеси различных солевых форм. Солевой обмен соответствующим образом включает иммобилизацию соединения формулы I на подходящей твердой подложке или смоле и элюирование соединений соответствующей кислотой с получением одной соли соединения формулы I.
[0071] Соединения формулы A могут быть получены с помощью способов, известных в данной области техники.
[0072] Пример соответствующего способа получения соединения формулы I через промежуточное соединение формулы A показан на схеме 1 ниже.
Реагенты и условия: стадии (a) и (b), указанные выше, относятся только к производному 1,2,4-оксадиазола, потому что 1-(4-хлорбензил)пиперазин и 1-((5-метил-1,2,4-оксадиазол-3-ил)метил)пиперазин являются коммерчески доступными: (a) для производного 1,2,4-оксадиазола: CH2Cl2, 3-(хлорметил)-1,2,4-оксадиазол, Et3N, 50°C; (b) для производного 1,2,4-оксадиазола: ТФУ, CH2Cl2, комн. темп.; (c) для производных 4-хлорбензила и 1,2,4-оксадиазола: 2-амино-4,5-дихлор-3-нитропиридин, изо-Pr2NEt, изо-PrOH, нагревание; (d) для производных 4-хлорбензила и 1,2,4-оксадиазола: 1,3-диметил-1H-пиразол-4-карбальдегид, EtOH, 1M водн. Na2S2O4, 80°C.
Схема 1
[0073] 2-Амино-4,5-дихлор-3-нитропиридин (4,5-дихлор-3-нитропиридин-2-амин) и 2-амино-5-бром-4-хлор-3-нитропиридин (5-бром-4-хлор-3-нитропиридин-2-амин), предшественники в синтезе производных A 2-амино-3-нитропиридина, были получены, как описано ранее26 или путем галогенирования 2-амино-4-хлор-3-нитропиридина (4-хлор-3-нитропиридин-2-амин)40.
Фармацевтические композиции
[0074] В соответствии с еще одним аспектом изобретения предложена фармацевтическая композиция, которая содержит соединение по изобретению, описанное выше, или его фармацевтически приемлемую соль или сольват в ассоциации с фармацевтически приемлемым разбавителем или носителем.
[0075] Композиции по изобретению могут быть в виде, подходящем для перорального применения (например, в виде таблеток, лепешек, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде мелкодисперсного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде мелкодисперсного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного, внутримышечного, внутрибрюшинного или внутримышечного дозирования или в виде суппозиториев для ректального дозирования).
[0076] Композиции по изобретению могут быть получены с помощью обычных способов с использованием обычных фармацевтических инертных вспомогательных веществ, хорошо известных в данной области техники. Таким образом, композиции, предназначенные для перорального применения, могут содержать, например, один или несколько красителей, подсластителей, ароматизаторов и/или консервантов.
[0077] Эффективное количество соединения по настоящему изобретению для применения в терапии пролиферативных заболеваний представляет собой количество, достаточное для симптоматического облегчения симптомов инфекции у теплокровных животных, в частности, у человека, для замедления прогрессирования инфекции или для уменьшения риска ухудшения состояния у пациентов с симптомами инфекции.
[0078] Количество активного ингредиента, которое объединяют с одним или несколькими инертными вспомогательными веществами для получения единой лекарственной формы, будет обязательно меняться в зависимости от субъекта, получающего лечение, и конкретного пути введения. Например, препарат, предназначенный для перорального введения людям, обычно содержит, например, от 0,5 мг до 0,5 г активного агента (более подходяще, от 0,5 до 100 мг, например, от 1 до 30 мг) в сочетании с подходящим и удобным количеством инертного вспомогательного вещества, которое может изменяться от около 5 до около 98% по массе от общей композиции.
[0079] Размер дозы для терапевтических или профилактических целей соединения формулы I будет, естественно, меняться в зависимости от характера и тяжести состояний, возраста и пола животного или пациента и пути введения, в соответствии с хорошо известными принципами медицины.
[0080] При использовании соединения по изобретению в терапевтических или профилактических целях его обычно вводят таким образом, чтобы ежедневная доза была в диапазоне, например, от 0,1 мг/кг до 30 мг/кг массы тела, давая, если необходимо, в виде раздельных доз. Обычно при парентеральном пути введения используются более низкие дозы. Так, например, для внутривенного или внутрибрюшинного введения, обычно используется доза в интервале, например, от 0,1 мг/кг до 30 мг/кг массы тела. Аналогичным образом для введения путем ингаляции используется доза в интервале, например, от 0,05 мг/кг до 25 мг/кг массы тела. Пероральное ведение также может быть подходящим, в частности, в виде таблеток. Как правило, стандартные лекарственные формы будут содержать от около 0,5 мг до 0,5 г соединения по настоящему изобретению.
Терапевтическое использование и применение
[0081] Соединения по изобретению являются ингибиторами активности Aurora киназы и FLT3.
[0082] Таким образом, в другом аспекте настоящее изобретение относится к способу ингибирования активности Aurora киназы и/или FLT3 в клетке, где способ включает введение в указанную клетку соединения формулы I, как определено в настоящем документе, или его фармацевтически приемлемую соль или сольват.
[0083] В следующем аспекте настоящее изобретение относится к способу ингибирования активности Aurora киназы и/или FLT3 in vitro или in vivo, где указанный способ включает контактирование клетки с эффективным количеством соединения или его фармацевтически приемлемой соли или сольвата, как определено в настоящем документе.
[0084] В другом аспекте настоящее изобретение относится к способу ингибирования активности Aurora киназы и/или FLT3 у субъекта человека или животного, при необходимости такого ингибирования, где способ включает введение указанному субъекту эффективного количества соединения формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
[0085] Aurora киназа может представлять собой Aurora киназу A, B или C.
[0086] В одном аспекте настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли или сольвату или к фармацевтической композиции, как определено в настоящем документе, для применения в терапии.
[0087] В другом аспекте настоящее изобретение относится к соединению формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвату для применения при лечении заболевания или состояния, связанного с активностью Aurora киназы (и/или активностью FLT3).
[0088] В другом аспекте настоящее изобретение относится к применению соединению формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвату, при получении лекарственного средства для применения в лечении заболевания или состояния, связанного с активностью Aurora киназы (и/или активностью FLT3).
[0089] В еще одном аспекте настоящее изобретение относится к способу лечения пролиферативного расстройства у субъекта человека или животного, где способ включает введение указанному субъекту терапевтически приемлемого количества соединения формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
[0090] В еще одном аспекте настоящее изобретение относится к соединению формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвату для применения при лечении пролиферативного расстройства.
[0091] В еще одном аспекте настоящее изобретение относится к применению соединения формулы I, как определено в настоящем документе, или его фармацевтически приемлемой соли или сольвата при получении лекарственного средства для применения в лечении пролиферативного расстройства.
[0092] В другом аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли или сольвату или фармацевтической композиции, как определено в настоящем документе, для применения при лечении злокачественного новообразования.
[0093] В еще одном аспекте настоящее изобретение относится к применению соединения или его фармацевтически приемлемой соли или сольвата, как определено в настоящем документе, при получении лекарственного средства для применения в лечении злокачественного новообразования.
[0094] В еще одном аспекте настоящее изобретение относится к способу лечения злокачественного новообразования у пациента, нуждающегося в таком лечении, где указанный способ включает введение указанному пациенту