Способ обработки силикатного минерала
Иллюстрации
Показать всеИзобретение может быть использовано в химической промышленности. Способ обработки силикатного материала включает стадии приготовления первой композиции взаимодействием при температуре от 500 до 1200°C соединения карбоната щелочного металла с силикатом магния и контакта первой композиции с водой с получением второй композиции, включающей аморфный гидрат силиката магния (M-S-H); а также стадию выделения или получения оксида магния, гидроксида магния или силиката щелочного металла из второй композиции. Молярное отношение соединения карбоната щелочного металла, выраженного в виде оксида щелочного металла формулы R2O, где R представляет собой щелочной металл, к силикату магния, выраженному в виде диоксида кремния формулы SiO2, составляет от 4:1 до 1:4. Предложенное изобретение позволяет переработать минерал на основе силиката магния с химическим поглощением диоксида углерода и получением полезных продуктов. 2 н. и 7 з.п. ф-лы, 2 ил., 15 пр.
Реферат
Данное изобретение относится к способу обработки силикатного минерала. Способ использует в качестве исходного материала силикат магния и приводит к получению безводного продукта, включающего смешанный ортосиликат магния и щелочного металла, который затем обрабатывают водой, получая продукт, включающий аморфный гидрат силиката магния, который можно подвергнуть дальнейшим обработкам для получения других продуктов.
Породы на основе силиката магния составляют основную часть мантии Земли, и огромные поверхностные отложения такой породы также найдены во многих месторождениях. В составе мантии Земли присутствует примерно 70% основного ортосиликата магния (Mg2SiO4), и когда данный материал обнаруживается в кристаллической форме поблизости от поверхности Земли, обычно он находится в форме оливина, который по существу представляет собой твердый раствор форстерита (чистого Mg2SiO4) и фаялита (чистого Fe2SiO4), представляющих собой два основных компонента мантии Земли. В земной коре, в дополнение к оливину, также встречаются безводные силикаты магния в виде пироксенов, такие как энстатит (MgSiO3). Вследствие воздействия воды, либо на поверхности, либо в глубине земной коры, безводные силикаты магния превращаются в обычные минералы на основе гидратов силиката магния, такие как серпентин (с идеализированным общим составом Mg3Si2O5(OH)4), а также тальк (с идеализированным общим составом Mg3Si4O10(OH)2).
Породы на основе силиката магния являются превосходным источником двух важных элементов, магния и кремния, в их оксидных формах (MgO и SiO2). Способы извлечения данных двух оксидов из таких пород до настоящего времени были избыточно энергоемкими и, таким образом, не были запущены в серийное производство.
Хотя минералы на основе силиката магния имеют тенденцию быть весьма ''нереакционноспособными'' (например, в том плане, что они имеют высокие температуры плавления, а также очень медленно растворяются в воде или разбавленных кислотах), известно, что они будут быстро взаимодействовать с расплавленными карбонатами щелочных металлов, такими как карбонат натрия (Na2CO3). Такие способы, обычно называемые ''карбонатным плавлением'', часто используются при приготовлении минералов для химического анализа. Как правило, добавляют большой избыток твердого карбоната щелочного металла (типично, по меньшей мере, десять частей карбоната щелочного металла к одной части породы на основе силиката магния) и смесь нагревают значительно выше температуры плавления карбоната щелочного металла. Силикат магния полностью растворяется в полученном в результате расплаве, который после охлаждения можно легко и быстро растворить в сильной водной кислоте и затем раствор проанализировать стандартными химическими методиками, таким образом давая возможность провести полный элементный анализ породы. Способ карбонатного плавления представляет собой мелкомасштабный процесс; он является аналитическим, не препаративным и не является энергосберегающим, поскольку включает в себя плавление большого избытка карбоната щелочного металла для того, чтобы полностью растворить силикат магния.
Термин ''смешанный силикат магния и натрия'' иногда используют, в соответствии с Международной номенклатурой косметических ингредиентов (INCI), для идентификации синтетических гекторитов в форме наночастиц, которые формируют прозрачные гели в воде. Согласно информации, предоставляемой одним из производителей таких продуктов, гекториты имеют формулу (Mg5,2Li0,8)(Si8)O20(OH)4Na0,8.
Настоящее изобретение нацелено на предложение способа получения из породы на основе силиката магния смешанных ортосиликатов магния и щелочного металла и оксида магния и/или силикатов щелочного металла, которые можно использовать, подвергнув химическому поглощению диоксида углерода (CO2), и которые можно подвергнуть дальнейшим обработкам с получением ряда полезных продуктов.
Соответственно, настоящее изобретение предлагает способ получения второй композиции, причем указанный способ включает стадии:
- приготовления первой композиции, включающей смешанный ортосиликат магния и щелочного металла и, необязательно, (i) оксид магния или (ii) силикат щелочного металла, взаимодействием при температуре от 500 до 1200°C соединения карбоната щелочного металла, причем данное соединение представляет собой карбонат щелочного металла, бикарбонат щелочного металла или их смесь, с силикатом магния, причем молярное отношение соединения карбоната щелочного металла, выраженного в виде оксида щелочного металла формулы R2O, где R представляет собой щелочной металл, к силикату магния, выраженному в виде диоксида кремния формулы SiO2, составляет от 4:1 до 1:4, и
- контакта первой композиции с водой с получением второй композиции, включающей аморфный гидрат силиката магния (M-S-H).
M-S-H представляет аморфный гидрат силиката магния переменного состава. Он может быть представлен формулой оксида в виде pMgO⋅SiO2⋅qH2O, где p обычно равно от 0,5 до 2,0 и, предпочтительно, от 0,6 до 1,5; и q обычно равно от 1 до 4.
Молярное отношение соединения карбоната щелочного металла, выраженного в виде оксида щелочного металла, к силикату магния, выраженному в виде диоксида кремния, предпочтительно, составляет от <4:1 до 1:4, более предпочтительно от 3:1 до 1:3, например, от 2:1 до 1:2. Данное отношение, наиболее предпочтительно, равно примерно 1.
Щелочной металл, предпочтительно, представляет собой калий или, более предпочтительно, натрий.
Соединение карбоната щелочного металла предпочтительно представляет собой карбонат щелочного металла. Следует понимать, что, когда соединение карбоната щелочного металла включает бикарбонат, последний будет обычно разлагаться до соответствующего карбоната при температурах, используемых в способе по изобретению.
Соединение карбоната щелочного металла может быть безводным или гидратированным. Гидраты карбоната натрия включают моногидрат и дигидрат. Гидраты карбоната калия включают сесквигидрат (также известный как полугидрат). Является предпочтительным, когда это экономически обосновано, использовать соединения безводных карбонатов щелочных металлов, чтобы избежать расходования энергии, требующейся для удаления гидратной воды.
Силикат магния, используемый в способе по изобретению, как правило, представляет собой минеральный силикат, например, породу на основе силиката магния, включающую силикат магния общего состава:
m(MgO)⋅t(QO)⋅SiO2⋅xH2O,
где m равно от 0,5 до 3, t меньше или равно 1, x равен от нуля до 2, и Q представляет металл или металлы, отличные от магния (например, кальций и/или металл переходной группы, такой как железо, хром или никель). Предпочтительно, порода на основе силиката магния включает 20% или более, более предпочтительно 50% или более силиката магния общего состава, описанного выше. Предпочтительно, когда Q представляет железо, никель и/или хром, способ по настоящему изобретению включает отделение соединения железа, никеля и/или хрома.
Необходимо понимать, что состав или формулу минералов часто изображают в виде теоретического количества оксидов, которые они содержат; однако оксиды не присутствуют как таковые в минералах, состав которых изображен таким способом.
Такие минералы включают оливины, например, форстерит и монтичеллит; серпентины, например, антигорит, хризолит, лизардит, сепиолит и гарниерит; пироксены, например, энстатит, диопсид, бронзит и гиперстен; амфиболы, например, амозит, антофиллит, тремолит и актинолит; гумиты, например, хондродит и норбергит; и другие минералы, такие как хлорит, тальк, иддингсит и гекторит. Данные минералы могут содержать значительные количества железа в дополнение к магнию и кремнию, а также значительные количества кальция, алюминия и щелочных металлов.
Асбест включает группу встречающихся в природе минералов, которые включают волокнистые минералы серпентин (например, хризолит) и амфибол (например, амозит, антофиллит, тремолит и актинолит). Известно, что волокнистые формы являются вредными для здоровья и считаются канцерогенными для человека. Способ по изобретению предлагает средство превращения данных минералов в полезные (и неканцерогенные) материалы.
Минеральный силикат, используемый в способе по изобретению, предпочтительно, представляет собой силикат магния. Мольное отношение MgO/SiO2 предпочтительно составляет от 0,5 до 3, более предпочтительно от 0,65 до 2. Мольное отношение CaO/SiO2 предпочтительно ≤0,5. Мольное отношение FeO/SiO2 предпочтительно ≤0,5. Содержание других элементов в виде мольного отношения (общее количество оксидов)/SiO2, предпочтительно, ≤0,2.
Соединение карбоната щелочного металла, используемое в способе по изобретению, может являться минералом, например, трона (дигидрат гидрокарбоната тринатрия; Na3H(CO3)2⋅2H2O), или имеющимся в продаже соединением. Оно может содержать примеси, например, гидроксиды и силикаты, и обычно в меньших количествах другие примеси, например, хлориды, сульфаты, сульфиты, нитраты и нитриты. Если присутствуют примеси (например, нитраты или гидроксиды щелочных металлов), которые при температуре, используемой в способе по изобретению, разлагаются до оксида щелочного металла, их следует принимать во внимание при вычислении количества оксида щелочного металла.
Способ по изобретению предпочтительно осуществляют при температуре от 600 до 1100°C, более предпочтительно от 800 до 1000°C. Нагревание обычно осуществляют в течение времени от нескольких минут до нескольких часов.
Способ предпочтительно осуществляют при температуре, при которой силикат магния является твердым, а карбонат щелочного металла, соответствующий соединению карбоната щелочного металла, является твердым или жидким.
Согласно характерной особенности изобретения, способ осуществляют при температуре ниже температуры плавления карбоната щелочного металла, соответствующего соединению карбоната щелочного металла.
Авторы изобретения неожиданно обнаружили, что можно получить высокую степень протекания реакции между соединением карбоната щелочного металла, предпочтительно карбонатом щелочного металла, и силикатом магния, когда два материала контактируют друг с другом в твердом состоянии. Предпочтительно, они находятся в дисперсной форме, например, в виде порошков. Смесь соединений предпочтительно нагревают, например, в печи до температуры, близкой, но ниже, чем температура плавления карбоната щелочного металла, соответствующего соединению щелочного металла. Отношение используемых карбоната и силиката, предпочтительно, по существу равно стехиометрическому отношению, рассчитанному, исходя из того, что один моль оксида щелочного металла (в общем виде написанного в виде ''R2O'', в котором R является таким, как определено выше для соединения карбоната щелочного металла) эквивалентен одному молю диоксида кремния (SiO2), присутствующему в силикате магния. Например, стехиометрическое массовое отношение для реакции между чистым форстеритом (Mg2SiO4, молек. масс. = 140) и чистым безводным карбонатом натрия (Na2CO3, молек. масс. = 106) было бы 140:106. Понятно, что действительные источники силиката и карбоната, используемые на практике, не всегда являются чистыми, но идеализированное стехиометрическое отношение относится к отношению, в котором нагреваемая смесь имеет общее молярное отношение R2O:SiO2, по существу равное единице.
Силикат магния и соединение карбоната щелочного металла, используемые в способе по настоящему изобретению, предпочтительно находятся в дисперсной форме или в формованном виде, например, в виде таблеток.
Породу, используемую для обеспечения силиката магния и/или соединения карбоната щелочного металла для способа по настоящему изобретению, как правило, будут подвергать сушке, дроблению и, при необходимости, измельчению (например, совместному измельчению) до желательного распределения размера частиц. Например, силикат магния можно раздробить до гранулометрии мелкого песка (размер зерна от 0,06 до 0,2 мм) или, при необходимости, измельчить в мелкодисперсный порошок (размер зерна менее 0,06 мм). Размер зерна более чем 0,06 мм, как правило, определяют просеиванием. Размер зерна менее чем 0,06 мм, как правило, определяют лазерной гранулометрией. Нежелательные минеральные примеси можно отделить до степени, соответствующей эффективности использования энергии, механическими или другими методами разделения.
В одном варианте осуществления способ по изобретению проводят в печи с движущейся колосниковой решеткой. Данная процедура в особенности подходит для пород на основе силиката магния (пород, в основном включающих MgO и SiO2), в которых молярное отношение MgO/SiO2 близко по величине или превышает 1.
Смесь соединения карбоната щелочного металла и силиката магния, причем каждый компонент присутствует в дисперсной форме, формуют в таблетки (например, используя тарельчатый или барабанный гранулятор). К смеси можно добавить воду для содействия процессу гранулирования. Таблетки подают на движущуюся колосниковую решетку, включающую, например, жаропрочный стальной сплав, где они нагреваются, например, в результате пропускания горячих газов, например, газов сгорания топлива. Горячие газы могут быть пропущены через слой таблеток на колосниковой решетке с помощью вентиляторов, обычно помещенных под колосниковую решетку. Способ схематически иллюстрируется на фиг. 1 прилагаемых чертежей.
Типично, горячие газы получают сжиганием в избытке воздуха горючего ископаемого, такого как природный газ, нефть или уголь; также можно использовать топливо, полученное из отходов или биомассы, такое как древесная стружка, или газы сбраживания отходов. Предпочтительно, используемое топливо должно иметь низкое содержание серы, например, <1%. Прохождение горячих газов через слой нагревает частицы, в конечном счете, до желаемой температуры.
Скорость нагрева контролируют, например, варьируя количество топлива, скорость движения колосниковой решетки и/или скорость вытяжных вентиляторов, чтобы обеспечить хорошую общую эффективность использования энергии, а также гарантировать, что таблетки сохраняют свою механическую целостность в течение процесса. Движущаяся колосниковая решетка спроектирована так, что газы можно пропускать через слой несколько раз вдоль длины решетки, позволяя осуществить эффективный теплообмен между газами и таблетками, так что газы, выходящие из печи, являются настолько холодными, насколько это возможно. Более того, как только таблетки проходят через наиболее горячую зону (''зону горения'') сразу после сгорания топлива, их охлаждают посредством пропускания воздуха через данный слой, так что их температура становится настолько низкой, насколько возможно, перед их выгрузкой из слоя. Поступающий воздух, подогретый таким способом с помощью отводимых твердых частиц, используют в качестве основного источника воздуха для сжигания топлива в зоне горения, таким образом приводя к высокой общей тепловой эффективности данного типа печи. Теоретическая общая химическая реакция, протекающая в течение процесса нагревания, показана ниже в уравнении (1a) для реакции между форстеритом (Mg2SiO4) и карбонатом щелочного металла (R2CO3):
| (1a) | Mg2SiO4+R2CO3⇒MgO+R2MgSiO4+CO2↑, |
в котором R является таким, как определено выше. Более общую форму данной реакции можно написать в виде уравнения (1b) для m>=1 и уравнения (1c) для m<1:
| (1b) | m(MgO)⋅t(QO)⋅SiO2⋅xH2O+R2CO3⇒(m-1)MgO+R2MgSiO4+tQO+CO2↑+xH2O↑ |
| (1c) | m(MgO)⋅t(QO)⋅SiO2⋅xH2O+R2CO3⇒(1-m)R2SiO3+mR2MgSiO4+tQO+CO2↑+xH2O↑, |
где m больше или равно 1 для реакции (1b) и меньше или равно 1 для реакции (1c); и Q, t, x являются такими, как определено выше. Вертикальные стрелки ↑ показывают, что газообразный диоксид углерода и пары воды, образующиеся в данной реакции, улетучиваются из слоя и уходят вместе с остатком отходящих газов. Таким образом, в идеальном случае конечный твердый продукт, остающийся в обработанных гранулах, представляет собой однородную смесь, включающую смешанный ортосиликат магния и щелочного металла (R2MgSiO4) и необязательно либо оксид магния (MgO, также известный как периклаз), либо силикат щелочного металла (R2SiO3), а также другие твердые продукты, включающие другие металлы (Q), в особенности железо, которое может присутствовать в виде магнетита (Fe3O4) или, возможно, в виде феррита щелочного металла (RFeO2), кальций, который может присутствовать в виде силикатов, хром, который может присутствовать в виде хроматов щелочных металлов (R2CrO4), и никель, который может присутствовать в виде оксидов.
Идеализированные реакции, показанные уравнениями (1a, b, c), иллюстрируют получение смешанных ортосиликатов магния и щелочного металла плюс оксидов и силикатов магния и/или других металлов в результате прямой реакции стехиометрической (т.е. 1:1 R2O:SiO2) смеси силиката магния и карбоната щелочного металла.
Данный тип реакции является очень эндотермичным, главным образом, вследствие высвобождения газообразного диоксида углерода: расходуется примерно 3,4 кДж (т.е. примерно 0,8 ккал) тепла на грамм высвобожденного CO2. Таким образом, независимо от температуры, при которой проводят реакцию, будет существовать значительный чистый расход энергии для всего процесса. Однако, если реакцию проводят, как описано выше, в топочной системе, которая позволяет осуществить хороший противоточный теплообмен между отходящими горячими газами и поступающими твердыми веществами и, аналогичным образом, между отводимыми твердыми веществами и поступающим воздухом для горения, чистый расход энергии можно понизить до величины, близкой к теоретическому пределу, данному выше. Для энергосбережения важно иметь эффективный противоточный теплообмен как в начале, так и в конце процесса, на входе и на выходе, например, в печи с движущейся колосниковой решеткой, как описано выше.
В дальнейшем варианте осуществления способ по изобретению проводят в системе, включающей движущиеся колосниковые решетки для предварительного нагрева и охлаждения и вращающуюся печь для способа по изобретению, который включает стадию декарбонизации, которая генерирует диоксид углерода.
Когда используют систему движущейся колосниковой решетки, важным является поддерживать твердое вещество в форме таблеток подходящего размера, чтобы они формировали пористый слой на решетке, позволяя проходить газам. Таблетки, предпочтительно, сохраняют свою механическую целостность; они, предпочтительно, также сохраняют свой средний размер внутри предварительно определенных границ.
Согласно характерной особенности изобретения, для того чтобы содействовать сохранению механической целостности таблеток: (a) максимальная температура твердого вещества в способе не превышает существенно температуру плавления карбоната щелочного металла, соответствующего соединению карбоната щелочного металла, и/или (b) максимальная объемная доля твердого вещества материала, образующего расплав (по существу карбоната щелочного металла), в таблетках, как правило, ниже значения, при котором гранула будет значительно деформироваться, даже если карбонат щелочного металла плавится. Данное значение, как правило, ниже примерно 35% от общего объема твердой фазы. Однако, поскольку сама реакция не приводит к образованию никаких жидких продуктов (только твердые вещества и газы) при предпочтительно используемых температурах, риск, что гранулы будут существенно деформированы вследствие плавления, является достаточно низким даже при существенно более высоких исходных объемных долях карбоната щелочного металла при условии, что нагревание происходит достаточно медленно, чтобы позволить значительную степень протекания реакции до того, как карбонат щелочного металла полностью расплавится.
Согласно дальнейшей характерной особенности изобретения, способ по настоящему изобретению проводят в системе подогрева суспензии, включающей множество циклонов в подогревателе-теплообменнике и, например, вращающуюся печь, например, как используется на типичном современном цементном заводе. Исходные материалы, например, в виде смешанного по существу сухого порошка подают (холодными) в верхнюю часть циклона теплообменника. В течение своего прохождения через башню циклонного теплообменника, посредством противоточного теплообмена с отходящими газами печи материал нагревается почти до температуры плавления карбоната щелочного металла, соответствующего соединению карбоната щелочного металла, но без достижения данной температуры плавления, чтобы избежать, например, образования отложений на стенках теплообменника. В нижней части башни теплообменника смешанный порошок поступает во вращающуюся печь, в которой, по мере увеличения температуры до температуры плавления карбоната щелочного металла, порошок самогранулируется. Отношение соединения карбоната щелочного металла к силикату магния и/или распределение размера частиц силиката магния и соединения карбоната щелочного металла в дисперсной форме выбирают таким, чтобы содействовать самогранулированию. Затем гранулы декарбонизируют во вращающейся печи. Затем декарбонизированные гранулы охлаждают, например, в холодильнике с движущейся колосниковой решеткой, как это осуществляется на типичном современном цементном заводе. Тепло от горячих гранул можно использовать, чтобы подогреть поступающий в печь воздух для горения посредством противоточного теплообмена.
Декарбонизированные и охлажденные таблетки или гранулы, включающие смешанный ортосиликат магния и щелочного металла и, необязательно, оксид магния или силикат щелочного металла, обрабатывают, чтобы разделить продукты реакции.
В способе по изобретению первая композиция, включающая смешанный ортосиликат магния и щелочного металла и, необязательно, продукты, представляющие собой оксид магния или силикат щелочного металла, контактирует с водой с образованием второй композиции, включающей твердые аморфные гидраты силиката магния (и, необязательно, твердый оксид или гидроксид магния), вместе с водным раствором, включающим катионы щелочного металла, гидроксид-анионы и анионы силиката.
Первую композицию в виде, например, таблеток или гранул предпочтительно быстро охлаждают в некотором количестве воды, так что конечная смесь после охлаждения имеет температуру, близкую к 100°C, но не превышающую данное значение, т.е. достаточную для быстрого охлаждения твердого вещества, но исключающую избыточное испарение воды. Горячее, подвергнутое быстрому охлаждению твердое вещество затем предпочтительно размалывают и механически перемешивают в форме суспензии. Если необходимо, можно добавить больше воды. Может быть необходимым дополнительное нагревание.
Альтернативно, обработку водой, например, в процессе быстрого охлаждения и формирования суспензии, как описано выше, можно проводить при температуре выше 100°C, если используют сосуд для работы под давлением (например, автоклав).
Альтернативно, вышеуказанный процесс быстрого охлаждения и формирования суспензии можно проводить при более низкой или комнатной температуре. Воду для превращения первой композиции во вторую композицию можно, необязательно, использовать из другой части способа.
Цель состоит в разделении компонентов второй композиции, поскольку (a) карбонаты, силикаты, хроматы, сульфаты и оксиды или гидроксиды щелочных металлов будут иметь тенденцию легко растворяться в воде; (b) смешанные ортосиликаты магния и щелочного металла будут иметь тенденцию гидратироваться в горячей воде с высвобождением щелочных металлов в раствор в виде силикатов и гидроксидов, причем остающаяся часть будет давать тонкую суспензию твердых аморфных гидратов силиката магния, и (c) оксид магния (MgO, также известный как периклаз) в образце будет иметь тенденцию гидратироваться в горячей воде с получением гидроксида магния (Mg(OH)2, также известного как брусит), образуя мягкий, легко диспергирующийся порошок.
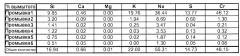
Может являться необходимым механически перемешивать суспензию. Затем жидкую фазу можно отделить от объемной массы непрореагировавшего смешанного ортосиликата магния и щелочного металла и других непрореагировавших безводных соединений, например, просеиванием, и мелкодисперсные частицы гидроксида магния и/или аморфных гидратов силиката магния, которые проходят через сито в виде суспензии, можно выделить из суспензии посредством, например, фильтрования, пропускания через гидроциклон, осаждения и/или центрифугирования. Водная фаза после отделения гидроксида магния включает водный раствор силикатов и гидроксидов щелочных металлов.
Альтернативно, процесс разделения можно провести в двух стадиях, причем первая стадия включает процесс быстрой промывки для удаления основной части легко растворимых карбонатов, силикатов и гидроксидов щелочных металлов, а вторая стадия, проводимая с дополнительным количеством воды, включает дальнейшую гидратацию как оксида магния, так и смешанного ортосиликата магния и щелочного металла. В данном двухстадийном подходе температура воды предпочтительно ниже для первой стадии (например, ниже, чем 60°C) по сравнению с температурой для второй стадии, и для второй стадии можно использовать автоклав, если это необходимо.
Полный результат процесса разделения, описанного выше, можно суммировать следующим образом.
Твердые продукты из способа по изобретению, например, из печи или обжиговой печи (например, смесь крупных частиц непрореагировавших исходных материалов с R2MgSiO4, MgO или R2SiO3, QO и, возможно, некоторым остаточным количеством R2CO3) контактирует с водой, давая вторую композицию, включающую:
(a) тонкую суспензию, включающую аморфные гидраты силиката магния и необязательно Mg(OH)2 в сильнощелочном растворе, обогащенном силикатами, гидроксидами и, возможно, также карбонатами щелочных металлов, и
(b) крупнозернистое непрореагировавшее твердое вещество, включающее R2MgSiO4 и, необязательно, MgO, QO и непрореагировавшие частицы исходной породы на основе силиката магния (например, Mg2SiO4) и которое легко отделяется осаждением (например, в гидроциклоне) от суспензии.
Тонкую суспензию затем можно дополнительно разделить (например, фильтрованием), получая
(c) мелкие твердые частицы, обогащенные аморфными гидратами силиката магния и необязательно Mg(OH)2, и
(d) раствор, обогащенный силикатами, гидроксидами и, возможно, также карбонатами щелочных металлов, а также включающий незначительные количества растворимых в щелочной среде примесей, например, сульфатов и хроматов.
Начальную часть реакции твердых продуктов в способе по изобретению с водой можно качественно описать следующим образом, для m≥1 (уравнение 2a) и m≤1 (уравнение 2b):
| (2a) | (m-1)MgO+R2MgSiO4⇒(m-1)Mg(OH)2+''M-S-H''+2R++(OH-, H2SiO42-, CO32-) |
| (2b) | (1-m)R2SiO3+mR2MgSiO4⇒''M-S-H''+2R++(OH-, H2SiO42-, CO32-). |
В вышеуказанных реакциях основными образовавшимися твердыми соединениями являются аморфный гидрат силиката магния, ''M-S-H'', переменного состава, плюс, в случае, когда m>1, гидроксид магния (брусит). Щелочные металлы могут полностью растворяться в водной фазе в виде катионов щелочных металлов (R+), и заряд данных катионов щелочных металлов сбалансирован смесью растворенных анионов, например, гидроксида (OH-), силиката (H2SiO42-) и, возможно, также карбоната (CO32-), присутствующих в различных соотношениях в зависимости от используемых условий и материалов. Следует также понимать, что уравнения (2a) и (2b) не являются полностью сбалансированными уравнениями, а скорее они просто предназначены для указания основных исходных продуктов реакции между твердыми продуктами способа по изобретения и водой.
В еще одном варианте осуществления изобретения щелочной раствор, полученный в стадии (d), контактирует с газом, содержащим диоксид углерода, например, отходящими газами процесса горения, чтобы поглотить диоксид углерода с получением карбоната щелочного металла, бикарбоната щелочного металла или их смеси, обычно в растворе, и (осажденного) диоксида кремния.
Например, водный раствор из стадии (d), включающий в основном гидроксиды и силикаты щелочных металлов, а также остаточное количество карбонатов щелочных металлов, контактирует с газом, содержащим диоксид углерода, например, обогащенными CO2 отходящими газами процесса горения, такими как газы, выходящие из печи обжига, используемые для термической обработки таблеток или гранул, и газы, выходящие из теплообменника. Раствор быстро поглощает CO2 из таких газов с образованием раствора карбонатов и бикарбонатов щелочных металлов и осадка аморфного диоксида кремния в соответствии со следующими ниже, или аналогичными, уравнениями:
| (3) | CO2 (газ) + 2ROH (в растворе) ⇒ R2CO3 (в растворе) |
| (4) | CO2 (газ) + R2SiO3 (в растворе) ⇒ R2CO3 (в растворе) + SiO2 (твердый осадок) |
| (5) | CO2 (газ) + R2CO3 (в растворе) ⇒ 2RHCO3 (в растворе) |
Полученный в результате твердофазный осадок диоксида кремния отделяют от раствора, например, фильтрованием, пропусканием через гидроциклон, осаждением и/или центрифугированием. Чтобы избежать получения осадка избыточно мелкодисперсного диоксида кремния, который может привести к тому, что раствор полностью превратиться в гель, или который очень трудно отфильтровать или отделить, контролируют концентрацию, температуру раствора в течение нейтрализации и/или скорость нейтрализации. В раствор также можно ввести дополнительные растворенные вещества, например, известные соли. Осажденный диоксид кремния, образовавшийся по реакции (4), указанной выше, можно отделить, промыть и высушить для использования в различных областях.
Исходя из массового баланса, необходимо понимать, что реакции (3) и (4) в принципе должны быть способны поглощать по существу весь CO2, выделяющийся в результате химической реакции, протекающей в способе по изобретению, как показано в реакции (1), но дополнительное количество CO2, образующегося в результате процесса сгорания, требующегося для нагревания исходных материалов, будет требовать дополнительной реакции для своего полного поглощения, например, такой реакции, как (5), или дополнительной реакции с другим абсорбентом.
Таким образом, настоящее изобретение предлагает способ, как описано выше, который дополнительно включает выделение или получение оксида магния, гидроксида магния или силиката щелочного металла из второй композиции.
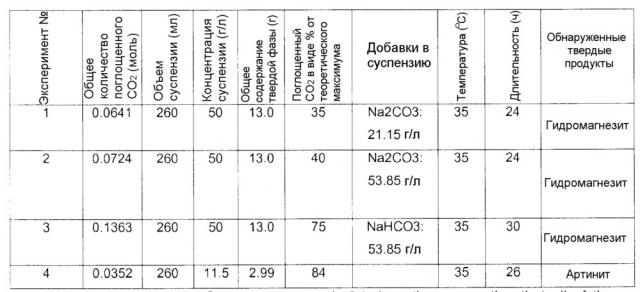
В еще одном варианте осуществления изобретения вторую композицию, включающую M-S-H, карбонизируют, т.е. осуществляют контакт с газом, содержащим диоксид углерода, предпочтительно в присутствии воды, получая третью композицию, включающую соединение карбоната магния. Скорость данной реакции можно контролировать температурой, давлением, относительной влажностью, присутствием катализаторов и/или типом используемого реактора. Реакцию карбонизации можно представить, например, уравнением:
| (6) | sCO2 (газ) + pMgO⋅SiO2⋅qH2O ⇒ s''MgCO3'' + (p-s)MgO⋅SiO2·q'H2O. |
Первый продукт данной реакции карбонизации, показанный выше как ''MgCO3'', может представлять собой либо просто карбонат магния, такой как магнезит (MgCO3) или несквегонит (MgCO3⋅3H2O), либо гидраты сложных гидрокси-карбонатов магния, такие как гидромагнезит (Mg(OH)2·4MgCO3⋅4H2O) или артинит (Mg(OH)2·MgCO3⋅3H2O), в зависимости от используемых условий. Второй продукт данной реакции, показанный выше как ''(p-s)MgO·SiO2⋅q'H2O'', представляет либо аморфный гидрат силиката магния с более низким отношением магний/кремний (p-s) по сравнению с (p) исходного гидрата силиката магния, либо, в случае, когда p=s, он представляет собой просто (гидратированный) аморфный диоксид кремния.
В дальнейшем варианте осуществления крупнозернистое, частично прореагировавшее твердое вещество, отделенное от реакционных продуктов, образовавшихся в указанной выше стадии 1(b), включает в основном непрореагировавший силикат магния (например, Mg2SiO4), смешанный с некоторыми промежуточными продуктами (например, Na2MgSiO4). Оно может быть подвергнуто сушке и повторно использовано путем смешивания с дополнительным количеством исходного материала, представляющего собой неочищенный силикат магния, для подачи обратно в процесс. Необходимо понимать, что сушку следует проводить энергосберегающим образом, например, сначала сливая и затем используя отходящее тепло от печи или других источников.
Согласно дальнейшей характерной особенности изобретения все твердые продукты из способа по изобретению, например, из печи или обжиговой печи (например, смесь крупнозернистых частиц непрореагировавших исходных материалов с R2MgSiO4 и MgO или R2SiO3 и/или QO и, возможно, некоторым количеством остаточного R2CO3) перемалывают вместе в водой, получая суспензию или взвесь, которую затем приводят в контакт с газом, содержащим диоксид углерода, например, обогащенными CO2 отходящими газами процесса горения, такими как газы, выходящие из печи обжига, используемой для термической обработки таблеток или гранул, и газы, выходящие из теплообменника. В течение данной обработки, в дополнение к другим реакциям, описанным выше (например, в уравнениях (2), (3), (4), (5) и (6)), соединение смешанного ортосиликата магния и щелочного металла также может взаимодействовать непосредственно с CO2, как представлено уравнениями (7) и (8) ниже:
| (7) | R2MgSiO4+2CO2⇒MgCO3 (твердое вещество) + SiO2 (твердое вещество) + R2CO3 (в растворе) |
или, альтернативно, используя раствор бикарбоната щелочного металла для достижения такой же реакции:
| (8) | R2MgSiO4+4RHCO3⇒MgCO3 (твердое вещество) + SiO2 (твердое вещество) + 3R2CO3 (в растворе). |
Бикарбонат щелочного металла RHCO3, используемый в реакции (8), может образоваться при взаимодействии раствора карбоната щелочного металла R2CO3, полученного в реакции (7), с диоксидом углерода, как показано в уравнении (5).
Реакции типа, представленного уравнениями (7) и (8), можно осуществить при комнатных температурах и атмосферных давлениях или при повышенных температурах и давлениях, вплоть до 300 атмосфер и 300°C. Могут образовываться и быть отделены дополнительные твердые продукты, такие как сложные карбонаты магния и щелочных металлов (например, эйтелит, Na2CO3·MgCO3), либо для повторного использования в способе, либо в качестве полезных продуктов как таковых.
Данные типы реакций способны поглощать