Способ эндоваскулярной химиоэмболизации печеночных артерий
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии и эндоваскулярной хирургии. Проводят пункцию правой или левой лучевой артерии. Затем осуществляют катетеризацию устья общей печеночной артерии проводниковым катетером Jadkins right 6F, длиной 100 см. После этого заводят по проводнику баллонный катетер типа over the wire с длиной шафта 130-135 см, диаметром и длиной баллона 4,0×20 мм. Затем через шахту баллонного катетера проводят ангиографический проводник в дистальные отделы печеночной артерии. После чего проводят баллонный катетер к новообразованию, раздувают его под давлением 4 атм. Затем удаляют проводник из катетера, выполняют инфузию лекарственно-насыщаемых микросфер через основную шахту баллонного катетера. В частном случае используют ангиографический гидрофильный проводник с «J» кончиком, диаметром 0,018 или 0,035 дюйма. Способ позволяет осуществить раннюю активизацию пациента, избежать таких осложнений как забрюшинная гематома, ложная аневризма, артерио-венозная фистула, а также предотвратить рефлюксэмболизирующих частиц в не целевые сосуды, а также спазм целевого сосуда. 1 з.п. ф-лы, 1 пр., 6 ил.
Реферат
Изобретение относится к медицине, а именно к онкологии и эндоваскулярной хирургии, и может быть использовано при лечении злокачественных новообразований и метастатического поражения печени.
Лечение злокачественных опухолей печени является одной из наиболее актуальных проблем клинической онкологии. По данным всемирной организации здравоохранения (ВОЗ) первичный рак печени входит в десятку наиболее часто встречающихся злокачественных опухолей. По результатам вскрытий метастазы рака в печень обнаруживаются у 20-30% онкологических больных, перенесших резекцию толстой кишки. У половины этих пациентов отсутствуют поражения опухолью других органов и именно метастазы печени являются причиной смерти.
Единственным методом, позволяющим добиться длительной выживаемости при злокачественном новообразовании печени, является хирургическая резекция. Однако к моменту диагностики радикальное удаление опухоли возможно лишь у 5-15% больных, а остальные пациенты подлежат паллиативному лечению. Рецидив опухоли в течение 3-5 лет после резекции печени наблюдается у 70-90% больных. Из них повторную резекцию удается выполнить не более чем в 10% случаев.
Из изложенного выше очевидно, что паллиативная противоопухолевая терапия требуется более чем 80% больных со злокачественным поражением печени. К сожалению, такие традиционные методы, как системная химиотерапия и облучение при новообразованиях печени малоэффективны. Попытки найти более действенные, малоинвазивные и вместе с тем эффективные способы терапии являлись стимулом в разработке внутрисосудистых вмешательств под рентгеноконтролем - метод интервенционной радиологии.
Лечебные рентгеноэндоваскулярные вмешательства при злокачественных опухолях печени можно условно разделить на две группы:
1. Артериальные:
- Химиоинфузия в печеноную артерию (ХИПА)
- Эмболизация печеночной артерии (ЭПА)
- Химиоэболизация печеночной артерии (ХЭПА)
- Масляная химиоэмболизация печеночной артерии (МХЭПА)
2. Внутрипортальные:
- Химиоинфузия воротной вены (ХИВВ)
- Масляная химиоэмболизация воротной вены (МХЭВВ)
- Механическая эмболизация воротной вены (ЭВВ)
Механизм внутриартериальной терапии основан на том факте, что питание новообразований печени на 90-95% осуществляется за счет артериальной крови, в то время как нормальная паренхима имеет двойное кровоснабжение: 70% из воротной вены и лишь 30% из печеночной артерии. В этих условиях, как регионарная химиотерапия, так и артериальное окклюзирование вызывают значительное воздействие на опухоль при относительно небольшом повреждении здоровой ткани печени. Чем селективнее (ближе к опухоли) установлен катетер, тем сильнее противоопухолевый эффект и меньше отрицательное действие на нормальную паренхиму печени [A.M. Гранов, М.И. Давыдов, «Интервенционная радиология в онкологии», Санкт-Питербург. – 2007. С. 98-99].
Также известен способ химиоэмболизации при первичных злокачественных и метастатических опухолях [Патент RU №2138204, 1999 г.], который осуществляют за счет того, что применяют сочетанное воздействие на опухолевое поражение с артериальной дистальной эмболизацией и суперселективной внутриартериальной химиотерапией, при этом проводят эмболизацию опухолевых новообразованных сосудов. Эмболизации подвергают все обнаруживаемые новообразованные опухолевые артерии с целью тотальной деваскуляризации опухоли. Этого достигают использованием широкого спектра эмболизирующих веществ, в качестве которых могут применять калиброванные эмболы (тефлон, ивалон, поролон), специальные приспособления (металлические спирали, клипсы), различные склерозирующие вещества (абсолютный этанол, 60% раствор глюкозы). Одновременно в эмболизируемую артерию инфузируют противоопухолевой препарат.
Предложенные выше методы имеют ряд недостатков:
- ХИЛА - инфузия высоких доз химиопрепарата за счет вымывания током крови не обеспечивает адекватное насыщение опухоли.
- ЭПА - в отсутствии химиопрепаратов не дает адекватного лечебного эффекта на опухолевый процесс.
- Внутрипортовые эндоваскулярные методы обладают низкой эффективностью и высоким негативным воздействием на нормальную паренхиму печени по сравнению с внутриартериальными вмешательствами ввиду механизма кровоснабжения печени.
- Способ химиоэмболизации при первичных злокачественных и метастатических опухолях: при введении большого количества эмболизирующих веществ существует очень высокий риск закупорки не целевого сосуда или ретроградная миграция эмболизирующих элементов в близлежащие артерии, питающие соседние здоровые органы.
Метод химиоэмболизации является наиболее современным методом, сочетает в себе два более простых метода: ХИПА и ЭПА [A.M. Гранов, М.И. Давыдов, «Интервенционная радиология в онкологии», Санкт-Питербург, 2007. С. 100].
Однако и данный способ имеет ряд недостатков: возможные гематомы в области пункции бедренной артерии; рефлюкс эмболизирующих частиц в соседние, не целевые сосуды; спазм артерии; невозможность ранней активации пациента, в связи с трансфеморальным доступом.
Прототипом изобретения является способ химиоэболизации печеночных артерий, который включает два этапа: диагностический и лечебный. Под местной анестезией проводят чрескожную пункцию и катетеризацию бедренной артерии, в которой устанавливают интродъюссер. В печеночную артерию вводят специальный катетер и выполняют селективную ангиографию с контрастированием артериального русла печени с целью оценки ангиографической морфологии внутрипеченочных опухолевых узлов, локализации и количества питающих их сосудов, наличия артериальных анастомозов при повторных вмешательствах.
Катетер устанавливают в ветвь печеночной артерии, питающей опухолевый узел, стабилизируют его для профилактики осложнений, связанных с попаданием эмболизирующих частиц в артерии поджелудочной железы, желудка, а также тонкого кишечника и осуществляют введение химопрепарата.
Для выполнения химиоэмболизации в качестве эмболизата применяют лекарственно-насыщаемые микросферы. Используют следующие химиопрепараты Доксорубицин (от 50 до 100 мг), Митомицин С (от 5 до 10 мг), Гемзар (от 600 до 1000 мг). Дозу препарата выбирают в зависимости от размеров поражения, биохимических показателей крови, характеризующих печеночный цитолиз, объема дистального артериального русла, питающего опухолевый узел. Масляную химиоэмболизацию дополняют механической окклюзией ветвей печеночной артерии мелконарезанной гемостатической губкой, в том числе у пациентов с частичным тромбозом ствола воротной вены и с ранее перевязанной правой ветвью воротной вены. [А.А. Серёгин, А.И. Зайцев, В.Е. Загайнов, Е.Г. Шарабрин, А.С. Чичканова Трансартериальная химиоэмболизация печеночной артерии в комплексном лечении у пациентов с опухолями печени [Электронный ресурс. Режим доступа: http://www.pomc.ru/publication/13504. Дата доступа: 27.12.2016].
Недостатками данного метода являются: возможные гематомы в области пункции бедренной артерии; рефлюкс эмболизирующих частиц в соседние, нецелевые сосуды; спазм артерии; невозможность ранней активации пациента в связи с трансфеморальным доступом.
Технический результат при использовании изобретения - ранняя активация пациента за счет отсутствия осложнений, связанных с трансфеморальным доступом, таких как забрюшинная гематома, ложная аневризма, артерио-венозная фистула, предотвращение рефлюкса эмболизирующих частиц в нецелевые сосуды, спазма целевой артерии.
Указанный технический результат достигается тем, что в способе химиоэмболизации печеночной артерии, включающем пункцию по Сильденгеру, установку интродъюссера, селективную ангиографию с контрастированием артериального русла печени, введение в качестве эмболизата лекарственно-насыщаемых микросфер, при этом используют в качестве химиопрепаратов Доксорубицин 50-100 мг, Митомицин С 5-10 мг, Гемзар 600-1000 мг, контрольную ангиографию, согласно изобретению проводят пункцию правой или левой лучевой артерии, затем осуществляют катетеризацию устья общей печеночной артерии проводниковым катетером Jadkins right 6F, длиной 100 см, после этого заводят по проводнику баллонный катетер типа over the wire с длиной шафта 130-135 см, диаметром и длиной баллона 4,0×20 мм, затем через шахту баллонного катетера проводят ангиографический проводник в дистальные отделы печеночной артерии, после чего проводят баллонный катетер к новообразованию, раздувают его под давлением 4 атм., удаляют проводник из катетера, выполняют инфузию лекарственно-насыщаемых микросфер размером 50-100 мic через основную шахту баллонного катетера. При этом используют ангиографический гидрофильный проводник с «J» кончиком, диаметром 0,018 или 0,035 дюйма.
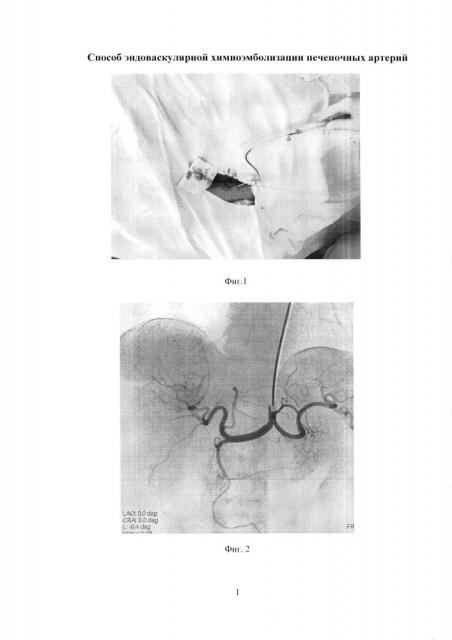
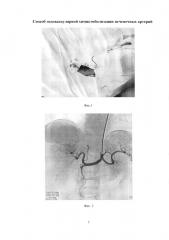
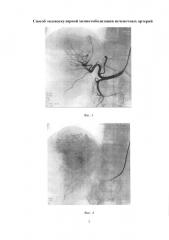
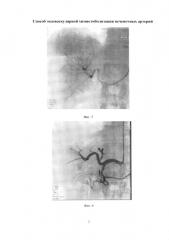
Изобретение иллюстрируется следующими фигурами: на фиг. 1 изображен вид до вмешательства; на фиг. 2-5 - этапы операции; на фиг. 6 - вид после вмешательства.
Предлагаемый способ осуществляется следующим образом: первым этапом выполняют пункцию правой или левой лучевой артерии по Сильденгеру, через боковой канал интрадьюссера вводят 1 мл раствора Изокета разведенного в 10 мл 0,9% раствора NaCl с 5000 ед гепарина и 1 мл Верапамила с целью профилактики спазма артерий, затем проводят ангиографический гидрофильный проводник с «J» кончиком, диаметром 0,018 или 0,035 дюйма длиной 260 см или более, под рентгенокон гролем в брюшную аорту. Вторым этапом катетеризируют устье общей печеночной артерии проводниковым катетером Jadkins right 6F, длиной 100 см, ангиографический проводник проводят в левую или правую печеночные артерии. Третьим этапом заводят по проводнику баллонный катетер, типа over the wire (OTW), с длиной шафта 130-135 см, диаметром и длиной баллона 4,0×20 мм. На проводнике баллонный катетер подводят к новообразованию. Четвертым этапом раздувают баллон в просвете артерии под давлением 4 атм., затем выполняют инфузию лекарственно-насыщаемых микросфер MeritMedical HepaSphere 50-100 mic. под рентгеноконтролем. Заключительным этапом выполняют контрольную ангиографию. Наличие стаза контрастного вещества в просвете артерии, свидетельствует об удовлетворительном результате процедуры, после чего баллон сдувают. Таким образом, способ трансрадиальной эндоваскулярной химиоэмболизации печеночных артерий избавляет пациента от нежелательных осложнений, связанных с трансфеморальным доступом (забрюшинная гематома, ложная аневризма, артерио-венозная фистула), и. как следствие, обеспечивает раннюю активизацию пациента. Использование в качестве инструментария проводникового катетера, баллонного катетера типа OTW и гидрофильного проводника позволяет при раздувании баллона в просвете печеночной артерии избежать нежелательного рефлюкса эмболизационных частиц в нецелевые сосуды, а также выполнить профилактику спазма артерии.
Предлагаемый способ применен у 8 пациентов с новообразованиями печени различной локализации.
Сущность изобретения поясняется следующим клиническим примером.
Пациент С., 66 лет, поступил в плановом порядке с диагнозом:
Первичный рак печени IIIa T3N0M0. Микронодулярный цирроз печени, класс А по Чайлд-Пью. Осл.: Асцит Соп.: Сахарный диабет 2 типа, средней степени тяжести, компенсация.
По данным обследования. МРТ: объемное образование печени (метастазы) - в сегменте S7-8 образование с четкими бугристыми контурами, неоднородной структуры, размером 78×68 мм, с наличием кистозных компонентов размером до 30 мм, с отсутствием накопления контрастного препарата в отсроченную фазу. Принято решение о выполнении трансрадиальной, эндоваскулярной химиоэмболизации правой печеночной артерии. Первым этапом выполнили пункцию правой лучевой артерии по Сильденгеру (Фиг. 1). Через боковой канал интрадьюссера ввели 1 мл раствора Изокета, разведенного в 10 мл 0,9% раствора NaCl с 5000 ЕД Гепарина и 1 мл Верапамила с целью профилактики спазма артерий, затем провели ангиографический гидрофильный проводник диаметром 0,035 дюйма с «J» кончиком длиной 260 см (Terrumo), под рентгеноконтролем в брюшную аорту. Вторым этапом катетеризировали устье чревного ствола проводниковым катетером Jadkins right 6F (Cordis), длиной 100 см (Фиг. 2). Провели ангиографический проводник в дистальные отделы правой печеночной артерии, и завели проводниковый катетер в общую печеночную артерию (Фиг. 3). Выполнили ангиографическую гепатографию с целью выявления гиперваскуляризованного участка новообразования печени (Фиг. 4). Третьим этапом на проводнике завели баллонный катетер Pacific Xtreme (Medtronic) типа over the wire (OTW), с длиной шафта 130 см, диаметром и длиной баллона 4,0×20 мм к новообразованию. Четвертым этапом раздули баллон в просвете правой печеночной артерии под давлением 4 атм., удалили проводник из катетера, затем выполнили химиоэмболизацию лекарственно-насыщаемых микросфер MeritMedical HepaSphere 50-100 Mic с химиопрепаратом доксирубицина в дозе 100 мг под рентгеноконтролем (Фиг. 5). Заключительным этапом выполнили контрольную ангиографию: стаз контрастного вещества в просвете артерии (Фиг. 6). Баллон сдули. Ангиографический результат признан удовлетворительным. Интродьюссер и катетер удалены, на место пункции наложено гемостатическое устройство TPvBand (Terrumo). Пациент через 1 час после процедуры, самостоятельно передвигается по палате, через 6 часов гемостатическое устройство TRBand (Terrumo) удалено, область пункции без особенностей, признаков гематомы не выявлено. Через 3 суток пациент выписан в удовлетворительном состоянии на амбулаторное наблюдение.
1. Способ химиоэмболизации печеночной артерии, включающий пункцию по Сильденгеру, установку интродъюссера, селективную ангиографию с контрастированием артериального русла печени, введение в качестве эмболизата лекарственно-насыщаемых микросфер, контрольную ангиографию, отличающийся тем, что проводят пункцию правой или левой лучевой артерии, затем осуществляют катетеризацию устья общей печеночной артерии проводниковым катетером Jadkins right 6F, длиной 100 см, после этого заводят по проводнику баллонный катетер типа over the wire с длиной шафта 130-135 см, диаметром и длиной баллона 4,0×20 мм, затем через шахту баллонного катетера проводят ангиографический проводник в дистальные отделы печеночной артерии, после чего проводят баллонный катетер к новообразованию, раздувают его под давлением 4 атм., удаляют проводник из катетера, выполняют инфузию лекарственно-насыщаемых микросфер через основную шахту баллонного катетера.
2. Способ по п. 1, отличающийся тем, что используют ангиографический гидрофильный проводник с «J» кончиком, диаметром 0,018 или 0,035 дюйма.