Способ получения растворимых бесхлорных калийных удобрений (варианты)
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Способы получения растворимых бесхлорных калийных удобрений представляют собой циклический процесс, включающий проведение в каждом цикле последовательности операций, являющихся реакциями ионного обмена, осуществляемыми в одной или нескольких ионообменных колоннах с использованием одинакового для всех операций катионита, находящегося перед началом каждой операции в ионной форме для данной операции, каждая операция включает обработку катионита раствором, являющимся исходным веществом указанного циклического процесса для данной операции, получение продукта данной операции и перевод катионита в ионную форму для очередной операции указанной последовательности, при этом одна из операций указанной последовательности включает обработку катионита, находящегося перед началом этой операции в Na-форме, раствором хлорида калия в качестве первого исходного вещества указанного циклического процесса, перевод катионита в К-форму и получение раствора хлорида натрия. Изобретение позволяет получить высокочистые бесхлорные калийные минеральные удобрения с использованием широкого ассортимента исходного сырья, включая кислоты. 2 н. и 24 з.п. ф-лы, 11 ил., 7 табл., 12 пр.
Реферат
Изобретение относится к технологии производства минеральных удобрений, а именно к двум вариантам способа для получения быстрорастворимых бесхлорных калийных удобрений.
Бесхлорные калийные удобрения относятся к группе наиболее ценных удобрений. В частности, монокалийфосфат (МКФ) является весьма ценным сложным удобрением, содержащим одновременно калий (34% по K2O) и фосфор (52% по Р2О5). Такое удобрение широко используется в овощеводстве, садоводстве и цветоводстве. В последнее время в связи с растущими потребностями в комплексных удобрениях в интенсивном растениеводстве с использованием технологии капельного орошения особенно востребована водорастворимая форма МКФ, представляющая собой практически чистую соль - дигидрофосфат калия, не содержащий нерастворимых примесей. Практически все количество потребляемого сегодня в России водорастворимого МКФ завозится по импорту, главным образом, из Израиля и Бельгии. Другим примером ценного сложного удобрения является нитрат калия, содержащий одновременно калий (46% K2O) и азот (13% N-NO3). Основная часть потребляемой в России селитры импортируется из Чили и других стран.
Известны способы получения МКФ методом частичной нейтрализации фосфорной кислоты карбонатом или гидроксидом калия (М.Е. Позин. Технология минеральных удобрений, Л., «Химия», 1989, с. 304 [1]; патент РФ №2164494, опубл. 27.03.2001 [2]; патент РФ №2261222, опубл. 27.09.2005 [3]; патент США №7601319, опубл. 13.10.2009 [4]). При этом нейтрализацию карбоната калия ведут при повышенной температуре до рассчитанных значений pH, кристаллизацию продукта ведут при охлаждении [2, 3]. При использовании в качестве сырья гидроксида калия возможно выделение продукта (кристаллизация) методом прямой грануляции при распылении его смеси с фосфорной кислотой в стехиометрическом соотношении [4]. Основным недостатком указанных способов является дороговизна используемого калиевого сырья. Другим недостатком является необходимость использования дорогостоящей термической фосфорной кислоты для получения растворимого монокалийфосфата или же необходимость очистки продукта однократной или многократной его перекристаллизацией при использовании промышленной экстракционной фосфорной кислоты.
Известны способы получения монокалийфосфата с использованием более дешевого сырья - хлорида калия ([1], а также: Химическая технология неорганических веществ/под ред. Ахметова Т.Г., в двух книгах, М., "Высшая школа", 2002, Кн. 1, 688 с. [5]; патент РФ №2369585, опубл. 10.10.2009 [6]; патент США №3393044, опубл. 16.07.1968 [7]).
В частности, известен промышленный способ получения МКФ с использованием хлорида калия, серной кислоты и фосфата кальция ([1], с. 304; [5], с. 152). В соответствии с этим способом хлорид калия обрабатывают избытком концентрированной серной кислоты при температуре от 80°С до 200°C с получением паров хлористого водорода и суспензии гидросульфата калия в серной кислоте. Хлористый водород утилизируют с получением соляной кислоты. Кислую суспензию при температуре около 70°С нейтрализуют фосфатом кальция, например, природным фосфоритом, в результате чего получают суспензию гипса в смешанном растворе, содержащем монокалийфосфат и фосфорную кислоту. Гипс отделяют от смешанного раствора фильтрацией, раствор упаривают до концентрации 50-60% МКФ, и последний высаливают из охлажденного раствора метанолом. Маточный раствор подвергают дистилляции для отгонки метанола, возвращаемого в голову процесса, а также для получения фосфорной кислоты с содержанием до 54% P2O5.
Недостатками данного способа являются трудоемкость технологического процесса, в том числе необходимость совмещения производства МКФ с производством другой химической продукции; необходимость использования специального антикоррозионного оборудования, а также вредность производства, связанного с выделением паров соляной кислоты и метанола. Кроме того, недостатком является невозможность получения водорастворимого МКФ указанным способом. При этом попытка последующей очистки, например, методом перекристаллизации, оказывается также весьма трудоемкой из-за необходимости использования нескольких последовательных ступеней переработки для достижения требуемого качества продукции.
Известны другие способы получения монокалийфосфата с использованием хлорида калия, в которых используется меньшее количество технологических стадий и с которыми сопряжено меньшее количество попутных продуктов ([6, 7]). В соответствии со способом [6] хлорид калия разлагают фосфорной кислотой при температуре 75÷100°С, а затем полученную пульпу нагревают до температуры выше 250°С, чтобы отогнать образующийся в результате реакции разложения хлористый водород, который улавливают водой с получением соляной кислоты средней концентрации. В соответствии со способом [7] образующийся хлористый водород экстрагируют органической жидкостью при температуре 120÷160°C с последующим разложением органического комплекса водой с получением соляной кислоты и возвратом органики в процесс. Способы [6, 7] сохраняют ряд недостатков, присущих способу [5], в том числе вредность производства, необходимость использования специального антикоррозионного оборудования, а также необходимость вторичной переработки продукта для получения водорастворимой формы МФК.
Общим недостатком способов [5-7] является также то, что эти способы требуют применения избытка фосфорной кислоты по сравнению со стехиометрическим количеством, что приводит к получению двойного соединения монокалийфосфата и фосфорной кислоты, а это требует использования определенного количества карбоната или гидроксида калия для получения МКФ.
Известен способ получения водорастворимого МКФ при температурах ниже 100°С, основанный на использовании фосфорной кислоты и хлорида калия (патент США №4836995, опубл. 06.06.1989 [8]). В соответствии с этим способом взаимодействие фосфорной кислоты и экстракционной фосфорной кислоты (ЭФК) осуществляют в двухфазной системе, содержащей смешанные водные растворы и несмешиваемую с водой органическую фазу, а именно растворенные в керосине длинноцепочечные первичные амины. Образующаяся при этом соляная кислота уходит в органическую фазу, а именно взаимодействует с органической фазой с образованием комплекса амина с хлористоводородной кислотой; в органическую фазу также экстрагируется существенная часть примесей, содержащихся в исходной ЭФК. Водную фазу отделяют от органической и дополнительно подкисляют исходной фосфорной кислотой с получением монокалийфосфата и выделением его кристаллизацией с получением твердого МФК и остаточного смешанного раствора, возвращаемого в процесс. Органическую фазу регенерируют щелочным агентом, например, оксидом или гидроксидом кальция, с получением раствора хлоридной соли щелочного агента, например, раствора хлорида кальция и исходной формы органической фазы, которую также возвращают в процесс. Указанный способ также обладает существенными недостатками:
- качество продукта полностью зависит от качества исходной экстракционной фосфорной кислоты и не всегда гарантируется получение растворимой формы МКФ без дополнительных переделов;
- образуются трудно утилизируемые жидкие отходы хлорида кальция;
- керосин имеет определенную (хотя и малую) растворимость в воде, из за чего и продукция и отходы оказываются загрязненными органической фазой;
- способ экологически опасен, особенно в случае возможных аварий и утечек жидкостей;
- требуются дорогостоящее оборудование и повышенная культура производства, для того чтобы исключить неприятные запахи на производственной площадке.
Известны способы получения других калийных сложных удобрений, в частности, калийной селитры из хлорида калия методом конверсии с использованием нитрата кальция или аммония ([1], с. 301; авторское свидетельство СССР №1248650, опубл. 07.08.1986 [9]). В соответствии с этими способами осуществляют циклический процесс, каждый цикл которого состоит из стадий сорбции и десорбции калия. Через катионит пропускают раствор хлорида калия, переведя ионообменник в K-форму (стадия сорбции). Затем через него пропускают растворы соответствующих нитратов (кальция или аммония), получая на выходе раствор нитрата калия и переводя ионит соответственно в кальциевую или аммонийную форму (стадия десорбции). В следующем цикле через катионит опять пропускают раствор хлорида калия, переводя его снова в K-форму и получая на выходе соответственно раствор хлорида кальция или хлорида аммония. Далее проводят стадию десорбции и повторяют цикл. Для осуществления процесса в непрерывном режиме используют по крайней мере две колонны с катеонитом, работающие на противоположных стадиях. К сожалению, указанные ионообменные способы не обеспечивают полного разделения растворов разной природы друг от друга, поэтому только малая часть фильтратов, выходящих из колонн, представляет собой чистые однокомпонентные растворы, остальная часть фильтратов представляет собой смешанные растворы, которые требуют последующей сложной переработки с целью дальнейшего использования. Кроме того, остается проблема утилизации также хлоридов кальция и аммония.
Общим недостатком всех перечисленных выше способов [1-9] является то, что они не универсальны, а узко направлены на получение только какого-нибудь одного конечного продукта из группы бесхлорных калийных удобрений.
Наиболее близким к предлагаемому способу является ионообменный способ получения растворимых бесхлорных калийных минеральных удобрений по патенту РФ №2201414, опубл. 27.03.2003 [10]. В соответствии с этим способом циклически проводят реакции ионного обмена. При этом в каждом цикле осуществляют реакцию ионного обмена с участием хлористого калия в качестве первого исходного вещества, используя катионит в форме вспомогательного компонента и преобразуя его в K-форму с получением хлорной соли вспомогательного компонента, а также реакцию ионного обмена с участием бесхлорной соли вспомогательного компонента в качестве второго исходного вещества, используя полученный перед этим катионит в K-форме и преобразуя его в форму вспомогательного компонента с получением продукта в виде бесхлорной калиевой соли. При этом катионит выбирают таким образом, чтобы его селективность к вспомогательному компоненту была меньше селективности к калию, а концентрацию указанной бесхлорной соли вспомогательного компонента выбирают большей, чем концентрация насыщенного раствора бесхлорной калийной соли. В качестве бесхлорной соли вспомогательного компонента могут выступать, в частности, сульфат натрия, нитрат аммония, дигидрофосфат аммония.
Способ по патенту [10] позволяет получать высококачественные растворимые бесхлорные калийные удобрения, однако, у этого способа имеется ряд недостатков:
- требование по свойствам применяемого катионита, а именно условие, что он должен обладать повышенной селективностью к иону калия по сравнению с другими катионами, участвующими в процессе, резко сужает круг применяемых ионообменных материалов, оставляя по сути только возможность применения сильнокислотных катионитов, для которых это условие выполняется по отношению к наиболее доступным вспомогательным компонентам, таким, как ионы натрия или аммония;
- это же ограничение делает невозможным применение катионов магния, кальция и других многозарядных ионов в качестве вспомогательных компонентов, а бесхлорных солей этих катионов в качестве сырья для получения целевого продукта - растворимого бесхлорного калийного удобрения;
- в способе предполагается только применение бесхлорных солей, содержащих вспомогательный компонент, что исключает возможность использования каких-либо еще широкодоступных и относительно дешевых веществ, в частности, кислот (например, серной или фосфорной), для ионообменной конверсии хлорида калия в бесхлорное калийное удобрение.
- в результате осуществления этого способа получают перенасыщенный раствор, из которого самопроизвольно кристаллизуется целевой продукт. Вследствие этого сужается ассортимент пригодного к использованию исходного сырья, так как при наличии в исходных веществах малорастворимых примесей последние оказываются в кристаллизовавшемся целевом продукте, создавая проблему его очистки. Например, недопустимо присутствие в исходном веществе кальция, образующего с сульфат-ионом нерастворимый гипс.
Технические решения по обоим вариантам предлагаемого изобретения, относящегося к способу получения растворимых бесхлорных калийных удобрений, направлены на достижение технического результата, заключающегося в обеспечении возможности получения высокочистых бесхлорных калийных минеральных удобрений с использованием широкого ассортимента исходного сырья, включая кислоты, и соответствующего расширения ассортимента получаемых удобрений при одновременном снижении требований к содержанию в сырьевых материалах малорастворимых примесей или примесей, способных образовывать малорастворимые вещества в ходе процессов получения целевых продуктов. Ниже при раскрытии сущности изобретения и рассмотрении частых случаев его осуществления по обоим вариантам могут быть названы и другие виды достигаемого технического результата.
Предлагаемый способ получения растворимых бесхлорных калийных удобрений по первому варианту, как и указанный наиболее близкий к нему известный, представляет собой циклический процесс, включающий проведение в каждом цикле последовательности операций, являющихся реакциями ионного обмена, осуществляемыми в одной или нескольких ионообменных колоннах с использованием в каждой из них слоя одинакового для всех операций катионита, находящегося перед началом каждой операции в специфичной для нее ионной форме. Каждая операция включает обработку катионита раствором, являющимся исходным веществом указанного циклического процесса, специфичным для данной операции, получение продукта данной операции и перевод катионита в другую ионную форму, специфичную для очередной операции указанной последовательности. При этом одна из операций указанной последовательности включает обработку катионита, находящегося перед началом этой операции в Na-форме, раствором хлорида калия в качестве первого исходного вещества указанного циклического процесса, перевод катионита в K-форму и получение раствора хлорида натрия.
Для достижения указанного выше технического результата в предлагаемом способе по первому варианту, в отличие от наиболее близкого известного способа, в качестве катионита, одинакового для всех проводимых в указанном циклическом процессе операций, используют слабокислотный катионит. После упомянутой операции, включающей обработку катионита раствором хлорида калия, осуществляют операцию с участием в качестве второго исходного вещества указанного циклического процесса раствора бесхлорной кислородсодержащей кислоты, включающую обработку этим раствором полученного в предыдущей операции катионита в K-форме, слой которого поддерживают в состоянии псевдоожижения, с переводом его в Н-форму и получением суспензии, содержащей целевой продукт в виде калиевой соли указанной бесхлорной кислородсодержащей кислоты, а также фильтрацию или центрифугирование получаемой суспензии для очистки ее от малорастворимых примесей. Далее продолжают обработку катионита в указанном поддерживаемом в состоянии псевдоожижения слое, используя для нее полученную суспензию, подвергнутую фильтрации или центрифугированию, и повторяют такую обработку и следующие за ней фильтрацию или центрифугирование получаемой суспензии несколько раз. Затем осуществляют операцию с участием дополнительного исходного вещества указанного циклического процесса в виде раствора натриевой щелочи или кальцинированной соды, которым обрабатывают полученный в предыдущей операции катионит в Н-форме, переводя его в Na-форму, специфичную для первой из перечисленных операций, и создавая тем самым возможность циклического продолжения указанного процесса.
Предусматриваемое предлагаемым способом по первому варианту проведение последовательности операций ионного обмена позволяет получать целевой продукт в результате обработки, проводимой во второй из названных операций. Присутствие этой операции в последовательности операций предлагаемого способа по первому варианту обеспечивает возможность выбора из целого ряда кислородсодержащих кислот с получением столь же обширного ряда калийных солей, а наличие третьей ионообменной операции наряду с первыми двумя обеспечивает возможность замыкания цикла. При этом указанная последовательность операций становится возможной благодаря использованию слабокислотного катионита, проявляющего повышенную селективность к катионам водорода (гидроксония).
В противоположность наиболее близкому известному способу, предусматривающему получение перенасыщенного раствора, из которого самопроизвольно кристаллизуется целевой продукт, в предлагаемом способе по первому варианту получают суспензию, содержащую раствор калийного бесхлорного удобрения. При этом благодаря поддержанию слоя катионита в состоянии псевдоожижения возникает возможность выведения из колонны всей твердой фазы получаемой суспензии, содержащей малорастворимые примеси, неизбежно присутствующие в исходных веществах, тогда как в плотном слое катионита имел бы место эффект фильтрации, и часть твердой фазы оставалась бы в нем к концу операции. В предлагаемом же способе выведенная из колонны суспензия, содержащая твердую фазу, подвергается фильтрации или центрифугированию с последующей обработкой ею катионита в колонне в циркуляционном режиме, что обеспечивает как надлежащую очистку получаемого целевого продукта, так и предотвращение загрязнения катионита в колонне.
В частном случае в качестве кислородсодержащей кислоты при осуществлении предлагаемого способа по первому варианту может быть использована экстракционная фосфорная кислота, предварительно подвергнутая очистке методом экстракции органически реагентом, например, в соответствии со способом по патенту РФ №2452685 (опубл. 10.06.2012 [11]), либо (предпочтительно) сорбционным методом "удерживания кислоты" в одной из следующих его модификаций:
- по методу с периодическим пропусканием исходной ЭФК снизу вверх через слой сильноосновного анионита в фосфатной форме до "проскока" кислоты и обратным вытеснением сорбированной на анионите очищенной кислоты водой сверху вниз (патент РФ №2544731, опубл. 20.03.2015 [12]);
- по методу, впоследствии названному его авторами "НьюКем-методом", с использованием сорбционных систем с двумя жидкими фазами, основанному на уменьшении объема пространства между гранулами сорбента, занимаемого перерабатываемым раствором, путем заполнения слоя сорбента органическим жидким веществом, не смешивающимся ни с водой, ни с этим раствором и химически не взаимодействующим с его компонентами перерабатываемого раствора (патент РФ №2434679, опубл. 27.11.2011 [13]; Р.Х. Хамизов. Сорбционный метод "удерживания кислоты". Некоторые технологические возможности по разделению электролитов. Сорбционные и хроматографические процессы. 2013. Т. 13. Вып. 5, с. 600-604 [14]).
В другом частном случае в качестве кислородсодержащей кислоты может быть использована азотнокислая вытяжка, полученная азотнокислым разложением фосфатного сырья и содержащая фосфорную кислоту с примесью азотной кислоты, предварительно очищенная сорбционным НьюКем-методом удерживания кислоты [13, 14].
В качестве кислородсодержащей кислоты при осуществлении предлагаемого способа по первому варианту может быть использована также техническая серная кислота любого вида, включая контактную, башенную и регенерированную.
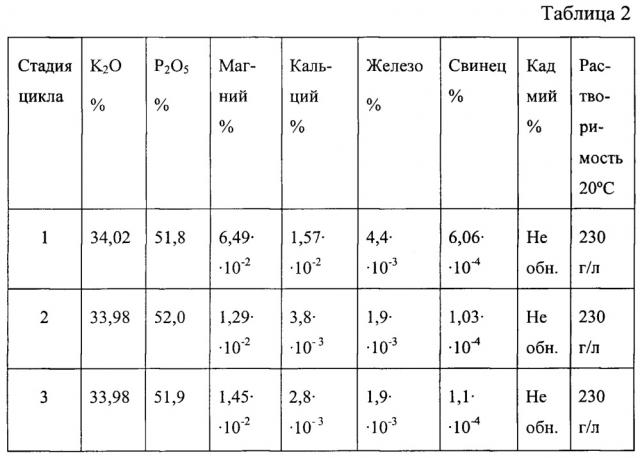
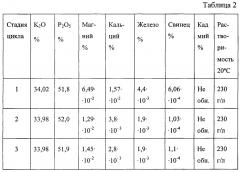
В названных случаях в качестве целевого продукта получают соответственно фосфат калия, смесь нитрата и фосфата калия, сульфат калия.
Предлагаемый способ по первому варианту может быть реализован с использованием единственной ионообменной колонны. В этом случае описанные выше операции являются стадиями, поочередно осуществляемыми в этой колонне. Однако более рационально проводить циклический процесс в несколько стадий в каждом цикле таким образом, что на каждой стадии названные выше ионообменные операции осуществляются в трех одновременно работающих ионообменных колоннах с одинаковыми сорбционными слоями катионита, но в трех разных ионных формах перед началом операции - Na-форме, K-форме и Н-форме, с чередованием от стадии к стадии этих ионных форм и подаваемых в ионообменные колонны растворов, являющихся исходными веществами указанного циклического процесса, специфичными для соответствующих операций.
При такой реализации способа может быть обеспечена непрерывность получения целевого продукта - бесхлорной соли калия.
По окончании каждой стадии целесообразно промывать каждую ионообменную колонну водой, вытесняя ею находящийся в данной колонне электролит, а воду, оставшуюся в колонне после промывки, вытеснять раствором, подаваемым в колонну для обработки находящегося в ней катионита на очередной стадии. Промывка выполняется с целью обеспечения чистоты получаемых продуктов и предотвращения перерасхода растворов исходных веществ.
В частном случае в способе по первому варианту операцию с участием хлорида калия в качестве первого исходного вещества на каждой стадии проводят в виде двух одновременно протекающих процессов в двух последовательно соединенных ионообменных колоннах, для чего необходима одна ионообменная колонна дополнительно к трем указанным выше. В первом из двух одновременно протекающих процессов осуществляют обработку раствором хлорида калия катионита, находящегося перед началом данной операции в первой из указанных последовательно соединенных ионообменных колонн в смешанной Na,K-форме, получают раствор, являющийся результатом указанной обработки, и переводят катионит в первой ионообменной колонне из указанной смешанной ионной формы в чистую K-форму. Во втором процессе осуществляют обработку раствором, получаемым в первом процессе, катионита, находящегося перед началом данной операции во второй из указанных последовательно соединенных ионообменных колонн в чистой Na-форме, получают раствор хлорида натрия и переводят катионит из Na-формы в указанную смешанную Na,K-форму.
При таком выполнении предлагаемого способа может быть достигнута более высокая чистота целевого продукта и предотвращен перерасход исходного вещества. Объясняется это тем, что при реальном проведении операций ионного обмена имеют место процессы взаимной диффузии в слое катионита и перемешивания в растворе. В таком процессе нет гарантии того, что в момент появления ионов калия в получаемом растворе (когда нужно завершать стадию цикла во избежание потерь исходного вещества), получается чистая K-форма катионита и часть катионита его все еще не остается в Na-форме. В таком случае на следующей стадии цикла при обработке катионита вторым исходным веществом (кислородсодержащей кислотой) существует риск получения не чистого целевого продукта (например, монокалийфосфата при использовании фосфорной кислоты), а продукта, загрязненного примесью дигидрофосфата натрия. При проведении указанной операции в виде двух одновременно протекающих процессов в двух последовательно соединенных ионообменных колоннах вероятность такой ситуации существенно уменьшается.
При осуществлении предлагаемого способа по первому варианту в данном частном случае в каждом цикле на каждой стадии одновременно используются четыре ионообменные колонны с одинаковыми сорбционными слоями катионита, но в четырех разных названных выше ионных формах (смешанной Na,K-форме, Na-форме, K-форме и H-форме) с чередованием от стадии к стадии в каждой из указанных колонн этих форм и подаваемых в колонны веществ, участвующих в ионном обмене, причем две их этих четырех колонн используются на каждой стадии цикла для осуществления двух одновременно протекающих процессов ионообменной операции с участием хлорида калия в качестве первого исходного вещества.
В данном частном случае по окончании каждой стадии каждую ионообменную колонну, содержащую катионит в чистой ионной форме, промывают водой, вытесняя ею находящийся в данной колонне электролит, а воду, оставшуюся в колонне после промывки, вытесняют раствором, подаваемым в колонну для обработки находящегося в ней катионита на очередной стадии.
Для обеспечения более высокой производительности процесса целесообразно осуществлять подбор скоростей пропускания растворов исходных веществ через ионообменные колонны таким образом, чтобы моменты окончания операций обработки катионита во всех ионообменных колоннах на каждой стадии цикла совпадали друг с другом.
Предлагаемый способ получения растворимых бесхлорных калийных удобрений по второму варианту, как и наиболее близкий к нему известный, представляет собой циклический процесс, включающий проведение в каждом цикле последовательности операций, являющихся реакциями ионного обмена, осуществляемыми в одной или нескольких ионообменных колоннах с использованием в каждой из них слоя одинакового для всех операций катионита, находящегося перед началом каждой операции в специфичной для нее ионной форме. Каждая операция включает обработку катионита раствором, являющимся исходным веществом указанного циклического процесса, специфичным для данной операции, получение продукта данной операции и перевод катионита в другую ионную форму, специфичную для очередной операции указанной последовательности. При этом одна из операций указанной последовательности включает обработку катионита, находящегося перед началом этой операции в Na-форме, раствором хлорида калия в качестве первого исходного вещества указанного циклического процесса, перевод катионита в K-форму и получение раствора хлорида натрия.
Для достижения указанного выше технического результата в предлагаемом способе по второму варианту, в отличие от наиболее близкого к нему известного способа, в качестве катионита, одинакового для всех проводимых в указанном циклическом процессе операций, используют слабокислотный катионит. После упомянутой операции, включающей обработку катионита раствором хлорида калия, осуществляют операцию с участием в качестве второго исходного вещества указанного циклического процесса раствора некалиевой соли бесхлорной кислородсодержащей кислоты. Данная операция включает обработку этим раствором полученного в предыдущей операции катионита в K-форме с переводом его в ионную форму катиона указанной некалиевой соли и получением суспензии, содержащей целевой продукт в виде калиевой соли указанной бесхлорной кислородсодержащей кислоты. Затем осуществляют операцию с участием третьего исходного вещества указанного циклического процесса в виде раствора бесхлорной кислородсодержащей кислоты, отличной от той, раствор соли которой является вторым исходным веществом указанного циклического процесса. Этим раствором обрабатывают полученный в предыдущей операции катионит в ионной форме катиона указанной некалиевой соли, слой которого поддерживают в состоянии псевдоожижения, с переводом его в Н-форму и получением суспензии, содержащей дополнительный целевой продукт в виде соли, образованной катионом указанной некалиевой соли и анионом бесхлорной кислородсодержащей кислоты, раствор которой является третьим исходным веществом указанного циклического процесса. При этом осуществляют также фильтрацию или центрифугирование получаемой суспензии для очистки ее от малорастворимых примесей и далее продолжают обработку катионита в указанном поддерживаемом в состоянии псевдоожижения слое, используя для нее полученную суспензию, подвергнутую фильтрации или центрифугированию, и повторяют такую обработку и следующие за ней фильтрацию или центрифугирование получаемой суспензии несколько раз. Затем осуществляют операцию с участием дополнительного исходного вещества указанного циклического процесса в виде раствора натриевой щелочи или кальцинированной соды, которым обрабатывают полученный в предыдущей операции катионит в Н-форме. Его переводят в Na-форму, специфичную для первой из перечисленных операций, создавая тем самым возможность циклического продолжения указанного процесса.
Предусматриваемое предлагаемым способом по второму варианту проведение последовательности операций ионного обмена позволяет получать целевой продукт в результате обработки, проводимой во второй из названных операций и дополнительный целевой продукт - в результате обработки, проводимой в третьей из названных операций. Вторая из названных выше ионообменных операций, содержащаяся в последовательности операций предлагаемого способа по второму варианту, обеспечивает возможность выбора из целого ряда бесхлорных кислот с получением столь же обширного ряда калийных солей. Присутствие третьей из названных выше ионообменных операций, позволяющей получать дополнительный целевой продукт в виде соли, образованной катионом второго исходного вещества и анионом бесхлорной кислородсодержащей кислоты, создает возможность выбора сочетания второго исходного вещества и бесхлорной кислородсодержащей кислоты, при котором второй продукт также является удобрением, образующим в комбинации с бесхлорным калийным удобрением сложное минеральное удобрение. Наличие четвертой ионообменной операции наряду с первыми тремя обеспечивает возможность замыкания цикла. При этом указанная последовательность операций предлагаемого способа по второму варианту становится возможной благодаря использованию слабокислотного катионита, проявляющего повышенную селективность к ионам водорода.
В противоположность наиболее близкому известному способу, предусматривающему получение перенасыщенного раствора, из которого самопроизвольно кристаллизуется целевой продукт, в предлагаемом способе по второму варианту в качестве целевого продукта получают суспензию, содержащую раствор калийного бесхлорного удобрения.
Для удаления из этой суспензии нерастворимых примесей, которые могут содержаться с них, в зависимости от чистоты используемых исходных веществ, она на заключительной стадии осуществления способа может быть подвергнута фильтрации или центрифугированию.
Одновременно получают также суспензию, содержащую дополнительный целевой продукт в виде соли, образованной катионом второго исходного вещества и анионом кислородсодержащей кислоты, которая тоже может представлять собой удобрение. При этом благодаря поддержанию слоя катионита в состоянии псевдоожижения становится возможным выведение из колонны всей твердой фазы получаемой суспензии, содержащей малорастворимые примеси, неизбежно присутствующие в исходных веществах, тогда как в плотном слое катионита имел бы место эффект фильтрации, и часть твердой фазы оставалась бы в нем к концу операции. В предлагаемом же способе по второму варианту, аналогично способу по первому варианту, выведенная из колонны суспензия, содержащая твердую фазу, подвергается фильтрации или центрифугированию с последующей обработкой ею катионита в колонне в циркуляционном режиме, что обеспечивает как надлежащую очистку получаемого целевого продукта, так и предотвращение загрязнения катионита в колонне.
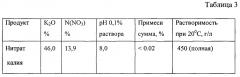
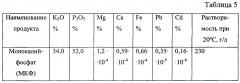
В качестве второго и третьего исходных веществ могут быть использованы, например, растворы, соответственно, нитрата аммония (аммиачной селитры) и очищенной экстракционной фосфорной кислоты. При этом могут быть получены целевой продукт - раствор калиевой селитры и дополнительный продукт - моноаммонийфосфат, совместно называемые аммофоской, которая является ценным сложным минеральным удобрением.
В частном случае в качестве второго и третьего исходных веществ могут быть использованы также растворы, соответственно, нитрата аммония и серной кислоты с получением нитрата калия и сульфата аммония.
В другом частном случае в качестве второго исходного вещества используют раствор сульфата аммония, а в качестве третьего исходного вещества - раствор фосфорной кислоты, получая в результате сульфат калия и моноаммонийфосфат.
Еще в одном частном случае в качестве второго и третьего исходных веществ используют растворы, соответственно, моноаммонийфосфата и серной кислоты с получением более ценного монокалийфосфата и сульфата аммония.
Предлагаемый способ по второму варианту, как и способ по первому варианту, может быть реализован с использованием единственной ионообменной колонны. В этом случае описанные выше операции являются стадиями, поочередно осуществляемыми в этой колонне. Однако более рационально проводить циклический процесс в несколько стадий в каждом цикле таким образом, что на каждой стадии названные выше ионообменные операции осуществляют в четырех одновременно работающих ионообменных колоннах с одинаковыми сорбционными слоями катионита, но в четырех разных ионных формах перед началом операции: Na-форме, K-форме, ионной форме катиона указанной некалиевой соли, раствор которой является вторым исходным веществом указанного циклического процесса, и H-форме, с чередованием от стадии к стадии этих ионных форм и подаваемых в ионообменные колонны растворов, являющихся исходными веществами указанного циклического процесса, специфичными для соответствующих операций.
При такой реализации способа может быть обеспечена непрерывность получения целевого продукта - бесхлорной соли калия и дополнительного целевого продукта.
По окончании каждой стадии каждую ионообменную колонну целесообразно промывать водой, вытесняя ею находящийся в данной колонне электролит. В этом случае воду, оставшуюся в колонне после промывки, вытесняют раствором, подаваемым в колонну для обработки находящегося в ней катионита на очередной стадии.
В частном случае осуществления способа по второму варианту возможно осуществление первой или последней из описанных выше операций или обеих этих операций, проводимых с участием соответственно, первого и дополнительного исходных веществ, на каждой стадии в виде двух одновременно протекающих процессов в двух последовательно соединенных ионообменных колоннах, т.е. с использованием дополнительно к четырем указанным выше еще одной ионообменной колонны для каждой из таких операций. Первый из этих процессов включает обработку исходным веществом указанного циклического процесса, специфичным для данной операции, катионита, находящегося перед началом данной операции в первой из указанных последовательно соединенных ионообменных колонн в смешанной ионной форме и содержащего катионит как в ионной форме, специфичной для данной операции, так и в ионной форме, специфичной для очередной операции указанной последовательности. В этом процессе получают раствор, являющийся результатом указанной обработки, и переводят катионит из указанной смешанной ионной формы в чистую ионную форму, специфичную для очередной операции способа. Второй процесс включает обработку раствором, получаемым в первом процессе, катионита, находящегося перед началом данной операции во второй из указанных последовательно соединенных ионообменных колонн в специфичной для данной операции ионной форме. При этом получают продукт данной операции и переводят катионит в указанную смешанную ионную форму для использования на следующей стадии циклического процесса, которым является предлагаемый способ.
При выполнении одной или обеих названных выше операций в виде двух одновременно протекающих процессов в двух последовательно соединенных ионообменных колоннах может быть достигнута более высокая чистота получаемых продуктов и уменьшается избыточный расход исходных веществ. Как и в способе по первому варианту, это объясняется тем, что при реальном проведении операций ионного обмена имеют место процессы взаимной диффузии в слое катионита и перемешивания в растворе. В таком процессе нет гарантии, что в момент появления ионов исходного вещества в получаемом растворе (когда нужно завершать стадию во избежание потерь исходного вещества), получается ч