Композиции и способы ингибирования masp-1, и/или masp-2, и/или masp-3 для лечения пароксизмальной ночной гемоглобинурии
Иллюстрации
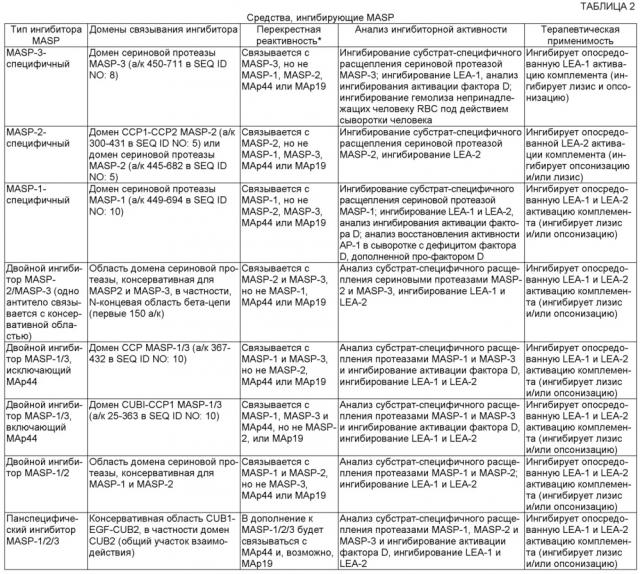
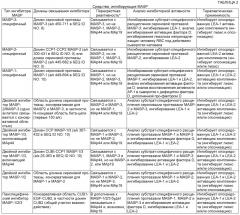
Показать всеИзобретение относится к фармакологии и медицине. Предложено применение композиции, содержащей количество средства, ингибирующего MASP-3, эффективное для ингибирования MASP-3-зависимой активации комплемента, в производстве лекарственного средства для лечения индивидуума, страдающего пароксизмальной ночной гемоглобинурией (PNH), где средством, ингибирующим MASP-3, является моноклональное антитело против MASP-3 или его фрагмент, специфически связывающееся с частью MASP-3 человека (SEQ ID NO: 8). Технический результат: показано, что дефицит MASP-3 снижает процентную долю опосредованного комплементом лизиса покрытых маннозой эритроцитов по сравнению с нормальной сывороткой человека; добавление антитела против MASP-3 (например, mAbD14) в сыворотку пациента с дефицитом MASP-3 (ЗМС) ингибирует запускаемое альтернативным путем накопление C3b и снижает лизис эритроцитов. 8 з.п. ф-лы, 47 ил., 19 табл., 19 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Для данной заявки испрашивается приоритет по заявке № 61/621461, поданной 6 апреля 2012 года.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, связанный с этой заявкой, представлен в текстовом формате вместо бумажной копии и включен, таким образом, в качестве ссылки в настоящее описание. Названием текстового файла, содержащего список последовательностей является MP_1_0146_PCT_Sequence_20130327_ST25.txt. Размер текстового файла составляет 85 KB; он был создан 1 апреля 2013 года и подан с помощью EFS-Web с подачей этого описания.
УРОВЕНЬ ТЕХНИКИ
Система комплемента представляет механизм раннего действия для инициирования, усиления и регуляции иммунного ответа на микробную инфекцию и другие острые повреждения (M.K. Liszewski и J.P. Atkinson, 1993, in Fundamental Immunology, Third Edition, edited by W.E. Paul, Raven Press, Ltd., New York) у людей и других позвоночных. Хотя активация комплемента обеспечивает важную защиту первой линии против потенциальных патогенов, активность комплемента, стимулирующего защитный иммунный ответ, также может представлять потенциальную угрозу для хозяина (K.R. Kalli, et al., Springer Semin. Immunopathol. 75:417-431, 1994; B.P. Morgan, Eur. J. Clinical Investig. 24:219-228, 1994). Например, протеолитические продукты C3 и C5 приводят к рекрутированию и активации нейтрофилов. Хоть и необходимые для защиты хозяина, активированные нейтрофилы действуют беспорядочно в высвобождении деструктивных ферментов и могут вызывать повреждение органа. Кроме того, активация комплемента может вызывать накопление литических компонентов комплемента на ближайших клетках хозяина, а также на микроорганизмах-мишенях, приводя к лизису клетки хозяина.
Система комплемента также участвует в патогенезе многих острых и хронических заболеваний, включая: инфаркт миокарда, инсульт, ARDS, реперфузионное повреждение, септический шок, повышение проницаемости капилляров после термических ожогов, воспаление после операции с использованием искусственного кровообращения, отторжение трансплантата, ревматоидный артрит, рассеянный склероз, миастению и болезнь Альцгеймера. При большинстве этих состояний комплемент является не причиной, а одним из нескольких факторов, участвующих в патогенезе. Как бы то ни было, активация комплемента может являться основным патологическим механизмом и представлять собой эффективную точку для клинического контроля при многих из этих заболеваний. Растущее понимание важности опосредуемого комплементом повреждения тканей при многих заболеваниях усиливает потребность в эффективных лекарственных средствах, ингибирующих комплемент. К настоящему времени, экулизумаб (Solaris®), антитело против C5, является единственным лекарственным средством, направленным против комплемента, одобренным для использования на людях. Тем не менее, C5 является одной из нескольких эффекторных молекул, расположенных «ниже в каскаде» системы комплемента, и блокада C5 не ингибирует активацию системы комплемента. Таким образом, ингибитор начальных этапов активации комплемента будет иметь значительные преимущества по сравнению с ингибитором «нижележащих в каскаде» компонентов комплемента.
В настоящее время широко признано, что система комплемента может активироваться тремя различными путями: классическим путем, лектиновым путем и альтернативным путем. Как правило, классический путь запускается комплексом, состоящим из антител хозяина, связанных с чужеродной частицей (т.е. антигеном), и, таким образом, для развития специфического гуморального ответа требуется предшествующее воздействие антигена. Т.к. активация классического пути зависит от предшествующего адаптивного иммунного ответа хозяина, классический путь является частью приобретенной иммунной системы. В отличие от этого, и лектиновый, и альтернативный путь не зависят от адаптивного иммунитета и являются частью врожденной иммунной системы.
Активация системы комплемента приводит к последующей активации зимогенов сериновых протеаз. Первым этапом активации классического пути является связывание специфичной распознающей молекулы C1q со связанными с антигеном молекулами IgG и IgM. C1q связан с проферментами сериновых протеаз C1r и C1s, этот комплекс называется C1. После связывания C1q с иммунным комплексом происходит аутопротеолитическое расщепление участка Arg-Ile C1r с последующим опосредованным C1r расщеплением и активацией C1s, который, таким образом, приобретает способность расщеплять C4 и C2. C4 расщепляется на два фрагмента, обозначаемых как C4a и C4b, и, аналогично, C2 расщепляется на C2a и C2b. Фрагменты C4b способны образовывать ковалентные связи со смежными гидроксильными группами или аминогруппами и образовывать конвертазу C3 (C4b2a) посредством нековалентного взаимодействия с фрагментом C2a активированного C2. Конвертаза C3 (C4b2a) активирует C3 посредством протеолитического расщепления на субкомпоненты C3a и C3b, что приводит к образованию конвертазы C5 (C4b2a3b), которая посредством расщепления C5 приводит к образованию мембраноатакующего комплекса (C5b, объединенный с C6, C7, C8 и C9, также обозначаемый как «MAC»), который может разрушать клеточные мембраны, что приводит к лизису клетки. Активированные формы C3 и C4 (C3b и C4b) посредством ковалентных связей накапливаются на поверхностях чужеродных мишеней и распознаются рецепторами комплемента на множестве фагоцитов.
Независимо от этого, первым этапом активации системы комплемента через лектиновый путь также является связывание специфических распознающих молекул, после которого следует активация ассоциированных проферментов сериновых протеаз. Однако, вместо связывания иммунных комплексов C1q, распознающие молекулы лектинового пути содержат группу углевод-связывающих белков (маннозо-связывающий лектин (MBL), H-фиколин, M-фиколин, L-фиколин и лектин C-типа CL-11), в совокупности обозначаемых как лектины. См. J. Lu et al., Biochim. Biophys. Acta 1572:387-400, (2002); Holmskov et al., Annu. Rev. Immunol. 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000)). См. также J. Luet et al., Biochim Biophys Acta 1572:387-400 (2002); Holmskov et al., Annu Rev Immunol 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000); Hansen et al., J. Immunol 185(10):6096-6104 (2010).
Ikeda et al. впервые продемонстрировали, что, подобно C1q, MBL может активировать систему комплемента после связывания с эритроцитами, покрытыми маннозой дрожжей, C4-зависимым образом (Ikeda et al., J. Biol. Chem. 2(52:7451-7454, (1987)). MBL, член семейства белков коллектинов, является кальций-зависимым лектином, связывающимся с углеводами с 3- и 4-гидроксигруппами, ориентированными в горизонтальной плоскости пиранозного кольца. Таким образом, значимыми лигандами для MBL являются D-манноза и N-ацетил-D-глюкозамин, в то время как углеводы, не удовлетворяющие этому стерическому требованию, имеют неопределяемую аффинность для MBL (Weis et al., Nature 360:127-134, (1992)). Взаимодействие между MBL и моновалентными сахарами является крайне слабым с константами диссоциации, как правило, в однозначном миллимолярном диапазоне. MBL достигает сильного, специфического связывания с гликановыми лигандами посредством авидности, т.е. взаимодействия одновременно с множеством остатком моносахаридов, локализованных в непосредственной близости друг к другу (Lee et al., Archiv. Biochem. Biophys. 299: 129-136, (1992)). MBL распознает углеводные паттерны, как правило, декорирующие микроорганизмы, такие как бактерии, дрожжи, паразиты и определенные вирусы. В отличие от этого, MBL не распознает D-галактозу и сиаловую кислоту, предпоследние и последние сахара, как правило, входящие в «зрелые» сложные гликоконъюгаты, присутствующие на гликопротеинах поверхностей клеточной мембраны млекопитающих. Считают, что эта специфичность связывания способствует распознаванию «чужеродных» поверхностей и помогает защищать от «аутоактивации». Однако MBL не связывается с высокой активностью с кластерами богатых маннозой «предшественником» гликанов на N-связанных гликопротеинах и гликолипидах, изолированных в эндоплазматической сети и аппарате Гольджи клеток млекопитающих (Maynard et al., J. Biol. Chem. 257:3788-3794, (1982)). Кроме того, показано, что MBL может связываться с полинуклеотидами, ДНК и РНК, которые могут быть экспонированы на некротических и апоптотических клетках (Palaniyar et al., Ann. N. Y. Acad. ScL, 1010:467-470 (2003); Nakamura et al., J. Leuk. Biol. 86:737-748 (2009)). Таким образом, поврежденные клетки являются потенциальными мишенями для активации через лектиновый путь посредством связывания с MBL.
Фиколины содержат иной тип лектинового домена, чем MBL, называемый фибриногеноподобным доменом. Фиколины связываются с остатками сахаров Ca++-независимым образом. У людей идентифицировали три типа фиколинов (L-фиколин, M-фиколин и H-фиколин). Два фиколина в сыворотке, L-фиколин и H-фиколин, обладают общей специфичностью для N-ацетил-D-глюкозамина; однако, H-фиколин также связывается с N-ацетил-D-галактозамином. Различие в специфичности к сахарам L-фиколина, H-фиколина, CL-11 и MBL означает, что различные лектины могут являться взаимодополняющими и воздействовать на различные гликоконъюгаты благодаря перекрыванию. Эту концепцию подтверждают в недавней статье о том, что из известных лектинов лектинового пути только L-фиколин специфически связывается с липотейхоевой кислотой, гликоконъюгатом клеточной стенки, обнаруживаемым на всех грамположительных бактериях (Lynch et al., J. Immunol. 172: 1198-1202, (2004)). В дополнение к ацетилированным остаткам сахаров фиколины также могут связываться с ацетилированными аминокислотами и полипептидами (Thomsen et al., Mol. Immunol. 48(4):369-81 (2011)). Коллектины (т.е. MBL) и фиколины не имеют значительной схожести аминокислотной последовательности. Однако две группы белков имеют схожую организацию доменов и, как C1q, собираются в олигомерные структуры, максимизирующие их способность к мультисайтовому связыванию.
Концентрации MBL в сыворотке сильно варьируются в популяциях здоровых индивидуумов и генетически контролируются полиморфизмами/мутациями в промоторе и кодирующих областях гена MBL. Экспрессия MBL, как белка острой фазы, дополнительно повышающе регулируется при воспалении. L-фиколин присутствует в сыворотке в концентрациях, аналогичных MBL. Таким образом, L-фиколиновая ветвь лектинового пути потенциально сравнима с MBL по своей силе. MBL и фиколины также функционируют как опсонины, позволяющие фагоцитам воздействовать на MBL- и фиколин-декорированные поверхности (см. Jack et al., J Leukoc Biol., 77(3):328-36 (2004), Matsushita and Fujita, Immunobiology, 205(4-5):490-7 (2002), Aoyagi et al., J Immunol, 174(1):418-25(2005). Для этой опсонизации необходимо взаимодействие этих белков с рецепторами фагоцитов (Kuhlman et al., J. Exp. Med. 169: 1733, (1989); Matsushita et al., J. Biol. Chem. 277:2448-54, (1996)), идентичность которых не установлена.
MBL человека осуществляет специфичное и высокоаффинное взаимодействие через свой коллагеноподобный домен с уникальными C1r/C1s-подобными сериновыми протеазами, называемыми MBL-ассоциированными сериновыми протеазами (MASP). К настоящему моменту описано три MASP. Впервые, отдельный фермент «MASP» идентифицировали и охарактеризовали как фермент, ответственный за инициацию каскада комплемента (т.е. расщепление C2 и C4) (Matsushita et al., J Exp Med 176(6): 1497-1502 (1992); Ji et al., J. Immunol. 750:571-578, (1993)). Затем определили, что активность MASP фактически представлена смесью двух протеаз: MASP-1 и MASP-2 (Thiel et al., Nature 556:506-510, (1997)). Однако было показано, что комплекса MBL-MASP-2 в отдельности достаточно для активации комплемента (Vorup-Jensen et al., J. Immunol. 165: 2093-2100, (2000)). Кроме того, только MASP-2 расщепляет C2 и C4 с высокой скоростью (Ambrus et al., J. Immunol. 770: 1374-1382, (2003)). Таким образом, MASP-2 является протеазой, ответственной за активацию C4 и C2 для образования конвертазы C3 C4b2a. Это является существенным отличием от комплекса C1 классического пути, где координированное действие двух специфичных сериновых протеаз (C1r и C1s) приводит к активации системы комплемента. Кроме того, выделена третья новая протеаза, MASP-3 (Dahl, M.R., et al., Immunity 15: 127-35, 2001). MASP-1 и MASP-3 являются продуктами альтернативного сплайсинга одного гена.
MASP имеют организацию доменов, идентичную C1r и C1s, ферментативным компонентам комплекса C1 (Sim et al., Biochem. Soc. Trans. 28:545, (2000)). Эти домены включают N-концевой домен C1r/C1s/VEGF морского ежа/морфогенетического белка кости (CUB), домен, подобный эпидермальному фактору роста, второй CUB домен, тандем доменов контролирующих комплемент белков и домен сериновой протеазы. Как и у протеаз C1, активация MASP-2 происходит посредством расщепления связи Arg-Ile, смежной с доменом сериновой протеазы, разделяющего фермент на связанные дисульфидной связью цепи A и B, последняя из которых состоит из домена сериновой протеазы.
MBL также может связываться с альтернативно сплайсированной формой MASP-2, известной как MBL-ассоциированный белок массой 19 кДа (MAp19) или малый MBL-ассоциированный белок (sMAP), у которого отсутствует каталитическая активность MASP-2. (Stover, J. Immunol. 162:3481-90, (1999); Takahashi et al., Int. Immunol. 11:859-863, (1999)). MAp19 содержит первые два домена MASP-2, за которыми следует дополнительная последовательность из четырех уникальных аминокислот. Функция MAp19 неясна (Degn et al., J Immunol. Methods, 2011). Гены MASP-1 и MASP-2 локализуются на хромосомах 3 и 1 человека, соответственно (Schwaeble et al., Immunobiology 205:455-466, (2002)).
Несколько линий доказательств позволяют предполагать, что существуют различные комплексы MBL-MASP, и большая фракция MASP в сыворотке не образует комплексы с MBL (Thiel, et al., J. Immunol. 165:878-887, (2000)). H- и L-фиколин связываются со всеми MASP и активируют лектиновый путь комплемента, как и MBL (Dahl et al., Immunity 15: 127-35, (2001); Matsushita et al., J. Immunol. 168:3502-3506, (2002)). И лектиновый, и классический путь приводят к образованию общей конвертазы C3 (C4b2a), и на этом этапе два пути пересекаются.
Распространено мнение, что лектиновый путь играет основную роль в защите против инфекции у наивного хозяина. Убедительное доказательство участия MBL в защите хозяина получено с помощью анализа пациентов со сниженными уровнями функционального MBL в сыворотке (Kilpatrick, Biochim. Biophys. Acta 1572:401-413, (2002)). Такие пациенты проявляют предрасположенность к рецидивирующим бактериальным и грибковым инфекциям. Эти симптомы, как правило, проявляются в начале жизни в течение выраженного «окна уязвимости» со снижением титров материнских антител, но до возникновения полного репертуара гуморальных ответов. Этот синдром часто является результатом мутаций в нескольких участках коллагеновой части MBL, мешающих правильному образованию олигомеров MBL. Однако, т.к. MBL может функционировать как опсонин независимо от комплемента, неизвестно, в какой мере повышается восприимчивость к инфекции по причине нарушенной активации комплемента.
Ранее показано, что в отличие от классического и лектинового путей, инициаторы альтернативного пути выполняют распознающие функции, которые C1q и лектины осуществляют в двух других путях. В настоящее время широко признано, что альтернативный путь спонтанно подвергается низкоуровневой циклической активации, которая может быстро повышаться в ответ на чужеродные или другие аномальные поверхности (бактерии, дрожжи, инфицированные вирусами клетки или поврежденную ткань) и в которой отсутствуют соответствующие молекулярные элементы, контролирующие спонтанную активацию комплемента. В сыворотке существуют четыре белка, напрямую участвующие в активации альтернативного пути: C3, факторы B и D и пропердин.
Хотя существует большое количество данных о вовлечении и классического, и альтернативного путей комплемента в патогенез неинфекционных заболеваний человека, роль лектинового пути только начинают оценивать. Недавние исследования показали, что активация лектинового пути может отвечать за активацию комплемента и связанное с ней воспаление при ишемическом/реперфузионном повреждении. Collard et al. (2000) показали, что культивируемые эндотелиальные клетки, подвергнутые оксидативному стрессу, связываются с MBL и демонстрируют накопление C3 после воздействия сывороткой человека (Collard et al., Am. J. Pathol. 156: 1549-1556, (2000)). Кроме того, обработка сывороток человека блокирующими моноклональными антителами против MBL ингибировала связывание MBL и активацию комплемента. Эти данные переносили на модель ишемии миокарда-реперфузии у крысы, в которой крысы, обработанные блокирующим антителом против MBL, демонстрировали значимо меньшее повреждение миокарда после окклюзии коронарной артерии, чем крысы, обработанные контрольным антителом (Jordan et al., Circulation 104: 1413-1418, (2001)). Молекулярный механизм связывания MBL с эндотелием сосудов после оксидативного стресса неясен; недавние исследования позволили предполагать, что активацию лектинового пути после оксидативного стресса может опосредовать связывание MBL с цитокератинами эндотелия сосудов, а не с гликоконъюгатами (Collard et al., Am. J. Pathol. 159:1045-1054, (2001)). В других исследованиях делали вывод о вовлечении классического и альтернативного путей в патогенез ишемического/реперфузионного повреждения, и роль лектинового пути в этом заболевании остается спорной (Riedermann, N.C., et al., Am. J. Pathol. 162:363-367, 2003).
Недавние исследования показали, что MASP-1 и MASP-3 конвертируют фермент активации альтернативного пути фактор D из его зимогена в ферментативно активную форму (см. Takahashi M. et al., J Exp Med 207(1):29-37 (2010); Iwaki et al., J. Immunol. 187:3751-58 (2011)). Физиологическую значимость этого процесса подчеркивает отсутствие функциональной активности альтернативного пути в плазме мышей с дефицитом MASP-1/3. Протеолитическое образование C3b из нативного C3 необходимо для функционирования альтернативного пути. Т.к. конвертаза C3 (C3bBb) альтернативного пути содержит C3b в качестве необходимой субъединицы, вопрос об образовании первого C3b через альтернативный путь представляет сложную проблему и стимулирует обширные исследования.
C3 принадлежит к семейству белков (вместе с C4 и α-2 макроглобулином), содержащих редкую посттрансляционную модификацию, известную как тиоэфирная связь. Тиоэфирная группа состоит из глутамина, терминальная карбонильная группа которого образует ковалентную тиоэфирную связь с сульфгидрильной группой цистеина, расположенного в трех аминокислотах от него. Эта связь является нестабильной, и электрофильный глутамил-тиоэфир может реагировать с нуклеофильными остатками, такими как гидроксильная группа или аминогруппа, и, таким образом, образовывать ковалентную связь с другими молекулами. Тиоэфирная связь является вполне стабильной при секвестрации в гидрофобном кармане интактного C3. Однако протеолитическое расщепление C3 до C3a и C3b приводит к экспонированию тиоэфирной связи с высокой реакционной активностью на C3b и, после нуклеофильной атаки смежными остатками, содержащими гидроксильную группу или аминогруппу, C3b становится ковалентно связанным с мишенью. В дополнение к его убедительно подтвержденной роли в ковалентном присоединении C3b к мишеням комплемента, также считают, что тиоэфир C3 играет ключевую роль в запуске альтернативного пути. Согласно широко распространенной «теории tick-over», альтернативный путь инициируется образованием конвертазы жидкой фазы, iC3Bb, образующейся из C3 с гидролизованным тиоэфиром (iC3; C3(H2O)) и фактора B (Lachmann, P. J., et al., Springer Semin. Immunopathol. 7:143-162, (1984)). C3b-подобный C3(H2O) образуется из нативного C3 посредством медленного спонтанного гидролиза внутреннего тиоэфира в белке (Pangburn, M.K., et al., J. Exp. Med. 154:856-867, 1981). Несмотря на активность конвертазы C3(H2O)Bb, молекулы C3b накапливаются на поверхности мишени, таким образом, инициируя альтернативный путь.
До настоящего открытия, представленного в настоящем описании, об инициаторах активации альтернативного пути было известно очень мало. Считали, что активаторы включают клеточную стенку дрожжей (зимозан), многие чистые полисахариды, эритроциты кролика, определенные иммуноглобулины, вирусы, грибки, бактерии, опухолевые клетки животных, паразитов и поврежденные клетки. Единственным свойством, общим для этих активаторов, являлось наличие углевода, но сложность и многообразие структур углеводов затрудняло обнаружение распознаваемых общих молекулярных детерминант. Было общепризнанным, что активация альтернативного пути контролируется точным балансом между ингибиторными регуляторными компонентами этого пути, такими как фактор H, фактор I, DAF и CR1, и пропердином, последний из которых является единственным положительным регулятором альтернативного пути (см. Schwaeble W.J. and Reid K.B., Immunol Today 20(1): 17-21 (1999)).
В дополнение к, по-видимому, нерегулируемому механизму активации, описываемому выше, альтернативный путь также может обеспечивать мощную амплификационную петлю для конвертазы C3 лектинового/классического пути (C4b2a), т.к. любая образующаяся C3b может участвовать вместе с фактором B в образовании дополнительной конвертазы C3 альтернативного пути (C3bBb). Конвертазу C3 альтернативного пути стабилизирует связывание с пропердином. Пропердин повышает время полужизни конвертазы C3 альтернативного пути в шесть-десять раз. Добавление C3b к конвертазе C3 альтернативного пути приводит к образованию конвертазы C5 альтернативного пути.
Считают, что все три пути (т.е. классический, лектиновый и альтернативный) перекрываются через C5, расщепляемый для образования продуктов с многочисленными провоспалительными эффектами. Конвергентный путь обозначили как терминальный путь комплемента. C5a является наиболее сильным анафилотоксином, вызывающим изменения в гладких мышцах и тонусе сосудов, а также проницаемости сосудов. Он также является сильным хемотаксином и активатором нейтрофилов и моноцитов. Опосредованная C5a клеточная активация может значительно усиливать воспалительные ответы посредством индуцирования высвобождения многочисленных дополнительных медиаторов воспаления, включая цитокины, гидролитические ферменты, метаболиты арахидоновой кислоты и активные формы кислорода. Расщепление C5 приводит к образованию C5b-9, также известного как мембраноатакующий комплекс (MAC). В настоящее время существует убедительное доказательство того, что сублитическое накопление MAC может играть важную роль в воспалении в дополнение к его роли в качестве литического порообразующего комплекса.
В дополнение к ее важной роли в иммунной защите, система комплемента участвует в повреждении ткани при многих заболеваниях. Таким образом, существует острая необходимость разработки терапевтически эффективных ингибиторов комплемента для профилактики этих неблагоприятных воздействий.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение относится к способу ингибирования MASP-3-зависимой активации комплемента у индивидуума, страдающего пароксизмальной ночной гемоглобинурией (PNH). Способ включает этап введения индивидууму композиции, содержащей количество средства, ингибирующего MASP-3, эффективное для ингибирования MASP-3-зависимой активации комплемента. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму композиции, содержащей средство, ингибирующее MASP-2.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно ингибирующее средство, где по меньшей мере одно ингибирующее средство содержит средство, ингибирующее MASP-2, и средство, ингибирующее MASP-3, и фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей средство, ингибирующее MASP-3, связывающееся с частью MASP-1 (полноразмерной SEQ ID NO: 10:), а также связывающееся с частью MASP-3 (SEQ ID NO: 8), и фармацевтический носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей средство, ингибирующее MASP-3, связывающееся с частью MASP-2 (полноразмерной SEQ ID NO: 5:), а также связывающееся с частью MASP-3 (SEQ ID NO: 8), и фармацевтический носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей средство, ингибирующее MASP-3, связывающееся с частью MASP-1 (полноразмерной SEQ ID NO: 10:), а также связывающееся с частью MASP-2 (SEQ ID NO: 5), и фармацевтический носитель.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей средство, ингибирующее MASP-3, связывающееся с частью MASP-1 (полноразмерной SEQ ID NO: 10), связывающееся с частью MASP-2 (полноразмерной SEQ ID NO: 5:), а также связывающееся с частью MASP-3 (SEQ ID NO: 8), и фармацевтический носитель.
Как представлено в настоящем описании, фармацевтические композиции по изобретению можно использовать в соответствии со способами по изобретению.
Эти и другие аспекты и варианты осуществления представленного в настоящем описании изобретения станут очевидными с учетом следующего подробного описания и чертежей. Все патенты США, публикации патентных заявок США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, цитируемые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме, как если бы каждую из них включали в отдельности.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие аспекты и многие из сопутствующих преимуществ настоящего изобретения станут более понятными с учетом следующего подробного описания в комбинации с сопутствующими чертежами, где:
На фигуре 1 представлено новое понимание лектинового и альтернативного путей;
Фигура 2 является схемой, взятой из Schwaeble et al., Immunobiol 205:455-466 (2002), модифицированной в Yongqing et al., BBA 1824:253 (2012), на которой представлены белковые домены MASP-2 и MAp19 и кодирующие их экзоны;
Фигура 3 является схемой, взятой из Schwaeble et al., Immunobiol 205:455-466 (2002), модифицированной в Yongqing et al., BBA 1824:253 (2012), на которой представлены белковые домены MASP-1, MASP-3 и MAp44 и кодирующие их экзоны;
На фигуре 4 показано выравнивание аминокислотных последовательностей белков MASP-1, MASP-2 и MASP-3 и консенсусных областей между ними;
На фигуре 5 показано выравнивание аминокислотных последовательностей альфа-цепей MASP-1, MASP-2 и MASP-3;
На фигуре 6 показано выравнивание аминокислотных последовательностей бета-цепей MASP-1, MASP-2 и MASP-3;
На фигуре 7A показано попарное выравнивание аминокислотных последовательностей протеазных доменов MASP-1 и MASP-2 (бета-цепей);
На фигуре 7B показано попарное выравнивание аминокислотных последовательностей протеазных доменов MASP-1 и MASP-3 (бета-цепей);
На фигуре 7C оказано попарное выравнивание аминокислотных последовательностей протеазных доменов MASP-2 и MASP-3 (бета-цепей);
Фигура 8 представляет собой график Каплана-Мейера, на котором показан процент выживаемости мышей MASP-2 KO и WT после введения инфицирующей дозы 2,6×107 КОЕ N. meningitidis серогруппы A Z2491, свидетельствующий о том, что мыши с дефицитом MASP-2 защищены от вызванной N. meningitidis гибели, как описано в примере 1;
Фигура 9 представляет собой график Каплана-Мейера, на котором показан процент выживаемости мышей MASP-2 KO и WT после введения инфицирующей дозы 6×106 КОЕ N. meningitidis серогруппы B штамма MC58, свидетельствующий о том, что мыши с дефицитом MASP-2 защищены от вызванной N. meningitidis гибели, как описано в примере 1;
На фигуре 10 представлен график логарифма КОЕ/мл N. meningitidis серогруппы B штамма MC58 на мл крови, взятой у мышей MASP-2 KO и WT в разные моменты времени после i.p.-инфицирования 6×106 КОЕ N. meningitidis серогруппы B штамма MC58 (n=3 в разные моменты времени для обеих групп мышей), свидетельствующий о том, что, хотя мышей MASP-2 KO инфицировали той же дозой N. meningitidis серогруппы B штамма MC58, что и мышей WT, мыши MASP-2 KO имели повышений клиренс бактериемии по сравнению с WT, как описано в примере 1;
На фигуре 11 графически представлен индекс заболеваемости мышей MASP-2 KO и WT через 3, 6, 12 и 24 часов после инфицирования 6×106 КОЕ N. meningitidis серогруппы B штамма MC58, свидетельствующий о том, что мыши с дефицитом MASP-2 демонстрируют гораздо меньший индекс заболеваемости через 6 часов, 12 часов и 24 часа после инфицирования по сравнению с мышами WT, как описано в примере 1;
Фигура 12 представляет собой график Каплана-Мейера, на котором показан процент выживаемости мышей после введения инфицирующей дозы 4×106 КОЕ N. meningitidis серогруппы B штамма MC58 с последующим через 3 часа после инфицирования введением антитела, ингибирующего MASP-2, (1 мг/кг) или контрольного изотипического антитела, свидетельствующий о том, что антитело против MASP-2 эффективно в лечении и улучшает выживаемость у индивидуумов, инфицированных N. meningitidis, как описано в примере 2;
На фигуре 13 представлен график логарифма КОЕ/мл жизнеспособных N. meningitidis серогруппы B штамма MC58, выделенных в разные моменты времени из образцов сывороток человека, представленных в таблице 5, взятых в различные моменты времени после инкубации N. meningitidis серогруппы B штамма MC58, как описано в примере 3;
На фигуре 14 представлен график логарифма КОЕ/мл жизнеспособных N. meningitidis серогруппы B-MC58, выделенных в разные моменты времени из образцов сывороток человека, представленных в таблице 7, свидетельствующий о том, что комплемент-зависимая гибель N. meningitidis в 20% (об./об.) сыворотке человека является MASP-3- и MBL-зависимой, как описано в примере 3;
На фигуре 15 представлен график логарифма КОЕ/мл жизнеспособных N. meningitidis серогруппы B-MC58, выделенных в разные моменты времени из образцов сывороток мышей, представленных в таблице 9, свидетельствующий о том, что сыворотка нокаутных по MASP-2-/- мышей (обозначаемых как «MASP-2 -/-») имеет более высокие уровни бактерицидной активности в отношении N. meningitidis, чем сыворотка мышей WT, одновременно, в отличие от этого, сыворотка мышей MASP-1/3-/- не имеет бактерицидной активности, как описано в примере 3;
На фигуре 16 графически представлена кинетика активации C3 в специфичных для лектинового пути условиях (1% плазма) в сыворотках мышей WT, C4-/-, MASP-1/3-/-, фактор B-/- и MASP-2-/-, как описано в примере 4;
На фигуре 17 графически представлен уровень запускаемого альтернативным путем (AP-запускаемого) накопления C3b на покрытых зимозаном планшетах для микротитрования в «традиционных» специфичных для альтернативного пути (AP-специфичных) условиях (т.е. BBS/EGTA/Mg++ без Ca++) как функция концентрации в образцах сыворотки, полученных от людей с дефицитом MASP-3, дефицитом C4 и дефицитом MBL, как описано в примере 4;
На фигуре 18 графически представлен уровень AP-запускаемого накопления C3b на покрытых зимозаном планшетах для микротитрования в «традиционных» AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) как функция времени в образцах 10% сыворотки человека, полученных от людей с дефицитом MASP-3, дефицитом C4 и дефицитом MBL, как описано в примере 4;
На фигуре 19A графически представлен уровень накопления C3b на покрытых маннозой планшетах для микротитрования как функция концентрации в образцах сыворотки, полученных от мышей WT, мышей с дефицитом MASP-2 и дефицитом MASP-1/3, в «традиционных» AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (AP) (BBS/Mg++/Ca++), как описано в примере 4;
На фигуре 19B графически представлен уровень накопления C3b на покрытых зимозаном планшетах для микротитрования как функция концентрации в образцах сыворотки, полученных от мышей WT, мышей с дефицитом MASP-2 и дефицитом MASP-1/3, в традиционных AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (BBS/Mg++/Ca++), как описано в примере 4;
На фигуре 19C графически представлен уровень накопления C3b на покрытых S. pneumoniae D39 планшетах для микротитрования как функция концентрации в образцах сыворотки, полученных от мышей WT, мышей с дефицитом MASP-2 и дефицитом MASP-1/3, в традиционных AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (BBS/Mg++/Ca++), как описано в примере 4;
На фигуре 20A графически представлены результаты анализа накопления C3b в сильно разведенных сыворотках, проведенного на покрытых маннозой планшетах для микротитрования в традиционных AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (BBS/Mg++/Ca++), с использованием концентраций сыворотки в диапазоне от 0% до 1,25%, как описано в примере 4;
На фигуре 20B графически представлены результаты анализа накопления C3b, проведенного на покрытых зимозаном планшетах для микротитрования в традиционных AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (BBS/Mg++/Ca++), с использованием концентраций сыворотки в диапазоне от 0% до 1,25%, как описано в примере 4;
На фигуре 20C графически представлены результаты анализа накопления C3b, проведенного на покрытых S. pneumoniae D39 планшетах для микротитрования в традиционных AP-специфичных условиях (т.е. BBS/EGTA/Mg++ без Ca++) или в физиологических условиях, позволяющих функционировать и лектиновому пути, и альтернативному пути (BBS/Mg++/Ca++), с использованием концентраций сыворотки в диапазоне от 0% до 1,25%, как описано в примере 4;
На фигуре 21 графически представлен уровень гемолиза (измеряемого с помощью фотометрии по высвобождению гемоглобина лизированными эритроцитами мыши (Crry/C3-/-) в супернатант) покрытых маннозой эритроцитов мыши сывороткой человека в физиологических условиях (т.е. в присутствие Ca++) в диапазоне разведений сыворотки MASP-3-/-, термически инактивированной нормальной сыворотки человека (HI NHS), MBL-/-, NHS+моноклональное антитело против MASP-2 и контроля NHS, как описано в примере 5;
На фигуре 22 графически представлен уровень гемолиза (измеряемого с помощью фотометрии по высвобождению гемоглобина лизированными эритроцитами мыши (Crry/C3-/-) в супернатант) покрытых маннозой эритроцитов мыши сывороткой человека в физиологических условиях (т.е. в присутствие Ca++) в диапазоне концентраций сыворотки MASP-3-/-, термически инактивированной (HI) NHS, MBL-/-, NHS+моноклональное антитело MASP-2 и контроля NHS, как описано в примере 5;
На фигуре 23 графически представлен уровень гемолиза (измеряемого с помощью фотометрии по высвобождению гемоглобина лизированными эритроцитами мыши WT в супернатант) непокрытых эритроцитов мыши сывороткой человека в физиологических условиях (т.е. в присутствие Ca++) в диапазоне концентраций сыворотки пациента с 3MC (MASP-3-/-), термически инактивированной (HI) NHS, MBL-/-, NHS+моноклональное антитело MASP-2 и контроля NHS, как описано в примере 5;
На Фигура 24 графически представлен гемолиз (измеряемый с помощью фотометрии по высвобождению гемоглобина лизированными эритроцитами мыши (CD55/59-/-) в супернатант) непокрытых эритроцитов мыши сывороткой человека в физиологических условиях (т.е. в присутствие Ca++) в диапазоне концентраций термически инактивированной сыворотки (HI) NHS, MBL-/-, NHS+моноклональное антитело MASP-2 и контроля NHS, как описано в примере 5;
На фигуре 25 графически представлен гемолиз (измеряемый с помощью фотометрии по высвобождению гемоглобина лизированными эритроцитами кролика в супернатант) покрытых маннозой эритроцитов кролика сывороткой мыши MASP-1/3-/- и контрольной сывороткой мыши WT в физиологических условиях (т.е. в присутствие Ca++) в диапазоне концентраций сыворотки, как описано в примере 6;
На фигуре 26 графически представлен уровень накопления C3b (OD при 405 нм) на покрытом зимозаном планшете для микротитрования как функция концентрации в образцах сывороток мышей фактор D-/-, MASP-2-/- и мышей WT в анализе накопления C3, проведенного в AP-специфичных условиях, как описано в примере 7;
На фигуре 27 графически представлен уровень накопления C3b (OD при 405 нм) на покрытом зимозаном планшете для микротитрования как функция концентрации в образцах сыворотки мышей фактор D-/-; MASP-2-/- и мышей WT в анализе накопления C3, проведенного в физиологических условиях (в присутствие Ca++), как описано в примере 7;
На фигуре 28 графически представлен уровень накопления C3b (OD при 405 нм) на покрытом зимозаном планшете для микротитрования как функция времени инкубации сыворотки (мин) в образцах сыворотки мыши, полученных из мышей фактор D-/-; фактор B-/-; с моноклональным антителом против MASP-2 и без него в анализе накопления C3b, проведенном в физиологических условиях (в присутствие Ca++), как описано в примере 7;
На фигуре 29A графически представлено специфическое для лектинового пути накопление C4b на покрытом зимозаном планшете для микротитрования, измеряемое ex vivo в неразведенных образцах сыворотки, взятых из мышей (n=3 мышей/группу) в различные моменты времени после подкожного введения 0,3 мг/кг или 1,0 мг MoAb против MASP-2/кг массы тела мыши, как описано в примере 13;