Соединение нафтиламида, способ его получения и применение
Иллюстрации
Показать всеИзобретение относится к соединению и его фармацевтической приемлемой соли, где соединение представлено следующей общей формулой (II), где –С(О)NHR3 расположен в любом из положений 1-4 нафталинового кольца; R3 выбран из группы, состоящей из С1-С6 алкила, С3-С6 циклоалкила, замещенного или незамещенного фенила и замещенного или незамещенного 5-6-членного гетероарила, содержащего от 1 до 2 гетероатомов, выбранных из N и О; при этом в случае замещения заместитель представляет собой от 1 до 3 заместителей, и каждый заместитель независимо выбран из группы, состоящей из С1-С3 алкила, С1-С3 алкокси, С1-С3 галогеналкила, С1-С3 галогеналкокси, гидрокси, амино, нитро и галогена; R2 представляет собой водород или галоген; Z представляет собой C(R5)=CH, S или О; Y представляет собой NH, NMe, О, СН=С(R6) или CH=N; R5 выбран из группы, состоящей из водорода, галогена, С1-С3 алкила и С1-С3 алкокси, предпочтительно из группы, состоящей из водорода, F, Cl, Br, метила и метокси; R6 выбран из группы, состоящей из водорода, пиразолила, С1-С3 алкилзамещенного пиразолила и С1-С3 гидроксиалкилзамещенного пиразолила, предпочтительно из группы, состоящей из водорода, пиразолила, метилзамещенного пиразолила и гидроксиэтилзамещенного пиразолила. Соединения формулы (II) предназначены для получения лекарственных средств для предотвращения и/или лечения заболеваний, связанных с патологическим ангиогенезом, предпочтительно в качестве ингибиторов протеин-тирозинкиназы, особенно в качестве ингибиторов VEGFR-2 (рецептор сосудистого эндотелиального фактора роста). 2 н. и 5 з.п. ф-лы, 3 табл., 46 пр.
Реферат
Область техники
Изобретение относится к области фармацевтической химии и фармакотерапии, в частности, к соединениям нафтиламида, их фармацевтическим солям, пролекарствам и гидратам или сольватам, а также относится к способу получения соединений, фармацевтическим композициям, содержащим соединения, и их применениям в качестве ингибиторов протеин-тирозинкиназы, в частности, в качестве ингибиторов VEGFR-2 (рецепторы сосудистого эндотелиального фактора роста), для получения лекарственных средств для предотвращения и лечения заболеваний, связанных с патологическим ангиогенезом.
Предшествующий уровень техники
Ангиогенез, т.е. образование нового кровеносного сосуда из уже существующего кровеносного сосуда, является важным механизмом многих физиологических и патологических процессов. В норме ангиогенез протекает только во время эмбрионального развития, в процессе заживления ран и менструального цикла у женщин. Патологический ангиогенез может протекать в условиях патологии (Shibuya М. ВМВ. Rep. 2008; 41(4): 278-86), в особенности во время роста опухолей, что требует образования новых кровеносных сосудов для снабжения питательными веществами и выделения метаболитов. Эндотелиальная пролиферация и образование новых кровеносных сосудов способствуют увеличению солидных опухолей.
Ключевой сигнальной системой, регулирующей пролиферацию и миграцию эндотелиальных клеток, является сосудистый эндотелиальный фактор роста (VEGF) и его рецептор (VEGFR-1, -2 и -3). VEGFR-2 обладает большей аффинностью и киназной активностью, и играет более важную роль в непосредственном регулировании ангиогенеза, митогензависимой активации и увеличении проницаемости. Рецепторы сосудистого эндотелиального фактора роста (VEGFR) на высоком уровне экспрессируются во многих солидных человеческих опухолях, включая глиому, рак легких, рак груди, рак почки, рак яичников и рак желудочно-кишечного тракта.
Сигнальный путь VEGF/VEGFR-2 играет определяющую роль в опухолевом ангиогенезе и может ингибировать ангиогенез путем блокирования или интерференции с сигнальным путем VEGF/VEGFR-2 для достижения эффекта контролирования роста опухолей. Следовательно, разрабатываются многие ингибиторы VEGFR-2, имеющие небольшой размер молекулы, некоторые из которых полезны в лечении заболеваний, связанных с расстройством ангиогенеза, таких как воспалительные заболевания, ретинопатия и так далее. Авторы настоящего изобретения разработали и синтезировали нафталинамиды, обладающие новыми структурами, и путем оптимизации выбора заместителей обнаружили ингибиторы VEGFR-2 с небольшим размером молекул, обладающие хорошей активностью на ферментативном и клеточном уровнях.
Краткое описание изобретения
В настоящем изобретении посредством изучения кристаллической структуры VEGFR-2 и зависимости структуры от активности другого ингибитора тирозинкиназы была разработана и синтезирована серия новых соединений, и отобрана путем молекулярной и клеточной моделей отбора. Эти соединения могут существенно ингибировать ферментативную активность VEGFR-2 на молекулярном уровне и существенно ингибировать индуцированную VEGF пролиферацию эндотелиальных клеток пупочной вены человека (HUVEC) на клеточном уровне.
Одним из объектов настоящего изобретения является получение соединений нафтиламида, представленных формулой (I), их фармацевтических солей, пролекарств и гидратов или сольватов:
Другим объектом настоящего изобретения является обеспечение способа получения вышеуказанных соединений нафтиламида.
Еще одним объектом настоящего изобретения является обеспечение фармацевтической композиции, содержащей терапевтически эффективное количество одного или более вышеуказанного соединения нафтиламида, его фармацевтических солей, пролекарств и гидратов или сольватов.
Еще одним объектом настоящего изобретения является обеспечение применения одного или более вышеуказанного соединения нафтиламида, его фармацевтических солей, пролекарств и гидратов или сольватов в качестве ингибитора протеин-тирозинкиназы, в особенности в качестве ингибитора VEGFR-2, для получения лекарственных средств для предотвращения и/или лечения заболеваний, связанных с нарушенным ангиогенезом.
Более конкретно, настоящее изобретение относится к соединениям нафтиламида общей формулы (I), их фармацевтическим солям, пролекарствам и гидратам или сольватам:
где
R1 может быть расположен в любом из положений 5-8 нафталинового кольца, и представляет собой замещенный или незамещенный 5-16-членный моноциклический, дициклический или трициклический гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из группы, содержащей N, О, S и Р, предпочтительно представляет собой замещенный или незамещенный 5-10-членный моноциклический или дициклический гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из группы, содержащей N, О и S, более предпочтительно следующую замещенную или незамещенную группу: пиразолил, фурил, пирролил, пиридил, индазолил (например, 1Н-индазолил, 2Н-индазолил), фуро[3,2-с]пиридил, тиено[3,2-с]пиридил, тиено[2,3-d]пиримидинил, бензо[d]изоксазолил, бензо[d]изотиазолил, индолил, хинолил или изохинолил; наиболее предпочтительно следующую замещенную или незамещенную группу: индазолил (например, 1Н-индазолил), фуро[3,2-с]пиридил, тиено[3,2-с]пиридил или тиено[2,3-d]пиримидинил, бензо[d]изоксазолил; при этом в случае замещения, заместитель может представлять собой от 1 до 3 заместителей, где указанный заместитель независимо выбран из группы, содержащей амино, С1-С3 алкил, С1-С3 алкокси, галоген, пиразолил, С1-С3 алкилзамещенный пиразолил, С1-С3 гидроксиалкилзамещенный пиразолил, предпочтительно амино, метил, метокси, F, Cl, Br, пиразолил, метилзамещенный пиразолил и гидроксиэтилзамещенный пиразолил;
в наиболее предпочтительном воплощении, R1 представляет собой следующую структуру:
где R4 выбран из группы, содержащей водород, галоген, С1-С3 алкил и С1-С3 алкокси, предпочтительно выбран из группы, содержащей водород, F, Cl, Br, метил и метокси;
может быть расположен в любом из положений 1-4 нафталинового кольца;
R3 выбран из группы, состоящей из водорода, С1-С6 алкила, С3-С6 циклоалкила, замещенного или незамещенного фенила и замещенного или незамещенного 5-10-членного гетероарила, содержащего от 1 до 5 гетероатомов, выбранных из N, О и S, предпочтительно выбран из группы, состоящей из водорода, С1-С3 алкила, С3-С6 циклоалкила, замещенного или незамещенного фенила и замещенного или незамещенного 5-6-членного гетероарила, содержащего от 1 до 3 гетероатомов, выбранных из N, О и S; более предпочтительно выбран из группы, состоящей из водорода, С1-С3 алкила, С3-С6 циклоалкила и следующей замещенной или незамещенной группы: фенил, пиридил, пиримидинил, оксазолил, изоксазолил, тиенил, имидазолил, пиразолил, тиазолил, фурил и пирролил; наиболее предпочтительно выбран из группы, состоящей из водорода, С1-С3 алкила, С3-С6 циклоалкила и следующей замещенной или незамещенной группы: фенил, пиридил, оксазолил и изоксазолил; при этом в случае замещения, заместитель может представлять собой от 1 до 3 заместителей, и каждый заместитель независимо выбран из группы, состоящей из С1-С3 алкила, С1-С3 алкокси, С1-С3 галогеналкила, С1-С3 галогеналкокси, гидрокси, амино, нитро и галогена; предпочтительно выбран из группы, состоящей из С1-С3 алкила, метокси, трифторметила, трифторметокси, гидрокси, амино, нитро, F, Cl и Br;
R2 может быть расположен в любом из положений 1-8 нафталинового кольца, за исключением R1 и , и представляет собой водород или галоген; предпочтительно водород, F, Cl или Br.
Предпочтительно, соединения нафтиламида, представленные общей формулой (I), представляют собой соединения, представленные следующей формулой (II):
где R2 и являются такими, как описано в общей формуле (I);
Z представляет собой C(R5)=CH, S или О;
Y представляет собой NH, NMe, О, CH=C(R6) или CH=N;
R5 выбран из группы, состоящей из водорода, галогена, С1-С3 алкила и С1-С3 алкокси, предпочтительно из группы, состоящей из водорода, F, Cl, Br, метила и метокси; R6 выбран из группы, состоящей из водорода, пиразолила, С1-С3 алкилзамещенного пиразолила и С1-С3 гидроксиалкилзамещенного пиразолила, предпочтительно из группы, состоящей из водорода, пиразолила, метилзамещенного пиразолила и гидроксиэтилзамещенного пиразолила.
Предпочтительно, соединения нафтиламида, представленные общей формулой (I), выбраны из соединений, представленных следующей общей формулой:
где может быть расположен в положении 1 или 2 нафталинового кольца; R2 и R3 являются такими, как описано в общей формуле (I); R4 выбран из группы, состоящей из водорода, галогена, С1-С3 алкила и С1-С3 алкокси, предпочтительно из группы, состоящей из водорода, F, Cl, Br, метила и метокси;
V представляет собой S или О;
W представляет собой N или C(R7);
R7 выбран из группы, состоящей из водорода, пиразолила, С1-С3 алкилзамещенного пиразолила и С1-С3 гидроксизамещенного пиразолила, предпочтительно из группы, состоящей из водорода, пиразолила, метилзамещенного пиразолила и гидроксиэтилзамещенного пиразолила.
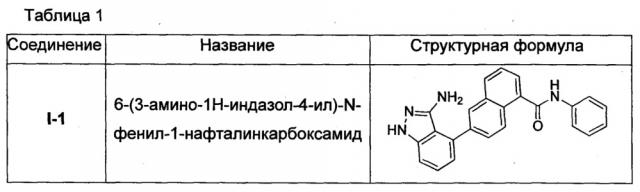
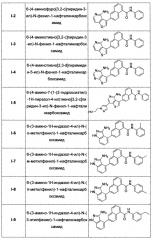
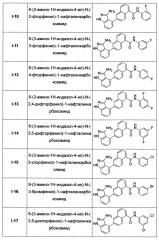
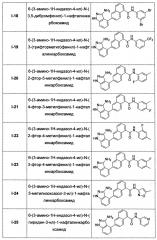
Предпочтительно, в настоящем изобретении соединение нафтиламида, представленное общей формулой (I), выбрано из соединений, представленных в Таблице 1:
Фармацевтически приемлемые соли соединений по настоящему изобретению могут быть получены посредством прямой реакции солеобразования между соединением в виде свободного основания и неорганической или органической кислотой. Неорганическая или органическая кислота может быть выбрана из группы, состоящей из соляной кислоты, серной кислоты, фосфорной кислоты, азотной кислоты, фтороводородной кислоты, бромоводородной кислоты, муравьиной кислоты, уксусной кислоты, пикриновой кислоты, лимонной кислоты, малеиновой кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, этансульфоновой кислоты, п-толуолсульфоновой кислоты и тому подобных.
Настоящее изобретение также относится к способу получения соединений нафтиламида общей формулы (I), например, включающему следующие стадии:
Начиная с соединения 1, гидроксил подвергали реакции с образованием трифлата и затем с образованием бората. Нафталат подвергали гидролизу, затем конденсировали с соответствующим аммиаком/амином с получением бората нафтиламида, и, наконец, подвергали реакции сочетания с галогенидом гетероалила с получением целевого соединения.
В частности, способ получения включает следующие стадии:
1) Соединение 1 приводят во взаимодействие с трифторметансульфоновым ангидридом в щелочных условиях с получением соединения 2;
2) Соединение 2 и бис(пинаколато)дибор подвергают реакции сочетания в присутствии палладиевого катализатора с получением бороната 3;
3) Соединение 3 подвергают гидролизу с гидроксидом лития или гидроксидом натрия с получением соединения 4;
4) Соединение 4 и соответствующий аммиак/амин R3NH2 подвергают реакции конденсации под воздействием такого конденсирующего агента, как дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI) или N,N'-диизопропилкарбодиимид (DIC) с получением соединения 5;
5) Соединение 5 и соответствующий галогенид гетероарила R1X подвергают реакции сочетания в присутствии палладиевого катализатора с получением целевого соединения (I);
где R1, R2 и R3 определены и предпочтительно являются такими, как указано выше, X представляет собой галоген, предпочтительно Br или I.
Способ получения соединений нафтиламида по настоящему изобретению обладает такими преимуществами, как мягкие условия протекания реакции, широко доступные исходные вещества, простота выполнения и постобработки, и тому подобное.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество одного или более соединения нафтиламида формулы (I), его фармацевтически приемлемых солей, пролекарств, гидратов и сольватов, и необязательно фармацевтически приемлемый носитель, которая может быть использована для предотвращения и/или лечения заболеваний, связанных с патологическим ангиогенезом. Фармацевтические композиции могут быть получены в различных формах в зависимости от различных путей введения.
Настоящее изобретение также относится к применению одного или более соединения нафтиламида формулы (I), его фармацевтически приемлемых солей, пролекарств, гидратов и сольватов, или фармацевтической композиции, содержащей терапевтически эффективное количество одного или более чем одного соединения нафтиламида формулы (I), его фармацевтически приемлемых солей, пролекарств, гидратов и сольватов для получения лекарственных средств для предотвращения и/или лечения заболеваний, связанных с патологическим ангиогенезом, предпочтительно в качестве ингибиторов протеин-тирозинкиназы, в особенности ингибиторов VEGFR-2.
При этом заболевание, связанное с патологическим ангиогенезом, выбрано из группы, состоящей из опухоли, ревматоидного артрита, возрастной макулярной дистрофии и псориаза.
Опухоль включает рак легких, рак груди, рак толстой кишки, рак предстательной железы, рак поджелудочной железы, рак желудка, рак печени, рак яичников, рак почки, глиому, меланому, рак поджелудочной железы, рак головы и шеи, рак мочевого пузыря, рак шейки матки, холангиокарциному, рак носоглотки, рак щитовидной железы, остеосаркому, синовиальную саркому, рабдомиосаркому, фибросаркому, лейомиосаркому, миелому, лимфому и тому подобное.
Подробное описание изобретения
Настоящее изобретение будет дополнительно проиллюстрировано нижеследующими примерами. Данные примеры предназначены для иллюстрации и ни в коем случае не ограничивают настоящее изобретение. Если не определено или не указано иное, все профессиональные и научные термины, используемые в настоящем документе, имеют значения, аналогичные известным из уровня техники.
Пример 1:
6-(3-амино-1Н-индазол-4-ил)-N-фенил-1-нафталинкарбоксамид (I-1)
Стадия 1: метил 6-(трифторметилсульфонилокси)-1-нафтоат
5 г 6-гидрокси-1-нафтойной кислоты растворяли в 200 мл метанола и по каплям добавляли 2,8 мл тионилхлорида при перемешивании. Смесь нагревали с обратным холодильником в течение 2 часов, затем охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением метил 6-гидрокси-1-нафтоата в виде бежево-коричневого твердого вещества, которое непосредственно использовали в следующей стадии. 2,5 г метил 6-гидрокси-1-нафтоата растворяли в 150 мл дихлорметана и 6,5 мл диизопропилэтиламина, и по каплям добавляли 3 мл трифторметансульфонового ангидрида при перемешивании при -78°С. Смесь перемешивали при -78°С в течение еще 1 часа и вливали 100 мл насыщенного водного раствора хлорида аммония. Отделяли органическую фазу и экстрагировали водную фазу дихлорметаном. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (этилацетат : петролейный эфир = 5:95) с получением 3,5 г метил 6-(трифторметилсульфонилокси)-1-нафтоата в виде бежево-коричневого твердого вещества. Выход: 93%.
1Н ЯМР (ядерный магнитный резонанс) (300 МГц, ДМСО (диметилсульфоксид)-d6) δ (млн-1): 3,97 (s, 3Н), 7,74-7,81 (m, 2Н), 8,27 (dd, J=7,2, 1,2 Гц, 1Н), 8,30 (d, J=3,0 Гц, 1Н), 8,36 (d, J=8,1 Гц, 1Н), 8,94 (d, J=9,3 Гц, 1Н).
Стадия 2: метил 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафтоат
3 г метил 6-(трифторметилсульфонилокси)-1-нафтоата, 2,74 г бис(пинаколато)диборона, 675 мг [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II), 498 мг 1,1'-бис(дифенилфосфино)ферроцена, 2,87 г ацетата калия и 60 мл диоксана добавляли в реакционную колбу, нагревали до 80°С в атмосфере аргона, перемешивали в течение 4 ч и затем охлаждали до комнатной температуры. Для разделения добавляли воду и этилацетат. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (этилацетат : петролейный эфир = 5:95) с получением 2,74 г метил 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафтолата в виде коричневого масла. Выход: 98%.
1Н ЯМР (300 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 4,01 (s, 3Н), 7,50 (t, J=7,5 Гц, 1Н), 7,97 (dd, J=8,7,1,2 Гц, 1Н), 8,06 (d, J=8,4 Гц, 1Н), 8,22 (dd, J=7,5,1,2 Гц, 1Н), 8,40 (s, 1Н), 8,88 (d, J=9,0 Гц, 1Н).
Стадия 3: 6-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-нафтойная кислота
2,74 г метил 6-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-нафтоата растворяли в 27 мл тетрагидрофурана и 27 мл воды и добавляли 1,11 г гидрата лития при перемешивании. Смесь перемешивали при комнатной температуре в течение 12 ч, затем подкисляли 2 моль/л соляной кислотой и экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (метанол : дихлорметан = 3:97) с получением 2,04 г 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафтойную кислоту в виде бледно-желтого твердого вещества. Выход: 78%.
1Н ЯМР (300 МГц, CDCl3) δ (млн-1): 1,41 (s, 12Н), 7,55 (t, J=8,1 Гц, 1Н), 7,80 (dd, J=8,4, 1,2 Гц, 1Н), 8,13 (d, J=8,1 Гц, 1Н), 8,43-8,46 (m, 2Н), 9,05 (d, J=8,7 Гц, 1Н).
Стадия 4: N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталин-карбоксамид
80 мг 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафтойной кислоты растворяли в 8 мл дихлорметана и последовательно добавляли 39 мг 4-диметиламинопиридина, 77 мг 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида при перемешивании при 0°С. По истечении 15 минут добавляли 27 микролитров анилина, и затем смесь нагревали до комнатной температуры и перемешивали в течение ночи. На следующий день смесь концентрировали. Остаток очищали колоночной хроматографией (дихлорметан) с получением 52 мг М-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксами да в виде беловатого твердого вещества. Выход: 52%.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 7,19 (m, 2Н), 7,41 (m, 2Н), 7,52 (m, 1Н), 7,69-7,01 (m, 3Н), 7,79 (d, J=6,8 Гц, 1H), 7,92 (dd, J=8,4, 1,2 Гц, 1H), 8,02 (d, J=8,0 Гц, 1H), 8,34 (d, J=8,4 Гц, 1H), 8,15 (s, 1Н).
Стадия 5: 4-иод-1Н-индазол-3-амин
500 мг 2-фтор-6-иодбензонитрила и 1,3 мл гидразин гидрата (85%) растворяли в 10 мл н-бутанола и нагревали до 110°С. Смесь перемешивали в течение 6 часов и затем охлаждали до комнатной температуры. Для разделения добавляли воду и этилацетат. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с получением 502 мг 4-иод-1Н-индазол-3-амина в виде бежево-коричневого твердого вещества. Выход: 96%.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 5,05 (s, 2Н), 6,90-6,96 (m, 1Н), 7,29 (d, J=8,1 Hz, 1Н), 7,34 (d, J=7,5 Гц, 1H), 11,80 (s, 1Н).
Стадия 6: 6-(3-амино-1Н-индазол-4-ил)-N-фенил-1-нафталинкарбоксамид (I-1)
30 мг N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксами да, 17 мг 4-иод-1Н-индазол-3-амина, 5 мг бис(трифенилфосфин)дихлорида палладия(II), 18 мг карбоната натрия, 2 мл этанола, 1 мл толуола и 1 мл воды добавляли в реакционную колбу и нагревали в атмосфере аргона до 85°С. Смесь перемешивали в течение 2 ч и затем охлаждали до комнатной температуры. Для разделения добавляли воду и этилацетат. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (метанол : дихлорметан = 3:97) с получением 14 мг I-1 в виде беловатого твердого вещества. Выход: 56%.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 4,32 (s, 2Н), 6,95 (t, J=3,6 Гц, 1Н), 7,14 (t, J=8,0 Гц, 1Н), 7,34-7,37 (m, 2Н), 7,39 (t, J=8,0 Гц, 2Н), 7,68 (dd, J=8,4, 7.2 Гц, 1Н), 7,75 (dd, J=8,8, 2.0 Гц, 1Н), 7,81 (dd, J=7,2, 0,8 Гц, 1Н), 7,84 (d, J=8,0, 2Н), 8,14 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,4 Гц, 1H), 8,30 (d, J=9,2 Гц, 1H), 10,64 (s, 1Н), 11,84 (s, 1H).
Пример 2:
6-(4-аминофуро[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид (I-2)
Стадия 1: 3-бромфуро[3,2-с]пиридин-4-амин
200 мг 3-бром-4-хлорфуро[3,2-с]пиридина, 3 мл концентрированного водного раствора аммиака и 3 мл диоксана добавляли в герметичную трубку из нержавеющей стали, закрывали и нагревали до 150°С. После перемешивания в течение 3 дней смесь охлаждали до комнатной температуры. Для разделения добавляли воду и этилацетат. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с получением 98 мг 3-бромфуро[3,2-с]пиридин-4-амина в виде бежево-коричневого твердого вещества. Выход: 67%.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 6,19 (s, 2Н), 6,92 (d, J=6,0 Гц, 1Н), 7,85 (d, J=6,0 Гц, 1Н), 8,11 (s, 1Н).
Стадия 2: 6-(4-аминофуро[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид (I-2)
4-иод-1Н-индазол-3-амин был заменен на 3-бромфуро[3,2-с]пиридин-4-амин, а другие исходные вещества, реагенты и способ получения были идентичны стадии 6 примера 1. I-2 было получено в виде желтого твердого вещества.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 5,68 (s, 2Н), 7,02 (d, J=6,0 Гц, 1Н), 7,11-7,16 (m, 1Н), 7,36-7,42 (m, 2Н), 7,66-7,71 (m, 1Н), 7,76 (dd, J=9,0, 1,8 Гц, 1Н), 7,82-7,85 (m, 3Н), 7,92 (d, J=6,0 Гц, 1Н), 8,13-8,19 (m, 3Н), 8,34 (d, J=8.4 Гц, 1Н), 10,62 (s, 1Н).
Пример 3:
6-(4-аминотиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид (I-3)
4-иод-1Н-индазол-3-амин был заменен на 3-бромтиено[3,2-с]пиридин-4-амин, а другие исходные вещества, реагенты и способ получения были идентичны стадии 6 примера 1. I-3 было получено в виде желтого твердого вещества.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 5,51 (s, 2Н), 7,11-7,16 (m, 1Н), 7,34-7,41 (m, 3Н), 7,64 (s, 1Н), 7,68-7,23 (m, 2Н), 7,82-7,88 (m, 4Н), 8,16-8,19 (m, 2Н), 8,32 (d, J=9,0 Гц, 1Н), 10,64 (s, 1Н).
Пример 4:
6-(4-аминотиено[2,3-d]пиримидин-5-ил)-N-фенил-1-нафталинкарбоксамид
Стадия 1: 5-бромтиено[2,3-d]пиримидин-4-амин
360 мг 5-бром-4-хлортиено[2,3-d]пиримидина и 20 мл концентрированного водного раствора аммиака добавляли в герметичную трубку из нержавеющей стали, закрывали и нагревали до 90°С. После перемешивания в течение 24 ч смесь охлаждали до комнатной температуры, фильтровали и промывали водой с получением 272 мг 5-бромтиено[2,3-d]пиримидин-4-амина в виде желтого твердого вещества. Выход: 82%.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 6,99-7,65 (br s, 1Н), 7,78 (s, 1Н), 8,32 (s, 1Н).
Стадия 2: 6-(4-аминотиено[2,3-d]пиримидин-5-ил)-N-фенил-1-нафталинкарбоксамид (I-4)
4-иод-1Н-индазол-3-амин был заменен на 5-бромтиено[2,3-d]пиримидин-4-амин, а другие исходные вещества, реагенты и способ получения были идентичны стадии 6 примера 1, с получением I-4 в виде белого твердого вещества.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 7,14 (t, J=7,2 Гц, 1Н), 7,39-7,41 (m, 2Н), 7,63 (s, 1Н), 7,67-7,31 (m, 2Н), 7,82-7,85 (m, 3Н), 8,16-8,19 (m, 2Н), 8,33 (d, J=9,0 Гц, 1Н), 8,38 (s, 1Н), 10,62 (s, 1Н).
Пример 5:
6-(4-амино-7-(1-(2-гидроксиэтил)-1Н-пиразол-4-ил)тиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид (I-5)
Стадия 1: 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-)этанол
100 мг 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразола и 91 мг 1,3-диоксолан-2-она растворяли в 2 мл диметилформамида. 336 мг карбоната цезия нагревали до 140°С, перемешивали в течение 0,5 ч, затем охлаждали до комнатной температуры и концентрировали. Остаток очищали при помощи колоночной хроматографии (этилацетат : петролейный эфир = 30:70) с получением 93 мг 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол-1-ил)этанола в виде светло-желтого масла. Выход: 76%.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 1,25 (s, 12Н), 3,71 (q, J=5,4 Гц, 2Н), 4,15 (t, J=5,4 Гц, 2Н), 4,87 (t, J=5,4 Гц, 1Н), 7,57 (s, 1Н), 7,88 (s, 1Н).
Стадия 2: 6-(4-амино-7-иодтиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид
80 мг 6-(4-аминотиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамида (I-3) растворяли в 3 мл диметилформамида. В ледяной бане добавляли 50 мг N-иодсукцинимида при перемешивании и перемешивали в течение ночи. На следующий день смесь концентрировали. Остаток очищали колоночной хроматографией (метанол : дихлорметан = 2:98) с получением 94 мг 6-(4-амино-7-иодтиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамида в виде черного твердого вещества. Выход: 90%.
1Н ЯМР (300 МГц, DMSO-d6) δ (млн-1): 5,58 (s, 2Н), 7,13 (t, J=7,2 Гц, 1Н), 7,39 (t, J=7,8 Гц, 2Н), 7,68-7,73 (m, 3Н), 7,82-7,85 (m, 3Н), 8,06 (s, 1Н), 8,16-8,19 (m, 2Н), 8,32 (d, J=8,7 Гц, 1Н), 10,64 (s, 1Н).
Стадия 3: 6-(4-амино-7-(1-(2-гидроксиэтил)-1Н-пиразол-4-ил)тиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамид (I-5)
26 мг 6-(4-амино-7-иодтиено[3,2-с]пиридин-3-ил)-N-фенил-1-нафталинкарбоксамида, 24 мг 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразол-1-ил)этанола, 4 мг бис(трифенилфосфин)дихлорида палладия(II), 13 мг карбоната натрия, 2 мл этанола, 1 мл толуола и 1 мл воды добавляли в реакционную колбу и нагревали до 90°С в атмосфере аргона. После перемешивания в течение 4 ч смесь охлаждали до комнатной температуры. Для разделения добавляли воду и этилацетат. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией (метанол : дихлорметан = 5:95) с получением 8 мг 1-5 в виде коричневого твердого вещества. Выход: 32%.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 3,81 (q, J=5,2 Гц, 2Н), 4,25 (t, J=5,6 Гц, 2Н), 5,02 (t, J=5,2 Гц, 1Н), 5,68 (s, 2Н), 7,14 (t, J=7,2 Гц, 1Н), 7,39 (t, J=8,0 Гц, 2Н), 7,70-7,74 (m, 2Н), 7,77 (s, 1Н), 7,83-7,86 (m, 3Н), 7,96 (s, 1Н), 8,11 (s, 1Н), 8,18-8,22 (m, 3Н), 8,33 (d, J=8,8 Гц, 1Н), 10,67 (s, 1Н).
Пример 6:
6-(3-амино-1Н-индазол-4-ил)-N-(о-метилфенил)-1-нафталинкарбоксамид (I-6)
Стадия 1: 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(о-метилфенил)-1-нафталинкар боксамид
Фениламин заменяли о-метилфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(о-метилфенил)-1-нафталинкар боксамида в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 2,32 (s, 3Н), 7,14-7,17 (m, 1Н), 7,25-7,26 (m, 1Н), 7,31-7,35 (m, 1Н), 7,51-7,55 (m, 2Н), 7,83 (d, J=6,4 Гц, 1Н), 7,94 (dd, J=8,4, 1,2 Гц, 1Н), 8,03 (d, J=8,0 Гц, 1Н), 8,14 (d, J=7,2 Гц, 1Н), 8,40 (d, J=8,4 Гц, 1H), 8,42 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(о-метилфенил)-1-нафталинкарбоксамид (I-6)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(о-метилфенил)-1-нафталинкар боксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 примера 1, с получением I-6 в виде бежево-коричневого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 2,36 (s, 3Н), 4,33 (s, 2Н), 6,94-6,96 (m, 1Н), 7,20-7,22 (m, 1Н), 7,25-7,32 (m, 2Н), 7,35-7,36 (m, 2Н), 7,54 (d, J=7,6 Гц, 1Н), 7,69 (t, J=7,6 Гц, 1Н), 7,77 (dd, J=8,8, 2,0 Гц, 1Н), 7,88 (d, J=7,2 Гц, 1Н), 8,13 (d, J=1,6 Гц, 1Н), 8,18 (d, J=8,0 Гц, 1Н), 8,42 (d, J=8,8 Гц, 1Н), 10,12 (s, 1Н), 11,84 (s, 1Н).
Пример 7:
6-(3-амино-1Н-индазол-4-ил)-N-(м-метилфенил)-1-нафталинкарбоксамид (I-7)
Стадия 1: 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(м-метилфенил)-1-нафталинкарбоксамид
Фениламин заменяли м-метилфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(м-метилфенил)-1-нафталинкарбоксамид а в виде бежево-коричневого твердого вещества.
1Н ЯМР (300 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 2,39 (s, 3Н), 6,99 (d, J=7,5 Гц, 1Н), 7,27 (t, J=8,1 Гц, 1Н), 7,42-7,50 (m, 2Н), 7,56 (s, 1Н), 7,69-7,75 (m, 2Н), 7.90 (dd, J=8,4, 0,9 Гц, 1Н), 7,99 (d, J=8,4 Гц, 1Н), 8,32 (d, J=9,0 Гц, 1Н), 8,40 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(м-метилфенил)-1-нафталинкарбоксамид (I-7)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(м-метилфенил)-1-нафталинка рбоксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 примера 1, с получением I-7 в виде беловатого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 2,34 (s, 3Н), 4,32 (s, 2Н), 6,93-6,97 (m, 2Н), 7,26 (m, 1Н), 7,34-7,35 (m, 2Н), 7,60 (d, J=8,0 Гц, 1Н), 6,67 (t, J=7,6 Гц, 1Н), 7,71 (s, 1H), 7,75 (dd, J=8,8, 1,6 Гц, 1H), 7,79 (d, J=6,8 Гц, 1H), 8,13 (d, J=1,2 Гц, 1H), 8,18 (d, J=8,0 Гц, 1H), 8,29 (d, J=8,8 Гц, 1H), 10,57 (s, 1H), 11,84 (s, 1H).
Пример 8:
6-(3-амино-1Н-индазол-4-ил)-N-(п-метилфенил)-1-нафталинкарбоксамид (I-8)
Стадия 1: 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(п-метилфенил)-1-нафталинкар боксамид
Фенил амин заменяли п-метилфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(п-метилфенил)-1-нафталинкар боксамида в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 2,36 (s, 3Н), 7,21 (d, J=8,0 Гц, 2Н), 7,49-7,53 (m, 1Н), 7,57 (d, J=8,4 Гц, 2Н), 7,64 (s, 1Н), 7,78 (d, J=7,2 Гц, 1Н), 7,92 (dd, J=8,4, 0,8 Гц, 1H), 7,80 (d, J=8,4 Гц, 1H), 8,34 (d, J=8,4 Гц, 1H), 8,41 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(п-метилфенил)-1-нафталинкарбоксамид (I-8)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-N-(п-метилфенил)-1-нафталинкар боксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 примера 1, с получением I-8 в виде бежево-коричневого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 2,30 (s, 3Н), 4,32 (s, 2Н), 6,94 (t, J=4,0 Гц, 1Н), 7,19 (d, J=8,0 Гц, 2Н), 7,34-7,35 (m, 2Н), 7,65-7,80 (m, 5Н), 8,13 (s, 1Н), 8,18 (d, J=8,0 Гц, 1Н), 8,30 (d, J=8,8 Гц, 1Н), 10,56 (s, 1Н), 11,85 (s, 1Н).
Пример 9:
6-(3-амино-1Н-индазол-4-ил)-N-(3-этилфенил)-1-нафталинкарбоксамид (I-9)
Стадия 1: N-(3-этилфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарб оксамид
Фениламин заменяли м-эти л фенил амином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением N-(3-этилфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарб оксамида в виде бежево-коричневого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,28 (t, J=7,6 Гц, 3Н), 1,40 (s, 12Н), 2,69 (q, J=7,6 Гц, 2Н), 7,04 (d, J=7,6 Гц, 1Н), 7,32 (t, J=8,0 Гц, 1Н), 7,49-7,53 (m, 2Н), 7,57 (s, 1Н), 7,65 (s, 1Н), 7,78 (d, J=6,8 Гц, 1Н), 7,92 (dd, J=8,4, 1,2 Гц, 1Н), 8,01 (d, J=8,4 Гц, 1Н), 8,35 (d, J=8,4 Гц, 1Н), 8,42 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(3-этилфенил)-1-нафталинкарбоксамид (I-9)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли N-(3-этилфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарб оксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 примера 1, с получением I-9 в виде белого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 1,21 (t, J=7,6 Гц, 3Н), 2,63 (q, J=7,6, 2Н), 4,32 (s, 2Н), 6,94 (t, J=4,0 Гц, 1Н), 6,99 (d, J=7,6 Гц, 1Н), 7,27-7,31 (m, 1Н), 7,33-7,36 (m, 2Н), 7,62-7,69 (m, 2Н), 7,73-7,80 (m, 3Н), 8,13 (d, J=1,2 Гц, 1Н), 8,18 (d, J=8,0 Гц, 1Н), 8,30 (d, J=8,4 Гц, 1Н), 10,58 (s, 1Н), 11,84 (s, 1Н).
Пример 10:
6-(3-амино-1Н-индазол-4-ил)-N-(2-фторфенил)-1-нафталинкарбоксамид (I-10)
Стадия 1: N-(2-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкар боксамид
Фениламин заменяли 2-фторфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением N-(2-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкар боксамида в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 7,12-7,16 (m, 2Н), 7,24-7,26 (m, 1Н), 7,53 (dd, J=8.4, 7.2 Гц, 1Н), 7,82 (dd, J=7,2, 0,8 Гц, 1Н), 7,93-7,95 (m, 2Н), 8,04 (d, J=8,0 Гц, 1Н), 8,37 (d, J=8,8 Гц, 1Н), 8,43 (s, 1Н), 8,59 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(2-фторфенил)-1-нафталинкарбоксамид (I-10)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли N-(2-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкар боксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 примера 1, с получением беловатого твердого I-10.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 4,32 (s, 2Н), 6,95 (t, J=4,0 Гц, 1Н), 7,27-7,36 (m, 5Н), 6,68 (t, J=7,6 Гц, 1Н), 7,76 (dd, J=8,8, 2,0 Гц, 1Н), 7,81-7,86 (m, 2Н), 8,13 (d, J=1,6 Гц, 1Н), 8,19 (d, J=8,4 Гц, 1Н), 8,38 (d, J=8,8 Гц, 1Н), 10,43 (s, 1Н), 11,84 (s, 1Н).
Пример 11:
6-(3-амино-1Н-индазол-4-ил)-N-(3-фторфенил)-1-нафталинкарбоксамид (I-11)
Стадия 1: N-(3-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксаимд
Фениламин заменяли 3-фторфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением N-(3-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамида в виде светло-желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 6,87-6,91 (m, 1Н), 7,29-7,35 (m, 2Н), 7,50-7,54 (m, 1Н), 7,69-7,72 (m, 1Н), 7,75-7,79 (m, 2Н), 7,93 (d, J=8,8 Гц, 1Н), 8.03 (d, J=8,0 Гц, 1Н), 8,31 (d, J=8,8 Гц, 1Н), 8,42 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(3-фторфенил)-1-нафталинкарбоксамид (I-11)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли N-(3-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкар боксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 6 опримера 1, с получением беловатого твердого I-11.
1Н ЯМР (400 МГц, DMSO-d6) δ (млн-1): 4,32 (s, 2Н), 6,94-7,00 (m, 2Н), 7,35-7,36 (m, 2Н), 7,40-7,45 (m, 1Н), 7,58 (d, J=8,4 Гц, 1Н), 7,67-7,71 (m, 1Н), 7,76 (dd, J=8,8, 2,0 Гц, 1Н), 7,82-7,86 (m, 2Н), 8,14 (d, J=1,6 Гц, 1Н), 8,20 (d, J=8,4 Гц, 1Н), 8,30 (d, J=8,8 Гц, 1Н), 10,86 (s, 1Н), 11,85 (s, 1Н).
Пример 12:
6-(3-амино-1Н-индазол-4-ил)-N-(4-фторфенил)-1-нафталинкарбоксамид (I-12)
Стадия 1:
N-(4-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид
Фениламин заменяли 4-фторфениламином, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стадии 4 примера 1, с получением N-(4-фторфенил)-6-(4,4,5,5-тетраметил-113,2-диоксаборолан-2-ил)-1-нафталинкар боксамида в виде беловатого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ (млн-1): 1,40 (s, 12Н), 7,10 (t, J=8,4 Гц, 2Н), 7,50-7,54 (m, 1Н), 7,64-7,69 (m, 3Н), 7,78 (d, J=6.4 Гц, 1Н), 7,93 (dd, J=8,4, 1,2 Гц, 1Н), 8,02 (d, J=8,0 Гц, 1Н), 8,32 (d, J=8,4 Гц, 1Н), 8,42 (s, 1Н).
Стадия 2: 6-(3-амино-1Н-индазол-4-ил)-N-(4-фторфенил)-1-нафталинкарбоксамид (I-12)
N-фенил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамид заменяли N-(4-фторфенил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафталинкарбоксамидом, а другие исходные вещества, реагенты и способ получения были идентичны использованным на стад