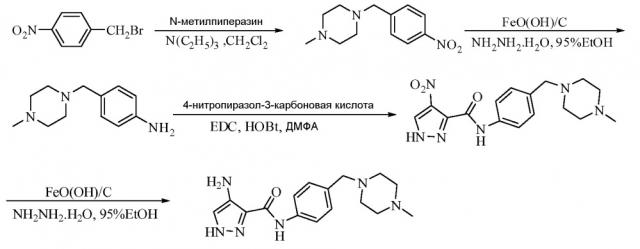
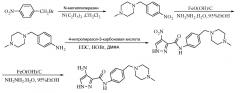
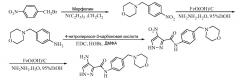
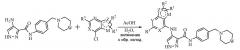
Замещенные полициклические пиразольные ингибиторы киназной активности и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к области медицинской химии и, в частности, относится к производным 4-(замещенного пятичленного гетероциклического пиримидин/пиридин)амино-1H-3-пиразолкарбоксамида формулы (I), в которой радикалы и символы определены в формуле изобретения. Соединения формулы (I) являются ингибиторами протеинкиназ. Изобретение также относится к фармацевтической композиции, содержащей эти соединения, и к их применению в медицине в качестве противоопухолевого средства. 6 н. и 6 з.п. ф-лы, 1 ил., 7 табл., 58 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицинской химии и относится к производным 4-(замещенный пятичленный гетероциклический пиримидин/пиридин)амино-1H-3-пиразолкарбоксамида, способам их получения и фармацевтической композиции, содержащей указанные соединения, а также к их применению в медицине, особенно при противоопухолевой терапии в качестве ингибитора протеинкиназы.
Предпосылки создания изобретения
В нормальных условиях клеточный цикл регулируется группой связанных протеаз, имеющих различные биологические функции, включая ингибирование или активирование клеточного цикла, где большинство белков, которые способствуют клеточному циклу, принадлежат к киназам. Киназы играют важную роль в регуляции белка для активирования важных физиологических функций. Их основная функция in vivo заключается в передаче фосфата из высокоэнергетических молекул аденозинтрифосфата (ATP) рецепторам, с тем, чтобы регулировать активацию или деактивацию рецепторного белка и, наконец, регулировать клеточный цикл. Однако во многих раковых клетках было обнаружено, что эти регулирующие нормальный клеточный цикл киназы внезапно исчезают из-под контроля. Таким образом, считается, что если эти нерегулируемые киназы могут быть подавлены, пролиферация раковых клеток будет под контролем. В последние годы, циклинзависимые киназы (CDK), киназы Aurora, поло-подобные киназы (PLK), кинезин (кинезины веретенообразного белка, KSP) и киназа контрольной точки клеточного цикла (CHK) и некоторые другие новые мишени находятся в тесной связи с клеточным циклом.
Среди них, соактивация киназы Aurora в центросоме и CDK имеет важное значение для инициации митоза. Они связаны друг с другом и взаимно способствуют регуляции клеточного цикла и процесса митоза. Соответствующие ингибиторы этих двух ингибиторов были исследованы, и различные соединения подвергались клиническим исследованиям, демонстрируя хорошие перспективы для разработки противораковых лекарственных средств.
Было обнаружено, что почти все опухоли связаны с расстройством регуляции клеточного цикла, которое может вызвать бесконтрольный рост клеток, нарушение дифференцировки клеток и аномальный апоптоз, и чрезмерная активация CDK (циклинзависимых киназ, CDK) является одной из важных причин для этих условий. CDK являются важными серин/треонин протеинкиназами, которые не проявляют биологической активности как таковой, до тех пор, пока они комбинированы с циклинами. После активации, CDK могут катализировать фосфорилирование субстрата, стимулируя каждую фазу клеточного цикла, выполнять последовательно синтез ДНК и митоз, и, наконец, индуцировать рост клеток и клеточную пролиферацию. Тем временем, CDK можно также связать с CDK ингибиторами (CDI) для оказания негативной роли на прогрессию регуляции, с тем, чтобы ингибировать клеточный цикл и предотвратить деление клеток. Так как CDK имеют решающее значение в регуляции пролиферации клеток опухоли и апоптоза, избирательное ингибирование активности CDK в тканях опухоли может играть позитивную роль в лечении опухолей и злокачественных заболеваний. Таким образом, исследование и скрининг низкомолекулярных ингибиторов для CDK является одной из главных областей для лечения рака и разработки новых химиотерапевтических лекарственных средств.
CDK1, CDK2, CDK4 и CDK6 являются более важными подтипами CDK в регуляции прогрессирования клеточного цикла. Благодаря тому, что дисрегуляция клеточного цикла является одной из основных причин рака, если клеточный цикл можно предотвратить от вступления в S-фазу, аберрантной репликации ДНК не произойдет. Процесс от G1 к S фазе регулируется главным образом CDK2/циклин E, поэтому CDK2 ингибиторы клеточного цикла могут предотвратить вступление в S-фазу для дальнейшей репликации ДНК. Кроме того, в дополнение к контролю от G1 в S-фазу, CDK2/циклин A также может контролировать прогрессирование S и G2 фазы через клеточный цикл. Можно увидеть, что CDK2 играет весьма значительную роль в клеточном цикле, и поэтому, если можно эффективно ингибировать активность CDK2, клеточный цикл будет контролируемым и неконтролируемая пролиферация клеток опухоли будет подавлена.
В последние годы ряд низкомолекулярных ингибиторов CDK были раскрыты и большинство из них показывают хорошую ингибирующую активность против CDK2. Они оказывают ингибирующее действие главным образом конкурентным связыванием с ATP активным сайтом CDK.
Семейство Aurora представляет собой серин/треонин-киназу. Существует три вида подтипов киназы Aurora, которые весьма существены в структуре и функциях в клетках человека: Aurora A, B и C. Она вовлечена в регуляцию клеточного митоза, включая дублирование центросома, формирование биполярного веретена и перегруппировку хромосомы в веретене, и т.д., и можно точно мониторить контрольную точку веретена, прерывать неправильную прогрессию клеточного цикла и полный процесс восстановления. Во время прогрессии клеточного цикла, киназы Aurora главным образом действуют на фазе М, и начинает серию биохимических событий митоза в сочетании с CDK.
Aurora А и Aurora В тесно связаны с опухолями. Во-первых, Aurora A расположена на 20q13.2, в то время как Aurora B расположена на 17p13. Обе из них расположены в хромосомных сегментах активных транслокаций, делеций или амплификаций, означая, что они обладают природной нестабильностью. Эти исследования показывают, что, когда Aurora A сверхэкспрессирована, она является потенциальным онкогеном. Амплификация этих двух хромосомных областей преобладает в тканях опухоли рака молочной железы и колоректального рака, и клеточной линии рака молочной железы, рака яичников, рака толстой кишки, рака простаты, рака шейки матки и нейробластомы. В настоящее время существует несколько исследований на канцерогенное действие Aurora C.
Aurora A, B и C являются высоко гомологичными в каталитической области только с различными короткими аминокислотными последовательностями в конечной области регуляции и каталитического домена. Активные сайты, где ингибиторы связываются, расположены в области петли. Пуриновое кольцо ATP может быть размещено в гидрофобном кармане киназы Aurora и образует водородную связь с аминокислотными остатками в области петли. Ингибитор киназы Aurora может конкурентно связываться с сайтом связывания ATP киназы Aurora, а также принадлежит к ATP конкурентным ингибиторам.
Сообщается, что на конечной стадии G2 микроинъекция антитела киназы Aurora может значительно задержать митотическую инициацию. В настоящее время полагают, что существует механизм участия киназы Aurora A в качестве последующего эффектора для активированных комплексов CDK/циклин в серии биохимических событий для инициации митоза. Он формирует положительную обратную связь интерактивной активации с комплексами CDK/циклин, таким образом, что комплексы CDK/циклин сначала активируют киназы Aurora, и киназы Aurora, в свою очередь, способствуют полной активации CDK и облегчению позиционирования в ядре комплекса. Эти два события являются важными для инициации митоза. Короче говоря, в ходе клеточного цикла соактивация киназы Aurora и CDK на центросоме является одним из необходимых условий для начала митоза клеток, при котором они взаимно связаны друг с другом в регуляции процесса клеточного цикла и митоза. Таким образом, если активности киназы Aurora и CDK могут ингибироваться одновременно, сдерживание разрастания опухолевых клеток может двойственно тормозится. Поэтому это имеет большое значение при разработке новых мульти-нацеленных ингибиторов CDK/Aurora.
На протяжении клеточного цикла, в добавление к контролю G1 в S-фазе, CDK2 также контролирует клеточные процессы в S и G2 фазах. Таким образом, путем ингибирования CDK2 можно препятствовать нормальной репликации ДНК в клеточном цикле. Вместе с тем, в фазе М регулирование митоза клеток главным образом зависит от Aurora A, которая играет незаменимую роль в дублировании центросомы, формировании биполярного веретена, хромосомных перестройках и тому подобное. Таким образом, полагают, что ингибирование Aurora A может предотвращать клеточный митоз. Поэтому, поиск низкомолекулярных мульти-мишеней, одновременно нацеливающих на CDK и киназы Aurora и затрагивающих клеточный цикл раковых клеток во множественных направлениях, будет наилучшим путем достижения цели лечения рака.
До сих пор многое, касающееся кристаллических структур CDK2 и Aurora A, было решено, и ингибирующее действие ингибиторов и мишеней стало ясным, что служит основой для создания на основе структуры лекарственных средств мульти-нацеленных ингибиторов. Для сравнения, ингибиторы CDK2 и киназы Aurora A конкурентно связываются с ATP-связывающим карманом, главным образом связываются с ферментом посредством водородных связей и гидрофобных взаимодействий. Существуют некоторые общие признаки для режимов действий низкомолекулярных ингибиторов с этими двумя киназами, и область их совместной эффективности заключаются в следующем: трехмерной структуре и физико-химических свойствах, таких как водородные связи, аналогичности гидрофобного и гидрофильного пространственного распределения с CDK2 и Aurora A: 1) шарнирное (шарнир): шарнирная область является самой важной областью для всех ATP-конкурентных ингибиторов, и в этой области зачастую имеются две или три критические водородные связи; и остатками в этих двух киназах, вовлеченными в формирование водородных связей, являются Glu81 и Leu83 для CDK2, и Glu211 и Ala213 для Aurora A. Более того, ряд гидрофобных плоских сегментов часто располагаются в шарнирной области, с тем чтобы обеспечить некоторые гидрофобные эффекты; 2) гидрофобная область A: эта область относится к гидрофобной полости, образованной между шарнирной областью и аспарагиновой кислотой (Asp145 для CDK2 и Asp274 для Aurora), которая расположена недалеко от области мотива киназы DFG. Поскольку область петли имеет определенную гибкость, выбор гидрофобных структурных фрагментов показывает некоторое разнообразие; 3) гидрофильная область: оба активных сайта двух киназ содержат гидрофильные области, где введение гидрофильных групп в эту область будет иметь большое значение для модуляции физико-химических свойств соединений. Гидрофильные области CDK2 расположены вблизи Gln85, в то время как Aurora A расположена около Leu215. Эти области высоко перекрывающихся фармакодинамических эффектов дают возможность конструирования мульти-нацеленных ингибиторов CDK/Aurora. Мульти-нацеленные лекарственные средства образованные перекрывающимися молекулами лигандов, как правило, имеют небольшую молекулярную массу, хорошие физические и химические свойства и значительно улучшенную лекарственную устойчивость.
В последние годы с развитием исследования в отношении протеинкиназ на основе структуры и последовательности гена, концепция семейства белка постоянно представляется как семейство ферментов с аналогичной структурностью и функциональностью и вовлеченное в различную передачу сигнала и клеточную регуляцию. Протеинкиназы могут быть классифицированы на множество субсемейств, основанных на различных фосфорилированных субстратах, таких как протеин-тирозин, протеин-серин/треонин, липиды и др. Протеинкиназы характеризуются их механизмами регуляции, включая аутофосфорилирование, трансфосфорилирование с другими киназами, белок-белковые взаимодействия, белок-липидные взаимодействия и взаимодействия белок-полинуклеотид. Единственная протеинкиназа может быть вовлечена в различные механизмы регуляции. Протеинкиназы катализируют δ-фосфат на конце ATP и фосфорилируют боковую цепь гидроксила остатков серина, треонина или тирозина, которые регулируют их субстратную активность, опосредуя большинство путей передачи клеточного сигнала, и регулируют множество различных клеточных процессов. Клеточные процессы включают, но, не ограничиваясь ими, пролиферацию, дифференцировку, апоптоз, моторику, транскрипцию, передачу и другие процессы передачи сигнала. Фосфорилирование действует в качестве молекулярного переключателя, регулирующего биологические функции белка-мишени. Фосфорилирование белков-мишеней происходит в ответ на разнообразные внеклеточные сигналы, события клеточного цикла, экологические или пищевые стрессы и т.д. Внеклеточные сигналы включают гормоны, нейромедиаторы, факторы роста и дифференцировки, и т.д. Специфическая протеинкиназа играет определенную роль в путях передачи сигналов, которые прямо или косвенно активируют или деактивируют метаболические ферменты, регуляторные белки, рецепторы, цитоскелетные белки, ионные каналы или насосы, или факторы транскрипции. Неконтролируемая передача сигналов, вызванная недостатком контролируемого фосфорилирования белков, имеет отношение ко многим заболеваниям, включая воспаление, рак, диабет, астмы/аллергии, заболевания и расстройства иммунной системы, расстройства и заболевания центральной нервной системы, а также ангиогенез при заболеваниях и расстройствах.
Кином человеческого белка содержит 518 членов протеинкиназ, включая 90 тирозинкиназ, 388 серин/треонин-киназ и 40 неклассических киназ. На основании филогенетического анализа, Хэнкс и Хантер разделили протеинкиназы человека на несколько категорий. С увеличением числа клонированных членов протеинкиназ, их классификация является более и более систематизированной и подробной. На основании филогенетического древа, они предложили классификацию на каталитический домен всех членов протеинкиназы, как опубликовано до июня 1993 года. Филогенетическое древо содержит четыре крупных семейства киназ: (a) семейство AGC, включающее семейство cAMP-зависимой протеинкиназы (PKA и PKG семейство), семейство протеинкиназы C, семейство B-адренергических рецепторов киназы (BARK), семейство рибосомной S6 киназы и других связанных киназ; (b) семейство CaMK, включающее семейство Ca2+/- кальмодулин регулируемой протеинкиназы, семейство Snfl/AMPK и других связанных протеинкиназ; (c) семейство CMGC, включая семейство CDK, семейство Erk (MAP) киназы, семейство гликоген-синтаза-киназы 3 (GSK3), семейство казеин-киназы II, семейство Clk и других связанных киназ; и (d) семейство протеин-тирозин-киназы (PTK). Филогенетическое древо также включает количество протеинкиназ, которые не принадлежат ни к одному из четырех семейств. Каждое большое семейство может далее подразделяться на подсемейства, и иметь по меньшей мере один из примеров, подобно Абельсон-киназе (ABL), Akt/протеинкиназе B (Akt/PKB), рецептору эпидермального фактора роста (EGFR), рецептору фактора роста фибробластов (FGFR), смешанной линии киназ (MLK), рецептору тромбоцитарного фактора роста (PDGFR), тирозин-киназе с иммуноглобулин-подобным и EGF-подобным доменами (TIE), рецептору васкулярно-эндотелиального фактора роста (VEGFR). В дополнение к основной структуре члены одного и того же семейства высоко согласуются в топологии, в виде регуляции и субстратной специфичности. Эволюционно подобные члены обладают схожей функциональностью.
CMGC представляет собой серин/треонин-киназу, и сайты фосфорилирования в основном расположены на серине или треонине в пролин-обогащенной среде. Члены этого семейства имеют большой нитрон в функциональностях X и XI субдоменов. Поскольку Dyrk (MNB), Dyrk2, Dyrk3 имеют высокую гомологию с Yakl, они организованы в семейство. В качестве члена семейства CMGC, CDK была приведена ранее. CDK1, CDK2, CDK4 и CDK6 главным образом вовлечены в регуляцию всего клеточного цикла, тогда как другие CDK связаны с другими биохимическими процессами. Для примера, для надлежащего развития нервной системы, требуется CDK5 и причастные к фосфорилированию различные нейрональные белки, такие как Tau, NUDE-1, синапсин 1, DARPP32 и комплекс Munc18/синтаксин 1A. Как правило, нейрональная CDK5 активируется путем связывания с p35/p39 белком. Однако активность может быть разупорядочена путем связывания с p25 (укороченная форма p35). Преобразование p35 в p25 и разупорядочение активности CDK5 может быть вызвана ишемией, эксцитотоксичностью и β-амилоидным пептидом. Таким образом, p25 относится к патогенезу при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, и имеет отношение к лечению таких заболеваний в качестве прямой мишени.
CDK7 представляет собой нуклеопротеин, который обладает cdc2CAK активностью и связан с циклином H. CDK7 является компонентом TFIIH транскрипции комплекса с РНК полимеразной II активностью C-концевого домена (CTD). Ее биохимические пути, при опосредовании Tat, связаны с регуляцией ВИЧ-1 транскрипции. CDK8 связывается с циклином C и имеет отношение к фосфорилированию РНК-полимеразы II CTD. Аналогично, комплекс CDK9/циклин-T1 (P-TEFb комплекс) имеет отношение к длительному контролю РНК-полимеразы II. PTEF-b также требует взаимодействия генома ВИЧ-1 с циклином T1, через которое он транскрибируется и активируется вирусным трансактивированным белком Tat. Таким образом, CDK7, CDK8, CDK9 и комплекс P-TEFb являются потенциальными мишенями для антивирусной обработки.
Регулирование активности комплекса CDK/циклин на молекулярном уровне требует серии стимуляции и ингибирования фосфорилирования и дефосфорилирования. Фосфорилирование CDK осуществляется группой активирующих киназ CDK (CAK) и/или некоторых киназ, таких как wee1, Myt1 и Mik1. Дефосфорилирование проводится фосфатазами, такими как cdc25 (a и c), pp2a, или KAP.
В то же время, было обнаружено, что гиперэкспрессия циклин D1 связана с раком пищевода, раком молочной железы, плоскоклеточным раком и немелкоклеточным раком легких. В патогенезе рака легких инактивация генов-супрессоров опухолей в настоящее время находится в "горячей точке". Ген-супрессор опухолей p15/MTS2, который обозначен как p15 ген и кодирует белок p15, принадлежит к семейству белков INK4. Он действует на CDK и циклиновый комплекс, специально ингибирующих активность CDK4 и CDK16 киназы, предотвращая фосфорилирование белков R6, ограничивая клеточный процесс от G1 к S-фазе и, таким образом, уменьшая пролиферацию клеток.
Митоген-активированная протеинкиназа (MAPK) является еще одним членом семейства CMGG киназы и рода серин/треонин-киназы. Она может передавать внеклеточные сигналы в клетки и ядро и регулировать экспрессию генов активацией факторов транскрипции через консервативные трехуровневые каскады (MAPKKK-MAPKK-MAPK). Этот путь существует у большинства клеток и принимает участие в различных клеточных функциях, таких как клеточное движение, апоптоз, дифференцировка и пролиферация клеток, и многих других физиологических процессах. Были идентифицированы четыре пути передачи сигнала MAPK, и каждый из них является весьма специфичным с индивидуальными функциями. В некоторой степени эти пути сигнала имеют некоторые перекрестные помехи. Исследования с ингибиторами и активаторами на различных путях сигнала могут не только содействовать пониманию механизма пути сигнала, но также создают новые возможности для диагностики и лечения заболеваний. ERK путь сигнала является одним из наиболее тщательно изученных путей, где Мек является ключевым ферментом в Ras-Raf-МЕК-ERK пути передачи сигнала, регулирующим клеточные ответы на различные сигналы роста. МЕК имеет семь подтипов, которые фосфорилируют и активируют последовательно MAPK, соответственно. MEK1 и MEK2 активируют "ERK"; MEK3 и MEK4 активируют p38; и MEK5 и MEK6 активируют JNK. Таким образом, MEK1/MEK2 обычно используется в качестве мишени при лечении рака для разработки перспективных противораковых лекарственных средств при исследовании пути сигнала ERK. Путь сигнала P38/MAPK представляет собой важную ветвь пути MAPK, который может быть активирован стрессорами (например, осмотическим шоком, УФ, гипоксией), цитокинами, факторами роста и инсулином, и даже может быть активирован в нормальной иммунной и воспалительной реакциях. Между тем, изучение другого пути сигнала p38, главной мишенью для лечения ревматоидного артрита в клинических исследованиях, также становится горячей точкой в последние годы. c-Jun N-концевой киназы (JNK)/путь сигнала стресс-активированного белка (SAPK) является важным членом семейства MAPK, в котором c-Jun является членом AP-1 фактора транскрипции комплекса, вовлеченного в контроле пролиферации, трансформации, выживания и апоптоза клеток. JNK также фосфорилирует p53 и некоторые ненуклеопротеинов. Фосфорилирование белка-мишени, опосредованное JNK, является очень важным, что может индуцировать экспрессию генов IL, VEGF, COX-2, MMP-9, гемциклооксигеназы-1 ICAM-1, NCX1, GnRHR и других цитокинов. Путь сигнала JNK вовлечен в воспалительные и аутоиммунные заболевания, такие как ревматоидный артрит, синдром раздраженного кишечника и атеросклероз. ERK5/BMK1, путь сигнала K5/большая митоген-активированная протеинкиназа (BMK1), является последним обнаруженным путем в семействе MAPK. Внеклеточные стрессоры включают высокий уровень сахара, низкий кислород, касательное напряжение кровяного потока, реактивнооксигенные виды (ROS), осмотическое давление и разнообразные митогены, подобно EGF, NGF и т.д. ERK5/BMK1 также следует за MAPK каскадом, MEKK 2/3 (MAPK-KK)-MEK5 (MAPKK)-BMK1/ERK5 (MAPK). После активации, ERK5 перемещается из цитоплазмы в ядро и фосфорилирует большое количество последовательных мишеней, которые включают MEF2C, c-Myc, Bim, AP-1 и т.д. ERK5 играет важную роль в выживании, пролиферации и дифференцировке клеток. Текущее исследование показало, что она тесно связана с патологическими процессами, диабетом, заболеваниями почек, фиброзом печени и опухолями.
Гликоген-синтаза-киназа-3 (GSK-3) представляет собой серин/треонин-киназу, существующую в виде двух повсеместно экспрессированных изоформах в организме человека (GSK-3α и GSK-3β). GSK-3 вовлечена в эмбриональное развитие, синтез белков, пролиферацию клеток, дифференцировку клеток, динамику микротрубочек, подвижность клеток и апоптоз клеток. Аналогичным образом, GSK-3 вовлечена в прогрессирование болезненных состояний, таких как диабет, рак, болезнь Альцгеймера, инсульт, эпилепсия, заболевание двигательных нейронов и/или травма головы. Филогенетически GSK-3 наиболее тесно связана с CDK.
При формировании части пути ответа на инсулин у млекопитающих, GSK-3 способна фосфорилировать, и тем самым инактивировать гликогенсинтазу. Разрегулирование активности гликогенсинтазы и, таким образом, синтеза гликогена через ингибирование GSK-3 рассматривается в качестве потенциального средства для борьбы с сахарным диабетом типа II или инсулин-независимым сахарным диабетом (NIDDM): состоянием, в котором тело ткани становится устойчивым к стимуляции инсулином. Ингибирование GSK-3, например, путем инактивации белка «мишени рапамицина в клетках млекопитающих» (mTOR), можно разрегулировать биосинтез белка. Наконец, имеются некоторые свидетельства для регуляции активности GSK-3 посредством MAPK пути через фосфорилирование GSK-3 киназами, такими как митоген-активированная протеинкиназа, активированная протеинкиназа 1 (MAPKAP-K1 или RSK). Эти данные позволяют предположить, что активность GSK-3 может быть модулирована митогенной, инсулиновой и/или аминокислотной стимуляцией.
Кроме того, GSK-3β является ключевым компонентом в сигнальном пути у позвоночных Wnt. Этот биохимический путь был показан, как имеющий критически важное значение для нормального эмбрионального развития и регуляции пролиферации клеток в нормальных тканях. В ответ на стимуляцию Wnt, GSK-3 становится ингибированной, что может вызвать дефосфорилирование субстрата GSK-3 (например, Axin, генный продукт аденоматозного полипоза (APC) и β-катенина). Аберрантный Wnt путь регуляции связан со многими типами рака. Мутации APC и/или β-катенина очень распространены при колоректальном раке и других опухолях, которые показывают, что β-катенин играет очень важную роль в клеточной адгезии. Таким образом, GSK-3 может также в некоторой степени модулировать процессы клеточной адгезии. Отдельно от уже описанных биохимических путей, существуют также данные, показывающие, что GSK-3 регулирует деление клеток посредством фосфорилирования циклина-D1, и фосфорилирует факторы транскрипции, такие как c-Jun, CCAAT/усилитель связывания белка α (C/EBPα), c-Myc и/или другие субстраты, такие как ядерный фактор активированных Т-клеток (NFATc), фактор теплового шока-1 (HSF-1) и c-AMP-ответный элемент активирующего белка (CREB). Независимо от специфики ткани, GSK-3 также играет роль в регуляции клеточного апоптоза. Роль GSK-3 в модуляции клеточного апоптоза через проапоптический механизм может иметь особое значение при медицинских состояниях, при которых может произойти апоптоз нейронов. Примерами являются травма головы, инсульт, эпилепсия, болезнь Альцгеймера и заболевание двигательных нейронов, прогрессивный надъядерный паралич, кортико-базальная дегенерация и болезнь Пика. Как было показано in vitro, GSK-3 способна гиперфосфорилировать микротрубочки ассоциированного белка Tau. Гиперфосфорилирование Tau разрушает его нормальное связывание с микротрубочками, а также может привести к образованию внутриклеточных нитей Tau. Считается, что постепенное накопление этих нитей приводит к возможной нейрональной дисфункции и дегенерации. Ингибирование Tau фосфорилирования путем ингибирования GSK-3 может, таким образом, обеспечить средства ограничения или предотвращения нейродегенеративных эффектов.
Протеин-тирозин-киназа (PTK), другое важное семейство протеинкиназы, катализированная γ-фосфатной группой ATP тирозиновых остатков многих важных белков, и поэтому фосфорилирует гидроксильные группы фенола. В нормальных клетках (за исключением нервных клеток) редко происходит фосфорилирование тирозина. Хотя фосфорилированный тирозин составляет только 0,5% фосфорилированных аминокислот в организме, он продемонстрировал, что фосфорилирование тирозина играет важную роль в регуляции многих клеточных процессов. Это является важным фактором в передаче сигнала путем передачи сигналов клетками. Кроме того, PTK вовлечены в серию клеточных функций и тесно связаны с ростом клеток, дифференцировкой и пролиферацией. PTK также играют весьма важную роль в росте и пролиферации злокачественных клеток. Расстройства функций тирозинкиназы могут привести к активации его последующих путей передачи сигнала и спровоцировать нарушения пролиферации клеток, в конечном итоге, приводя к образованию опухоли. Таким образом, ингибиторы тирозинкиназы полезны в лечении и профилактике рака.
PTK могут быть классифицированы на нерецепторные тирозинкиназы (NRTK) и рецепторные тирозинкиназы (RTK) в соответствии с тем, могут ли они существовать в рецепторах клеточной мембраны. До настоящего времени было обнаружено 58 видов RTK. Эти протеинкиназы структурно очень похожи на каталитическую область, которая состоит из около 270 аминокислотных остатков. RTK являются трансмембранными белками, и, как правило, состоящих из внеклеточного домена, трансмембранного домена и внутриклеточного киназного домена. Клинические исследования предполагают, что эти рецепторы и их лиганды имеют весьма прямое отношение ко многим видам рака. Гиперэкспрессия соответствующих факторов роста, которые вовлечены в рак, может привести к избыточным сигналам фосфорилирования тирозина, передаваемым в клетки. Такие факторы роста, подобно PDGF рецепторам (PDGF рецептор α и β), рецептору колониестимулирующего фактора (CSF-I) (CSF-1R, c-Fms), FLT-3 и c-kit и др., имеют отношение ко многим заболеваниям, таким как воспаление, и пролиферации клеток. Среди них ген FLT3, расположенный на хромосоме 13q12, является ранним гемопоэтическим фактором роста, обнаруженным в 1991 году, и закодированный рецептор FLT3 принадлежит к третьему типу семейства рецепторов RTK. Когда внеклеточный домен рецептора FLT3 связывается с его эндогенным лигандом, гомо- или гетеродимерный комплекс будет сформирован, что приведет к активации тирозинкиназы, открытию активной петли и подготовке белкового субстрата к связыванию с сайтом связывания ATP. Следовательно, белковый субстрат фосфорилируется, что приводит к передаче серии последовательных сигналов, вызывая пролиферацию и дифференцировку клеток. FLT3 рецепторы широко распространены в гемопоэтических стволовых/прогениторных клетках, тимусе, лимфатических, плацентных, мозговых, гонадных и многих других тканях. Однако мутация гена FLT3 (главным образом, включая внутренние тандемные дублированные мутации околомембранного домена и точечные мутации домена тирозинкиназы) и гиперэкспрессия могут привести к различным гематологическим злокачественным заболеваниям, таким как острый миелобластный лейкоз. В результате, FLT-3 становится "горячей точкой" в лечении рака, в частности в лечении гемобластозом. Гиперэкспрессия или мутация FLT-3 приводит к индукции неконтролируемых рецепторов FLT3 и впоследствии каналов, которые могут привести к активации Ras. Гемобластозомы включают лейкемию, лимфому (NHL), болезнь Ходжкина (также известный как лимфома Ходжкина) и миелому, подобно острому лимфобластному лейкозу (ALL), острому миелобластному лейкозу (AML), острому промиелоцитарному лейкозу (APL), хроническому лимфолейкозу (CLL), хроническому миелолейкозу (CML), хроническому нейтрофильному лейкозу (CNL), острому недифференцированному лейкозу (AUL), анапластической крупноклеточной лимфоме (ALCL), незрелому лимфолейкозу (PML), ювенильному миеломоноцитарному лейкозу (JMML), возрастному Т-клеточному острому лимфобластному лейкозу, трехлинейной миелодисплазии (AML/TMDS), лейкемии смешанного происхождения (MLL), миелодиспластическим синдромам (MDS), миелодисплазии (MPD), множественной миеломе (MM) и саркоме спинного мозга.
Тем временем, внеклеточный домен RTK можно связать с конкретными лигандами, такими как факторы роста, в то время как их внутриклеточные домены фосфорилированы. Сигнальные пути и биологические процессы, опосредованные RTK, расположены в ангиогенезе. Показано, что путь, активированный RTK, выбран в ангиогенезе. Активация путей, таких как через VEGFR или PDGFR, может привести к различным процедурам по ангиогенезу, подобно пролиферации клеток, миграции, выживанию и сосудистой проницаемости, которые тесно связаны с сериями сосудистых заболеваний.
В настоящее время существует 32 нерецепторные тирозинкиназы (nRTK), которые постоянно или временно существуют в цитоплазме, или связаны с трансмембранным белком в клетке. Таким образом, они также известны как цитоплазматические тирозинкиназы. В тканях опухоли nPTK часто являются активированными, способствующими пролиферации клеток, сопротивляющимися апоптозу и способствующими развитию и прогрессии опухоли. nRTK главным образом содержат 10 семейств: SRC, ABL, JAK, ACK, CSK, FAK, FES, FRK, TEC, SYK и др. Цитокины могут передавать сигналы через различные каналы для участия в регуляции роста клеток, дифференцировке и апоптозе. Как правило, рецепторы цитокина не содержат доменов RTK в цитоплазме, но сигнал опосредованно передается цитокином, когда связывание с его рецептором существуют в цитокин-нацеленной клетке. Среди них, Янус-киназа (JAK) и ее последующий STAT составляют важный путь передачи сигнала, и многие цитокины могут активировать JAK/STAT путь передачи сигнала. Когда цитокины связаны с их рецепторами, конформационные изменения будут происходить в цитоплазматических рецепторах, тем самым активизируя ассоциированные с семейством рецепторов JAK киназы. JAK киназы вызывает активацию STAT путем содействия ее соответствующему фосфорилированию. Активированный STAT затем диссоциирует от его рецептора, формирует димер, вступает в ядро и связывается с расширенным семейством GAS, таким образом, активируя транскрипцию, вызывая клеточную трансформацию и регуляцию некоторых генов экспрессии, связанных с пролиферацией клеток и их выживанием, что играет важную роль в возникновении опухолей.
В настоящее время рецепторы тирозинкиназ, такие как VEGFR и EGFR, главным образом исследуются, и ингибиторы ангиогенеза были разработаны для создания стратегия лечения системных типов рака. Ранее продаваемые ингибиторы протеинкиназы являются главным образом однонацеленными ингибиторами против одной мишени. Хотя они добились замечательных предварительных успехов в терапии рака, по мере увеличения времени их использования и случаев, все чаще встречаются недостатки. В противоположность этому, мульти-нацеленные ингибиторы протеинкиназы показали некоторые преимущества. Одновременное нацеливание на множественные мишени и множественные киназные пути передачи сигналов, ингибиторы киназ, мульти-нацеленные ингибиторы киназы могут не только предотвратить лекарственную устойчивость, вызванную мутацией одной мишени, но также значительно расширить их противоопухолевый спектр. Недостаток одно-нацеленных ингибиторов SU5416 и SU6668 указывает, что мульти-нацеленные ингибиторы киназ станут преобладающими в развитии ингибиторов киназ в будущем. SU5416 и SU6668 мишени KDR и PDGFR-β, соответственно, были приостановлены из-за плохой эффективности на клинической стадии III и II. Однако мульти-нацеленный ингибитор сунитиниб, который нацелен на множественные киназы, подобно KDR и т.д., в конечном итоге, остается успешным на рынке. Большинство изучаемых в настоящее время соединений являются мульти-нацеленными ингибиторами, так как они показывают лучшую ингибирующую активность и переносимость пациентами по сравнению с одно-нацеленными ингибиторами. Низкомолекулярные ингибиторы тирозина, которые в настоящее время присутствуют на рынке или в клинических испытаниях, в основном делятся на следующие категории в зависимости от химической структуры: хиназолины, индолиноны, пиридазины, цианохинолины, пирролопиримидины и др. Три антиангиогенных TKI, включая сунитиниб, сорафениб и пазопаниб с различной способностью к связыванию с ангиогенными киназами, недавно одобрены для успешного лечения рака у пациентов (с клеточной карциномой почки, стромальной опухолью желудочно-кишечного тракта и гепатоцеллюлярной карциномой). Многие другие антиангиогенные TKI в настоящее время находятся на клинических испытаниях от фазы I до фазы III. В дополнение к выгодной противоопухолевой активности эти лекарственные средства также были показаны, как обладающие клинической переносимостью и токсичностью.
Длительное и высокодозное применение инъекций таксанов привело к лекарственной устойчивости у пациентов и к снижению эффективности. Все свидетельства показывают, что резистентность может ограничить эффективность таргетирующего рецептора TKI. Таким образом, она имеет важное значение для разработки нового поколения противораковых лекарственных средств. В то же время, исследования показывают, что связанные с киназой заболевания являются эндогенно-родственными, делая однонацеленные ингибиторы затруднительными в приложении их ингибирующей активности.
Из-за существенно важной роли CDK и Auraro A и их родственных белков в пролиферирующих клетках для координации и промотирования клеточного цикла, их соответствующие ингибиторы могут быть использованы для лечения пролиферативных расстройств, таких как рак (применения, как правило, нацеленные на CDK или CDK специфическую терапию), а также для лечения других заболеваний, таких как вирусные инфекции, аутоиммунные заболевания, нейродегенеративные заболевания. При использовании в сочетании с существующими или новыми терапевтическими средствами, CDK-нацеленная терапия может также предоставлять клинические преимущества в лечении заболеваний, описанных выше. По сравнению со многими существующими противоопухолевыми средствами и в отношении приведенных выше тирозинкиназ, мутации CDK и лекарственная устойчивость ее ингибиторов происходят относительно меньше. Таким образом, CDK нацеленная противоопухолевая терапия может потенциально иметь преимущества перед многими существующими в настоящее время противоопухолевыми средствами, так как они не будут непосредственно взаимодействовать с ДНК и поэтому должны будут уменьшать риск развития вторичных опухолей.
Низкомолекулярные мульти-нацеленные ингибиторы CDK, такие как флавопиридол и UCN201, уже показали хорошую противоопухолевую активность в клинических испытаниях I и II. Тем не менее, большинство ингибиторов являются одно-нацеленными и многие компании провели исследования в этом аспекте. Для примера, новый низкомолекулярный ингибитор CDK AT7519, который в настоящее время на клинических испытаниях I/II действует на множественные мишени, такие как CDK1/циклин B, CDK2/циклин А, CDK3/циклин E и др. В то же время, AT7519 может вызвать активацию белка, члена его семейства GSK-3β ослабленной регуляцией уровня его фосфорилирования, ведущей к апоптозу клеток. Относительно типа структуры семейства ингибиторов кросс-протеинкиназ, в настоящее время редко сообщалось, и таким образом разработка ингибиторов киназы, которые