Покровная композиция для протравливания семян и стерилизации поверхности
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Покровная композиция содержит пиритион цинка, триклозан и карбоксиметилцеллюлозу. Композиция проявляет противовирусную, противогрибковую, противобактериальную, антикандидозную активность в семенах растений. Изобретение позволяет повысить противомикробную активность композиции. 7 з.п. ф-лы, 10 ил., 6 табл.
Реферат
Область техники
Настоящее изобретение относится к покровной композиции, разработанной для протравливания семян однолетних и многолетних растений и стерилизации сельскохозяйственного инвентаря.
Предпосылки создания изобретения
Наиболее важным элементом в растениеводстве, связанным с воспроизводством и разведением, являются семена. Сообщается, что по приблизительной оценке в мире ежегодно используют 127400000 тонн семян. Стоимость такого количества семян составляет около 40-50 миллиардов долларов. Объем производства семян с целью продажи по некоторым оценкам составляет около 30 миллионов долларов. К серьезным потерям в растениеводстве могут приводить патогенные микроорганизмы, передающиеся с семенами, по-разному проявляя свое действие. Известно, что патогенные микроорганизмы, передающиеся с семенами, в растениеводстве особенно, вызывают весьма серьезное снижение объема и качества продукции [1]. Патогенные микроорганизмы, вызывающие заболевания растений, которые передаются с семенами, называют "патогенными микроорганизмами, передающимися с семенами" [3]. Большое значение имеют все виды протравливания и стерилизации, которые будут выполняться для повышения всхожести семян, используемых на сельскохозяйственных территориях, и сокращения или полного устранения потерь продукции в результате действия патогенных микроорганизмов, передающихся с семенами.
Грибковые и бактериальные заболевания, передающиеся с семенами, могут вызывать серьезные проблемы для продукции, полученной как органическими, так и обычными методами ведения сельского хозяйства. Таким образом, для исключения потенциального вреда для семян или факторов заболеваний растений, передающихся через почву, в сельскохозяйственном производстве выполняется обработка семян (нанесение пестицидов на семена). Для этого возможно применение фунгицидов, используемых в обычной сельскохозяйственной практике для борьбы с грибковыми заболеваниями, передающимися с семенами [4, 5]. Кроме того, в исследовании, проведенном Kasselaki et al. в 2007 году, сообщается об использовании в органическом сельском хозяйстве нескольких альтернативных усовершенствованных методов [6]. Однако используемые на сегодняшний день методы лишь частично эффективны в борьбе с патогенными бактериальными микроорганизмами, передающимися с семенами, что является одной из наиболее важных проблем, с которыми мы сталкиваемся в практике органического и традиционного сельского хозяйства [7, 8]. По этой причине очень важной представляется разработка новых усовершенствованных методов устранения патогенных микроорганизмов, передающихся с семенами.
Одним из периодов, когда патогенные микроорганизмы, передающиеся с семенами, вызывают серьезные проблемы, является рассадный период. Заражение семян патогенными микроорганизмами способствует выживаемости этих микроорганизмов и их распространению на новые и обширные территории. В условиях, сходных с тепличными, весьма высока опасность серьезных экономических потерь, связанная с заболеваемостью чувствительных растений, поскольку такие факторы, как высокая плотность насаждения, высокая относительная влажность, высокая температура и орошение дождеванием способствуют распространению болезней растений. В этих условиях наиболее эффективным методом борьбы с болезнями является отбраковка. В этом смысле, партии семян подвергают выборочной проверке на патогенные микроорганизмы, и здоровые семена, после удаления зараженных семян, используют в качестве посевного материала [9].
Термины "заражение" и "инвазия" относятся к пассивной взаимосвязи между патогенными микроорганизмами и семенами. Заражение семян патогенными микроорганизмами может быть связано как с агрономическими мероприятиями в поле в ходе выращивания, так и произойти во время сбора урожая, смешивания, упаковывания, транспортировки или хранения [2].
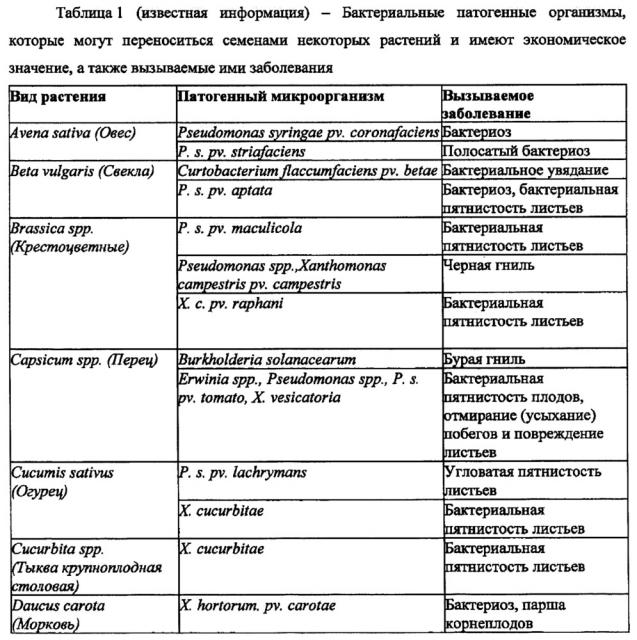
Заражение семян патогенными микроорганизмами рассматривают как адсорбцию бактериальной клетки, спор грибов (хламидоспоры, ооспоры, телиоспоры, уредоспоры) или вирионов на семенах во время или после сбора урожая. В Таблице 1 (известная информация) приведены бактериальные патогенные микроорганизмы, которые могут переноситься с семенами некоторых растений и имеют экономическое значение, а также вызываемые ими заболевания. В Таблице 2 (известная информация) приведены грибковые заболевания и грибы, вызывающие эти заболевания.
Бактериальные патогенные микроорганизмы, передающиеся с семенами, приводят к таким последствиям как уменьшение объема произведенной продукции (15-30%); снижение или потеря всхожести семян; заболеваемость растения; изменения цвета, формы или биохимические изменения и образование токсинов в семенах, затруднение процесса формирования и созревания семян; порча семян; и гниение семян [10, 11].
Существует около 11000 болезнетворных факторов, вызывающих бактериальные, грибковые и вирусные инфекции у растений [12]. Около 13% потерь произведенной продукции во всем мире вызвано болезнями растений. Большая часть этих потерь вызывается вирусными патогенами [13,14]. Экономические потери сельскохозяйственной продукции, вызванные патогенными микроорганизмами, изменяются от года к году, от сезона к сезону, от региона к региону, от продукта к продукту. При этом согласно оценкам размер ежегодных потерь продукции из-за вирусных заболеваний растений составляет около 60 миллиардов долларов [14-16]. Ежегодные потери, вызванные некоторыми вирусами, для различных растений, приведены в Таблице 3 (известная информация).
*$: Доллар, **£: Фунт стерлингов
В этой отрасли известны различные исследования, касающиеся протравливания поверхности семян. Ранее в литературе сообщалось о протравливании поверхности семян 1-5% раствором гипохлорита натрия [17-20]. Тем не менее, в ходе некоторых исследований наблюдалось, что споры Aspergillus в семенах, обработанных 1-5% раствором гипохлорита натрия, не уничтожались [21, 22].
В своем исследовании, проведенном в 1915 г., Wilson установил, что после протравливания 30 различных семян гипохлоритом кальция, содержащим 2% хлора, только в трех семенах были обнаружены грибы, и что гипохлорит кальция пригоден для использования с целью протравливания семян [23].
Чтобы не подвергать семена, предназначенные к использованию в органическом земледелии, процессам химического протравливания, Nega et al. (2003) протравливали их теплой водой при различных температурах в течение различных по продолжительности периодов времени, и им удалось снизить количество патогенных микроорганизмов в семенах без потери всхожести семян [8]. Однако и этот метод не позволяет полностью устранить патогенный микроорганизм на семенах. Микробная нагрузка может быть уменьшена лишь до определенной степени.
В известных в этой отрасли патентных заявках WO 2012152737 и WO 2009021986 предложены способы и композиции по улучшению качества семян [24, 25].
В заявке на патент США US 20130005811 предложена композиция, снижающая концентрацию микроорганизмов, находящихся на внешней поверхности оболочки семян [26]. Однако не указано, что какой-либо из указанных способов протравливания оказывает какой-либо эффект одновременно против бактерий, грибов, дрожжей и вирусов, находящихся как внутри, так и снаружи семян.
Противобактериальная композиция предложена в известной в этой отрасли заявке на патент Японии JP 2007209267. В ней описана композиция, позволяющая дезинфицировать оболочку семян.
В известной в этой отрасли заявке на Европейский патент ЕР 1865032 описана пигментная смесь, которая может быть использована на слюдяных поверхностях. Этот пигмент также может быть применен для получения поверхности с противомикробными свойствами на оболочке семян с применением оксида цинка и его производных.
Краткое изложение сущности изобретения
Целью настоящего изобретения является создание противогрибковой покровной композиции, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу.
Другой целью настоящего изобретения является создание антикандидозной покровной композиции, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу.
Еще одной целью настоящего изобретения является создание противобактериальной покровной композиции, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу.
Другой целью настоящего изобретения является создание противовирусной покровной композиции, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу.
Еще одной целью настоящего изобретения является создание покровной композиции, которая может наноситься на семена однолетних и многолетних растений.
Другой целью настоящего изобретения является создание покровной композиции, повышающей всхожесть семян путем предотвращения роста микроорганизмов.
Еще одной целью настоящего изобретения является создание покровной композиции, которая уменьшает или исключает потери продукции в результате инфекции, которой подвергаются семена однолетних и многолетних растений.
Другой целью настоящего изобретения является создание покровной композиции для стерилизации поверхностей, имеющих грибковое, бактериальное и вирусное заражение, полученное в местах использования семян однолетних и многолетних растений, и поверхностей зернохранилищ, складов и хранилищ, в которых семена хранятся перед посевом.
Другой целью настоящего изобретения является создание покровной композиции, которая может использоваться для стерилизации сельскохозяйственного инвентаря и оборудования.
Еще одной целью настоящего изобретения является создание противомикробного продукта, полученного на основе композиции по этому изобретению.
Подробное описание изобретения
Покровная композиция для семян, разработанная в соответствии с настоящим изобретением, эффективна против патологических факторов всех видов (бактерии, грибы и вирусы), которые присутствуют как на поверхности, так и внутри семян, и не снижает всхожесть этих семян. Эта покровная композиция обеспечивает протравливание семян всех видов. Применение указанной композиции обеспечивает сдерживание заболеваний, передающихся с семенами, а также снижение потерь, вызванных патогенными микроорганизмами, передающимися через почву. Разработанный продукт демонстрирует одинаковую противомикробную и противовирусную активность на семенах не одного, а всех видов.
Осуществление процесса создания покровной композиции для семян, содержащей пиритион цинка (C10H8N2O2S2Zn), триклозан и карбоксиметилцеллюлозу, для протравливания поверхности описано ниже.
- 5 г карбоксиметилцеллюлозы смешивают с 964,16 г воды, перемешивают при температуре 50°С до тех пор, пока смесь не станет полностью однородной и вязкой, и получают 1000 г раствора. Затем в указанный раствор добавляют 0,5 г триклозана и 20,83 г пиритиона цинка. Полученную смесь перемешивают в течение приблизительно 30 мин. В результате получают соотношение 0,01-0,1% (объем.) триклозана и 0,5-2% (объем.) пиритиона цинка. После охлаждения до комнатной температуры полученную композицию используют для нанесения покрытия на поверхность семян. Указанная композиция, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу, в дальнейшем именуется "ZTC" (аббревиатура).
Процесс нанесения покрытия на семена упомянутой композицией осуществляется следующим образом.
- Для осуществления нанесения покрытия на семена раствором при комнатной температуре (25°С) вначале раствор, а затем семена помещают во флаконы. Процесс нанесения покрытия проводят при комнатной температуре 25-30°С в течение 15 мин при 12 об/мин, чтобы раствор во флаконах полностью покрыл поверхность семян. На последнем этапе, позволяющем обеспечить семенам противомикробные свойства, семена отделяют фильтрованием и затем сушат при температуре 25-30°С в сушильной печи.
Эта же композиция может быть нанесена на сельскохозяйственный инвентарь и поверхности хранилищ путем погружения или распыления так, чтобы была покрыта вся поверхность.
Продукт, полученный на основе указанной покровной композиции, протравливает поверхность семян, а также стерилизует сельскохозяйственный инвентарь и поверхности хранилищ путем нанесения покрытия на них.
"Покровная композиция для протравливания семян и стерилизации поверхности", разработанная для достижения цели настоящего изобретения, проиллюстрирована на прилагаемых фигурах, на которых:
На Фиг. 1 показано противобактериальное воздействие покровного продукта, содержащего ZTC, на бактерию Clavibacter michiganensis.
На Фиг. 2 показано противогрибковое воздействие покровного продукта, содержащего ZTC, на гриб Botrytis spp.
На Фиг. 3 показано противогрибковое воздействие покровного продукта, содержащего ZTC, на гриб Fusarium spp.
На Фиг. 4 показано противобактериальное воздействие покровного продукта, содержащего ZTC, на бактерию Pseudomonas syringae на семенах сафлора красильного, а также семена сафлора красильного без какого-либо покрытия.
На Фиг. 5 показана всхожесть семян кукурузы, на которые нанесен покровный продукт, содержащий ZTC.
На Фиг. 6 показаны семена кукурузы без покрытия.
На Фиг. 7 показана всхожесть семян подсолнечника, на которые нанесен покровный продукт, содержащий ZTC.
На Фиг. 8 показаны семена подсолнечника без покрытия.
На Фиг. 9 показана всхожесть семян пшеницы, на которые нанесен покровный продукт, содержащий ZTC.
На Фигуре 10 показаны семена пшеницы без покрытия.
Экспериментальные исследования
Противомикробные испытания
Противомикробную покровную композицию для семян по настоящему изобретению наносили на семена способом нанесения покрытия, описанным ниже. Чтобы наблюдать рост микроорганизмов на поверхности семян, покрытые и необработанные семена помещали в равных количествах в чашки с питательным агаром (NA), агаром Сабуро с глюкозой (SDA) и картофельным агаром с глюкозой (PDA), соответственно. Чашки Петри, содержащие пригодные для роста бактерий, дрожжей и грибов среды, выдерживали при температуре 25±1°С в течение 24 часов в случае бактерий, при температуре 36±1°С в течение 48 часов в случае дрожжей и при температуре 25±1°С в течение 72 часов в случае грибов. В качестве негативного контроля использовали необработанные семена. Противомикробную активность противомикробной покровной композиции для семян оценивали на семенах с учетом микроорганизмов, растущих вокруг семян. Результаты испытаний противомикробной активности на семенах, покрытых экспериментальным противомикробным покровным продуктом для семян, содержащим пиритион цинка, триклозан и карбоксиметилцеллюлозу, в обобщенном виде представлены в Таблице 1 (известная информация). Все испытания повторяли по меньшей мере два раза.
Испытания противомикробной активности на покрытых семенах
Испытания на противомикробную активность композиции, содержащей ZTC, нанесенной на семена растений, как описано выше, проводили одновременно двумя различными методами. Согласно первому методу испытаний изолятами бактерий Pseudomonas syringae, Clavibacter spp., Burkholderia spp., Curtobacterium spp., Bacillus spp., Pseudomonasaeruginosa, Erwinia spp., Xanthomonasaxonopodis, Xanthomonascampestris и Agrobacterium spp; дрожжей Candida spp.и грибов Aspergillus spp., Botrytis cinerea, Fusarium spp., Penicillium spp, Rhizopus spp., Alternaria spp., Rhizoctonia spp.и Sclerotinia spp. инокулировали чашки Петри, содержащие приемлемые среды (NA, SDA и PDA, соответственно). Семена, покрытые композицией, содержащей ZTC, размещали на инокулированных чашках Петри. Инокулированные чашки Петри инкубировали в течение 24 часов в случае бактерий, 48 часов в случае дрожжей при температуре 36±1°С и 72 часов в случае грибов при температуре 25±1°С. Противомикробную активность композиции, нанесенной на семена, оценивали путем наблюдения зоны ингибирования (зона, в которой микроорганизмы не растут), образующейся вокруг образцов, на которые была нанесена указанная композиция.
Согласно второму методу семена, покрытые композицией, содержащей ZTC, измельчали с использованием ступки и пестика, чтобы наблюдать воздействие композиции на эндофитную микробную нагрузку в семенах. Измельченные семена инкубировали в бульонной питательной среде (NB) и бульонной питательной среде Сабуро с глюкозой (SDB), соответственно. Образцы перемешивали при температуре 25±1°С в течение одного часа при 100 об/мин, затем с помощью микропипетки помещали на чашки с питательным агаром (NA), агаром Сабуро с глюкозой (SDA) и картофельным агаром с глюкозой (PDA), соответственно, по 100 мкл в каждую, с последующей инокуляцией диффузионным мотодом Дригальского. Инокулированные образцы инкубировали в течение 24 часов в случае бактерий, 48 часов в случае дрожжей при температуре 36±1°С и 72 часов в случае грибов при температуре 25±1°С, а испытания воздействия композиции на эндофитную микробную нагрузку в семенах проводили путем наблюдения роста микроорганизмов.
Испытания всхожести покрытых и непокрытых семян
Семена, покрытые композицией, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу, и семена, которые никак не обрабатывались, использованные в качестве контрольной группы, размещали в средах NA и PDA. Всхожесть семян и влияние загрязнения среды на их прорастание наблюдали через определенные промежутки времени в чашках Петри, помещенные в камеры для проращивания семян для обеспечения подходящей для прорастания среды.
Противовирусные испытания
Испытания противовирусной активности пиритиона цинка
Для получения штамма Adenoid 75 человеческого аденовируса типа 5 и штамма Chat полиовируса типа 1 и для проведения эксперимента использовали монослой клеток Нер-2 (АТСС (Американская коллекция типовых культур) CCL-23), представляющий собой монослой опухолевых клеток человека. Для определения титра вируса инокуляцию клеток Нер-2 осуществляли путем последовательных разведений эталонного человеческого штамма Adenoid 75 аденовируса типа 5 и эталонного штамма Chat полиовируса типа 1, принимая за основу разведение вируса, которое оказывает цитопатическое действие, видимое в инвертированном фазово-контрастном микроскопе. Титр вируса вычисляли по методу Спирмена-Карбера. Эти вирусы испытывали в качестве модельных ДНК- и РНК-содержащих вирусов. Композиции, эффективные против этих вирусов, считаются эффективными и против других патогенных вирусов растений и человека. Для определения субцитотоксической концентрации пиритиона цинка, жидкий пиритион цинка подвергали 10-кратному последовательному разведению с помощью минимальной эссенциальной среды Игла (MEM), в клеточной среде выявляли нетоксичную концентрацию, и эту концентрацию использовали в эксперименте. В качестве контролей вместо вируса использовали МЕМ-инокулированные клетки Нер-2, монослой клеток Нер-2 без добавления пиритиона цинка, 10-кратно разведенный титрационный контроль эталонного вируса, формальдегидный контроль и контроли, содержащие токсичные концентрации пиритиона цинка.
Получение клеточной культуральной среды и химических веществ
Минимальная эссенциальная среда (MEM): 10% сыворотки (FBS (сыворотка плода коровы)), содержащей ферменты, гормоны и факторы роста для адсорбирования и пролиферации клеток на поверхности, в которую было добавлено 40 МЕ/мл пенициллина, 0,04 мг/мл стрептомицина, 0,5 мг/мл глутамина для предотвращения грибкового и бактериального заражения; и 1% раствор бикарбоната натрия в качестве буферного раствора.
FBS: инактивированная, без микоплазм.
Бикарбонат натрия: Стерильный 7,5% раствор.
Питательная среда, использованная при инокуляции вируса: Среда включала 1% антибиотиков (пенициллин, стрептомицин, амфотерицин В) для предотвращения грибкового и бактериального заражения, и 1% раствор бикарбоната натрия в качестве буферного раствора. FBS к этой питательной среде не добавляли.
Получение чистых и загрязненных сред
Чистая среда; 0,3 г бычьего сывороточного альбумина фракции V растворяют в 100 мл стерильной воды. Полученный раствор стерилизуют путем пропускания через фильтр с размером ячейки 0,22 мкм.
Загрязненная среда; для получения загрязненной среды используют овечьи эритроциты и BSA (бычий сывороточный альбумин). 3 г BSA растворяют в 100 мл стерильной воды и фильтруют. 3 мл овечьих эритроцитов добавляют к 97 мл BSA.
Эритроциты; 8 мл свежей овечьей крови центрифугировали при 800×g в течение 10 минут, после чего удаляли супернатант. После добавления 8 мл забуференного фосфатом физиологического раствора (PBS) осуществляли пипетирование с повторным центрифугированием при 800×g в течение 10 минут. Эту процедуру повторяли три раза.
Анализ
Сначала жидкий пиритион цинка последовательно разводили в клеточной культуральной среде (MEM), и определяли его нетоксичную концентрацию в клеточной культуре. 8 мл пиритиона цинка, подлежащего испытанию, смешивали с 2 мл жесткой воды. Полученный раствор последовательно разводили (шаг разведения 1:10) клеточной культуральной средой. После инкубирования в клеточном монослое на 96-луночном планшете, регистрировали произошедшие микроскопические изменения. Определили концентрации, вызвавшие цитопатический эффект (СРЕ). Сравнили СРЕ пиритиона цинка и формальдегида. После определения нетоксичной концентрации пиритиона цинка в клетках на чистых и загрязненных средах изучали влияние пиритиона цинка на титр вируса в результате применения в течение промежутков времени продолжительностью 1-60 минут. В качестве контролей вместо вируса использовали МЕМ-инокулированные клетки Нер-2, монослой клеток Нер-2 без добавления пиритиона цинка, 10-кратно разведенный титрационный контроль эталонного вируса, формальдегидный контроль и контроли, содержащие токсичные концентрации пиритиона цинка. Принимая за основу разведения вируса, оказывающие цитопатический эффект, видимый в инвертированном фазово-контрастном микроскопе, по методу Спирмена-Карбера вычисляли титр вируса в виде TCID50. Согласно стандарту TS EN 14476 (март 2007 г.), дезинфицирующие средства, для проявления своей противовирусной активности, должны снижать титр вируса на 4 или более логарифмических единиц.
Экспериментальные результаты
Композицию, содержащую пиритион цинка, триклозан и карбоксиметилцеллюлозу, наносили на семена в условиях in vitro. Согласно проведенному испытанию на противомикробную активность, было отмечено, что нанесение покрытий на семена композицией, содержащей пиритион цинка, триклозан и карбоксиметилцеллюлозу, привело к предотвращению роста всех исследованных микроорганизмов (бактерии, дрожжи и грибы) (Таблица 1).
а. Знак + указывает на то, что нанесенная композиция обладает противомикробной активностью.
Противомикробную активность на подготовленных семенах испытывали с использованием изолятов бактерий (Pseudomonas syringae, Clavibacter spp., Burkholderia spp., Curtobacterium spp., Bacillus spp., Pseudomonasaeruginosa, Erwinia spp., Xanthomonasaxonopodis, Xanthomonascampestris и Agrobacterium spp); дрожжей (Candida spp.); и грибов (Aspergillus spp., Botrytis cinerea, Fusarium spp., Penicillium spp., Rhizopus spp., Alternaria spp., Rhizoctonia spp.и Sclerotinia spp.). Согласно полученным результатам было отмечено, что противомикробная покровная композиция для семян, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу, проявляла противомикробную активность в отношении всех исследованных микроорганизмов (Таблица 2, Таблица 3, Таблица 4). Кроме того, композиция по настоящему изобретению обладает противовирусной активностью в отношении всех видов ДНК- и РНК-содержащих вирусов, вызывающих заболевания у растений.
a. ZTC: нанесенная на семена композиция, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу.
b. N.K.: Нанесенная на семена дистиллированная вода.
c. Знак + указывает на то, что нанесенная композиция обладает противомикробной активностью.
d. Знак - указывает на то, что нанесенная композиция не обладает противомикробной активностью.
a. ZTC: нанесенная на семена композиция, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу.
b. N.K.: Нанесенная на семена дистиллированная вода.
c. Знак + указывает на то, что нанесенная композиция обладает противомикробной активностью.
d. Знак - указывает на то, что нанесенная композиция не обладает противомикробной активностью.
a. ZTC: нанесенная на семена композиция, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу.
b. N.K.: Нанесенная на семена дистиллированная вода.
c. Знак + указывает на то, что нанесенная композиция обладает противомикробной активностью.
d. Знак - указывает на то, что нанесенная композиция не обладает противомикробной активностью.
В результате экспериментальных исследований было установлено, что противомикробный покровный продукт для семян, содержащий пиритион цинка, триклозан и карбоксиметилцеллюлозу, обладает противомикробной активностью в отношении микроорганизмов (Фиг. 1, Фиг. 2, Фиг. 3). При том что на семенах, обработанных противомикробным покровным продуктом для семян, содержащим пиритион цинка, триклозан и карбоксиметилцеллюлозу, микробного заражения не наблюдалось, было установлено, что необработанные семена были подвержены микробному заражению (Фиг. 4).
Наряду с тем, что в питательных средах, в которые были помещены семена, обработанные противомикробным покровным продуктом для семян, содержащим пиритион цинка, триклозан и карбоксиметилцеллюлозу, заражения не наблюдалось (Фиг. 5, Фиг. 7, Фиг. 9), было установлено, что всхожесть этих семян была выше, чем у негативных контролей (Фиг. 6, Фиг. 8, Фиг. 10).
Поскольку исследованные 10%, 1% и 0,1% суспензии пиритиона цинка продемонстрировали цитопатический эффект в культуре клеток, был использован раствор с самой низкой концентрацией пиритиона цинка, т.е. 0,01%, который не демонстрирует цитопатический эффект.
В расчетах, выполненных по результатам испытаний, установлено, что пиритион цинка при всех экспериментальных условиях вызывал снижение титра вируса на по меньшей мере 4 логарифмические единицы (Таблица 5 и Таблица 6) как результат применения в соотношении 1/1, при комнатной температуре (20°С), в чистых и загрязненных средах и с продолжительностью применения в пределах от 1 мин до 60 мин.
Согласно стандарту противомикробного подразделения Агентства по охране окружающей среды США (Antimicrobial Division US ЕРА), дезинфицирующие средства, для проявления своей противовирусной активности, должны снижать титр вируса на 4 или более логарифмических единиц.
* Log10 TCID50 значение вируса в мл.
** Log10 TCID50 значение вируса при обработке дезинфицирующим средством с различной продолжительностью по времени и в разных средах.
*** Соотношение log10 TCID50 вируса до и при обработке дезинфицирующим средством.
* Log10 TCID50 значение вируса в мл.
** Log10 TCID50 значение вируса при обработке дезинфицирующим средством с различной продолжительностью по времени и в разных средах.
*** Соотношение Log10 TCID50 вируса до и при обработке дезинфицирующим средством.
В заключение, результаты этих экспериментов показывают, что пиритион цинка обладает 99,9% активностью против человеческого аденовируса типа 5 и 99,9% активностью против полиовируса типа 1 при непосредственном использовании без разбавления при комнатной температуре (20°С) при применении с продолжительностью по времени от 1 мин до 60 мин.
В соответствии со стандартами TS EN 14476 (март 2007 г.) Института стандартов Турции (TSE), принято считать, что продукт, вирулицидная активность которого против человеческого аденовируса типа 5, представляющего собой модельный образец ДНК-содержащего вируса, исследована, проявляет такую же вирулицидную активность и против других оболочечных или безоболочечных ДНК-содержащих вирусов, которые не могут быть практически испытаны в лабораторных условиях, как например, HBV (вирус гепатита В), при условии, что этот продукт используется по меньшей мере в упомянутой выше концентрации и в течение упомянутых периодов времени, а также против других патогенных вирусов растений, при условии использования в соответствии с любым из способов промывания, обтирания, пропитывания (смачивание/погружение). Также принято считать, что продукт, вирулицидная активность которого против полиовируса типа 1, представляющего собой модельный образец РНК-содержащего вируса, исследована, проявляет такую же вирулицидную активность и против других оболочечных или безоболочечных РНК-содержащих вирусов, которые не могут быть практически испытаны в лабораторных условиях, как например, HCV (вирус гепатита С) и HIV (вирус иммунодефицита человека), при условии, что этот продукт используется по меньшей мере в упомянутой выше концентрации и в течение упомянутых периодов времени.
Настоящее изобретение не ограничивается семенами, указанными выше, и может быть применено к семенам всех однолетних и многолетних растений.
Покровная композиция для семян по настоящему изобретению также устраняет заражение, возникающее во время выполнения агрономических приемов, таких как черенкование (прививка), обрезка (пасынкование) и рыхление, используемых в растениеводстве, и может использоваться для стерилизации сельскохозяйственного инвентаря.
Эта композиция может также использоваться в качестве защитного средства или добавки к покровным продуктам для предотвращения биологической деградации и порчи, возникающих в результате бактериального или грибкового заражения деревянных поверхностей.
Содержимому композиции по настоящему изобретению может быть придана форма изделий из различных материалов.
Ссылки
1. Bastas, K., N. Boyraz, and S. Maden, Turkiye'de ekimi yapilan bazi sekerpancari tohumlarindaki fungal floranini belirlenmesi (Determination of fungal flora of some sugar beet seeds sown in Turkey). Selcuk Univ Zir Fak Derg, 2004.18: p. 87-89.
2. Agarwal, V.K. and J.B. Sinclair, Principles of seed pathology. 1996: CRC Press.
3. Nome, S.F., D. Barreto, and D.M. Docampo. Seedborne pathogens, in Proceedings International Seed Seminar: Trade, Production and Technology. 2002.
4. Biddle, A., Seed treatment: challenges & opportunities (Wishaw, 26-27 February 2001). Monograph- British Crop Protection Council.
5. Trewavas, A., Urban myths of organic farming. Nature, 2001. 410(6827): p. 409-410.
6. Kasselaki, A.M., et al., Effect of alternative treatments on seed-borne Didymella lycopersici in tomato. Journal of applied microbiology, 2008. 105(1): p. 36-41.
7. Berg, G., Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture. Applied Microbiology and Biotechnology, 2009. 84(1): p. 11-18.
8. Nega, E., et al., Hot water treatment of vegetable seed-an alternative seed treatment method to control seed borne pathogens in organic farming. Journal of Plant Diseases and Protection, 2003. 110(3): p. 220-234.
9. Walcott, R.R., Detection of seedborne pathogens. HortTechnology, 2003. 13(1): p. 40-47.
10. McGee, D., Seed pathology: its place in modern seed production. Plant Diseases, 1981.
11. Neergaard, P., Seed Pathology. 2 volumes. Seed Pathology. 2 volumes., 1977.
12. Agrios, G.N., Plant pathology. 1988: Acad, press San Diego etc.
13. Fauquet, С.М., et al., Virus taxonomy: VIIIth report of the International Committee on Taxonomy of Viruses. 2005: Academic Press.
14. Strange, R.N. and P.R. Scott, Plant disease: a threat to global food security. Phytopathology, 2005. 43.
15. Matthews, R., Fundamentals of plant virology. 1992: Academic Press.
16. Bos, L., Crop losses caused by viruses. Crop Protection, 1982. 1(3): p. 263-282.
17. Walkey, D.G.A., Applied plant virology. 1991: Chapman and Hall.
18. Hull, R. and J.W. Davies, Approaches to nonconventional control of plant virus diseases. Critical Reviews in Plant Sciences, 1992. 11(1): p. 17-33.
19. Griep, R.A., et al., Application of phage display in selecting Tomato spotted wilt virus-specific single-chain antibodies (scFvs) for sensitive diagnosis in ELISA. Phytopathology, 2000. 90(2): p. 183-190.
20. Sauer, D. and R. Burroughs, Disinfection of seed surfaces with sodium hypochlorite. Phytopathology, 1986. 76(7): p. 745-749.
21. Halloin, J., Postharvest infection of cottonseed by Rhizopus arrhizus, Aspergillus niger, and Aspergillus flavus. Phytopathology, 1975. 65(11).
22. Harman, G. and F. Pfleger, Pathogenicity and infection sites of Aspergillus species in stored seeds. Phytopathology, 1974. 64(10).
23. Wilson, J.K., Calcium hypochlorite as a seed sterilizer. American Journal of Botany, 1915. 2(8): p. 420-427.
24. Becco, C., Seed treatment method and composition. 2012, Google Patents.
25. Israels, R., et al., Seed Treatment Compositions and Methods. 2011, US Patent 201101105333.
26. Walcott, R., M. Doyle, and T. Zhao, Antimicrobial treatment for seeds and sprouts. 2011, Google Patents.
1. Покровная композиция, содержащая пиритион цинка, триклозан и карбоксиметилцеллюлозу, которая проявляет противовирусную, противогрибковую, противобактериальную, антикандидозную активность в семенах растений.
2. Покровная композиция по п. 1, содержащая 0,5-2 мас.% пиритиона цинка в готовой смеси.
3. Покровная композиция по п. 2, содержащая 0,01-0,1 мас.% триклозана в готовой смеси.
4. Покровная композиция по п. 3, проявляющая активность против бактерий Pseudomonas syringae, Clavibacter spp., Burkholderia spp., Curtobacterium spp., Acinetobacterbaumannii, Bacillus spp., Pseudomonasaeruginosa, Erwinia spp., Xanthomonasaxonopodis, Xanthomonascampestris и Agrobacterium spp.
5. Покровная композиция по п. 3, проявляющая активность против дрожжей Candida spp.
6. Покровная композиция по п. 3, проявляющая активность против грибов Aspergillus spp., Botrytis spp., Fusarium spp., Penicillium spp., Rhizopus spp., Alternaria spp., Rhizoctonia spp. и Sclerotinia spp.
7. Покровная композиция по п. 3, проявляющая активность против ДНК- и РНК-содержащих вирусов, вызывающих заболевания у растений.
8. Покровная композиция по п. 3, которая может быть применена к семенам однолетних и многолетних растений.