Улучшенный способ получения инкапсулированного в липосомы винкристина для терапевтического применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описаны улучшенные способы эффективного восстановления винкристина, инкапсулированного в липосомы, для внутривенных инъекций (VSLI), характеризующиеся сниженной вероятностью ошибок при их проведении и сниженной вероятностью загрязнения. 2 н. и 13 з.п. ф-лы, 1 ил., 13 табл., 3 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/728378, озаглавленной «Улучшенный способ получения инкапсулированного в липосомы винкристина для терапевтического применения», поданной 20 ноября 2012 г., которая включена в настоящую заявку во всей полноте посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Липосомы представляют собой широко известные наночастицы, способные повышать эффективность терапевтически активных лекарственных средств путем улучшения распределения в плазме и фармакокинетики лекарственных средств по сравнению с неинкапсулированными формами (например, Weinstein, Liposomes: From Biophysics to Therapeutics, (Ostro, M. J., ed.), Marcel Dekker, Inc., N.Y., pp. 277-338 (1987). Например, липосомы с винкристина сульфатом для инъекций (VSLI) представляют собой состав в виде липосом, содержащий противораковое терапевтическое средство винкристина сульфат, инкапсулированный в липосомы из сфингомиелина и холестерина, которые обеспечивают более высокую эффективность по сравнению со стандартным винкристина сульфатом для инъекций USP (VSI). Клинические испытания также показали, что VSLI способствует интенсификации дозы путем значительного увеличения периода полувыведения винкристина из кровотока по сравнению с неинкапсулированным винкристином. Липосомы обеспечивают механизм замедленного высвобождения лекарственного средства, и размер липосом позволяет лекарственному средству накапливаться в раковых тканях в результате экстравазации (Webb et al, Cancer Chemother. Pharmacol 42:461-470, 1998; Shan et al. Cancer Chemother. Pharmacol 58:245-255, 2006). Указанные свойства обуславливают улучшенную клиническую эффективность по сравнению со стандартным VSI.
Инкапсулирование винкристина сульфата в липосомы из сфингомиелина и холестерина обычно проводят с применением кислого внутрилипосомного рН (например, рН 4) и внешней среды с нейтральным рН (например, рН 7). Указанный градиент рН обеспечивает возможность диффундирования слабоосновного винкристина во внутреннюю полость липосомы с высокой эффективностью (Cullis et al. Trends in Biotech 9:268-272, 1991; Boman et al. Bioch Biophys Acta, 1152:253-258, 1993). Для накопления винкристина во внутренней полости липосомы с трансмембранным градиентом pH мембрана липосомы должна становиться временно проницаемой для стерически объемного винкристина. Таким образом, в отличие от нейтральных или анионных лекарственных средств, которые, как правило, могут быть пассивно инкапсулированы в липосомы, для обеспечения действия трансмембранного градиента рН в случае винкристина требуется увеличение температуры липосомы из сфингомиелина и холестерина. Для бислоя липосомы, который образован ориентацией связанных друг с другом молекул сфингомиелина и холестерина, требуется применение уникальной схемы нестационарного нагрева для получения термотропных переходных состояний. Указанные переходные состояния существенно снижают слабые межмолекулярные связи между липидами мембраны с образованием зазоров между связанными друг с другом липидами, что делает бислой липосомы временно проницаемым. В процессе инкапсулирования используют способность спонтанной самоорганизации липидов сфингомиелина и холестерина, наблюдаемой при охлаждении до температуры окружающей среды, в результате которого происходит восстановление целостности мембраны.
Указанный профиль нагрева для инкапсулирования лекарственного средства должен учитывать химическую нестабильность винкристина при тепловом воздействии (Vendrig et al, Internatl. J. of Pharmaceutics 50:189-196, 1989; Sethi et al, Cancer Res. 45:5386-5389, 1985). Винкристин является термически лабильным и при повышенных температурах легко разлагается до N-десформилвинкристина. Указанный гидролиз до формамидного производного винкристина является хорошо известным процессом разложения и влияет на стабильность срока годности винкристина сульфата для инъекций (VLSI). Например, растворы VLSI нельзя стерилизовать нагреванием из-за указанной термолабильности и следует хранить и транспортировать при температуре охлаждения для обеспечения длительной стабильности.
Соответственно, в настоящее время липосомы с винкристина сульфатом для инъекций (VSLI) получают из отдельных компонентов в аптечном учреждении в соответствии с инструкциями, приведенными на этикетке, утвержденной FDA (www.accessdata.fda.gov; Reference ID: 3172211, 2012). Указанные инструкции включают нагревание, требующее использования водяной бани для достижения эффективного инкапсулирования винкристина в липосомы из сфингомиелина и холестерина и поддержания химической чистоты винкристина. Превосходные теплопередающие свойства воды позволяют достичь больше чем 95% инкапсулирования винкристина при отсутствии заметного химического разложения лекарственного средства.
Поскольку VSLI представляет собой лекарственное средство для инъекций, производство компонентов и аптечное получение строго регламентированы для поддержания стерильности. Соответственно, использование водяной бани открытого типа в процессе получения VSLI требует дополнительных средств, планирования и оборудования (например, плавающего кольца), включая асептический вытяжной шкаф или «чистую» комнату для поддержания асептической среды. В некоторых аптечных учреждениях невозможно осуществить восстановление VSLI по причине ограничений, связанных с поддержанием стерильной среды.
Соответственно, существует потребность в улучшенных способах получения VSLI, которые могут быть осуществлены эффективным и воспроизводимым образом без использования дополнительных средств и оборудования, необходимых в настоящее время.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по меньшей мере частично, основано на разработке способа получения VSLI, который позволяет исключить необходимость использования нагретой водяной бани в процессе инкапсулирования. Таким образом, в настоящем изобретении предложены эффективные, воспроизводимые способы получения VSLI, которые с неожиданной легкостью могут быть широко применены со сниженным риском загрязнения.
В одном из аспектов настоящее изобретение относится к способу получения фармацевтически приемлемой жидкой композиции, содержащей винкристин, инкапсулированный в липосомы, которая, по существу, не содержит продуктов разложения, включающему стадии (а) восстановления в одном флаконе (i) первого раствора, содержащего винкристина сульфат в концентрации от примерно 1 мг/мл до примерно 5 мг/мл, где первый раствор имеет рН от примерно 3,5 до примерно 5,5; и (ii) второго раствора, содержащего липосомы из сфингомиелина и холестерина, с низким рН; (b) повышения рН восстанавливаемого раствора, содержащегося в указанном одном флаконе, до рН от примерно 7,0 до 7,5; (с) нагревания указанного одного флакона, содержащего восстанавливаемый раствор, в термостате сухого нагрева, уравновешенного при примерно 75°С, в течение по меньшей мере от примерно 13 до примерно 18 минут, где указанный термостат сухого нагрева содержит одну или более лунок, примерно на 1-5% превышающих среднюю длину или диаметр флакона, с получением раствора, содержащего восстановленный винкристин, инкапсулированный в липосомы; (а) уравновешивания восстановленного раствора до комнатной температуры; (е) разбавления объема восстановленного раствора, содержащего дозу винкристина, инкапсулированного в липосомы, для пациента в количестве от примерно 1,5 до примерно 2,4 мг/м2, с применением фармацевтического разбавителя, подходящего для внутривенного введения, с получением фармацевтически приемлемой жидкой композиции; и (f) введения фармацевтически приемлемой жидкой композиции пациенту, где восстановленный раствор, содержащий винкристин, инкапсулированный в липосомы, содержит (i) меньше чем примерно 2,5% свободного винкристина; и (ii) меньше чем примерно 1,5% N-десформилвинкристина.
В некоторых вариантах реализации первый раствор, содержащий винкристина сульфат, имеет рН от примерно 4,5 до примерно 4,7. В одном из вариантов реализации первый раствор дополнительно содержит маннит в концентрации примерно 100-200 мг/мл.
В некоторых вариантах реализации рН второго раствора, содержащего липосомы, составляет примерно 4,0. В одном из вариантов реализации второй раствор дополнительно содержит цитратный буфер.
В некоторых вариантах реализации рН восстанавливаемого раствора повышают путем добавления третьего раствора, содержащего буфер, с рН примерно 9,0. В одном из вариантов реализации третий раствор содержит натрий-фосфатный буфер.
В некоторых вариантах реализации восстанавливаемый раствор имеет отношение концентраций винкристина сульфата к липиду от примерно 0,1/1,0 до примерно 0,2/2,0.
В некоторых вариантах реализации концентрация винкристина сульфата в восстановленном растворе составляет от примерно 0,1 мг/мл до примерно 0,5 мг/мл. В некоторых вариантах реализации концентрация винкристина сульфата в восстановленном растворе составляет от примерно 0,15 мг/мл до примерно 0,2 мг/мл. В одном из вариантов реализации концентрация винкристина сульфата в восстановленном растворе составляет примерно 0,16 мг/мл.
В одном из вариантов реализации первый раствор содержит винкристина сульфат USP (5 мг/5 мл), что эквивалентно 4,5 мг/5 мл винкристина в форме свободного основания, и 500 мг/5 мл маннита, второй раствор содержит липосомы из сфингомиелина и холестерина, состоящие из 73,5 мг/мл сфингомиелина, 29,5 мг/мл холестерина, 33,6 мг/мл лимонной кислоты, 35,4 мг/мл цитрата натрия, а третий раствор содержит 355 мг/25 мл двухосновного фосфата натрия и 225 мг/25 мл хлорида натрия.
В некоторых вариантах реализации отношение сфингомиелина к холестерину в липосоме составляет от примерно 75/25 мол.%/мол.% сфингомиелин/холестерин до 30/50 мол.%/мол.% сфингомиелин/холестерин. В некоторых вариантах реализации липосомы содержат от примерно 70/30 мол.%/мол.% сфингомиелин/холестерин до 40/45 мол.%/мол.% сфингомиелин/холестерин. В одном из вариантов реализации липосомы содержат примерно 55/45 мол.%/мол.% сфингомиелин/холестерин. В другом варианте реализации липосомы содержат примерно 60/40 мол.%/мол.% сфингомиелин/холестерин.
В некоторых вариантах реализации липосомы имеют размер в диапазоне примерно 0,05-0,5 микрон. В некоторых вариантах реализации липосомы имеют средний диаметр примерно 50-200 нм. В одном из вариантов реализации липосомы имеют средний диаметр примерно 90-125 нм.
В некоторых вариантах реализации восстанавливаемый раствор имеет объем примерно 20-50 мл. В некоторых вариантах реализации восстанавливаемый раствор имеет объем 30-35 мл.
В некоторых вариантах реализации термостат сухого нагрева уравновешивают при 75±2°С в течение примерно 15 минут перед установкой флакона, содержащего восстанавливаемый раствор. В некоторых вариантах реализации восстанавливаемый раствор нагревают в течение примерно 13-15 минут в калиброванной лунке термостата сухого нагрева, уравновешенного при 75±2°С. В одном из вариантов реализации восстанавливаемый раствор нагревают в течение 14 минут ±30 секунд в калиброванной лунке термостата сухого нагрева, уравновешенного при 75±2°С.
В некоторых вариантах реализации лунки в термостате меньше чем примерно на 3% превышают среднюю длину или диаметр указанного одного флакона, содержащего восстанавливаемый раствор. В некоторых вариантах реализации флакон, содержащий восстанавливаемый раствор, имеет диаметр от примерно 35,8 до примерно 37,3 мм, и калиброванные лунки в термостате являются цилиндрическими и имеют диаметр от 37,2 до 37,8 мм.
В некоторых вариантах реализации восстановленный раствор уравновешивают до комнатной температуры в течение по меньшей мере примерно 30 минут.
В некоторых вариантах реализации объем восстановленного раствора, содержащий дозу винкристина, инкапсулированного в липосомы, для пациента в количестве от примерно 1,5 до примерно 2,4 мг/м2, разбавляют с применением стандартных фармацевтических разбавителей, подходящих для внутривенного введения, с получением фармацевтически приемлемой жидкой композиции. В некоторых вариантах реализации объем дозы, рассчитанной для пациента, удаляют из емкости для инфузии и заменяют рассчитанным объемом восстановленного раствора VSLI.
В некоторых вариантах реализации фармацевтически приемлемую жидкую композицию, содержащую винкристин, инкапсулированный в липосомы, вводят пациенту в течение не более 24 часов после восстановления.
VSLI, полученный в соответствии со способами согласно настоящему изобретению, обычно вводят пациенту с раковым заболеванием. В некоторых вариантах реализации раковое заболевание представляет собой лимфому, лейкоз, миелому, рак головного мозга или нейробластому.
В некоторых вариантах реализации фармацевтически приемлемую жидкую композицию, содержащую винкристин, инкапсулированный в липосомы, вводят при помощи внутривенной инфузии в течение периода примерно от 30 до 60 минут. В некоторых вариантах реализации фармацевтически приемлемую жидкую композицию, содержащую винкристин, инкапсулированный в липосомы, вводят при помощи внутривенной инфузии один раз в 7-28 дней. В одном из вариантов реализации фармацевтически приемлемую жидкую композицию, содержащую винкристин, инкапсулированный в липосомы, вводят при помощи внутривенной инфузии один раз в 7 дней.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
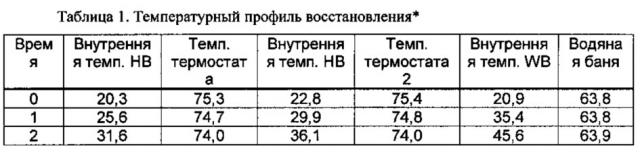
Фигура 1 представляет собой график профиля внутреннего нагрева восстановленного раствора, содержащего винкристина сульфат и липосомы из сфингомиелина и холестерина, с применением термостата сухого нагрева и водяной бани.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение устраняет недостатки, связанные с использованием водяной бани в применяемых в настоящее время способах получения VLSI. Неожиданно было установлено, что использование термостата со специально разработанной вставкой, соответствующей емкости, используемой для восстановления VSLI, обеспечивает профиль нагрева, необходимый для достижения равномерного инкапсулирования винкристина при отсутствии значительного разложения.
Кроме того, важной характеристикой является улучшенная способность способов получения VSLI, описанных в настоящей заявке, демонстрировать параметрический выпуск. Поскольку для поддержания стабильности VSLI его нужно получать «точно к нужному моменту», способ восстановления фармацевтом должен быть высокоэффективным и воспроизводимым. Фармацевту следует знать (т.е. параметрически), что инкапсулирование проводят при помощи способа, обеспечиваемого нагреванием, поскольку он обеспечивает «систему высвобождения, которая гарантирует, что продукт имеет предполагаемое качество на основании информации, собранной при реализации способа восстановления, и в соответствии с конкретными требованиями GMP, относящимися к параметрическому выпуску» (приложение 17 к рекомендациям ЕС).
Процедура с применением термостата согласно настоящему изобретению обеспечивает удобный и соответствующий требованиям способ восстановления VSLI с эффективностью инкапсулирования более 95%. Поскольку он включает всего несколько стадий, снижается вероятность ошибок при его проведении. Способ в целом является более простым, занимает меньше времени, требует меньшего количества средств и является удобным для обычных рабочих условий аптечного учреждения. Кроме того, при отдельном получении VSLI устраняется возможность загрязнения микробами, растущими в водяной бане или в водяном паре, образующимся на водяной бане с подогревом.
Определения
Если конкретно не указано иное, все технические и научные термины, применяемые в настоящей заявке, имеют стандартные определения, обычно понятные специалисту в области терапевтических и фармацевтических наук.
Если из контекста явно не следует иное, формы единственного числа включают формы множественного числа.
Термины «содержит» и «содержащий» являются не исключающими и открытыми, т.е. допускают включение дополнительных элементов.
Термин «примерно», в частности в отношении заданной величины или численного значения, охватывает отклонения в плюс или минус пять процентов.
Термин «стерильная» композиция или емкость, применяемый в настоящей заявке, означает отсутствие жизнеспособных микробов, определяемое с применением USP теста на стерильность (см. «The United States Pharmacopeial Convention», 2008).
Термины «липосома», «везикула» и «липосомальная везикула» означают структуры, имеющие мембраны, содержащие липиды, окружающие водную внутреннюю полость. Если не указано иное, структуры могут иметь одну или более липидных мембран, хотя обычно липосомы имеют только одну мембрану. Такие однослойные липосомы в настоящей заявке называют «моноламеллярными». Многослойные липосомы в настоящей заявке называют «мультиламеллярными».
Термин «стандартный» терапевтический агент или «свободный» терапевтический агент относится к терапевтическому агенту, не инкапсулированному в липосомы. Если не указано иное, обычно полагают, что лекарственное средство является «стандартным» или «свободным». Стандартный алкалоид барвинка в свободной форме может находиться в комбинации с другими реагентами, такими как другие химиотерапевтические соединения, фармацевтический носитель или комплексообразующие агенты, т.е. термин, применяемый в настоящей заявке, конкретно исключает только липидные составы, содержащие алкалоиды барвинка.
Фраза «точно к нужному моменту» относится к объединению отдельных компонентов лекарственного средства (например, VSLI) незадолго (например, в течение 24 часов или меньше) до введения пациенту для сохранения качества лекарственного средства (например, для минимизирования разложения).
Термин «системная доставка», применяемый в настоящей заявке, относится к доставке, обеспечивающей широкое биораспределение соединения в организме. Системная доставка означает, что подходящее для применения, предпочтительно терапевтическое, количество соединения воздействует на большую часть организма. Для обеспечения широкого биораспределения обычно требуется использование способа введения, при котором соединение не разлагается или не выводится слишком быстро (например, в результате пресистемного метаболизма (в печени, легких и т.п.) или за счет быстрого неспецифического связывания с клетками) до достижения очага заболевания. Системную доставку алкалоидов барвинка, инкапсулированных в липосомы, предпочтительно обеспечивают при помощи внутривенной доставки.
Фраза «терапевтически эффективное количество» относится к количеству лекарственного средства (например, VSLI), эффективного при лечении заболевания или расстройства (например, ракового заболевания) у млекопитающих, например с обеспечением стабилизации заболевания, частичной ремиссии или полной ремиссии ракового заболевания.
Термин «стабилизация заболевания», применяемый в настоящей заявке, относится к состоянию, при котором введение лекарственного средства (например, VSLI) приводит к прекращению роста или распространения опухоли или ракового заболевания, определяемому при помощи стандартных клинических, рентгенологических и/или биохимических исследований, хотя при этом не происходит регрессии или уменьшения размера опухоли или распространения ракового заболевания.
Термины «частичный ответ» или «частичная ремиссия», применяемые в настоящей заявке, относятся к облегчению ракового заболевания, определяемому при помощи стандартных клинических, рентгенологических и/или биохимических исследований, в результате лечения. Как правило, термин «частичный ответ» означает, что размер опухоли или содержание в крови маркеров ракового заболевания в результате лечения снижается относительно начального уровня (например, на 20%, 30%, 40% или 50%). Например, для лечения раковых заболеваний крови ответные реакции оценивают на основе международных экспертных критериев (международные экспертные критерии (IWS); BD Cheson et al. J Clin Oncol 15:4642-4649).
Термины «полный ответ» или «полная ремиссия» означают, что в результате лечения раковое заболевание, оцениваемое на основе, например, размера опухоли и/или содержания маркеров ракового заболевания, не диагностируется.
«Неврологическая токсичность» включает симптомы невропатии, такие как гипестезия, гиперестезия, парестезия, гипорефлексия, арефлексия, невралгия, гнатодиния, пониженная вибрационная чувствительность, невропатия черепных нервов, илеус, чувство жжения, артралгия, миалгия, мышечный спазм, слабость и/или ортостатическая гипотензия, как перед лечением, так и в процессе лечения. Может наблюдаться ортостатическая гипотензия. Неврологическую токсичность относят к 1-3 степени на основе общих терминологических критериев для нежелательных явлений (СТСАЕ) национального института онкологии (NCI) версии 4.03 (http://ctep.cancer.gov/reporting/etc.html).
Винкристина сульфат
Винкристина сульфат является представителем семейства алкалоидов барвинка, впервые полученных из барвинка (Catharanthus roseus). Винкристина сульфат обладает специфической противораковой активностью, направленной на клеточный цикл. Алкалоиды барвинка связываются с тубулином, оказывая влияние на полимеризацию тубулина, в результате чего наблюдаются задержка метафазы, ингибирование митоза клеток и гибели клеток. Терапевтический ответ на его действие в качестве специфического агента, направленного на клеточный цикл, продлевают путем инкапсулирования в липосомы, что позволяет поддерживать повышенный уровень лекарственного средства. Было показано, что пролонгированное воздействие винкристина (и других специфических лекарственных средств, направленных на клеточный цикл) на клетки повышает цитотоксичность in vitro лекарственного средства (Bfurris et al. JNCI 84; 1816-1826, 1992; Georgiadis et al, Clin Cancer Res 3:449-454, 1997; Jackson and Bender, Cancer Res 39:4346-4349, 1979).
Винкристина сульфат обычно выделяют в виде 1:1 сульфатной соли. Он представляет собой гигроскопичный белый или слегка желтоватый кристаллический порошок, растворимый в воде. Его молекулярная масса составляет 923,04 (солевая форма)/824,98 (основание), и молекулярная форма представляет собой C46H56N4O10⋅H2SO4. Химическим названием винкристина сульфата является 22-оксовинкалейкобластин, и он имеет следующую химическую структуру:
Винкристина сульфат назначают в виде винкристина сульфата для инъекций USP (например, в виде 1 мг/мл раствора), и он также известен как лейрокристина сульфат, киокристин, винкозид, винкрекс, онковин, винкасар PFS®, коммерчески доступные из многих источников.
Липосомы
Липосомальный компонент-носитель согласно настоящему изобретению содержит липосомы из сфингомиелина и холестерина для инъекций (SCLI). Отношение сфингомиелина к холестерину в липосоме может варьировать, но обычно находится в диапазоне от 75/25 мол.%/мол.% сфингомиелин/холестерин до 30/50 мол.%/мол.% сфингомиелин/холестерин. В одном из вариантов реализации липосомальная композиция содержит от примерно 70/30 мол.%/мол.% сфингомиелин/холестерин до 40/45 мол.%/мол.% сфингомиелин/холестерин. В другом варианте реализации липосомальная композиции содержат примерно 55/45 мол.%/мол.% сфингомиелин/холестерин. В другом варианте реализации липосомальные композиции содержат примерно 60/40 мол.%/мол.% сфингомиелин/холестерин.
В некоторых вариантах реализации в составах могут присутствовать дополнительные липиды, например для предотвращения окисления липидов или для приоединения лигандов к поверхности липосомы. Как правило, включение других липидов приводит к снижению отношения сфингомиелин/холестерин.
Липосомы из сфингомиелина и холестерина, применяемые в настоящем изобретении, могут являться мультиламеллярными или моноламеллярными. Подходящие способы получения липосом включают, но не ограничиваются ими, обработку ультразвуком, экструзию, гомогенизацию под высоким давлением, микрофлюидизацию, детергентный диализ, опосредованное кальцием слияние небольших липосомальных везикул, испарение тонкой пленки и инфузию простого эфира, все из которых хорошо известны в данной области техники. Например, различные способы, подходящие для получения липосом, описаны, например, в, Szoka, et al. Ann. Rev. Biophys. Bioeng., 9:467 (1980), патентах США №№4186183, 4217344, 4235871, 4261975, 4485054, 4501728, 4774085, 4837028, 4946787, 5543152, 6723338, публикации WO 91/17424, Deamer and Bangham, Biochim. Biophys. Acta, 443:629 634 (1976); Fraley, et al. Proc. Natl. Acad. Sci. USA, 76:3348 3352 (1979); Hope, et al. Biochim. Biophys. Acta, 812:55 65 (1985); Mayer, et al. Biochim. Biophys. Acta, 858: 161 168 (1986); Williams, et al. Proc. Natl. Acad. Sci., 85:242 246 (1988), материале «Liposomes», Marc J. Ostro, ред., Marcel Dekker, Inc., New York, 1983, Chapter 1, и Hope, et al. Chem. Phys. Lip., 40:89 (1986), все из которых включены в настоящую заявку посредством ссылки.
После получения липосом их размер можно доводить до требуемого диапазона размеров с применением стандартных способов, хорошо известных в данной области техники (см., например, патент США №6723338). Обычно липосомы, которые могут быть применены в препаратах VSLI, описанных в настоящей заявке, имеют диапазон размеров примерно 0,05-0,5 микрона (50-500 нм), 0,2-0,4 микрона (200-400 нм), примерно 0,1-0,4 микрона (100-400 нм), примерно 0,05-0,2 (50-200 нм) или от примерно 0,5 (500 нм) до примерно 0,15 микрона (150 нм). В некоторых вариантах реализации липосомы представляют собой частицы со средним диаметром примерно 50 нм, примерно 60 нм, примерно 70 нм, примерно 80 нм, примерно 90 нм, примерно 100 нм, примерно 105 нм, примерно 110 нм, примерно 115 нм, примерно 120 нм, примерно 130 нм, примерно 140 нм, примерно 150 нм, примерно 160 нм, 170 нм, примерно 180 нм, примерно 190 нм или примерно 200 нм. В одном из вариантов реализации средний размер частиц составляет от 90 до 125 нм с предпочтительным средним размером частиц примерно 107,5 нм, где 25% частиц имеют диаметр не меньше 70 нм, и 90% частиц имеют диаметр не больше 170 нм.
Липосомы из сфингомиелина и холестерина выступают в качестве липосомального компонента, применяемого в препаратах VSLI, описанных в настоящей заявке, и получают таким образом, чтобы внутренняя полость липосомы имела низкий рН. В процессе восстановления VSI, имеющий низкий рН, и SPLI, имеющий низкий рН, разбавляют в буфере с более высоким рН, в результате чего конечный рН внешнего раствора VSLI является примерно физиологически нейтральным. В результате образуется градиент рН через липидную мембрану, при котором рН внутреннего ядра липосомы ниже, чем рН внешнего окружающего раствора. Указанный градиент получают в соответствии с известными способами (например, патент США №6723338). Например, градиент может быть достигнут путем приготовления состава липосом в присутствии буфера с рН от примерно 2 до примерно 6, рН от примерно 3 до примерно 5, с последующим переносом липосом в среду с более высоким рН, например от примерно 7,0 до примерно 7,5. В одном из вариантов реализации липосомы имеют внутренний рН примерно 4,0. Можно использовать любые буферы для разбавления, например фосфат натрия. В одном из вариантов реализации буфер имеет рН 8-10, предпочтительно 9,0, в результате чего конечный разбавленный внешний липосомальный раствор после смешивания с VSI и SPLI имеет физиологически нейтральный рН.
Перед использованием для получения VSLI в соответствии со способами, описанными в настоящей заявке, SPLI липосомы можно хранить при температуре охлаждения в течение длительного времени перед инкапсулированием лекарственного средства и восстановлением VSLI для введения пациенту. Альтернативно, липосомы можно дегидрировать, хранить, а затем восстанавливать перед применением в соответствии с хорошо известными способами (см., например, патенты США №№5077056 или 5736155).
Получение VSLI
VSLI получают при помощи строгих асептических способов, например в боксе биологической безопасности или с применением установленных фармацевтических правил обеспечения безопасности при получении стерильных инъецируемых составов и опасных лекарственных средств. Следует строго соблюдать способы обработки и утилизации противораковых лекарственных средств (NIOSH Alert: Preventing occupational exposure to antineoplastic and other hazardous drugs in healthcare settings. 2004. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2004-16; OSHA Technical Manual, TED 1-0.15A, Section VI: Chapter 2. Controlling Occupational Exposure to Hazardous Drugs. OSHA, 1999; American Society of Health-System Pharmacists. ASHP guidelines on handling hazardous drugs. Am J Health-Syst Pharm. (2006) 63:1172-1193; Polovich M, White JM, Kelleher LO (eds.) 2005. Chemotherapy and biotherapy guidelines and recommendations for practice (2nd. ed.) Pittsburgh, PA: Oncology Nursing Society).
Способ получения восстановленного VSLI включает следующие общие стадии:
- Восстанавливаемый раствор получают путем смешивания в стерильной емкости первого раствора винкристина сульфата, содержащего примерно 1 мг/мл, примерно 2 мг/мл или примерно 5 мг/мл винкристина сульфата в буфере, содержащем от примерно 100 до примерно 200 мг/мл маннита (также можно использовать другие фармацевтически приемлемые вспомогательные вещества, в которых винкристина сульфат остается стабильным), с рН от примерно 3,5 до примерно 5,5 или от примерно 4,5 до примерно 4,7, со вторым раствором липосом, суспендированных в буфере, с низким рН (например, примерно 4,0) при соответствующем отношении концентраций, например от 0,1/1,0 до 0,2/1,0 (массы винкристина сульфата к массе липида).
- Затем рН восстанавливаемого раствора, содержащего винкристина сульфат и липосомы, повышают до значения из диапазона от примерно 7,0 до примерно 7,5 с получением градиента рН. Такое увеличение может быть достигнуто, например, путем добавления буфера (например, фосфата натрия) с более высоким рН (например, примерно 9,0).
- Затем восстанавливаемый раствор нагревают в течение по меньшей мере от примерно 13 до примерно 18 минут в термостате сухого нагрева, уравновешенном при примерно 75°С, содержащем калиброванные лунки, размер которых не более чем примерно на 5% превышает среднюю длину или диаметр емкости, содержащей восстанавливаемый раствор, с получением восстановленного продукта VSLI.
- Затем нагретый восстанавливаемый раствор, содержащий восстановленный продукт, оставляют для уравновешивания в течение по меньшей мере примерно 30 минут, по меньшей мере примерно 45 минут или по меньшей мере примерно 60 минут до комнатной температуры (от 15°С до 30°С).
- Затем объем восстанавливаемого раствора, соответствующий дозе восстановленного VSLI, предназначенного для введения пациенту, смешивают с раствором, подходящим для внутривенного введения в конечном объеме примерно 100 мл.
В некоторых вариантах реализации растворы винкристина сульфата, липосом и буфера с высоким рН обеспечивают в трех отдельных емкостях. В некоторых вариантах реализации указанные три раствора смешивают в одной стерильной емкости объемом, достаточным для вмещения общего объема растворов, например примерно 20-50 мл, примерно 25-40 мл или примерно 30-35 мл.
В одном из вариантов реализации отдельные компоненты представлены в виде набора, включающего 3 или более флаконов. По меньшей мере один из флаконов содержит раствор винкристина, содержащего, например, 1 мг/мл, 2 мг/мл или 5 мг/мл винкристина сульфата в буфере, содержащем, например, 100 или 200 мг/мл маннита (также можно использовать другие вспомогательные вещества, которые являются фармацевтически приемлемыми и в которых винкристин остается стабильным в течение длительного времени), с рН, доведенным до 3,5-5,5 или предпочтительно 4,5-4,7. Один из флаконов содержит раствор, содержащий липосомы из сфингомиелина и холестерина, суспендированные в 300 мМ нитратном буфере, например, при рН 4,0. Другой флакон или флаконы содержат щелочно-фосфатный буфер (например, с рН 9,0), такой как двухосновный фосфат натрия, 14,2 мг/мл (20 мл/флакон).
В одном из вариантов реализации ингредиенты для восстановления VSLI представлены отдельно в трех флаконах, содержащих (i) винкристина сульфат USP (5 мг/5 мл), что эквивалентно 4,5 мг/5 мл винкристина в форме свободного основания, и 500 мг/5 мл маннита; (ii) липосомы из сфингомиелина и холестерина для инъекций (SPLI), состоящие из 73,5 мг/мл сфингомиелина, 29,5 мг/мл холестерина, 33,6 мг/мл лимонной кислоты, 35,4 мг/мл цитрата натрия и не больше чем 0,1% этанола; и (iii) фосфат натрия для инъекций (SPI), содержащий 355 мг/25 мл двухосновного фосфата натрия и 225 мг/25 мл хлорида натрия, все из которых получены с применением воды для инъекций.
Емкости, используемые в способах согласно настоящему изобретению, являются стерильными и состоят из любого из фармацевтически приемлемых веществ (например, стекла или пластика). Существует ряд различных типов и размеров флаконов, коммерчески реализуемых множеством различных производителей (например, Wheaton Products, Thomas Scientific). В одном из вариантов реализации компоненты готовят в стерильном флаконе со средним диаметром примерно 36,5 мм и со средним диапазоном от примерно 35,8 до примерно 37,3 мм.
Подходящие термостаты сухого нагрева, которые обеспечивают безопасный и сухой источник постоянной температуры, коммерчески доступны из множества источников (например, Bibby Scientific Ltd, V&P Scientific, Inc., Fisher Scientific Inc., VWR Scientific, Thermolyne Inc.). Теплопроводящие вставки, содержащие одну или более калиброванных лунок, разработанных под емкость с восстанавливаемым раствором, могут представлять собой металл (например, анодированный алюминий, медь) или другие подходящие теплопроводные материалы. Вставки, содержащие лунки соответствующего размера, могут быть легко приобретены (например, V&P Scientific, Inc.) или произведены с применением стандартных способов. В некоторых вариантах реализации термостат имеет отверстия, которые примерно на 1-5% или примерно на 4,5%, 4,2%, 4,0%, 3,8%, 3,5%, 3,3%, 3,0%, 2,8%, 2,5%, 2,2%, 2,0%, 1,8%, 1,5%, 1,2% или 1,0% превышают среднюю длину или диаметр емкости, содержащей восстанавливаемый раствор. В некоторых вариантах реализации термостат имеет цилиндрические отверстия. В одном из вариантов реализации отверстия имеют диаметр от 37,2 до 37,8 мм или от примерно 37,4 до 37,6 мм.
В некоторых вариантах реализации восстанавливаемый раствор нагревают в течение примерно 13 минут, примерно 14 минут, примерно 15 минут, примерно 16 минут, примерно 17 минут при примерно 75°С. В одном из вариантов реализации восстанавливаемый раствор нагревают в течение примерно 14 минут в термостате, уравновешенном при 75°С.
Восстановленный VSLI может быть смешан с фармацевтически приемлемым разбавителем, подходящим для внутривенного введения пациенту (например, декстроза, хлорид натрия), который может находиться, например, в предварительно заполненной стерильной емкости (стеклянная бутылка, пластиковая бутылка или пластиковый мешок). В некоторых вариантах реализации из мешка для инфузии выводят объем дозы, рассчитанной для пациента, и заменяют его рассчитанным объемом восстановленного раствора VSLI, например, чтобы конечный объем емкости для инфузии составлял 100 мл. В одном из вариантов реализации фармацевтически приемлемые разбавители представляют собой 5% раствор декстрозы для инъекции или 0,9% раствор хлорида натрия для инъекции.
VSLI
VSLI, полученный в соответствии со способами, описанными в настоящей заявке, представляет собой белую или беловатую полупрозрачную суспензию, по существу, не содержащую видимых посторонних веществ и агрегатов. Как правило, больше чем примерно 95%, примерно 96%, примерно 97%, примерно 98% или более винкристина сульфата инкапсулировано в липосомы.
VSLI, полученный в соответствии со способами, описанными в настоящей заявке, имеет общее содержание примесей меньше чем примерно 4,0%, 3,5%, 3,4%, 3,2%, 3,1% или 3,0%. В некоторых вариантах реализации VSLI содержит меньше чем примерно 2,0%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4% или 1,3% N-десформилвинкристина.
VSLI, полученный в соответствии со способами, описанными в настоящей заявке, имеет среднюю скорость высвобождения in vitro (IVR) или скорость высвобождения in vivo по меньшей мере примерно 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84% или примерно 85% за 72 часа.
Исследования для определения степени инкапсулирования винкристина, содержания примесей и скоростей высвобождения винкристина из липосом известны в данной области техники. См., например, патенты США №№5543152 и 5837282; Zhigalstev et al. J. Controlled Release 104:103-111, 2005; Puscalau et al. Am. J. Health-Syst. Pharm. 62:1606-1612, 2005.
Как правило, VSLI, полученный в соответствии со способами, описанными в настоящей заявке, содержит от примерно 0,1 мг/мл до примерно 0,5 мг/мл винкристина сульфата. В некоторых вариантах реализации винкристина сульфат содержится в концентрации от примерно 0,15 мг/мл до примерно 0,2 мг/мл. В одном из вариантов реализации винкристина сульфат содержится в концентрации примерно 0,16 мг/мл. В одном из вариантов реализации VSLI содержит 5 мг винкристина сульфата, 500 мг маннита, 73,5 мг сфингомиелина, 29,5 мг холестерина, 36 мг цитрата натрия, 38 мг лимонной кисло