Способ получения комплекса технеция-99м с модифицированными специфичными мини-антителами для диагностики онкологических заболеваний с гиперэкспрессией her2/neu
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа получения комплекса технеция-99м с модифицированными специфичными мини-антителами DARPin для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu, включающего связывание технеция-99м с мини-антителами DARPin, где на первом этапе проводят модификацию мини-антител DARPin сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноатом, очистку модифицированных мини-антител проводят гель-фильтрацией. На втором этапе способа проводят связывание технеция-99м с модифицированными мини-антителам DARPin, для чего к модифицированным мини-антителам DARpin последовательно добавляют раствор технеция-99м, свежеприготовленный раствор цитрата натрия, свежеприготовленный раствор олова (II) хлорида дигидрата и инкубируют при комнатной температуре. Изобретение обеспечивает получение целевого продукта с высокой радиохимической чистотой и выходом. 9 ил., 2 табл., 18 пр.
Реферат
Изобретение относится к медицине и представляет собой способ получения комплекса технеция-99м с модифицированными специфичными мини-антителами для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu.
Значительное место в диагностике занимают радиофармацевтические препараты на основе изотопа технеция-99 м, обладающие оптимальными периодом полураспада (6 часов) и типом излучения (γ-излучение, энергия 140 кэВ). При использовании препаратов для высокоточной доставки к мишени радиоизотопа Тс-99m возможно существенное снижение его концентрации, что обеспечит снижение дозовой нагрузки на пациента и медицинский персонал.
В настоящее время радиоизотоп технеция (99mTc), получаемый непосредственно в клиниках из генератора 99Мо/99mTc, является наиболее приемлемым по цене и идеальным по физико-химическим характеристикам для создания РФП с целью проведения диагностики с использованием доступных γ-камер в медицинской практике.
Одним из наиболее изученных и часто упоминаемых в литературе опухолевых антигенов является поверхностный рецептор HER2/neu. HER2/neu - ракоассоциированный антиген клеточной поверхности, который гиперэкспрессирован во многих человеческих карциномах, таких как рак молочной железы, легких, желудка, яичников, простаты. К этому антигену разработан ряд моноклональных антител, пригодных для применения в диагностических и терапевтических целях. Перспективными являются мини-антитела DARPin, являющиеся рекомбинантными гуманизированными мини-антителами, специфичными к раковоассоциированному антигену HER2/neu [1-3].
Известны некоторые методы мечения белковых молекул (в том числе моноклональных антител, мини-антител) радионуклидом технецием-99м. Наиболее эффективным считается мечение с использованием химической модификации биомолекул химическими соединениями - прекурсорами, содержащими хелатные центры для связывания металлов, которые способны образовывать достаточно прочные координационные связи.
Поэтому главным в разработке синтеза таких радиофармпрепаратов является введение в структуры пептидов прекурсоров - лиганд с высокой хелатирующей способностью для прочного связывания технеция-99м, в качестве которых успешно могут применяться ω-бис(пиридин-2-илметил)амино)алифатические кислоты.
Таким образом, разработка способа получения комплекса технеция-99м с модифицированными специфичными мини-антителами для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu является актуальной.
Известны способы радиомечения радионуклидами иодом-125 и индием-111 мини-антител DARPin (G3) для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu [2]. В данном способе получения используют DARPin (G3), коньюгированный с DOTA, для связывания с радионуклидом индия-111, мечение проводят в буферном растворе в присутствии индия-111 хлорида при инкубировании при 37°С в течение 2 часов. Радиохимическая чистота до очистки составляет 70-80%, после очистки более 95%. Мечение иодом-125 мини-антител DARPin (G3) проводят прямым способом - иодированием остатков тирозина при комнатной температуре в течение 10 мин. Радиохимическая чистота до очистки 60-70%, после очистки более 95%. Данные способы отличаются применением других радионуклидов и хелатирующего реагента (DOTA), однако не показана устойчивость к дегалогенированию в организме меченого иодом-125 DARPin (G3).
Известен способ получения комплекса [99mTc(СО)3]+ - G3DARPin-His6, который характеризуется в 3,5 раза выше уровнем поглощения в опухолевых клетках с гиперэкспрессией HER2/neu по сравнению с HER2/neu - отрицательными клетками in vivo [4]. Однако недостатком этого комплекса является то, что комплекс [99mTc(СО)3]+ - G3DARPin-His6 в организме не показал оптимальное соотношение опухоль-печень и опухоль-кровь. В данном способе получения используют прямое связывание аквакарбонильного комплекса технеция-99м ([99mTc(СО)3]+) с G3DARPin-His6 без хелатирующих реагентов, недостатком прямого мечения является низкая стабильность такого комплекса в плазме крови.
В способе получения комплекса технеция-99м со специфичными белками описан способ мечения с использованием другого реагента - олова фторида с добавлением хлористоводородной кислоты [5]. Радиохимическая чистота находится в пределах от 96 до 98%, радиохимический выход более 92%. В данном методе мечения использовали белки, не являющиеся мини-антителами, однако применение методики мечения технецием-99м белковых веществ в присутствии олова фторида характеризуется хорошими выходами, стабильными комплексами с высокой чистотой.
Также известен способ получения комплекса технеция-99м со специфичными белками (affibody molecules), в котором используют для мечения олова хлорид, кальция глюконат и эденат натрия [6]. Мечение проводят в фосфатном буфере после добавления элюата с генератора технеция-99м (400-500 МБк) при инкубировании смеси при 90°С 60 мин. В описанном способе указаны высокие выходы и чистота радиохимического продукта. Однако использованы иные белковые вещества, а не мини-антитела DARPin, а также условия мечения являются жесткими, высокая температура приводит к деструкции белковых веществ.
Наиболее близким к предлагаемому является способ получения комплекса [99mTc(СО)3]+ - DARPin, который заключается в прямом связывании 99mTc(СО)3]+ с мини-антителами DARPin [7]. В патенте предложен способ получения терапевтического радиоконъюгата, специфически связывающегося вещества с короткоживущим альфа-излучающим радиоизотопом для его доставки в патологические области. При этом осуществляют мечение рекомбинантных гуманизированных мини-антител, специфичных к раковоассоциированному антигену HER2/neu, диагностическим гамма-излучающим радиоизотопом, а именно аквокарбонильным комплексом Тс-99m, проводят конъюгирование мини-антител с человеческим сывороточным альбумином, очищают полученный конъюгат, вводят в состав конъюгата хелатирующий агент DOTA (1,4,7,10 - тетраазициклододекан тетрауксусной кислоты) или DTPA (диэтилентриамин пентауксусной кислоты), проводят мечение полученного конъюгата терапевтическими радиоизотопами, а именно короткоживущими альфа-излучающими радиоизотопами, и очищают полученный препарат. В указанном способе используют для мечения изотоп конъюгата аквокарбонильный комплекс Тс-99m, являющий труднодоступным. Также в указанном методе мечения используется прямой способ мечения мини-антител технецием-99м без использования хелатирующих агентов, что снижает устойчивость полученного комплекса мини-антител с радионуклидом в живом организме, поскольку радионуклид может переходить к белкам плазмы крови, образуя более прочные комплексы.
Новый технический результат - повышение селективности, универсальности доступности способа, повышение выходов устойчивых продуктов.
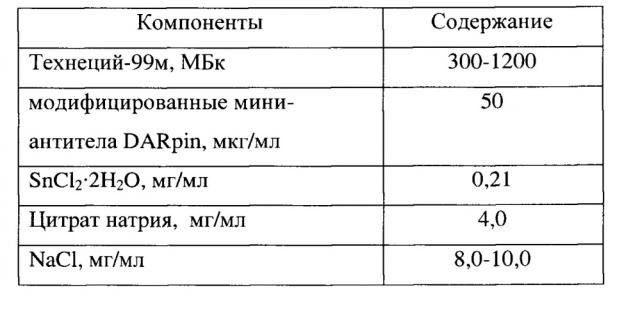
Для достижения нового технического результата в способе получения комплекса технеция-99м с модифицированными специфичными мини-антителами для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu, заключающемся в связывании технеция-99м с мини-антителами DARPin, причем на первом этапе проводят модификацию мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом в Tris-буферном растворе, в растворе ДМСО или ДФМА, при этом используют растворы мини-антител DARPin в Tris-буфере или фосфатном буфере с pH 8,3-8,5, реакацию проводят при перемешивании 4 часа при комнатной температуре, далее выдерживают 24 часа при температуре 5-10°С, модификацию проводят при соотношении мини-антител - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом - 1:5-20, далее очистку модифицированных мини-антител проводят с помощью гель-фильтрации на колонке с Superdex-75, на втором этапе проводят связывание технеция-99м с модифицированными мини-антителам DARPin, для чего к модифицированным мини-антителам DARpin в количестве 50 мкг в буферном растворе при pH 8,3-8,5 последовательно добавляют 1 мл раствора технеция-99м в количестве 300-1200 МБк и 40 мкл свежеприготовленного раствора цитрата натрия с концентрацией - 100 мг/мл (4 мг) и 30 мкл свежеприготовленного раствора олова (II) хлорида дигидрата с концентрацией 7 мг/мл (0,21 мг) и инкубируют при комнатной температуре в течение 30 мин.
Получают комплекс технеция-99м с модифицированными специфичными мини-антителами с радиохимической чистотой более 96%.
Пример 1. Получение метилового эфира ω-иодгексановой кислоты
К раствору циклогексанона в 10 мл метанола (6 ммоль, 0,588 г, ρ=0,946 г/см3) добавляют иод (3 ммоль, 0,762 г), катализатор меди (I) хлорида (0,6 ммоль, 0,06 г). Затем при перемешивании при комнатной температуре по каплям вносят раствор пероксида водорода в метаноле (12 ммоль, 1,275 г пергидроля (32%-ного Н2О2, ρ=1,125 г/см3) в 5 мл метанола) в течение 4 часов. Далее добавляют 12 ммоль (1,275 г) пергидроля и меди (I) хлорида (0,3 ммоль, 0,03 г), перемешивают при комнатной температуре 10 часов и после этого добавляют еще 6 ммоль (0,638 г) пергидроля при перемешивании еще 6 часов в тех же условиях.
К реакционной смеси добавляют насыщенный раствор натрия гидрокарбоната до прекращения выделения углекислого газа и натрия сульфит для окисления остатка иода. Далее реакционную смесь фильтруют, отбрасывая осадок, содержащий соли меди (I), хлориды и иодиды. Полученный фильтрат экстрагируют этилацетатом (2×10 мл). Этилацетатное извлечение осушают путем пропускания через натрий сульфат безводный и растворитель отгоняют. Полученную светло-желтую маслообразную массу сушат под вакуумом. Выход 1,248 г (81%). Спектр ЯМР 1Н (500 MHz, CDCl3, δ, м.д.): 3,67 (с, 3Н), 3,18 (т, 2Н), 2,32 (т, 2Н), 1,84 (кв, 2Н), 1,62 (кв, 2Н), 1,43 (кв, 2Н) (фиг. 5).
Пример 2. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 55°С в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол = 10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистке методом колоночной хроматографии на силикагеле с использованием в качестве элюента смеси гексан - этилацетат (1:1), постепенно повышая градиент последнего. Выход продукта составил 86%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J = 4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11(т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+- вычислено: 328,2020 (фиг. 6 и 7).
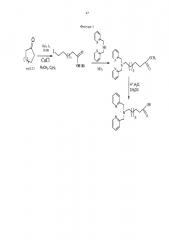
Пример 3. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты (фиг. 1)
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 50°С. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол = 10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 96%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоты (300 МГц, H2O, δ, м.д., J, Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2) (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9).
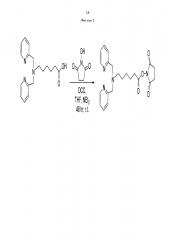
Пример 4. Методика синтеза сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноата (фиг. 2)
0,4 г (1,14 ммоль) 6-(бис(пиридин-2-илметил)амино)гексановой кислоты смешивают с 2 мл тетрагидрофурана, затем добавляют 160 мкл (1,14 ммоль) триэтиламина и перемешивают 30 минут. После добавляют 0,1575 г (1,4 ммоль) г N-гидроксисукцинимида и 0,2889 г (1,4 ммоль) N,N-дициклогексилкарбодиимида. Перемешивают 48 часов при комнатной температуре. Выпавший осадок N,N-дициклогексилмочевины отфильтровывают. В фильтрате отгоняют тетрагидрофуран, к полученному маслу добавляют 3 мл воды и экстрагируют метиленхлоридом (3×5 мл). Метиленхлоридное извлечение сушат над безводным натрия сульфатом и растворитель отгоняют. Полученную светло-коричневую маслообразную массу сушат под вакуумом. Выход продукта составил 83%.
Для идентификации синтезированного сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,49 (д, 2Наром, J=5,7 Гц), 7,67 (т, 2Наром), 7,51 (д, 2Наром, J = 7,8 Гц), 7,11 (т, 2Наром), 3,81 (с, 4Н, СН2), 2,81 (с, 4Н, СН2), 2,53 (т, 4Н, СН2), 1,50-1,71 (м, 4Н, СН2), 1,32-1,41 (м, 2Н, СН2) (фиг. 3). MS (ESI)-m/z для C22H27N4O4: (М+Н)+ - найдено: 411,2113; (М+Н)+ - вычислено: 411,2020 (фиг. 4).
Пример 5. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом при pH 8,1
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH=8,1) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 79%. Активность 99mTc, связанного на коллоиде (СК), составила 7,8%.
Пример 6. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом при pH 8,3
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH 8,3) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 94%. Активность 99mTc, связанного на коллоиде (СК), составила 4,8%.
Пример 7. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом при рН 8,5
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH=8,5) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 97%. Активность 99mTc, связанного на коллоиде (СК), составила 2,8%.
Пример 8. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом при pH 8,7
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH 8,7) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 89%. Активность 99mTc, связанного на коллоиде (СК), составила 8,8%.
Пример 9. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом при pH 8,9
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH 8,9) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 75%. Активность 99mTc, связанного на коллоиде (СК), составила 10,5%.
Пример 10. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом в 5 ммоль Tris-буфере
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH=8,5) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в Tris-буфере (концентрация 6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 95%. Активность 99mTc, связанного на коллоиде (СК), составила 3,2%.
Пример 11. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом в присутствии ДМСО
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в буфере (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH 8,5) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМСО (6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 96%. Активность 99mTc, связанного на коллоиде (СК), составила 3,1%.
Пример 12. Методика модификации мини-антител DARPin активированным эфиром - сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноатом в фосфатном буфере
К 100 мкл раствора DARPin (концентрация 3 мг/мл) в фосфатном буфере (7 мМ NaH2PO4, 3 мМ Na2HPO4, 350 мМ NaCl, pH 8,5) добавляют 10 мкл раствора сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноата в ДМФА (концентрация 6,7 мг/мл). Пробу перемешивают и инкубируют 4 часа при комнатной температуре. Далее пробу выдерживают 24 часа при температуре 5-10°С. Очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75. Радиохимическая чистота полученного комплекса составляет 96%. Активность 99mTc, связанного на коллоиде (СК), составила 3,4%.
Пример 13. Методика мечения технецием-99 м модифицированных мини-антител DARPin
Во флакон вместимостью 10 мл вносят 100 мкл модифицированных мини-антител DARpin (50 мкг/мл) в буферном растворе (5 ммоль Tris, 40 ммоль K2HPO4⋅3H2O, 500 ммоль NaCl, pH 8,5). Затем последовательно добавляют 1 мл раствора технеция-99м и 40 мкл свежеприготовленного раствора цитрата натрия с концентрацией - 100 мг/мл (4 мг) и 30 мкл свежеприготовленного раствора олова (II) хлорида дигидрата с концентрацией - 7 мг/мл (0,21 мг). Далее инкубируют при комнатной температуре в течение 30 мин.
Выход реакции мечения - радиохимическую чистоту (РХЧ) полученного продукта оценивают методом тонкослойной хроматографии (ТСХ) путем снятия хроматограмм в двух подвижных фазах: в ацетоне и в смеси С2Н5ОН: 25% NH4OH : H2O (2:1:5) с использованием полосок силикагеля ПТСХ-АФ-А-УФ (Sorbfil) с последующим изучением распределения активности 99mTc по длине радиохроматограмм.
Затем РХЧ рассчитывали по формуле:
РХЧ (%) = 100 - НТ-ГТ (%),
где РХЧ - радиохимическая чистота комплекса технеция-99м с модифицированными мини-антителами DARpin, %;
НТ - процентное содержание не восстановленных пертехнетат ионов 99mTc(VII), %;
ГТ - процентное содержание гидролизованного технеция-99м (IV), связанного в коллоид, %.
Определение НТ
Для определения содержания невосстановленных пертехнетат ионов готовят пластины силикагеля ПТСХ-АФ-А-УФ (Sorbfil) размером 150 мм длиной и 20 мм шириной. Пробу исследуемого раствора (3-5 мкл) наносят на линию старта, отступив от одного из краев на 20 мм (линия старта), наносят пробу в определенном количестве (около 5 мкл), так чтобы статистически достоверно зарегистрировать на радиометрической установке, по крайней мере 0,5% активности от нанесенной. После высушивания пятна на воздухе полоску помещают в камеру, предварительно насыщенную ацетоном, в течение 1 ч. Хроматографирование проводят в ацетоне в течение 10 мин. В указанных условиях пертехнетат - 99mTc-ионы продвигаются с фронтом растворителя и имеют Rf=0,95±0,05, а комплекс технеция-99м с модифицированными мини-антителами DARpin и гидролизованный технеций-99м (99mTcO2, IV) остаются на линии старта. Полученную хроматограмму высушивают на воздухе при комнатной температуре и обклеивают с обеих сторон полиэтиленовой пленкой с липким слоем (ГОСТ 20477-86) и измеряют скорость счета от участка, содержащего пертехнетат - 99mTc-ионы, и от всей хроматограммы радиометрическим методом.
Определение ГТ
Для определения содержания гидролизованного технеция-99м (99mTcO2, IV), связанного в коллоид, готовят пластины силикагеля ПТСХ-АФ-А-УФ (Sorbfil) размером 150 мм длиной и 20 мм шириной. Пробу исследуемого раствора (3-5 мкл) наносят на линию старта, отступив от одного из краев на 20 мм (линия старта), наносят пробу в определенном количестве (около 5 мкл) так, чтобы статистически достоверно зарегистрировать на радиометрической установке, по крайней мере 0,5% активности от нанесенной. После высушивания пятна на воздухе полоску помещают в камеру, предварительно насыщенную смесью С2Н5ОН : 25% NH4OH : H2O (2:1:5), в течение 1 ч. Хроматографирование проводят в течение 40 мин. В указанных условиях пертехнетат - 99mTc-ионы и комплекс технеция-99м с модифицированными мини-антителами DARpin продвигаются с фронтом растворителя, а гидролизованный технеций-99м (99mTcO2, IV) остается на линии старта и имеет Rf=0,05±0,05. Полученную хроматограмму высушивают на воздухе при комнатной температуре и обклеивают с обеих сторон полиэтиленовой пленкой с липким слоем (ГОСТ 20477-86) и измеряют скорость счета участка, содержащего гидролизованный технеций-99м, от всей хроматограммы радиометрическим методом.
Расчеты, сделанные по этим хроматограммам, показывают, что общее содержание примесей НТ (99mTc (VII)) и ГТ (гидролизованного технеция-99м (99mTcO2, IV)) в препарате не превышает 3,7%, а его радиохимическая чистота составляет более 96%.
Приготовленный комплекс технеция-99м с модифицированными мини-антителами DARpin имеет состав, приведенный в таблице 1.
Таблица 1
Пример 14. Методика мечения технецием-99м модифицированных мини-антител DARPin
Реакционную смесь готовят так же, как и в примере 13, с тем отличием, что после смесь инкубировали при нагревании до 50°С на водяной бане в течение 30 мин.
Последующее изучение РХЧ препарата согласно методике, приведенной в Примере 13, показало, что радиохимическая чистота препарата составила 92,0%.
Пример 15. Методика мечения технецием-99м модифицированных мини-антител DARPin
Реакционную смесь готовят так же, как и в примере 13, с тем отличием, что добавляют свежеприготовленный раствор олова (II) хлорида дигидрата в количестве 0,07 мг. Радиохимическая чистота полученного комплекса составляет 69%. Содержание примеси гидролизованного технеция-99м (99mTcO2, IV) составило 9,8%.
Пример 16. Методика мечения технецием-99м модифицированных мини-антител DARPin
Реакционную смесь готовят так же, как и в примере 13, с тем отличием, что добавляют свежеприготовленный раствор олова (II) хлорида дигидрата в количестве 0,14 мг. Радиохимическая чистота полученного комплекса составляет 75,1%. Содержание примеси гидролизованного технеция-99м (99mTcO2, IV) составило 5,8%.
Пример 17. Методика мечения технецием-99м модифицированных мини-антител DARPin
Реакционную смесь готовят так же, как и в примере 13, с тем отличием, что добавляют свежеприготовленный раствор олова (II) хлорида дигидрата в количестве 0,28 мг. Радиохимическая чистота полученного комплекса составляет 93%. Содержание примеси гидролизованного технеция-99м (99mTcO2, IV) составило 8,2%.
Пример 18. Методика мечения технецием-99м модифицированных мини-антител DARPin
Реакционную смесь готовят так же, как и в примере 13, с тем отличием, что добавляют свежеприготовленный раствор олова (II) хлорида дигидрата в количестве 0,35 мг. Радиохимическая чистота полученного комплекса составляет 83%. Содержание примеси гидролизованного технеция-99м (99mTcO2, IV) составило 16,3%.
Обоснование режима
Как показали данные экспериментальных исследований, изложенные в вышеприведенных примерах, реакция активированного эфира с мини-антителами проявляет существенную зависимость от pH. При низких значениях pH (менее 8,1) происходит протонирование аминогрупп, в результате чего снижается эффективность реакции. При высоких значениях существенным становится процесс гидролиза активированного эфира (более 8,7). Оптимальным значением pH для модификации является 8,3-8,5 (примеры 5-9).
Поскольку активированный эфир имеет низкую растворимость в воде, в качестве сорастворителя использовали диметилсульфоксид (ДМСО), диметилформамид (ДМФА) и 5 ммоль Tris-буфер (примеры 7, 10-11). Результаты мечения технецием 99m показали возможность применения всех указанных сорастворителей. Однако ДМФА может портиться при хранении, при этом в нем накапливается диметиламин, способный реагировать с активированными эфирами. Поэтому ДМФА для мечения должен быть хорошего качества или можно модификацию проводить в Tris-буфере или фосфатном буфере.
Для модификации мини-антител использовали фосфатный буфер и Tris-буфер (примеры 7 и 12). РХЧ в разных буферах имела высокое значение, следовательно, для модификации мини-антител можно проводить в указанных буферных растворах, однако, предпочтительнее фосфатный буфер.
Изменение температуры инкубирования при мечении технецием-99м модифицированных мини-антител показало, что повышение температуры приводит к снижению РХЧ, а содержание коллоида в пробе осталось на том же уровне, как и в примере 13, что говорит о нецелесообразности проведения инкубирования препарата с нагреванием на водяной бане до 50°С (примеры 13, 14).
Как известно [8], от количества хлорида олова (II) напрямую зависит радиохимическая чистота (РХЧ) получаемых радиофармпрепаратов и количество образующего в них коллоида типа (-O-TcO-O-SnCl2-O-TcO-)n, где n = 2, 3…- число, зависящее от pH раствора. Кроме того, высокая активность 99mTc, связанного на коллоиде (ГТ), приводит к нецелевому накоплению радиоактивности в печени.
В этой связи были проведены предварительные исследования для установления необходимого и достаточного количества Sn (II) в составе препарата, которое бы обеспечивало практически полное восстановление 99mTc (VII) при минимальном количестве образующегося коллоида в виде гидролизованного технеция-99м (примеры 13, 15-18).
Результаты этих исследований представлены в таблице 2.
Таблица 2
Из представленных результатов следует, что оптимальной концентрацией SnCl2⋅2H2O в составе смеси является 0,21 мг (п. 3), при которой достигается максимальное значение радиохимической чистоты препарата при минимальном содержании гидролизованного технеция-99 м (табл. 2).
Таким образом, предлагаемый способ позволяет получать целевой продукт с высокой радиохимической чистотой и выходом комплекса технеция-99 м с модифицированными специфичными мини-антителами для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu, также отличается простотой и доступностью выполнения, что является перспективным для производства в промышленном масштабе.
Изобретение поясняется чертежами, где:
Фигура 1 - Схема получения ω-бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов.
Фигура 2 - Схема получения сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноата прекурсора с хелатными центрами для связывания металлов.
Фигура 3 - 1Н-ЯМР-спектр сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноата (300 МГц, CDCl3, δ, м.д., J, Гц).
Фигура 4 - Элементный анализ сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино) гексаноата.
Фигура 5 - 1Н-ЯМР-спектр метил 6-иодгексаноата (300 МГц, CDCl3, δ, м.д., J, Гц).
Фигура 6 - 1Н-ЯМР-спектр метил 6-(бис(пиридин-2-илметил)амино)гексаноата (300 МГц, CDCl3, δ, м.д., J, Гц).
Фигура 7 - Элементный анализ метил 6-(бис(пиридин-2-илметил)амино)гексаноата.
Фигура 8 - 1Н-ЯМР-спектр 6-(бис(пиридин-2-илметил)амино)гексановой кислоты (в виде гидрохлорида) (300 МГц, H2O, δ, м.д., J, Гц).
Фигура 9 - Элементный анализ 6-(бис(пиридин-2-илметил)амино)гексановой кислоты.
Источники информации
1) DARPins: A new generation of protein Therapeutics / Michael T. Stumpp, H. Kaspar Binz and Patrick Amstutz // Drug Discovery Today. Volume 13, Numbers 15/16. August 2008. P. 695-701.
2) Development of the designed ankyrin repeat protein (DARPin)G3 for HER2 molecular imaging / Robert Goldstein, Jane Sosabowski, Maria Livanos, Julius Leyton, Kim Vigor, Gaurav Bhavsar, Gabriela Nagy-Davidescu, Mohammed Rashid, Enrique Miranda, Jenny Yeung, Berend Tolner, Andreas Pluckthun, Stephen Mather, Tim Meyer, Kerry Chester // Eur. J. Nucl. Med. Mol. Imaging (2015) 42:288-301.
3) Современные технологии создания неприродных антител для клинического применения / С.М. Деев, Е.Н. Лебеденко // Acta naturae. №1. 2009. С. 32-50.
4) Hofstrom С, Altai М, Honarvar Н, Strand J, Malmberg J, Hosseinimehr SJ, et al. HAHAHA, HEHEHE, HIHIHI, or HKHKHK: influence of position and composition of histidine containing tags on biodistribution of [(99m)Tc(CO)3](+)-labeled affibody molecules. J Med Chem. 2013; 56: 4966-74.
5) 99mTc-labeling and in vitro characterization of N4- and N3S-RGDS-derivative peptides / A. Perera Pintado, S.J. Mather, M.A. Stalteri, D. Allison, A. Prats Capote, A. Hernandez Cairo, O. Reyes Acosta, M. Bequet Romero // Journal of Radioanalytical and Nuclear Chemistry, Vol. 275, No.3 (2008). P. 619-626. Патент №2537175 от 31.10.2014.
6) Use of a HEHEHE Purification Tag Instead of a Hexahistidine Tag Improves Biodistribution of Affibody Molecules Site-Specifically Labeled with 99m-Tc, 111-In and 125-I / Camilla Hofstrom, Anna Orlova, Mohamed Altai, Fredrik Wangsell, Torbjorn Graslund and Vladimir Tolmachev // J. Med. Chem. 2011, 54, 3817-3826.
7) Патент 2537175. Способ получения радиоиммунного препарата для диагностики и терапии онкологических заболеваний / Чувилин Д.Ю., Загрядский В.А., Дубинкин Д.О., Бочагин Ф.С., Панченко В.Я., Деев С.М., Головаченко В.А., Решетов И.В.
Зайцева Л.Л., Величко А.В., Виноградов И.В. Соединения технеция и области их применения // Итоги науки и техники. - М.: ВИНИТИ, 1984. - Т. 9. - С. 180.
Способ получения комплекса технеция-99м с модифицированными специфичными мини-антителами DARPin для диагностики онкологических заболеваний с гиперэкспрессией HER2/neu, включающий связывание технеция-99м с мини-антителами DARPin, отличающийся тем, что на первом этапе проводят модификацию мини-антител DARPin сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноатом в Tris-буферном растворе, в растворе ДМСО или ДФМА, при этом, используют растворы мини-антител DARPin в Tris-буфере или фосфатном буфере с pH 8,3-8,5, синтез проводят при перемешивании 4 часа при комнатной температуре, далее выдерживают 24 часа при температуре 5-10°С, далее модификацию проводят при соотношении мини-антител к сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноату - 1:5 - 20, очистку модифицированных мини-антител проводят гель-фильтрацией на колонке с Superdex-75, на втором этапе способа проводят связывание технеция-99м с модифицированными мини-антителам DARPin, для чего к модифицированным мини-антителам DARpin в количестве 50 мкг в буферном растворе при pH 8,3-8,5 последовательно добавляют 1 мл раствора технеция-99м 300-1200 МБк и 40 мкл свежеприготовленного раствора цитрата натрия с концентрацией 100 мг/мл и 30 мкл свежеприготовленного раствора олова (II) хлорида дигидрата с концентрацией 7 мг/мл и инкубируют при комнатной температуре в течение 30 мин.