Рекомбинантная плазмидная днк pbipr-abiga1fi6-ht для получения рекомбинантного иммуноглобулина а изотипа iga1
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложены рекомбинантная плазмидная ДНК pBiPr-ABIgA1FI6-ht, кодирующая человеческое антитело к гемагглютинину вируса гриппа А человека изотипа IgA1, и способ получения указанного человеческого антитела, а также линия эукариотических клеток, содержащая указанную рекомбинантную плазмидную ДНК, и способ получения указанной линии клеток. Предложенная рекомбинантная плазмидная ДНК содержит ген тяжелой цепи под контролем промотора hEF1-HTLV и сигнала полиаденилирования бычьего гормона роста BGH polyA и ген легкой цепи под контролем промотора CMV и сигнала полиаденилирования тимидинкиназы вируса герпеса, а также селективный маркер, обеспечивающий отбор трансфецированных эукариотических клеток. Промоторы hEF1-HTLV и CMV размещены в последовательности, обеспечивающей однонаправленую транскрипцию, что обеспечивает стабильную коэкспрессию генов тяжелой и легкой цепей антитела. Предложенная группа изобретений может быть использована в биотехнологии для получения человеческого антитела изотипа IgA1 к гемагглютинину вируса гриппа А. 4 н. и 13 з.п. ф-лы, 10 ил., 7 табл., 2 пр.
Реферат
Область техники
Изобретение относится к области биотехнологии, в частности предложена рекомбинантная плазмидная ДНК, позволяющая осуществлять транскрипцию и трансляцию кодирующей последовательности генов тяжелой и легкой цепей иммуноглобулина А, для последующего получения линий клеток, экспрессирующих антитела изотипа IgA1, которые могут быть использованы при производстве терапевтических средств (препаратов и вакцин), в т.ч. против вируса гриппа А.
Уровень техники
В литературе описано несколько способов получения рекомбинантных иммуноглобулинов А в животных клетках и создания культур - продуцентов антител на основе клеток грызунов и приматов, например на основе линии клеток СНО (клетки яичника китайского хомячка).
Известна плазмида, созданная на основе рЕЕ14.4 [R.C. Kallmeier, T.J. Macartney and R.D. Gay. IMPROVEMENTS TO THE GS SYSTEM. FOR EASIER RE-EXPRESSION OF HUMAN ANTIBODIES. METHODS. http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_Poster_Easier_Expression_of_Antibodies_using_GS.pdf], содержащая промотор и энхансер гена hCMV-MIE, включая 5'-нетранслируемую последовательность и первый интрон, лидерный пептид HAVT20, вариабельный домен легкой цепи антитела 225 против рецептора эпидермального фактора роста человека EGF-R, константный домен легкой каппа-цепи человека, сайт полиаденилирования и, в качестве селективного маркера на безглутаминовой среде, ген глутамин-синтетазы под контролем слабого позднего промотора вируса SV40 [Beyer Т., Lohse S., Berger S., Peipp M., Valerius Т., Dechant M. Serum-free production and purification of chimeric IgA antibodies. // Journal of Immunological Methods 346 (2009) 26-37].
Известна плазмида, созданная на основе рЕЕ14.4, содержащая промотор и энхансер гена hCMV-MIE, включая 5'-нетранслируемую последовательность и первый интрон, лидерный пептид HAVT20, вариабельный домен тяжелой цепи антитела 225 против EGF-R, ген констанных доменов тяжелой α1-цепи человека (или α2-цепи в варианте для IgA2(m1)), сайт полиаденилирования и ген глутамин-синтетазы под контролем слабого позднего промотора вируса SV40 в качестве селективного маркера на безглутаминовой среде. Полученные с помощью ко-трансфекции в клетках СНО-K1 стабильные клеточные линии обеспечивали продукцию мономерных IgA1 и IgA2 в суспензионной культуре в бессывороточной среде с выходом 2,2 пикограмм/клетку/день [Beyer Т., Lohse S., Berger S., Peipp M., Valerius Т., Dechant M. Serum-free production and purification of chimeric IgA antibodies. // Journal of Immunological Methods 346 (2009) 26-37].
Известна плазмида, полученная на основе вектора pIR-ESpuro3 (Clontech, Mountain View, CA), содержащая ранний промотор и энхансер цитомегаловируса человека PCMV IE, ген J-цепи человека с гексагистидиновой последовательностью на N-конце (кодирующая последовательность 6 гистидинов взята из вектора pcDNA6His (Invitrogen)), синтетический интрон IVS, внутренный сайт посадки рибосом вируса энцефаломиокардита IRES, ген пуромицин-N-ацетил-трансферазы Puror и ранний сигнал полиаденилирования вируса SV40. Котрансфекция этой плазмидой клонов, хорошо продуцирующих антитела 225-IgA против EGF-R, обеспечивает продукцию димеров 225-IgA, связанных с J-цепью, в суспензионной культуре в бессывороточной среде в клетках (CHO)-K1 с выходом 200.8 (673.3) и 295.2 (6139.5) мг/мл для мономерной и димерной форм 225-IgA1 [Lohse S., Derer S., Beyer Т., Klausz K., Peipp M., Leusen J. H. W., van de Winkel J.G. J., Dechant M., Valerius T. Recombinant Dimeric IgA Antibodies against the Epidermal Growth Factor Receptor Mediate Effective Tumor Cell Killing. // The Journal of Immunology, 2011, 186:3770-3778.].
Известна плазмида pEF-dhfr2a-NEO-IGA-chi-H, содержащая кодирующую последовательность вариабельного домена тяжелой цепи мышиного антитела НА-9 против вируса птичьего гриппа H5N1, кодирующую последовательность константных доменов IgA2 антител человека из pGEM-T-Easy-IGHA с нитронами, ген устойчивости к неомицину NeoR и ген дигидрофолатредуктазы dhfr, промоторы CMV и фактора элонгации 1 человека (EF1)-α, искусственный интрон перед и поздний сайт полиаденилирования SV40 poly (А) после гена цепи антитела [Cun Li, Xiaoping An, Azeem Mehmood Butt, Baozhong Zhang, Zhiyi Zhang, Xiaona Wang, Yong Huang, Wenhui Zhang, Bo Zhang, Zhiqiang Mi, Yigang Tong. Construction of a Chimeric Secretory IgA and Its Neutralization. Activity against Avian Influenza Virus H5N1. // J Immunol Res. 2014: 394127. Published online 2014 February 13. doi: 10.1155/2014/394127, PMCID: РМС3987799].
Известна плазмида pEF-dhfr2a-NEO-IGA-Kappa, содержащая кодирующую последовательность вариабельного домена легкой цепи мышиного антитела НА-9 против вируса птичьего гриппа H5N1, кодирующую последовательность константного домена каппа легкой цепи антител человека из pGEM-T-Easy-CK, устойчивости к неомицину NeoR и ген дигидрофолатредуктазы dhfr, промоторы CMV и фактора элонгации 1 человека (EF1)-α, искусственный интрон перед и поздний сайт полиаденилирования SV40 poly (А) после гена цепи антитела [Cun Li, Xiaoping An, Azeem Mehmood Butt, Baozhong Zhang, Zhiyi Zhang, Xiaona Wang, Yong Huang, Wenhui Zhang, Bo Zhang, Zhiqiang Mi, Yigang Tong. Construction of a Chimeric Secretory IgA and Its Neutralization. Activity against Avian Influenza Virus H5N1. // J Immunol Res. 2014: 394127. Published online 2014 February 13. doi: 10.1155/2014/394127, PMCID: РМС3987799].
Обе плазмиды обеспечивают продукцию химерного антитела IgA2 НА-9 против вируса птичьего гриппа H5N1 при котрансфекции в клетки CHO/dhfr- в суспензионной культуре в бессывороточной среде. Известна плазмида pcDNA4/His A-IgJ, содержащая ген J-цепи антител IgJ. Известна плазмида pcDNA4/HisA-SC, содержащая ген секреторного компонента (состоит из первых 585 аминокислот полимерного рецептора иммуноглобулинов pIgR человека). Обе плазмиды обеспечивают продукцию секреторного варианта химерного антитела IgA2 НА-9 против вируса птичьего гриппа H5N1 при котрансфекции в клетки CHO/dhfr-, продуцироющие мономерный вариант в суспензионной культуре в бессывороточной среде с выходом 25 мг/л супернатанта. [Cun Li, Xiaoping An, Azeem Mehmood Butt, Baozhong Zhang, Zhiyi Zhang, Xiaona Wang, Yong Huang, Wenhui Zhang, Bo Zhang, Zhiqiang Mi, Yigang Tong. Construction of a Chimeric Secretory IgA and Its Neutralization. Activity against Avian Influenza Virus H5N1. // J Immunol Res. 2014: 394127. Published online 2014 February 13. doi: 10.1155/2014/394127, PMCID: РМС3987799].
Известна плазмида, полученная на основе pFUSE2ss-CLIg-hK (InvivoGen), содержащая гибридный промотор hEF1-HTLV, сигнальную последовательность интерлейкина-2 человека, кодирующую последовательность вариабельного домена легкой цепи антитела 9F4 против вирусов гриппа H5N1, ген константного каппа-домена легкой цепи антитела человека, сигнал полиаденилирования SV40 pAn, ген устойчивости к бластицидину под контролем гибридного промотора CMV enh / hFerL и сайта полиаденилирования бета-глобина человека βGlo рАn в качестве селективного маркера [Tze-Minn Mak, Brendon J. Hanson, Yee-Joo Tan. Chimerization and characterization of a monoclonal antibody with potent neutralizing activity across multiple influenza A H5N1 clades. // Antiviral Res. 2014 Jul; 107: 76-83. doi: 10.1016/j.antiviral.2014.04.011].
Известна плазмида, полученная на основе pFUSEss-CHIg-hA1 (InvivoGen), содержащая гибридный промотор hEF1-HTLV, сигнальную последовательность интерлейкина-2 человека, кодирующую последовательность вариабельного домена тяжелой цепи антитела 9F4 против вирусов гриппа H5N1, кодирующую последовательность константных доменов тяжелой цепи антитела человека IgA1, сигнал полиаденилирования SV40 pAn, ген устойчивости к зеоцину под контролем гибридного промотора CMV enh / hFerL и сайта полиаденилирования бета-глобина человека βGlo pAn в качестве селективного маркера. При транзиентной котрансфекции клеток 293FT обе плазмиды обеспечивали продукцию химерного антитела против вирусов гриппа H5N1 xi-IgA1-9F4 [Tze-Minn Mak, Brendon J. Hanson, Yee-Joo Tan. Chimerization and characterization of a monoclonal antibody with potent neutralizing activity across multiple influenza A H5N1 clades. // Antiviral Res. 2014 Jul; 107:76-83. doi: 10.1016/j.antiviral.2014.04.011].
Известна плазмида pYR-GCEVH, содержащая тяжелую цепь антитела HCAb к раку кишечника человека, и плазмида pYR-GCEVL, содержащая легкую цепь антитела к раку кишечника человека [Xiong Н., Ran Y., Xing J., Yang X., Li Y. and Chen Z. Expression vectors for human-mouse chimeric antibodies// Journal of Biochemistry and Molecular Biology. - 2005. - V. 38 (4). - P. 414-419]. Плазмида pYR-GCEVL включает в себя ген устойчивости к неомицину/генетицину под управлением раннего промотора вируса SV40 с удаленным энхансером. Транскрипция гена легкой цепи находится под контролем CMV на 5' конце и терминатора бычьего гормона роста (BGHT), на 3' конце находится сайт полиаденилирования. Плазмида pYR-GCEVH включает в себя ген dhfr под управлением раннего промотора вируса SV40. Транскрипция гена легкой цепи находится под контролем CMV на 5' конце и терминатора бычьего гормона роста (BGHT), на 3' конце находится сайт полиаденилирования.
Культура клеток dhfr (-) СНО (АТСС, США), дефицитных по дигидрофолатредуктазе (ДГФР), была ко-трансфецирована с использованием равных количеств плазмид pYR-GCEVH, pYR-GCEVL. После проведения нескольких раундов селекции была получена культура, клоны которой имели продукцию химерных антител против рака кишечника человека от 30 до 100 и более мкг/мл кондиционированной среды [Xiong и др., 2005].
Известны плазмиды pOptiVEC-L и pcDNA3.3-L, содержащие в своем составе ген легкой цепи антитела против ФНО-альфа человека [Radko B.V., Boitchenko V.E., Nedospasov S.A., Korobko V.G. Characterization of the genes encoding variable light and heavy chains of the high-affinity monoclonal antibody against human tumor necrosis factor// Russ J Immunol. - 2002.- V. 7(4). P. 371-4] под контролем промотора CMV, а также OptiVEC-H, pcDNA3.3-H, содержащие в своем составе ген легкой цепи антитела против ФНО-альфа человека под контролем промотора CMV. Плазмиды pcDNA3.3-L и pcDNA3.3-H содержат в своем составе также ген устойчивости к селективному антибиотику G418, а плазмиды pOptiVEC-L и pOptiVEC-H содержат в своем составе также миниген ДГФР мыши. После трансфекции экспрессирующими векторами pOptiVEC-L и pcDNA3.3-H клеток линии СНО DG44 и селекции в среде без нуклеотидов получен клон клеток, секретирующий химерные антитела против ФНО-альфа человека в среду культивирования с выходом 2 мкг на мл кондиционированной среды. Путем проведения нескольких раундов амплификации в присутствии возрастающих концентраций метотрексата и селективного антибиотика G418 была получена линия-продуцент, стабильно секретирующая химерные антитела против ФНО-альфа человека с выходом до 24,5 мкг/мл. [Балабашин Д.С., Зайцева-Зотова Д.С., Топорова В.А., Панина А.А., Марквичева Е.А., Свирщевская Е.В., Алиев Т.К. Способы увеличения продукции рекомбинантных антител в клеточных линиях СНО DG44 // Современные проблемы науки и образования. - 2011. - №5.].
Недостатком данного продуцента, в котором используются 2 различные плазмиды, имеющие в своем составе гены тяжелой и легкой цепей антитела, является то, что интегрированные в них гены цепей антител против ФНО-альфа человека находятся в клетке под контролем одинаковых промоторов и терминаторов. Также различные генетические маркеры, позволяющие за счет селективного давления увеличивать продукцию cis-ориентированных генов в клетках-продуцентах, имеют различную активность, что может влиять на количество экспрессируемого белкового продукта каждой из плазмид. Данное обстоятельство может изменять соотношение легкой и тяжелой цепей и приводить к токсичности белкового продукта для клеток-продуцентов. При использовании метода селекции клеточной линии-продуцента с помощью метотрексата увеличение уровня экспрессии будет происходить только для той цепи антитела, которая находится в непосредственной близости от селективного маркера, гена ДГФР.
Известно нейтрализующее моноклональное антитело FI6 к гемагглютинину вируса гриппа А (ВГА), полученное из культуры единичных клеток плазмы периферической крови человека и демонстрирующее широкую специфичность к гемагглютининам обеих гетерологичных групп и нейтрализующую активность к вирусам разных серотипов [Corti D., Voss J., Gamblin S.J., Codoni G., Macagno A., Jarrossay D., Vachieri S.G., Pinna D., Minola A., Vanzetta F., Silacci C, Fernandez-Rodriguez B.M., Agatic G., Bianchi S., Giacchetto-Sasselli I., Calder L., Sallusto F., Collins P., Haire L.F., Temperton N., Langedijk J.P., Skehel J.J. and Lanzavecchia A. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins. // Science 333 (6044), 850-856 (2011). PUBMED 21798894]. кДНК вариабельных доменов этого антитела были получены с помощью метода RT-PCR, клонированы в экспрессионные векторы IgG1 и Igk и экспрессированы путем транзиентной трансфекции суспензионной культуры клеток 293Т. Эти антитела и их фрагменты потенциально могут быть использованы для диагностики и терапии гриппа [Antonio Lanzavecchia. Neutralizing anti-influenza A virus antibodies and uses thereof. Патент US 9340603 B2 https://www.google.ch/patents/US 9340603].
Известна плазмида pBiPr-ABTNF [Алиев Т.К., Балабашин Д.С., Долгих Д.А., Кирпичников М.П., Панина А.А., Топорова В.А. Рекомбинантная плазмидная ДНК, кодирующая химерное антитело против фактора некроза опухоли-альфа человека, линия экуариотических клеток - продуцент химерного антитела и способ получения химерного антитела. Патент №2555533, прототип по конструированию], кодирующая химерное антитело против фактора некроза опухолей-альфа человека (ФНО-альфа) изотипа IgG1, созданная на основе плазмиды pOptiVEC™-TOPO®. Трансфецированная этой плазмидой линия эукариотических клеток осуществляет продукцию антитела против ФНО-альфа на уровне 90 мг/л. Наличие в плазмиде pBiPr-ABTNF активного гена ДГФР, находящегося под контролем IRES, позволяет проводить селекцию и амплификацию чужеродных последовательностей, интегрированных в геном клетки СНО DG44 (dhfr-/- вариант линии клеток СНО-K1), в среде, содержащей метотрексат. Сочетание процессов трансфекции, селекции и амплификации позволяет получить линию клеток продуцентов CHO-S11, содержащую в своем геноме интегрированные копии генов химерного антитела против ФНО-альфа человека и стабильно секретирующую рекомбинантные антитела в культуральную жидкость. Наличие генов тяжелой и легкой цепей антитела в составе одной плазмиды позволяет осуществлять одновременную амплификацию генов легкой и тяжелой цепей рекомбинантного антитела, встроенных в геном клеток СНО, при воздействии метотрексатом.
Недостатком плазмиды является то, что эта плазмида позволяет получать антитела только изотипа G1 и только против фактора некроза опухолей-альфа человека. Возникшая необходимость получения антител изотипа IgA1 приводит к созданию сходной бипромоторной рекомбинантной плазмиды, обеспечивающей получение антител изотипа IgA1. В качестве вариабельных доменов тяжелой и легкой цепей используются вариабельные домены атитела FI6 как имеющие потенциальное терапевтическое значение. Кроме того, в ходе создания плазмиды получаются варианты как с однонаправленной, так и с разнонаправленной транскрипцией генов тяжелой и легкой цепей антитела. В литературе данные по влиянию взаимной ориентации транскрипции генов не найдены, что приводит к необходимости как разработки способов дифференцирования клонов по взаимному направлению транскрипции генов, так и изучения влияния однонаправленной и разнонаправленной транскрипции генов на уровень продукции антител изотипа IgA1. В дальнейшем эти данные могут позволить оптимизировать работу по получению рекомбинантных плазмид и клеточных культур, экспрессирующих другие антитела изотипа IgA1.
Раскрытие изобретения
Задачей настоящего изобретения является создание рекомбинантной плазмиды для получения рекомбинантных человеческих антител изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА).
Сконструированая рекомбинантная плазмидная ДНК pBiPr-ABIgA1FI6-ht (структура плазмиды pBiPr-ABIgA1FI6-ht показана в Фиг. 1), содержит:
- фрагмент плазмиды pOptiVEC™-TOPO®, включающий промотор/энхансер ранних генов цитомегаловируса человека (CMV), внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV), ген ДГФР, сигнал полиаденилирования тимидинкиназы вируса герпеса TKpA, сайт начала репликации в Е. coli из плазмиды pUC, ген β-лактамазы, а также следующие модификации - единичный сайт узнавания рестриктазы MluI вместо сайта узнавания рестриктазы SalI в положении 23, единичные сайты узнавания рестриктаз NheI и XhoI после промотора CMV для клонирования ДНК легкой цепи антитела;
- фрагмент ДНК, включающий фланкированную сайтами рестрикции NheI и XhoI кДНК легкой цепи типа каппа человеческого антитела к гемагглютинину вируса гриппа A [Corti D., Voss J., Gamblin S.J., Codoni G., Macagno A., Jarrossay D., Vachieri S.G., Pinna D., Minola A., Vanzetta F., Silacci C, Fernandez-Rodriguez B.M., Agatic G., Bianchi S., Giacchetto-Sasselli I., Calder L., Sallusto F., Collins P., Haire L.F., Temperton N., Langedijk J.P., Skehel J.J. and Lanzavecchia A. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins. // Science 333 (6044), 850-856 (2011). PUBMED 21798894] человека под контролем промотора/энхансера ранних генов цитомегаловируса человека (CMV);
- MluI/MluI - фрагмент ДНК, содержащий ДНК тяжелой цепи человеческого антитела к гемагглютинину вируса гриппа А человека [Corti D., Voss J., Gamblin S.J., Codoni G., Macagno A., Jarrossay D., Vachieri S.G., Pinna D., Minola A., Vanzetta F., Silacci C., Fernandez-Rodriguez B.M., Agatic G., Bianchi S., Giacchetto-Sasselli I., Calder L., Sallusto F., Collins P., Haire L.F., Temperton N., Langedijk J.P., Skehel J.J. and Lanzavecchia A.A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins. // Science 333 (6044), 850-856 (2011). PUBMED 21798894] изотипа IgA1 под контролем гибридного промотора hEFl-HTLV и сигнала полиаденилирования бычьего гормона роста BGH polyA. Фрагмент ориентирован так, что транскрипция с промоторов hEF1-HTLV и CMV идет однонаправленно.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК pBiPr-ABIgA1FI6-ht, характеризующуюся тем, что в ней содержится фрагмент ДНК, кодирующий тяжелую цепь человеческого антитела изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА) с аминокислотной последовательностью SEQ ID NO:1.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК pBiPr-ABIgA1FI6-ht, характеризующуюся тем, что фрагмент ДНК, кодирующий тяжелую цепь человеческого антитела изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА), имеет нуклеотидную последовательность SEQ ID NO: 2.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что в ней содержится фрагмент ДНК, кодирующий легкую цепь человеческого антитела к гемагглютинину вируса гриппа А (ВГА) с аминокислотной последовательностью SEQ ID NO: 3.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что фрагмент ДНК, кодирующий легкую цепь человеческого антитела к гемагглютинину вируса гриппа А (ВГА), имеет нуклеотидную последовательность SEQ ID NO: 4.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный промотор/энхансер ранних генов цитомегаловируса человека (CMV) имеет нуклеотидную последовательность SEQ ID NO: 5.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный гибридный промотор hEF1-HTLV имеет нуклеотидную последовательность SEQ ID NO: 6.
Также настоящее изобретение представляет упомянутую выше рекомбинантную плазмидную ДНК, характеризующуюся тем, что указанный сигнал полиаденилирования бычьего гормона роста BGH polyA имеет нуклеотидную последовательность SEQ ID NO: 7.
Поставленная задача также решается способом получения культуры клеток яичника китайского хомячка СНО - продуцента иммуноглобулина А изотипа IgA1 человеческого антитела к гемагглютинину вируса гриппа А (ВГА) путем трансфекции клеток упомянутой выше рекомбинантной плазмидной ДНК pBiPr-ABIgA1FI6-ht.
Также поставленная задача решается линией клеток яичника китайского хомячка СНО - продуцента человеческого антитела изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА), полученной путем трансфекции линии клеток СНО DG44 упомянутой выше рекомбинантной плазмидной ДНК pBiPr-ABIgA1FI6-ht.
Поставленная задача также решается способом получения человеческого антитела к гемагглютинину вируса гриппа А (ВГА) изотипа IgA1, включающим:
- культивирование в питательной среде упомянутых выше линий клеток,
- выделение полученного целевого белка из культуральной жидкости.
Технический результат заключается в стабильной коэкспрессии генов тяжелой и легкой цепей антитела под давлением одного селективного маркера и достигается за счет однонаправленной транскрипции генов тяжелой и легкой цепей антитела изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА) клетками-продуцентами при использовании полученной рекомбинантной плазмидной ДНК pBiPr-ABIgA1FI6-ht с выходом до 16,2 мг/л культуральной среды.
Наличие в плазмиде pBiPr-ABIgA1FI6-ht активного гена ДГФР, находящегося под контролем IRES, позволяет проводить селекцию и амплификацию чужеродных последовательностей, интегрированных в геном клетки СНО DG44 (dhfr-/- вариант линии клеток СНО-К1), в среде, содержащей метотрексат. Сочетание процессов трансфекции, селекции и амплификации позволяет получить линию клеток продуцентов СНО DG44/pBiPr-ABIgA1FI6-ht, содержащую в своем геноме интегрированные копии генов человеческого антитела к гемагглютинину вируса гриппа А (ВГА) и стабильно секретирующие рекомбинантные антитела изотипа IgA1 в культуральную жидкость. Наличие генов тяжелой и легкой цепей антитела в составе одной плазмиды позволяет осуществлять одновременную амплификацию генов легкой и тяжелой цепей рекомбинантного антитела, встроенных в геном клеток СНО, при воздействии метотрексатом.
Преимущество предлагаемого изобретения заключается в том, что культуры, трансфецированные плазмидой pBiPr-ABIgA1FI6-ht, значительно быстрее проходят процедуру селекции с использованием метотрексата в концентрации до 200 нМ в сравнении с культурой, трансфецированной двумя отдельными плазмидами, которой необходимы котрансфекция и дополнительный этап селекции с помощью добавления 500 мкг на мл питательной среды селективного антибиотика генетицина (G418). Линия-продуцент СНО DG44/pBiPr-ABIgA1FI6-ht отличается от линии клеток СНО DG44 по признакам, передаваемым последовательностями ДНК, использованными для трансфекции, т.е. является устойчивой к высоким дозам метотрексата (200 нМ), и синтезирует рекомбинантные человеческие антитела изотипа IgA1 к гемагглютинину вируса гриппа А (ВГА) с выходом до 16,2 мг/л культуральной среды.
Продукция антител может быть осуществлена в эукариотических клетках. Примером эукариотической клетки, пригодной для продукции полноразмерного антитела, согласно настоящему изобретению являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (СНО). Фраза "клетки яичников Cricetulus griseus" означает, что указанные эукариотические клетки классифицируют как клетки яичников С.griseus (СНО) в соответствии с классификацией, известной специалисту в данной области биотехнологии. Примерами клеток яичников Cricetulus griseus (СНО), применимых в рамках настоящего изобретения, являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (СНО) клетки СНО DG44 (Invitrogen).
Предложенная рекомбинантная плазмида pBiPr-ABIgA1FI6-ht и способ получения линии культивируемых клеток СНО, основанный на использовании рекомбинантной плазмиды pBiPr-ABIgA1FI6-ht, впервые получены авторами данного изобретения, в научной и патентной литературе не описаны. Кроме того, нуклеотидная последовательность вариабельных доменов тяжелой и легкой цепей антитела FI6 получена отличным от прототипа способом и отличается от опубликованной в прототипе, так как адаптирована для прокариотической и эукариотической экспрессии по частотам встречаемости кодонов, а также сайтам узнавания рестриктаз. Также большая часть использованных праймеров впервые разработана для получения данной плазмиды и ранее не встречались в литературе.
Краткое описание чертежей
На Фиг. 1 показана структура плазмиды pBiPr-ABIgA1FI6-ht. hEF1-HTLV - гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1а и 5'-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV (позиции 29-560), lidFlOH - секреторный пептид тяжелой цепи антитела F10 (позиции 605-661), FI6Hv - кодирующая последовательность вариабельного домена тяжелой цепи антитела FI6 (позиции 662-1047), IgA1 - ген константных доменов тяжелой цепи антитела человека изотипа IgA1 (позиции 1048-2191), BGH рА - сайт полиаденилирования BGH из плазмиды pBudCE4.1 (позиции 2192-2415), CMV promoter - промотор/энхансер ранних генов цитомегаловируса человека (позиции 2443-3122), lidF10L - секреторный пептид легкой цепи антитела F10 (позиции 3161-3220), FI6Lv - кодирующая последовательность вариабельного домена легкой цепи антитела FI6 к гемагглютинину вируса гриппа А (ВГА) (позиции 3221-3556), Lc-kappa - ген константного домена типа каппа легкой цепи антитела человека (позиции 3557-3877), EMCV IRES - внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (позиции 3965-4553), DHFR - ген дигидрофолатредуктазы (позиции 4566-5129), ТК рА - сигнал полиаденилирования тимидинкиназы вируса герпеса (позиции 5169-5441), pUC ori - последовательность начала репликации (позиции 5803-6476), bla (AmpR) - ген резистентности к ампициллину (позиции 6618-7478), bla pr - промотор гена ампициллиновой резистентности blа (позиции 7473-7577), MluI, NheI, XhoI, PstI - сайты узнавания соответствующих эндонуклеаз рестрикции (MluI - позиции 23, 2418, NheI - 571, 3140, XhoI - 2186, 3919, PstI - 902, 1087, 1841, 3464).
На Фиг. 2 показана кодирующая последовательность вариабельного домена легкой цепи антитела FI6 с секреторным пептидом (двойное подчеркивание) и местами расположения праймеров (выделены курсивом). Подчеркнут сайт узнавания рестриктазы NheI. Приведена аминокислотная последовательность вариабельного домена легкой цепи антитела FI6.
На Фиг. 3 показана схематическая структура промежуточной плазмиды pOpti-FI6L-MluI. CMV promoter - промотор/энхансер ранних генов цитомегаловируса человека, L -ген легкой цепи антитела к гемагглютинину вируса гриппа А (ВГА), EMCV IRES -внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита, DHFR - ген дигидрофолатредуктазы, ТК рА - сигнал полиаденилирования тимидинкиназы вируса герпеса, MluI, NheI, XhoI - сайты узнавания соответствующих рестриктаз.
На Фиг. 4 показана кодирующая последовательность вариабельного домена тяжелой цепи антитела FI6 с секреторным пептидом (двойное подчеркивание) и местами расположения праймеров (выделены курсивом). Подчеркнуты сайт узнавания рестриктаз NheI, PstI, Bsp120I и SacI. Приведена аминокислотная последовательность вариабельного домена тяжелой цепи антитела FI6.
На Фиг. 5 показана структура промежуточной плазмиды pcDNA3.3-FI6HG1. CMV promoter - промотор/энхансер ранних генов цитомегаловируса человека, ТК рА - сигнал полиаденилирования тимидинкиназы вируса герпеса, FI6HG1 - ген тяжелой цепи антитела FI6 изотипа IgG1, Psv40 - промотор ранних генов вируса SV40, SV40 рА - сигнал полиаденилирования ранних генов вируса SV40, Neomycin - ген устойчивости к антибиотику генетицину, NheI, XhoI - сайты узнавания соответствующих эндонуклеаз рестрикции.
На Фиг. 6 показана структура полученной промежуточной плазмиды pSK-EF1-FI6HG1-BGH. hEF1-HTLV promoter - гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1a и 5'-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV, BGH - сигнал полиаденилирования BGH из плазмиды pBudCE4.1, FI6HG1 - ген тяжелой цепи антитела FI6 изотипа IgG1, MluI, NheI, XhoI - сайты узнавания соответствующих эндонуклеаз рестрикции.
На Фиг. 7 показана структура полученной промежуточной плазмиды pSK-EF1-FI6HA1-BGH. hEF1-HTLV promoter - гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1a и 5'-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV, BGH - сигнал полиаденилирования BGH из плазмиды pBudCE4.1, FI6HA1 - ген тяжелой цепи антитела FI6 изотипа IgA1, MluI, NheI, XhoI - сайты узнавания соответствующих эндонуклеаз рестрикции.
На Фиг. 8 показана структура полученных плазмид pBiPr-ABIgA1FI6-hh и pBiPr-ABIgA1FI6-ht. hEF1-HTLV promoter - гибридный промотор из плазмиды pMG, состоящий из промотора фактора элонгации EF-1a и 5'-нетранслируемой области вируса Т-клеточной лейкемии человека HTLV, FI6HA1 - ген тяжелой цепи антитела FI6 изотипа IgA1, BGH -сайт полиаденилирования BGH из плазмиды pBudCE4.1, CMV promoter – промотор/энхансер ранних генов цитомегаловируса человека, L - ген легкой цепи антитела к гемагглютинину вируса гриппа А (ВГА), EMCV IRES - внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита, DHFR - ген дигидрофолатредуктазы, TK рА - сигнал полиаденилирования тимидинкиназы вируса герпеса, MluI, NheI, XhoI - сайты узнавания соответствующих эндонуклеаз рестрикции.
На Фиг. 9 показано сравнение экспрессии рекомбинантного IgA1 антитела при использовании для трансфекции би-плазмидной системы, где тяжелая и легкая цепь антитела клонированы в различные вектора для проведения ко-трансфекции, с трансфекцией с использованием новой би-промоторной плазмиды, где обе цепи клонированы в один вектор. Продукция антител дана для культивирования клеток в статическом режиме в малых объемах на 10 и 14 день культивирования.
На Фиг. 10 показано влияние различной ориентации генов тяжелой и легкой цепей («голова-голова» и «голова-хвост») в экспрессионных плазмидах для продукции рекомбинантных антител к гемагглютинину вируса гриппа А (ВГА) изотипа IgA1 в клеточной линии СНО DG44. IgA1(HH) - pBiPr-ABIgA1FI6-hh, IgA1(HT) - pBiPr-ABIgA1FI6-ht.
Осуществление изобретения
В частном варианте воплощения настоящего изобретения указанная плазмида pBiPr-ABIgA1FI6-ht может представлять собой плазмиду, кодирующую полипептиды со свойствами тяжелой и легкой цепей человеческого антитела к гемагглютинину вируса гриппа А (ВГА) изотипа IgA1 с молекулярной массой 2,83 Md (7,596 т.п.о.), и, например, состоять из:
фрагмента плазмиды pOptiVEC™-TOPO® длиной 4,402 т.п.о., включающего промотор/энхансер ранних генов цитомегаловируса человека (CMV), обеспечивающий высокий уровень экспрессии целевых белков в клетках млекопитающих, внутренний сайт связывания рибосом (IRES) вируса энцефаломиокардита (EMCV) для кэп-независимой трансляции гена ДГФР, ген ДГФР для ауксотрофной селекции трансфецированных клеток СНО DG44 и геномной амплификации стабильных клеточных линий с использованием метатрексата, сигнал полиаденилирования тимидинкиназы вируса герпеса ТК рА для правильной терминации и процессинга рекомбинантных транскриптов, сайт начала репликации в Е. coli из плазмиды pUC, ген β-лактамазы, а также следующие модификации - единичный сайт узнавания рестриктазы MluI вместо сайта узнавания рестриктазы Sall в положении 23, единичные сайты узнавания рестриктаз NheI и XhoI после промотора CMV для клонирования кДНК легкой цепи антитела;
NheI/XhoI - фрагмента ДНК длиной 0,779 т.п.о., включающего фланкированную сайтами рестрикции NheI и XhoI кДНК легкой каппа цепи человеческого антитела к гемагглютинину вируса гриппа А (ВГА);
MluI/MluI - фрагмента ДНК длиной 2,395 т.п.о., включающего гибридный промотор hEFl-HTLV из плазмиды pMG, ген тяжелой цепи человеческого антитела к гемагглютинину вируса гриппа А (ВГА) изотипа IgA1 и сигнал полиаденилирования гена фактора роста быка BGH polyA из плазмиды pBudCE4.1. Фрагмент ориентирован так, что транскрипция с промоторов hEFl-HTLV и CMV идет однонаправленно.
Способом согласно настоящему изобретению является способ получения полноразмерного человеческого антитела к гемагглютинину вируса гриппа А (ВГА) изотипа IgA1, включающий выращивание трансформированных клеток эукариот в питательной среде и выделение полученных антител из культуральной жидкости. В настоящем изобретении выращивание, накопление и очистка антител из культуральной жидкости может быть осуществлена методом, сходным с традиционными методами ферментации, когда некий белок производится с использованием трансформированных клеток.
Выращивание клеток эукариот осуществляют в атмосфере 8% СО2 в СО2-инкубаторе при 37°С и 96% влажности в режиме культивирования с перемешиванием в синтетических средах, таких как среда OptiCHO или среда CD DG44 (Invitrogen, USA), в течение 3-6 суток.
После выращивания твердые компоненты, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрации с использованием мембраны, а затем антитела могут быть выделены и очищены методом осаждения с солями, с использованием сульфата натрия или сульфата аммония, аффинной хроматографии, ионообменной хроматографии и т.п.
Предложенная рекомбинантная плазмида pBiPr-ABIgA1FI6-ht и способ получения линии культивируемых клеток СНО, основанный на использовании рекомбинантной плазмиды pBiPr-ABIgA1FI6-ht, впервые получены авторами данного изобретения, в научной и патентной литературе не описаны. Кроме того, нуклеотидная последовательность вариабельных доменов тяжелой и легкой цепей антитела FI6 получена отличным от прототипа способом и отличается от опубликованной в прототипе, так как адаптирована для прокариотической и эукариотической экспрессии по частотам встречаемости кодонов, а также сайтам узнавания рестриктаз. Также большая часть использованных праймеров впервые разработана для получения данной плазмиды и ранее не встречались в литературе.
Ниже следуют примеры осуществления предлагаемого изобретения.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pBiPr-ABIgA1FI6-ht
Пример 1a. Конструирование промежуточной рекомбинантной плазмидной ДНК pOpti-FI6L-MluI.
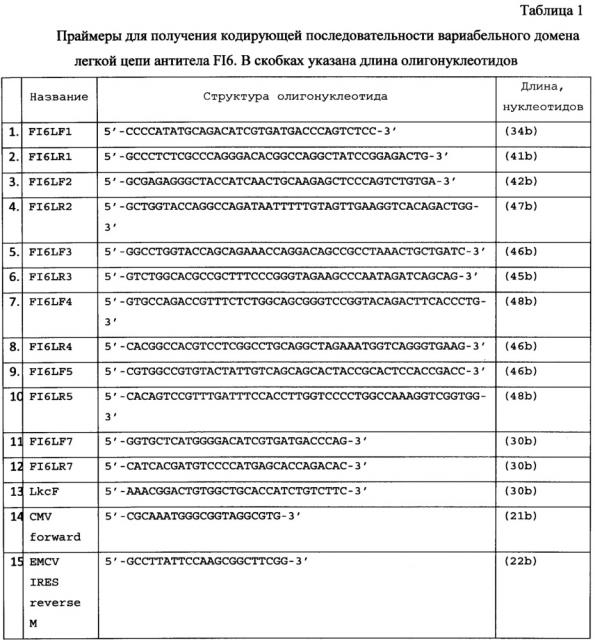
Кодирующая последовательность вариабельного домена легкой цепи антитела FI6 [Corti D., Voss J., Gamblin S.J., Codoni G., Macagno A., Jarrossay D., Vachieri S.G., Pinna D., Minola A., Vanzetta F., Silacci C, Fernandez-Rodriguez B.M., Agatic G., Bianchi S., Giacchetto-Sasselli I., Calder L., Sallusto F., Collins P., Haire L.F., Temperton N., Langedijk J.P., Skehel J.J. and Lanzavecchia A. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins. // Science 333 (6044), 850-856 (2011). PUBMED 21798894] была составлена, исходя из аминокислотной последовательности легкой цепи антитела FI6, частот встречаемости кодонов в прокариотах и эукариотах и наличия сайтов узнавания рестриктаз. Для получения кодирующей последовательности используются частично перекрывающиеся олигонуклеотидные праймеры (структура праймеров приведена в Таблице 1). Расположение праймеров на нуклеотидной последовательности вариабельного домена легкой цепи антитела FI6 приведено на Фиг. 2). Данные олигонуклеотидные праймеры (кроме CMV forward и EMCV IRES reverse М) разработаны для получения составленной последовательности и ранее в литературе не встречались. Олигонуклеотиды (FI6LF1 и FI6LR1, FI6LF2 и FI6LR2, FI6LF3 и FI6LR3, FI6LF4 и FI6LR4, FI6LF5 и FI6LR5) попарно смешивают в эквимолярных количествах и проводят ПЦР с полимеразой Pfu с циклом (94°С - 2 min, потом 25 циклов: 94°С - 30 сек, 40°С - 40 сек, 72°С - 40 сек). В первом раунде достраивают комплементарные концы дуплексов. Во втором раунде достроенные олигонуклеотиды смешивают и используют в качестве матрицы для ПЦР с концевыми праймерами FI6LF7 и FI6LR5 (с полимеразой Pfu, цикл амплификации тот же), получая фрагмент LvT (354 пары оснований).
Праймеры CMV forward и EMCV IRES reverse М (№№14 и 15) являются коммерческими, остальные синтезированы для этой работы и ранее в литературе не встречались.
На матрице плазмиды pOpti-F10L-MluI [Балабашин Д.С., Зайцева-Зотова Д.С., Топорова В.А., Панина А.А., Марквичева Е.А., Свирщевская Е.В., Алиев Т.К. Способы увеличения продукции рекомбинантных антител в клеточных линиях СНО DG44 // Современные проблемы науки и образования. - 2011. - №5.] [Алиев Т.К., Балабашин Д.С., Долгих Д.А., Кирпичников М.П., Панина А.А., Топорова В.А. Рекомбинантная плазмидная ДНК, кодирующая химерное антитело против фактора некроза опухоли-альфа человека, линия экуариотических клеток - продуцент химерного антитела и способ получения химерного антитела. Патент №2555533 http://www.findpatent.ru/patent/255/2555533.html © FindPatent.ru - патентный поиск, 2012-2016] с помощью ПЦР с полимеразой Pfu со специфическими олигонуклеотидными праймерами (CMV forward и FI6LR7, LkcF и EMCV IRES reverse М, соответственно) получают фрагменты LlidT1 (253 пары оснований), содержащий секреторный пептид легкой цепи антитела F10 и сайт узнавания рестриктазы NheI на 5'-конце фрагмента, и LcT1 (474 пары оснований), содержащий кодирующую последовательность константной области легкой цепи типа каппа с сигналом полиаденилирования и сайтом узнавания рестриктазы XhoI на 3'-конце. Реакцию проводят в следующем температурном режиме: денатурация - 94°С, 30 сек; отжиг - 50°С, 40 сек; элонгация - 72°С, 2 мин; 30 циклов. Фрагменты очищают с помощью электрофореза в 1% легкоплавкой агарозе и выделения фрагментов из геля.
Кодирующую последовательность легкой цепи получают методом SOE-ПЦР на матрице фрагментов LlidT1, LvT и LcT1 с перекрывающимися концами с полимеразой Pfu со специфическими олигонуклеотидными праймерами CMV forward и EMCV IRES reverse М, при этом на 5'-конец гена вводят сайт узнавания рестриктазы NheI, а на 3'-конец - сайт XhoI. После обработки ПЦР-фрагмента соответствующими рестриктазами кодирующую последовательность легкой цепи человеческого антитела FI6 клонируют в вектор pOpti-F10L-MluI по сайтам узнавания рестриктаз NheI и XhoI.
Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных клонов промежуточной рекомбинантной плазмидной ДНК pOpti-FI6L-MluI секвенированием по двум цепям по методу Сэнгера. Структура полученной промежуточной плазмиды pOpti-FI6L-MluI приведена в Фиг. 3.
Пример 1б. Конструирование промежуточной рекомбинантной плазмиды pAL-2T-IgA1.
Наиболее эффективным способом получения константного домена тяжелой цепи изотипа IgA1 является амплификация экзонов соответствующего гена с использованием хромосомной ДНК в качестве матрицы. Ген находится в кластере генов иммуноглобулинов в области 14q32.33 хромосомы 14 человека и содержит три экзона.
Анализ последовательностей на наличие сайтов узнавания рестриктаз показывает, что последовательность IgA1 не содержит сайт узнавания рестриктазы SacI, что можно использовать для подстыковки гена к кодирующей последовательности вариабельного домена тяжелой цепи антитела FI6 (в конце гена FI6VHv3A находится сайт узнавания рестриктазы SacI). Сайт SacI и последовательность CG для восстановления рамки считывания вносятся на 5'-конец