Применение лизата пробиотической бактерии для улучшения и/или восстановления барьерной функции кожи
Иллюстрации
Показать всеГруппа изобретений относится к применению лизата пробиотической бактерии. Лизат пробиотической бактерии Lactobacillus rhamnosus GG ATCC 53103 или Lactobacillus reuteri ATCC 55730 или Bifidobacterium longum ATCC 51870 применяют для местного нанесения на кожу для улучшения и/или восстановления барьерной функции кожи. Указанный лизат применяют в способе улучшения и/или восстановления барьерной функции кожи, включающем местное введение лизата в кожу субъекта. Указанный лизат используют для улучшения и/или восстановления барьерной функции кожи в составе косметической композиции, фармацевтической композиции для местного применения, композиции, составленной для введения в кожу. Также указанный лизат используют в составе противобактериальной композиции для применения при инфекциях Staphylococcus. Группа изобретений обеспечивает увеличение и восстановление барьерной функции кератиноцитов. 6 н. и 16 з.п. ф-лы, 20 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к пробиотическим бактериям и, в частности, хотя не исключительно, к медицинским и косметическим применениям пробиотических бактерий и их лизатов.
Уровень техники, предшествующий изобретению
Люди живут в постоянном контакте с множеством микроорганизмов. Кишечник, безусловно, является наиболее интенсивно колонизированным, и было показано, что микробиота кишечника играет множество ролей в нормальной физиологии, включая нутриентную секвестрацию (3) и развитие нормальных иммунных ответов (22).
В микробиоте нормального кишечника имеются так называемые пробиотические бактерии. Их прием внутрь, как было показано, предотвращает или лечит желудочно-кишечные нарушения, такие как ассоциированная с антибиотиком диарея (47) и воспалительные заболевания кишечника (42). Механизмы, лежащие в основе этих эффектов, являются по большей части неизвестными. Однако в ходе исследований было предположено, что пробиотики могут ингибировать колонизацию кишечника патогенами. В работе in vitro было предположено, что пробиотики используют различные механизмы для ингибирования патогенов, включая прямое конкурирование за связывающие участки на эпителиальных клетках (12) и конкурирование с патогенными бактериями за нутриенты. Пробиотические организмы также способны вырабатывать ингибирующие вещества, такие как бактериоцины (13) и органические кислоты (25), которые могут уничтожать или ограничивать рост патогенов. Отобранные пробиотики, такие как L. plantarum 299v, как было показано, повышающе регулируют выработку муцина эпителиальными клетками, тем самым предотвращая прикрепление патогена (33). Пробиотики могут также вырабатывать биологические поверхностно-активные вещества, которые позволяют прикрепление пробиотика, при этом ингибируя прикрепление патогенных бактерий к клеткам (43).
В отличие от кишечника очень мало известно о нормальных взаимодействиях между кожной микрофлорой и эпидермисом. Недавняя работа предполагает, что кожные симбионты могут также быть способны ограничивать колонизацию кожи патогенными бактериями (48). Исследования также предполагают, что некоторые кожные заболевания (такие как вульгарные угри и атопический дерматит) могут быть связаны с разрушениями нормальной микрофлоры (4, 6, 8). Следовательно, было уделено некоторое внимание концепции, заключающейся в том, что кожная микрофлора может подвергаться модуляции с применением специфических кожных симбионтов для стимулирования здоровья или ингибирования заболевания (30, 31). Однако кожные симбиотические бактерии могут также являться патогенными при некоторых обстоятельствах (16). В отличие от этого, пробиотики, как правило, считаются безопасными (GRAS) и, следовательно, такие бактерии потенциально могут быть применены местно, если они имеют терапевтическое значение (17). К настоящему времени ограниченное количество исследований в этой области предполагает, что общепринятые пробиотические бактерии могут иметь существенное значение при применении на кожу. Например, местное нанесение лизата B. longum reuter, как было показано, индуцирует клиническое улучшение "реактивной кожи". Это представляет собой кожу, которая более чувствительна к физическим изменениям, таким как атмосферная температура, и к химическим изменениям, таким как наблюдаемые с наносимыми местно продуктами (20). Было показано, что нанесение лизата B. longum на кожу добровольцев снижает чувствительность и снижает трансэпидермальную потерю влаги (TEWL) после соскоба липкой лентой. Дополнительно, было показано, что нанесение лизата на кожу ex-vivo снижает признаки воспаления, такие как вазодилатация, эдема и высвобождение TNF-α (20). Также было продемонстрировано, что местное нанесение L. plantarum улучшает восстановление тканей в мышиной модели ожога и предотвращает инфекцию в хронических ножных язвах и ожогах у людей (40, 41, 46). Однако в целом механизмы, лежащие в основе этих эффектов, не известны.
Staphylococcus aureus является кратковременным колонизатором кожи преимущественно во влажных, теплых участках тела, таких как пах, подмышечная впадина и ноздри (28). Вплоть до 60% людей являются периодическими носителями, тогда как 20% людей могут являться стабильно колонизированными (28). Хотя нормальное носительство является бессимптомным, S. aureus может проникать в ткани (например, через разрушенную кожу), где она вызывает заболевания, варьирующиеся от относительно небольшого импетиго и токсического эпидермального некролиза до угрожающих жизни состояний, таких как септицемия (29). Кроме того, S. aureus инфекция часто является вторичным явлением в коже с соответствующими состояниями, такими как атопический дерматит (27).
Плотные сочленения (tight junctions, TJ) являются многобелковыми комплексами, заполняющими параклеточное пространство между смежными эпителиальными клетками и ограничивающими транспорт через этот путь для маленьких гидрофильных молекул и ионов (55). Трансэпителиальное электрическое сопротивление (Transepithelial electrical resistance, TEER) является мерой функционирования TJ (56, 57). Функция TJ часто отражается уровнями экспрессии конкретных белков, задействованных в комплексах. Главные белки TJ, экспрессруемые кератиноцитами, содержат клаудин 1, клаудин 4, ZO-1 и окклюдин.
В частности, изменения выражения уровней клаудинов, как было показано много раз ранее, связаны с изменениями в барьерной функции. К настоящему времени 24 клаудина млекопитающих были идентифицированы и их, как правило, разделяют на два класса: которые упрочняют барьер и которые формируют селективные поры (58). Несколько доказательств указывают на роль клаудинов 1 и 4 в качестве упрочняющих барьер клаудинов. В клеточных линиях сверхэкспрессия клаудина 1 повышала TEER и снижала проницаемость клеток для параклеточных маркеров. Клаудин 4 изолирует параклеточное пространство от прохождения ионов и посредством этого повышает TEER монослоев [59, 60]. Повышения экспрессии ZO-1 увеличивают TEER клеток A431 (61) и гормон GLP1 также увеличивает функцию TJ в клетках caco-2 повышением экспрессии ZO-1 и окклюдина (62). Наличие TJ в коже было открыто лишь относительно недавно. Следовательно, в настоящее время вклад конкретных видов белков TJ в барьерную функцию кожи остается по большей части неизвестным. Однако, известно, что генетическая потеря клаудина 1 является смертельной для мышей (63).
Кератиноциты воспринимают наличие бактерий посредством образ-распознающих рецепторов, таких как толл-подобные рецепторы (TLR). Несколько линий наблюдения указывало на то, что в кишечнике имеет место зависимость между активацией TLR и изменением барьерной функции TJ. Недавняя работа Yuki et al. (53) продемонстрировала TLR-опосредованную аугментацию функции TJ в кератиноцитах в ответ на бактериальные лиганды, такие как пептидогликан.
WO 2011/029784 описывает противовоспалительное действие штамма Lactobacillus rhamnosus штамма LMG P-25211 на коже, и применение в предотвращении или обработке воспалительных или аллергических кожных состояний.
WO 2010/056198 описывает препараты, пригодные для лечения индуцированных стафилококком инфекций, которые содержат комбинацию одного или более жизнеспособных штаммов α-стрептококка и одного или более жизнеспособных штаммов молочнокислой бактерии, выбранных из групп из Lactobacillus rhamnosus штамма LB21, Lactobacillus plantarum штамма LB3, Lactobacillus plantarum штамма LB7.
WO 2006/000992 описывает косметические виды лечения, предназначенные для предотвращения и/или обработки сухой или чувствительной кожи, где пробиотический микроорганизм, часть или его метаболит комбинируется с по меньшей мере одним двухвалентным неорганическим катионом.
Marsella et al (Veterinary Immunology and Immunopathology 146 (2012) 185-189) описывает иммуномодуляторные эффекты орального введения Lactobacillus rhamnosus GG в модели аллергического/атопического дерматита.
EP 2161329A1 описывает иммуномодуляторные эффекты экстрактов из молочнокислых бактерий и описывает применение в лечении воспалительных нарушений.
Hoang et al (Inflammation & Allergy - Drug Targets, 2010, 9, 192-196) описывает применение орально вводимого клеточного лизата Lactobacillus rhamnosus в качестве ежедневного иммунобиотического дополнения в лечении атопической экземы.
WO 2011/045471 описывает применение Lactobacillus rhamnosus GG в комбинации с Lactobacillus rhamnosus LC705 для применения в лечении респираторной инфекции, в частности для применения против вирусов, вызывающих респираторные инфекции, например, вирус гриппа.
Сущность изобретения
Изобретение относится к пробиотическим бактериям и их лизатам для применения в способах медицинского лечения, в способах косметического лечения и для применения в качестве противобактериального агента. Раскрыты применение в лечении инфекций, включая кожные инфекции, и способы, содержащие регенерацию или восстановление кожного барьера.
Изобретение относится к пробиотической бактерии для применения в способе лечения. Пробиотическая бактерия может быть представлена в виде лизата. В предпочтительных вариантах осуществления пробиотическая бактерия является штаммом L. rhamnosus, L. reuteri или Bifidobacterium longum. Предпочтительно, пробиотическая бактерия является L. rhamnosus GG. L. rhamnosus GG депонирована в ATCC под номером доступа 53103. Способ лечения может содержать введение L. rhamnosus GG пациенту. Способ может содержать введение L. rhamnosus GG в кожу пациента. Способы по изобретению приводят к лечению или облегчению состояния пациента, подвергающегося лечению.
В некоторых вариантах осуществления способ медицинского лечения является способом лечения или предотвращения инфекции, например, бактериальной инфекции, такой как инфекция стафилококком. Инфекция может являться инфекцией Staphylococcus aureus. Инфекция может являться кожной инфекцией. Пробиотическая бактерия, лизат или композиция может быть введена отдельно, последовательно или одновременно с инфекционным агентом, например, на рану или другое повреждение в кожном барьере.
В некоторых вариантах осуществления (или дополнительно) способ медицинского лечения является способом, содержащим восстановление или регенерацию кожного барьера. В способах, включающих восстановление или регенерацию кожного барьера, пробиотическая бактерия может являться штаммом L. rhamnosus, L. reuteri или Bifidobacterium longum. Пробиотическая бактерия может являться L. rhamnosus GG. В этих способах два различных штамма пробиотической бактерии могут быть введены в одном и том же способе лечения, например, L. reuteri и L. rhamnosus GG могут быть введены совместно. Пробиотическая бактерия может быть введена живой, инактивированной или в виде лизата. Когда две или более пробиотических бактерии должны быть введены, одна или более могут быть введены в виде лизата.
Способы лечения, содержащие восстановление или регенерацию кожного барьера, могут содержать восстановление или регенерацию кожи после поражения.
Способы лечения, включающие восстановление или регенерацию кожного барьера могут быть пригодны в лечении псориаза, ихтиоза, дерматита, в заживлении ран, в лечении акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии или других нарушений, ассоциированных с разрушением или разрывом кожного барьера. Другие такие нарушения легко поддаются оценке специалисту в данной области. Предпочтительно, способы содержат введение пробиотической бактерии на кожу.
Изобретение дополнительно относится к применению пробиотической бактерии или ее лизата в производстве лекарственного препарата для лечения кожной инфекции и/или восстановлении или регенерации кожного барьера. Пробиотическая бактерия может представлять собой L. rhamnosus, L. reuteri или штамм Bifidobacterium longum. Это может представлять собой L. rhamnosus GG. Лекарственный препарат может содержать два или более штаммов пробиотической бактерии или может быть введен совместно с другим штаммом пробиотической бактерии или ее лизатом. Лекарственный препарат может быть пригоден в восстановлении или регенерации кожи после поражения или в лечении псориаза, ихтиоза, дерматита, заживлении ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикоза, дерматоза или эктодермальной дисплазии или других нарушений, ассоциированных с разрушением или разрывом кожного барьера. Другие такие нарушения легко будут определены специалистом в данной области.
Изобретение также относится к фармацевтической композиции, содержащей пробиотическую бактерию. Фармацевтическая композиция может содержать пробиотическую бактерию L. rhamnosus, такую как L. rhamnosus GG или L. reuteri, или может содержать пробиотическую бактерию Bifidobacterium longum. Фармацевтическая композиция может дополнительно содержать еще один другой штамм пробиотической бактерии, такой как одна из L. reuteri, L. rhamnosus GG или Bifidobacterium longum. Фармацевтическая композиция может содержать лизаты одного или более пробиотических бактериальных штаммов или смесь лизатов, живые или инактивированные пробиотические бактерии. Фармацевтическая композиция может быть составлена для введения в кожу пациента, нуждающегося в таком лечении.
Изобретение дополнительно относится к способам косметического лечения, содержащим введение пробиотической бактерии или ее лизата пациенту, или применению такой пробиотической бактерии или ее лизата в способе косметического лечения. Такие варианты осуществления не содержат лечение человека или животного организма посредством терапии или хирургии. В таких косметических способах пробиотическая бактерия предпочтительно содержит пробиотическую бактерию L. rhamnosus или ее лизат, например, пробиотическую бактерию L. rhamnosus GG или L. reuteri или ее лизат или пробиотическую бактерию Bifidobacterium longum или ее лизат. Способы могут содержать введение пробиотической бактерии в кожу пациента.
Изобретение также относится к косметическим композициям, содержащим пробиотик L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, Bifidobacterium longum или их лизаты. Косметическая композиция может содержать одну или более из пробиотической бактерии L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, Bifidobacterium longum или лизаты или одну, две или каждую из этих пробиотических бактерий.
Изобретение дополнительно относится к антибактериальным композициям, содержащим пробиотическую бактерию или ее лизат. Пробиотическая бактерия может представлять собой L. rhamnosus GG. Такие композиции могут быть пригодны для уничтожения или ингибирования действия или роста бактерий. Композиции могут быть пригодны для очистки или предварительной обработки поверхности, которая имеет или предполагается, что на ней имеются бактерии или вероятно подвержена воздействию бактерий. В некоторых вариантах осуществления антибактериальная композиция может быть составлена так, чтобы она не была пригодна для введения пациенту или субъекту.
Изобретение также относится к способам приготовления композиций, например, пригодных для терапевтического и/или косметического, и/или противобактериального применения. Способ может содержать подвергание популяции пробиотических бактерий лизису и составление полученного в результате лизата в композицию. Альтернативно, способ может содержать составление интактных бактерий в композицию. Способ может содержать этап обработки бактерий или лизата так, чтобы удалить или инактивировать интактные бактерии, например, выделением интактных бактерий из лизата. Лизат может быть подвержен этапу очистки или фильтрации, например, для удаления интактных бактерий, сред для бактериального роста или загрязняющих веществ.
Композиции, приготовленные таким способом, могут быть пригодны для применения в лечении, например, в обработке бактериальных инфекций или для восстановления кожного барьера. Такие способы могут содержать добавление одного или более фармацевтически или косметически приемлемых вспомогательных веществ. Другие композиции могут не быть пригодны для применения в лечении, например, противобактериальные композиции, такие как лосьоны.
Следующие пронумерованные параграфы (абзацы) содержат изложения обширного ряда комбинаций технических характеристик изобретения, изложенных в данном документе.
1. Пробиотическая бактерия или ее лизат для применения в способе лечения, в котором пробиотическая бактерия представляет собой Lactobacillus rhamnosus GG.
2. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 1, в котором способ лечения содержит введение пробиотической бактерии или ее лизата в кожу пациента, подвергаемого лечению.
3. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 1 или параграфом 2 для применения в способе лечения или предотвращения инфекции.
4. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 3, в котором инфекция содержит бактериальную инфекцию.
5. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 4, в котором бактериальная инфекция представляет собой инфекцию стафилококком, предпочтительно инфекцию S. aureus.
6. Пробиотическая бактерия или ее лизат для применения в соответствии с любым из предшествующих параграфов, в котором способ лечения предназначен для кожной инфекции.
7. Пробиотическая бактерия или ее лизат для применения в способе лечения, включающем восстановление или регенерацию кожного барьера, в котором пробиотическая бактерия представляет собой пробиотическую бактерию L. rhamnosus или L. reuteri.
8. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 7, в котором способ содержит введение пробиотической бактерии или ее лизата в кожу.
9. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 7, в котором пробиотическая бактерия представляет собой L. rhamnosus GG.
10. Пробиотическая бактерия для применения в соответствии с любым из параграфов 7-9, в котором способ предназначен для лечения псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
11. Пробиотическая бактерия для применения в соответствии с любым из предшествующих параграфов, в котором пробиотическую бактерию вводят совместно с пробиотической бактерией другого штамма или ее лизатом.
12. Пробиотическая бактерия или ее лизат в соответствии с любым из предшествующих параграфов, в котором способ лечения содержит совместное введение с L. reuteri или ее лизатом.
13. Фармацевтическая композиция, содержащая L. rhamnosus GG или ее лизат.
14. Фармацевтическая композиция в соответствии с параграфом 13, дополнительно содержащая штамм пробиотической бактерии, отличный от L. rhamnosus, или ее лизата, в котором предпочтительно пробактерия штамма, отличного от L. rhamnosus, представляет собой L. reuteri.
15. Косметический способ, содержащий введение субъекту одной или более из пробиотической бактерии L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, или их лизатов.
16. Косметический способ в соответствии с параграфом 15, в котором пробиотическую бактерию или лизат вводят в кожу субъекта.
17. Косметическая композиция, содержащая пробиотическую бактерию L. rhamnosus или ее лизат и/или пробактерию L. reuteri или ее лизат.
18. Способ медицинского лечения, содержащий введение L. rhamnosus GG или ее лизата пациенту, посредством этого осуществляя лечение пациента.
19. Способ в соответствии с параграфом 18, в котором пробиотическую бактерию или ее лизат вводят в кожу пациента.
20. Способ медицинского лечения в соответствии с параграфом 18 или параграфом 19, дополнительно содержащий введение пробиотической бактерии, отличной от L. rhamnosus GG или ее лизата, пациенту, в котором пробиотическая бактерия, отличная от L. rhamnosus, предпочтительно представляет собой L. reuteri.
21. Способ медицинского лечения в соответствии с параграфом 18, в котором медицинское лечение представляет собой лечение или предотвращение инфекции.
22. Способ медицинского лечения в соответствии с любым из параграфов 18-21, в котором медицинское лечение представляет собой лечение или предотвращение инфекции кожи, и в котором кожная инфекция подвергается лечению или ослабляется после лечения.
23. Способ медицинского лечения, содержащий введение L. rhamnosus, L. rhamnosus GG или L. reuteri пациенту, нуждающемуся в этом, в котором лечение осуществляется для восстановления или регенерации кожного барьера, в котором кожный барьер восстанавливается или регенерируется после лечения.
24. Способ медицинского лечения в соответствии с параграфом 23, в котором L. rhamnosus, L. rhamnosus GG или L. reuteri вводят в кожу пациента.
25. Способ в соответствии с параграфом 22 или параграфом 23, в котором способ лечения предназначен для псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
26. Применение пробиотической бактерии или ее лизата в производстве лекарственного препарата для применения в лечении инфекции, в котором пробиотическая бактерия представляет собой L. rhamnosus GG.
27. Применение пробиотической бактерии или ее лизата в производстве лекарственного препарата для применения в лечении, в котором лечение включает восстановление или регенерацию кожного барьера и в котором пробиотическая бактерия представляет собой пробиотическую бактерию L. rhamnosus или L. reuteri.
28. Применение в соответствии с параграфом 26 или параграфом 27, в котором лекарственный препарат составляют для введения в кожу.
29. Применение в соответствии с параграфом 28, в котором способ предназначен для лечения псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
30. Применение пробиотической бактерии или лизата в соответствии с любым из параграфов 26-29, в котором лечение включает совместное введение более чем одной пробиотической бактерии или ее лизата.
31. Лизат L. rhamnosus GG.
32. Композиция, составленная для введения в кожу и содержащая L. rhamnosus GG, L. rhamnosus и/или L. reuteri или лизат одной или более из указанных бактерий.
33. Противобактериальная композиция, содержащая L. rhamnosus GG или ее лизат.
Описание предпочтительных вариантов осуществления
Изобретение содержит комбинацию аспектов и описанные предпочтительные свойства, за исключением случаев, когда комбинация является очевидно невозможной или ее однозначно следует избегать.
Заголовки разделов, применяемые в данном документе, предназначены только для целей организации и не должны рассматриваться как ограничивающие описываемый субъект изобретения.
Аспекты и варианты осуществления данного изобретения далее будут проиллюстрированы посредством примеров, ссылаясь на прилагаемые фигуры. Дополнительные аспекты и варианты осуществления будут очевидны специалисту в данной области. Все документы, упомянутые в тексте, включены в данный документ посредством ссылки.
Кожа является первичным барьером между организмом и окружающей средой. Она должна как предотвращать инвазию патогенов, так и в то же время предотвращать потерю воды и электролита из организма. До настоящего времени считалось, что барьерная функция кожи является исключительно ролью рогового слоя. Однако, комплексы, известные как плотные сочленения, также являются критичными для барьерной функции кожи. Изредка барьер кожи поврежден из-за ран или царапин. В этих случаях кожа должна восстановиться сама. Однако изредка восстановление не происходит достаточно быстро и в результате этого кожа остается открытой для инфекции. Авторы изобретения проскринировали диапазон пробиотических бактерий на их способность к:
1) защите кожи от вредного патогена Staphyloccus aureus (включая устойчивые к метициллину штаммы)
2) стимулированию регенерации и улучшения барьерной функции клеток кожи.
Авторы идентифицировали штамм пробиотической бактерии (L. rhamnosus GG) с защитными и регенерирующими свойствами клеток кожи. Что показательно, лизаты этого штамма улучшают способность кератиноцитов кожи противодействовать опасной токсичности, индуцированной S. aureus (SA) (Фиг. 9A). При применении в комбинации с лизатом второго штамма (L. reuteri), комбинация является даже более эффективной в защите против S. aureus, чем когда какой-либо из штаммов применяется отдельно (Фиг. 9B). Авторы также продемонстрировали, что когда кератиноцитные монослои поцарапаны для удаления клеток (т.е. модельная рана), наличие свойства по изобретению у пробиотических лизатов значительно и неожиданно ускоряет восстановление монослоя и повторное установление барьера (Фиг. 10).
Агенты, которые увеличивают и восстанавливают барьерную функцию кератиноцитов, являются весьма перспективными не только в качестве терапевтических агентов, но также в качестве косметических улучшающих кожу средств. Увеличение барьерной функции увеличивает уровень гидратации кожи и известно, что он улучшает внешний вид кожи и приводит к более здоровому косметическому внешнему виду.
Наблюдения авторов расширяют полезность и применение пробиотиков. Первоначальные наблюдения авторов указывают на то, что пробиотики могут быть использованы в ряде применений в уходе за кожей, которые включают: заживление ран, технологию покрытий для раневых повязок, кремы с улучшенным кожным барьером для косметических и терапевтических применений (например, атопический дерматит); противобактериальные продукты, такие как лосьоны для рук и мыла, и косметические препараты, направленные на поддержание/восстановление барьерной функции кожи, и видах лечения для восстановления разрушенного барьера из-за воздействия солнца и старения.
С возможностью предотвращения пагубных эффектов вредных бактерии и одновременного активного восстановления разрушенного кожного барьера коммерческие применения пробиотиков в уходе за кожей имеют большое значение. Для все большего количества людей требуется естественные, безопасные и эффективные виды лечения для общего выравнивания кожи, и технология авторов изобретения представляет значительный прогресс в удовлетворении этих потребностей рынка.
Технология авторов изобретения может не только предоставить новое терапевтическое средство для установления/восстановления кожного барьера, но может устранить потребность в существующих агрессивных методах терапии, например, в антибиотиках. В настоящее время предотвращающие способы содержат противобактериальные агенты, которые, несмотря на то, что являются эффективными, имеют ряд пагубных эффектов. Лечение основано на применении антибиотика для уничтожения вредных бактериальных инфекций. Подход авторов изобретения не только ингибирует вредные кожные патогены, но и активно стимулирует восстановление барьера на клеточном уровне. Так как снижение барьерной функции/восстановления неразрывно связано со сниженной способностью к сдерживанию инфекции, лизат авторов изобретения предоставляет технологию, которая увеличивает как барьер, так и его способность к защите против патогенов.
В настоящее время на рынке существует совсем немного продуктов с живым бактериями в качестве компонентов (например, косметический ряд живых кожных пробиотиков Nude). Подход с очищенным лизатом авторов изобретения имеет ряд функциональных и коммерческих преимуществ по сравнению с другими, что выражается в представлении контролируемой и определяемой активности при низких концентрациях; повышенной стабильности и облегченного производства; и улучшенного срока хранения. Все это в совокупности делает технологию авторов изобретения более пригодной для терапевтических и косметических применений в отличие от сложных в изготовлении и распространении живых бактериальных кремов.
Краткое описание фигур
Варианты осуществления и эксперименты, иллюстрирующие принципы изобретения, описаны далее со ссылками на прилагаемые фигуры, в которых:
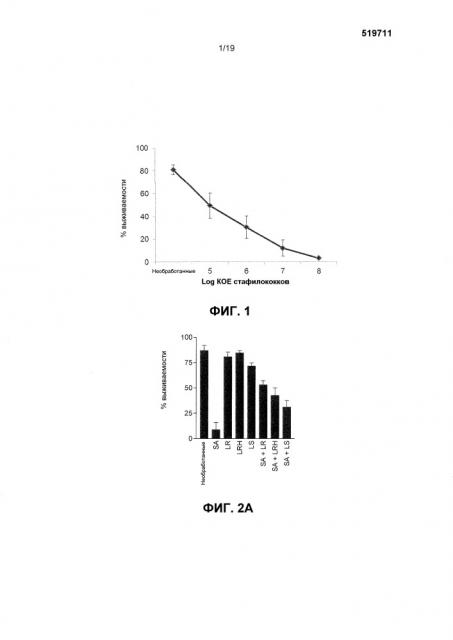
Фиг. 1. График, показывающий, что S. aureus обладает дозозависимыми эффектами на жизнеспособность кератиноцитов. Неинфицированные клетки имели жизнеспособность 81,2±4,1%. Клетки, подвергаемые 105 КОЕ/мл S. aureus, имели жизнеспособность 49,4±11,1%. Клетки, подвергаемые 106 КОЕ/мл S. aureus, имели жизнеспособность 30,5±9,8%. Клетки, подвергаемые 107 КОЕ/мл S. aureus, имели жизнеспособность 12,1±1,1%, тогда как клетки, подвергаемые 108 КОЕ/мл S. aureus, имели жизнеспособность 3,3±1,1%. Анализ линейной регрессии подтвердил линейную зависимость между концентрацией и процентной жизнеспособностью (p<0,001). Результаты выражены как среднее ± SEM.
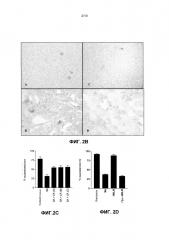
Фиг. 2. Молочнокислые бактерии защищают кератиноциты от цитотоксических эффектов S. aureus. (A) График, показывающий процентную жизнеспособность для неинфицированных NHEK (86,9±5,1%) и NHEK, инфицированных с 108 КОЕ/мл S. aureus (SA), (8,8±7,1%) L. reuteri (LR), (80,8±4,5%); L. rhamnosus (LRH), (84,8±2,1%) L. salivarius (LS), (71,7±2,9%) S. aureus и L. reuteri (SA+LS), (53,1±4,2%) S. aureus и L. rhamnosus (SA+LRH), (42,7±7,4%) и S. aureus и L. salivarius (SA+LS) (31,1±6,5%). (B) Репрезентативные изображения инфицированных клеток, окрашенных трипановым синим (Увеличение ± 200). A) без обработки, B) инфицированные с 108 КОЕ/мл S. aureus, C) подверженные 108 КОЕ/мл L. reuteri, или D) инфицированные с 108 КОЕ/мл S. aureus и 108 КОЕ/мл L. reuteri одновременно. (C) График, показывающий жизнеспособность клеток, инфицированных или с 106 S. aureus (SA) (31,6±4,1%), или с S. aureus и 106 L. reuteri (A) (54,8±2,7%), S. aureus и 107 L. reuteri (B) (55,4±4,3%) и S. aureus и 108 L. reuteri (C) (56,2±4,1%) (D) График, показывающий, что кератиноциты, подверженные S. aureus (SA), имели сниженные жизнеспособности 37,4±1,3% по сравнению с контролями (92±1,9%), тогда как кератиноциты, подверженные убитой нагреванием L. reuteri (HKLR), имели небольшое изменение жизнеспособности (88,3±3,3%). Кератиноциты, предварительно подверженные убитой нагреванием L. reuteri (Pre-HKLR), имели жизнеспособности, подобные подверженным S. aureus кератиноцитам (33±2,1%). (E) График, показывающий, что лизат L. reuteri (Лизат LR) был способен защищать кератиноциты, P=0,01. Клетки, подвергаемые S. aureus (SA) отдельно, имели значительно более низкую жизнеспособность (38,3±4,7 log КОЕ), чем клетки, предварительно подверженные лизату L. reuteri (пре-лизат)(57,7±2,4 log КОЕ). Результаты выражены, как среднее ± SEM.
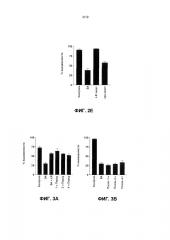
Фиг. 3. L. reuteri защищает только кератиноциты при добавлении перед инфекцией S. aureus. (A) График, показывающий, что процентная жизнеспособность была значительно выше в клетках, которые были коинфицированы (SA+LR) (57,1±2, P=0,0016) и предварительно подвергались в течение 1 (1 ч перед) (63,6±5,6%, P=0,0003), 2 (2 ч перед) (56,1±1,2%, P=0,0022) и 4 часов (4 ч перед) L. reuteri (52,4±4,1%, P=0,0066) по сравнению с инфицированными S. aureus (SA) клетками (29,8±3,8). (B) График, показывающий, что не было значительного различия между жизнеспособностью клеток, обрабатываемых с L. reuteri 1 (после 1 ч) (25,8±0,6%), 2 (после 2 ч) (29,3±2,6%) или 4 часов (после 4 ч) (33,57±4,9%), после того как инфекция началась, и клетками, которые были инфицированы с S. aureus (SA) отдельно (29,9±3,4%) (P>0,05). Результаты выражены как среднее ± SEM.
Фиг. 4a. L. reuteri не ингибирует рост S. aureus в совместной культуре. График, показывающий результаты конкурентного анализа, выявляющего отсутствие значительного различия между группами с течением времени (P=0,146).
Фиг. 4b (Таблица 1). L. reuteri не воздействует на стафилококковую жизнеспособность в клеточной культуре. S. aureus, выращиваемая в отсутствие клеток, имела счет жизнеспособности 8,0 (log КОЕ). S. aureus, выращиваемая в присутствии кератиноцитов, имела счет жизнеспособности 8,6±0,2. S. aureus, инкубированная совместно с L. reuteri в отсутствие клеток, имела счет жизнеспособности 8,4±0,4, хотя S. aureus, инкубированная совместно с L. reuteri в присутствии клеток, имела счет жизнеспособности 8,0±0,2. Не было обнаружено значительного различия между группами (P=0,34). Результаты выражены как среднее ± SEM.
Фиг. 5. L. reuteri ингибирует стафилококковую адгезию и инвазию кератиноцитов. Графики демонстрируют: (A) S. aureus адгезирует с приблизительно 5,5±0,3 log КОЕ/мл и L. reuteri адгезирует с приблизительно 6,2±0,1 log КОЕ/мл. (B) Вытеснение. Клетки, предварительно подверженные L. reuteri перед инфекцией S. aureus (Пре-LR), имели значительно меньше адгезированных к ним стафилококков (5,7±0,2 log КОЕ) по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (4,4±0,4 log КОЕ). (C) Конкурирование. Клетки, коинфицированные с L. reuteri (SA+LR), имели значительно меньше адгезированных к ним стафилококков (4,4±0,4 log КОЕ) по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (5,6±0,1 log КОЕ). (D) Замещение. Не имело место значительное различие в количестве адгезивных стафилококков на клетках, подвергаемых L. reuteri после того, как инфекция S. aureus началась (Пост-LR) (5,3±0,5 log КОЕ), по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (5,7±0,3 log КОЕ, P=0,47). (E) Клетки, коинфицированные с L. reuteri, имели значительно меньше интернализованных стафилококков (4,5±0,1 log КОЕ), чем клетки, инфицированные с S. aureus отдельно (6,1±0,1 log КОЕ). Результаты выражены как среднее ± SEM.
Фиг. 6. Убитая нагреванием L. reuteri не была способна ингибировать стафилококковую адгезию к кератиноцитам, но лизаты были способны. Графики демонстрируют: (A) Количество стафилококков, адгезивных к NHEK, при применении отдельно (SA) (6,5±0,2 log КОЕ), при добавлении после NHEK, предварительно подверженных живым L. reuteri (Pre-LR) (5,3±0,1 log КОЕ), и предварительно подверженных убитой нагреванием L. reuteri (Pre-HKLR) (6,1±0,3 log КОЕ). Клетки подвергали необработанной L. reuteri и имели значительно меньше стафилококков, связанных с ними (P=0,003), но клетки, подвергаемые убитой нагреванием L. Reuteri, не имели значительного различия в адгезивных стафилококках (P=0,09). (B) Количество стафилококков, адгезивных к NHEK при применении отдельно (SA) (6,3±0,1 log КОЕ), было значительно больше, чем при добавлении после того как NHEK были предварительно подвержены живым L. reuteri (PRE-LR) (5,6±0,2 log КОЕ, P=0,0002), и чем при предварительном подвергании лизатам L. reuteri (PRE-LYS) (6,0±0,2 log КОЕ, P=0,032). Результаты выражены как среднее ± SEM.
Фиг. 7. S. aureus использует интегрин α5β1 для связывания с кератиноцитами, и блокирование этого интегрина достаточно для защиты кератиноцитов от эффектов S. aureus. Графики показывают: (A) Значительно меньше стафилококков, адгезированных к клеткам, обрабатываемым с 60 мкг/мл блокирующего антитела (5,7±0,1 log КОЕ), по сравнению с необработанными кератиноцитами (6,1±0,1 log КОЕ, P=0,007). Результаты выражены как среднее ± SEM. (B) Значительно больше кератиноцитов являлись жизнеспособными после инфекции с S. aureus в течение 24 часов, если их предварительно подвергали анти-α5β1 интегрин (PRE-INT) антителу перед инфекцией (47,9±6,0%) по сравнению с кератиноцитами, инфицированными с S. aureus отдельно (SA) (19,3±2,0%, P=0,03). Результаты выражены как среднее ± SEM.
Фиг. 8. L. salivarius не была способна ингибировать стафилококковую адгезию к кератиноцитам. Графики показывают: (A) Кератиноциты, предварительно подверженные L. salivarius (PRE-LS), имели подобные количества адгезивных стафилококков (4,5±0,2 log КОЕ) по сравнению с клетками, подверженными S. aureus отдельно (SA) (4,9±0,2 log КОЕ). (B) L. reuteri (LR) адгезировали значительно лучше (6,7±0,1 log КОЕ), чем L. salivarius (LS) (5,6±0,1 log КОЕ, P=0,005). Результаты выражены как среднее ± SEM.
Фиг. 9. Графики показывают: (A) Человеческие первостепенные кератиноциты, подверженные патогену S. aureus (SA) в течение 24 часов. Это приводит к приблизительно 80% умирающих клеток с только 20% кератиноцитов, жизнеспособными после 24 часов. В присутствии лизатов P1 (LGG) или P2 (L. reuteri) значительно большее количество кератиноцитов остаются жизнеспособными после 24 часов подвергания патогену (50% и 60%, соответственно), (B) Пробиотические лизаты P1 (LGG) и P2 (L. reuteri) являются более эффективными при применении одновременно и имеют больший защитный эффект на жизнеспособность кератиноцитов, чем когда каждый штамм применяется отдельно.
Фиг. 10. Изображения анализов методом зарастания царапины. В анализах методом зарастания царапины как P1 (LGG), так и P2 (L. reuteri) лизаты ускоряли восстановление барьера. Через 18 часов после оцарапавания клетки в обработанных лизатом образцах (P1 и P2) почти восстанавливали разрушение, вызванное царапиной, тогда как в необработанных клетках (con) царапина оставалась все еще видимой.
Фиг. 11. Изображение луночного диффузионного анализа. Луночный диффузионный анализ показывает, что AC413 не ингибирует рост S. aureus. Для этого эксперимента S. aureus высеивали в виде сплошного слоя бактерий. Затем лунки погружали в агар и AC413 помещали в лунки. Любое уничтожение S. aureus посредством AC413 было бы заметно в виде области ингибирования вокруг лунки.
Фиг. 12. График, показывающий, что LGG снижает скорость роста S. aur