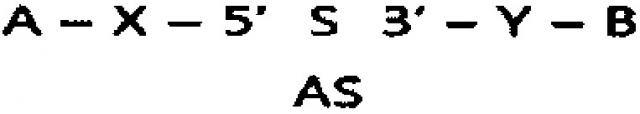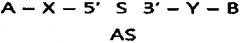Связанная с респираторным заболеванием ген-специфическая мирнк, двуспиральная конструкция олиго-рнк, содержащая мирнк, и содержащая ее композиция для предупреждения или лечения респираторного заболевания
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложены конструкция и наночастица, содержащая указанную конструкцию, предназначенные для эффективной доставки в клетки CTGF-специфической миРНК, а также фармацевтическая композиция и состав, содержащий лиофилизированную указанную фармацевтическую композицию, для предупреждения или лечения респираторных заболеваний, и способ предупреждения или лечения респираторных заболеваний. Указанная конструкция состоит из гидрофильного и гидрофобного материалов, связанных напрямую через простую ковалентную связь или с помощью линкеров с различными концами смысловой или антисмысловой цепи CTGF-специфической миРНК. Строение предложенной конструкции обеспечивает самопроизвольную сборку содержащих указанную конструкцию наночастиц, которые имеют низкие индексы полидисперсности и однородные размеры. Контроль строения гидрофильного фрагмента предложенной конструкции обеспечивает возможность регулирования индекса полидисперсности и размера наночастиц. Предложенная группа изобретений обеспечивает эффективную доставку CTGF-специфической миРНК в клетки и может быть использована в медицине для предупреждения или лечения респираторных заболеваний. 5 н. и 18 з.п. ф-лы, 25 ил., 2 табл., 11 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к связанной с респираторным заболеванием ген-специфической миРНК и высокоэффективной конструкции, представляющей собой двуспиральную олиго-РНК («двуспиральную конструкцию олиго-РНК»), содержащую миРНК. Двуспиральная конструкция олиго-РНК представляет собой структуру, в которой гидрофильный материал и гидрофобный материал конъюгированы с обоими концами двуспиральной РНК (миРНК) посредством простой ковалентной связи или опосредованной линкером ковалентной связи для эффективной доставки в клетки, при этом конструкция может быть превращена в форму наночастицы путем гидрофобных взаимодействий двуспиральной конструкции олиго-РНК в водном растворе. миРНК, включенная в двуспиральную конструкцию олиго-РНК, предпочтительно представляет собой миРНК, специфическую к CTGF, Cyr61 или Plekhol (далее в настоящем документе называемая CTGF-, Cyr61- или Plekhol-специфическая миРНК), который представляет собой ген, связанный с респираторными заболеваниями, в частности, идиопатическим легочным фиброзом и хроническим обструктивным заболеванием легкого (COPD).
Кроме того, настоящее изобретение относится к способу получения двуспиральной конструкции олиго-РНК и фармацевтической композиции, содержащей двуспиральную конструкцию олиго-РНК, для предупреждения или лечения респираторных заболеваний, в частности, идиопатического легочного фиброза и COPD.
Предпосылки создания изобретения
Технологии ингибирования экспрессии генов являются важными инструментами при разработке терапевтического агента и валидации мишени для лечения заболеваний. Среди этих технологий есть технологии на основе РНК-интерференции (далее в настоящем документе называемая «RNAi»), после обнаружения ее действия на последовательность-специфическую мРНК в различных видах клеток млекопитающих (Silence of the transcripts: RNA interference in medicine. J. Mol. Med. (2005) 83: 764-773). При доставке в клетку длинная двухцепочечная РНК превращается в малую интерферирующую РНК (далее в настоящем документе называемую «миРНК»), которая процессируется до 21-23 пар оснований (по) под действием эндонуклеазы дайсер. миРНК связывается с РНК-индуцированным комплексом сайленсинга (RISC), где руководящая (антисмысловая) цепь узнает и расщепляет целевую мРНК для последовательность-специфического ингибирования экспрессии целевого гена (NUCLEIC-ACID THERAPEUTICS: BASIC PRINCIPLES AND RECENT APPLICATIONS. Nature Reviews Drug Discovery. 2002. 1, 503-514).
Bertrand et al. обнаружили, что по сравнению с антисмысловым олигонуклеотидом (ASO) на том же самом целевом гене миРНК обладает эффектом значительного ингибирования экспрессии мРНК in vitro и in vivo, и соответствующий эффект сохраняется в течение длительного времени (Comparison of antisense oligonucleotides and siRNAs in cell culture and in vivo. Biochem. Biophys. Res. Commun. 2002. 296: 1000-1004). Кроме того, поскольку миРНК комплементарно связана с целевой мРНК для последовательность-специфического регулирования экспрессии целевого гена, механизм действия миРНК имеет преимущество, состоящее в том, что направленное воздействие может быть значительно увеличено по сравнению с существующими медицинскими продуктами или химическими фармацевтическими препаратами на основе антител (низкомолекулярными лекарственными средствами) (Progress Towards in Vivo Use of siRNAs. MOLECULAR THERAPY. 2006 13(4): 664-670).
Для разработки миРНК в качестве терапевтического агента с превосходным эффектом и различным диапазоном использования миРНК необходима эффективная доставка миРНК в клетку-мишень с улучшенной стабильностью и более эффективная доставка миРНК в клетку (Harnessing In Vivo siRNA Delivery for Drug Discovery and Therapeutic Development. Drug Discov. Today. 2006 Jan; 11(1-2): 67-73.
Для решения указанных проблем предпринимались активные исследования в отношении модификации некоторых нуклеотидов или основной цепи миРНК, для придания устойчивости нуклеиновой кислоты к действию лиазы, или использования носителей, таких как вирусные векторы, липосомы или наночастицы и т.п. для улучшения стабильности in vivo.
Системы доставки с использованием вирусных векторов, таких как аденовирус, ретровирус и т.п., обладают высокой эффективностью трансфекции, а также высокой иммуногенностью и онкогенностью. При этом невирусная система доставки, включая наночастицы, обладает низкой эффективностью доставки в клетку по сравнению с вирусной системой доставки, но обладает высокой стабильность in vivo и может быть доставлена мишень-специфически, обладает значительно улучшенными эффектами доставки олигонуклеотида RNAi в клетки или ткани, такими как поглощение, интернализация и т.п., и редко обладает цитотоксичностью и стимуляцией иммунной системы, таким образом, невирусная система доставки оценивается в настоящее время как перспективный способ доставки по сравнению с вирусными системами доставки (Nonviral delivery of synthetic siRNA s in vivo. J Clin Invest. 2007 December 3; 117(12): 3623-3632).
В способе с использованием наноносителя в невирусных системах доставки для формирования наночастиц используются различные полимеры, такие как липосомы, катионные полимерные композиты и т.п., и для доставки в клетки миРНК загружают на наночастицы, то есть наноноситель. Среди способов с использованием наноносителей в основном применяют способ с использованием полимерной наночастицы, полимерной мицеллы, липоплекса или т.п., при этом липоплекс состоит из катионного липида для взаимодействия с анионным липидом эндосомы клетки, вызывая тем самым дестабилизирующий эндосому эффект для доставки миРНК в клетку (Proc. Natl. Acad. Sci. 15; 93(21): 11493-8, 1996).
Кроме того, известно, что химические материалы и т.п. соединены с концевыми участками сопровождающей (смысловой) цепи миРНК для обеспечения улучшенных фармакокинетических характеристик, таким образом, что может быть индуцирована высокая эффективность in vivo (Nature 11; 432(7014): 173-8, 2004). В настоящем документе стабильность миРНК может варьировать в зависимости от свойств химических материалов, соединенных с концами смысловой («сопровождающей») или антисмысловой («направляющей») цепи миРНК. Например, миРНК, с которой конъюгировано полимерное соединение, такое как полиэтиленгликоль (PEG), взаимодействует с анионной фосфатной группой миРНК в присутствии катионных материалов с образованием комплекса, являясь таким образом носителем, обладающим улучшенной стабильностью миРНК (J. Control Release 129(2): 107-16, 2008). В частности, мицелла, состоящая из полимерных комплексов, характеризуется чрезвычайно малым размером, высокооднородным распределением и спонтанным образованием, тем самым являясь легкой в отношении управления качеством состава и обеспечения воспроизводимости по сравнению с другими системами, используемыми в качестве носителей для доставки лекарственных средств, такими как микросферы, наночастицы и т.п.
Кроме того, для улучшения эффективности внутриклеточной доставки миРНК разработана технология использования конъюгата миРНК, в котором гидрофильный материал, представляющий собой биосовместимый полимер (например, полиэтиленгликоль (PEG)), конъюгирован с миРНК посредством простой ковалентной связи или опосредованной линкером ковалентной связи, для обеспечения стабильности миРНК и эффективной проницаемости клеточной мембраны (смотри публикацию корейского патента №883471). Однако химическая модификация миРНК и конъюгирование с полиэтиленгликолем (PEG) (пегилирование) все же имеют недостатки, связанные с низкой стабильностью in vivo и неравномерной доставкой в орган-мишень. Для устранения указанных недостатков была разработана двуспиральная конструкция олиго-РНК, в которой гидрофильный материал и гидрофобный материал соединены с олигонуклеотидами, в частности, двуспиральной РНК, такой как миРНК, при этом двуспиральная конструкция олиго-РНК формирует самособирающуюся наночастицу, названную Self-Assembled-Micelle-irihibitory-RNA (SAMiRNA™), путем гидрофобного взаимодействия гидрофобного материала (смотри публикацию корейского патента №1224828), при этом технология SAMiRNA™ обладает преимуществом, состоящим в возможности получения гомогенных наночастиц чрезвычайно малого размера по сравнению с существующими технологиями доставки.
Конкретным примером технологии SAMiRNA™ является использование PEG (полиэтиленгликоля) в качестве гидрофильного материала, при этом PEG представляет собой синтетический полимер, используемый для увеличения растворимости фармацевтических средств, в частности, белка и для контроля фармакокинетики. PEG представляет собой полидисперсный материал, при этом полимер в одной партии состоит из суммы различного числа мономеров, молекулярная масса показана на кривой Гаусса, и значения индекса полидисперсности (Mw/Mn) выражают степень гомогенности материала. То есть, когда PEG имеет низкую молекулярную массу (от 3 до 5 кДа), индекс полидисперсности составляет около 1,01, и когда PEG имеет высокую молекулярную массу (20 кДа), индекс полидисперсности является высоким и составляет около 1,2, то есть при более высокой молекулярной массе гомогенность материала является сравнительно низкой (F.М. Veronese. Peptide and protein PEGylation: a review of problems and solutions. Biomaterials (2001) 22: 405-417). Таким образом, при комбинировании PEG с фармацевтическими средствами показатель полидисперсности PEG отражается на конъюгате, таким образом, затруднительно выполнить верификацию одного материала, и поэтому возрастает тенденция получения материалов с низким показателем полидисперсности путем синтеза PEG и улучшения способов очистки, но при этом имеются проблемы, связанные с характеристикой полидисперсности материала, в частности, при комбинировании PEG с материалом с низкой молекулярной массой имеются трудности, связанные с подтверждением легкости получения комбинации и т.д. (Francesco М. Veronese and Gianfranco Pasut. PEGylation, successful approach to drug delivery. DRUG DISCOVERY TODAY (2005) 10(21): 1451-1458).
Таким образом, недавно в качестве улучшенной технологии SAMiRNA™, которая представляет собой существующие самособирающиеся наночастицы, была разработана технология получения новой формы носителя, имеющего чрезвычайно малый размер по сравнению с существующими SAMiRNA™ и значительно улучшенную полидисперсность, путем объединения гидрофильного материала двуспиральной конструкции РНК, формирующей SAMiRNA™, в блоки, основная единица которых включает от 1 до 15 однородных мономеров, имеющих предварительно определенную молекулярную массу, и при необходимости линкер, и использования по необходимости соответствующего количества блоков гидрофильных материалов.
При этом, поскольку биофармацевтические препараты специфически действуют на последовательность целевого гена или структуру белка, для оценки эффективности и безопасности в неклинической суррогатной модели дополнительно требуется материал, действующий по такому же механизму, как соответствующие биофармацевтические препараты у человека, даже в разновидностях суррогатной модели. Таким образом, для того, чтобы избежать трудностей, связанных с дополнительным поиском материала, имеющего такой же механизм действия, как у человека, необходимо разработать материал, действующий по одинаковому механизму у человека (подвергаемая лечению мишень) и мышей (неклиническая суррогатная модель).
Идиопатический легочный фиброз (далее в настоящем документе называемый сокращенно «IPF») представляет собой заболевание, в котором хронические воспалительные клетки проникают в стенку альвеол (альвеола легких), делая легкие более твердыми, вызывая тяжелое структурное изменение в легочной ткани, такое, что функция легких постепенно снижается, приводя к смерти. Однако до сих пор не существует эффективного лечения, и идиопатический легочный фиброз обычно диагностируется после появления симптомов и имеет чрезвычайно плохой прогноз, поскольку медиана выживаемости составляет примерно от трех до пяти лет. Имеются сообщения о том, что частота случаев в различных странах составляет примерно 3-5 человек на 100000 и известно, что частота возникновения обычно является более высокой в возрасте старше 50 лет, и частота возникновения у мужчин в два раза выше, чем у женщин.
Причина IPF до сих пор до конца не установлена и имеются лишь сообщения о том, что высокая частота возникновения наблюдается у курильщиков, принимающих антидепрессанты, имеющих хроническую легочную дисфункцию вследствие гастроэзофагеального рефлюкса, после вдыхания металлической пыли, древесной пыли, растворителей и т.п., которые рассматриваются как факторы риска, связанные с возникновением IPF. Однако у большинства пациентов конкретные причинные факторы не могут быть выявлены.
Известно, что IPF непрерывно ухудшается при отсутствия лечения, и около 50% пациентов умирают в течение 3-5 лет, и после того как легкие полностью затвердевают путем фиброза по мере прогрессирования заболевания улучшение не наступает несмотря на любое лечение, и поэтому можно предположить, что раннее лечение повышает эффективность. В настоящее время известен способ комбинированной терапии с использованием в качестве терапевтического агента стероида и азатиоприна или циклофосфамида, но трудно сказать о наличии особых эффектов, и попытки использования нескольких ингибиторов фиброза в экспериментах на животных и малых группах пациентов не показали четких эффектов. В частности, отсутствует другое эффективное лечение для пациентов с конечной стадией IPF, дополнительно к трансплантации легких. Таким образом, существует острая потребность в разработке более эффективного терапевтического агента против IPF.
При этом COPD, одно из типичных заболеваний легких, наряду с астмой, отличается от астмы тем, что сопровождается необратимой обструкцией дыхательных путей и представляет собой респираторное заболевание, сопровождающееся ненормальным воспалительным ответом легких на повторную инфекцию, вредные частицы, выхлопные газы или курение, и не является полностью обратимым, демонстрируя возрастающее прогрессирующее ограничение воздушного потока (Pauwels et al, AmJRespir Crit Care Med, 163: 1256-1276, 2001). COPD представляет собой заболевание, вызванное патологическими изменениями бронхиол и легочной паренхимы путем воспаления дыхательного пути и паренхимы легких, и характеризуется обструктивным бронхиолитом и эмфиземой (разрушением легочной паренхимы). Типы COPD включают хронический обструктивный бронхит, хронический бронхиолит и эмфизему. COPD характеризуется увеличенным количеством нейтрофилов и повышенной секрецией цитокинов, таких как GM-CSF, TNF-α, IL-8 и MIP-2. Кроме того, наблюдается воспаление дыхательного пути, утолщенная стенка бронхов и закупорка бронхов вследствие увеличенной секреции слизи. Когда бронхи закупориваются, альвеолы расширяются и повреждаются, таким образом, происходит нарушение обмена кислорода и двуокиси углерода, приводя к дыхательной недостаточности.
По степени тяжести заболевание COPD в 1990 году занимало 6-е место среди причин смерти от заболеваний, но прогнозируется, что в 2020 году будет занимать третье место, и является единственным заболеванием, частота случаев возникновения которого выросла в 10 раз. COPD имеет высокий показатель распространенности, вызывает респираторные нарушения и требует больших прямых медицинских затрат для диагностики и лечения, а также значительных непрямых затрат, таких как потери вследствие одышки и вынужденный отпуск или потери вследствие преждевременной смерти, что является социальной и экономической проблемой в мире (Chronic obstructive pulmonary disease (COPD) treatment guidelines 2005. Chronic obstructive airway disease Clinical Research Center, p. 30-31).
Существующие терапевтические лекарственные средства не были подтверждены в качестве лекарственных средств, которые на длительное время уменьшают сокращение функции легких, что является характеристикой COPD. Таким образом, главной целью лечения COPD лекарственными средствами является уменьшение симптомов или осложнений. Бронходилатор является типичным аллопатическим средством для лечения COPD из терапевтических средств, и обычно назначают противовоспалительное лекарственное средство или кортикостероид, но эффект является незначительным, область применения является узкой и существует большая вероятность побочных эффектов. Известно, что в качестве других лекарственных средств только вакцина против гриппа уменьшает серьезные симптомы и вероятность смертельного исхода примерно на 50% у пациентов с COPD (chronic obstructive pulmonary disease (COPD) treatment guidelines 2005. Chronic obstructive airway disease Clinical Research Center, p. 52-58).
Между тем, установлено множество генетических факторов, которые повышают (или понижают) риск возникновения COPD у индивидуума. Генетическим фактором риска, который был продемонстрирован на сегодняшний день, является генетический дефицит альфа-1-антитрипсина. Курильщики значительно повышают риск возникновения COPD, однако возникновение панлобулярной эмфиземы и сокращение функции легких, которые быстро прогрессируют в молодом возрасте, продемонстрировано как курильщиками, так и не курящими людьми, имеющими значительный генетический дефицит. Хотя было получено подтверждение того, что другие гены связаны с COPD, до сих пор отсутствует мнение о патогенезе дополнительно к альфа-1-антитрипсину, и предпринимаются попытки идентифицировать биомаркеры заболевания в диагностических целях путем исследования клеточных, молекулярных и генетических ненормальных состояний, которые преимущественно наблюдаются у пациентов с COPD, или найти новый способ лечения (P.J. Barnes and R.A. Stockely. COPD: current therapeutic interventions and future approaches. Eur Respir J. (2005) 25: 1084-1106). В частности, было проведено исследование с целью диагностики COPD и отбора мишени для лечения методами, такими как микрочипы для идентификации генов, протеомика и т.д., и в основном выполняли анализы генетических факторов для получения данных по чувствительности (подверженности) к COPD и причинам ухудшения симптомов COPD, вызванных курением (Peter J. Castaldi et al. The COPD genetic association compendium. Human Molecular Genetics, 2010, Vol. 19, No. 3 526-534).
CTGF (фактор роста соединительной ткани; CCN2), который является одним из матриксно-клеточных белков, включенных в семейство CCN, известен как секретируемый цитокин, вовлеченный в различные биологические процессы, такие как клеточная адгезия, миграция, пролиферация, ангиогенез, заживление ран и т.п. Сверхэкспрессия CTGF рассматривается как основная причина симптомов, таких как склеродерма, фиброзирующее заболевание и формирование шрамов (Brigstock DR. Connective tissue growth factor (CCN2, CTGF) and organ fibrosis: lessons from transgenic animals. J Cell Commun Signal (2010) 4 (1): 1-4). В частности, в отношении фиброза известно, что CTGF вызывает устойчивый фиброз вместе с TGF-β (трансформирующий фактор роста-β) или стимулирует выработку ЕСМ (внеклеточного матрикса) под действием условий, которые вызывают формирование волокон, и недавно стало известно о возможности лечить нарушения зрения или дистрофию мышц, вызванную ненормальной экспрессией CTGF путем обработки образцов или материалов, которые препятствуют экспрессии CTGF или ингибируют его действие, но актуальность в отношении респираторного заболевания не была описана (патент США No. 7,622,454 и публикация заявки на патент США No. 20120164151).
CYR61 (обогащенный цистеином ангиогенный индуктор 61) представляет собой сигнальный белок, ассоциированный с внеклеточным матриксом (ЕСМ), включенный в семейство CCN, который, как известно, контролирует различные клеточные события, такие как клеточная адгезия, миграция, пролиферация, дифференцировка, апоптоз и т.п. Очищенный CYR61 стимулирует прикрепление и распространение эндотелиальных клеток подобно действию фибронектина, и не обладает митогенной активностью, но усиливает митогенный эффект фактора роста фибробластов (MARIA L. KIREEVA et al. Cyr61, a Product of a Growth Factor-Inducible Immediate-Early Gene, Promotes Cell Proliferation, Migration, and Adhesion. MOLECULAR AND CELLULAR BIOLOGY, Apr. 1996, p. 1326-1334).
Имеются сообщения о том, что Plekho1 (семейство О, первый член семейства, содержащий плекстрин-гомологичный домен) присутствует в плазматической мембране или ядре, действует в качестве неферментного регулятора протеинкиназы CK2α1 (казеинкиназа 2, альфа 1) и вовлечен в апоптоз путем ингибирования действия АР-1 посредством С-концевого участка, образующегося при расщеплении каспазой 3 (Denis G. Bosc et al. Identification and Characterization of CKIP-1, a Novel Pleckstrin Homology Domain-containing Protein That Interacts with Protein Kinase CK2. The Journal of Biological Chemistry(2000) 275, 14295-14306; Lingqiang Zhang et al. Role for the pleckstrin homology domain containing protein CKIP-1 in AP-1 regulation and apoptosis. The EMBO Journal (2005) 24, 766-778).
Как описано выше, уровень распространения респираторных заболеваний, в частности, идиопатического легочного фиброза и COPD увеличился, но до сих пор отсутствуют терапевтические агенты, способные предупреждать или лечить идиопатический легочный фиброз и COPD. Таким образом, в настоящее время на рынке имеется острая потребность в терапевтическом агенте, который обладает высокой эффективностью по предупреждению и лечению идиопатического легочного фиброза и COPD без вызывания побочных эффектов.
Описание изобретения
Целью настоящего изобретения является обеспечение новой миРНК, специфической к CTGF, Cyr61 или Plekho1 (далее в настоящем документе называемой CTGF-, Cyr61- или Plekho1-специфическая миРНК), которая способна ингибировать их экспрессию с высокой эффективностью, двуспиральной конструкции олиго-РНК, содержащей миРНК, и способа получения двуспиральной конструкции олиго-РНК.
Еще одной целью настоящего изобретения является обеспечение фармацевтической композиции, включающей в качестве эффективного компонента CTGF-, Cyr61- или Plekho1-специфическую миРНК или двуспиральную конструкцию олиго-РНК, содержащую миРНК, для предупреждения или лечения респираторных заболеваний, в частности, идиопатического легочного фиброза и COPD.
Еще одной целью настоящего изобретения является обеспечение способа предупреждения или лечения респираторных заболеваний, в частности, идиопатического легочного фиброза и COPD, путем использования CTGF-, Cyr61- или Plekho1-специфической миРНК или двуспиральной конструкции олиго-РНК, содержащей миРНК.
Краткое описание чертежей
На фигуре 1 представлена схематическая диаграмма наночастицы, образованной двуспиральной структурой олиго-полимера в соответствии с настоящим изобретением.
На фигуре 2 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов человека миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 1 по 10, с 101 по 110, и с 201 по 210, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 1 по 10.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 101 по 110.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 201 по 210.
На фигуре 3 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов человека миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 1, 3, 4, 8, 9, 10, 102, 104, 105, 106, 107, 108, 109, 204, 206, 207, 208, 209 или 210, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 0,2 или 1 нМ миРНК, имеющей последовательность, представленную в SEQ ID NO: 1, 3, 4, 8, 9 или 10, в качестве смысловой цепи.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 0,2 или 1 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 102, 104, 105, 106, 107, 108 или 109.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 0,2 или 1 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 204, 206, 207, 208, 209, или 210.
На фигуре 4 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии рака легких человека миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 35, 42, 59, 602, 603, 604, 124, 153, 166, 187, 197, 212, 218, 221 или 223, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 0,04, 0,2 или 1 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 35, 42, 59, 602, 603, или 604.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 0,5, 1 или 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 124, 153, 166, 187, или 197.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 0,5, 1 или 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 212, 218, 221 или 223.
На фигуре 5 представлена диаграмма, демонстрирующая величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии рака легких человека SAMiRNA, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 42, 59 или 602, в соответствии с настоящим изобретением.
На фигуре 6 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов мышей миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 301 по 330, с 401 по 430, с 501 по 530, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 301 по 330.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 401 по 430.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 501 по 530.
На фигуре 7 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов мышей миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 404 по 406, с 408 по 410, с 414 по 418, с 420 по 422, 424, 427, 429, 430, с 503 по 509, с 514 по 517, 519, с 521 по 526 или 528, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 404 по 406, с 408 по 410, с 414 по 418, с 420 по 422, 424, 427, 429 или 430.
В: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: с 503 по 509, с 514 по 517, 519, с 521 по 526 или 528.
На фигуре 8 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов мышей миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 301, 303, 307, 323, 410, 422, 424, 507, 515 или 525, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 0,2, 1 или 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 301, 303, 307 или 323.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 0,2, 1 или 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 410, 422 или 424.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 0,2, 1 или 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 507, 515 или 525.
На фигуре 9 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов мышей миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 4, 5, 6, 8, 9, 102, 104, 105, 107, 108, 109, 202, 204, с 206 по 209, 307, 424 или 525, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 4, 5, 6, 8, 9 или 307.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 102, 104, 105, 107, 108, 109 или 424.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 5 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 202, 204, с 206 по 209 или 525.
На фигуре 10 представлены диаграммы, демонстрирующие величину ингибирования экспрессии целевого гена, подтвержденную после трансформации клеточной линии фибробластов мышей миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 6, 8, 102, 104, 105, 204, 207, 208, 307, 424 или 525, в соответствии с настоящим изобретением.
А: Диаграмма, демонстрирующая величину экспрессии CTGF после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 6, 8 или 307.
В: Диаграмма, демонстрирующая величину экспрессии Cyr61 после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 102, 104, 105 или 424.
С: Диаграмма, демонстрирующая величину экспрессии Plekho1 после лечения 5 или 20 нМ миРНК, имеющей в качестве смысловой цепи последовательность, представленную в SEQ ID NO: 204, 207, 208 или 525.
Лучший способ осуществления изобретения
Для достижения указанных выше целей, настоящее изобретение обеспечивает CTGF-, Cyr61- или Plekho1- (гены, связанные с респираторными заболеваниями)-специфическую миРНК, состоящую из первого олигонуклеотида, который представляет собой смысловую цепь, имеющую любую последовательность, выбранную из группы, состоящей из SEQ ID NO: с 1 по 600 и с 602 по 604, и второго олигонуклеотида, который представляет собой антисмысловую цепь, имеющую комплементарную смысловой цепи последовательность.
В настоящем изобретении миРНК включает все материалы, обладающие общим действием RNAi (РНК-интерференции) и, таким образом, специалисту в данной области будет очевидно, что CTGF-, Cyr61- или Plekho1-специфическая миРНК включает CTGF-, Cyr61- или Plekho1-специфическую короткую шпилечную РНК (кшРНК) и т.п.
SEQ ID NO: с 1 по 100 или с 602 по 604 представляют собой последовательности смысловой цепи CTGF (Homo sapiens)-специфической миРНК, SEQ ID NO: с 101 по 200 представляют собой последовательности смысловой цепи Cyr61 (Homo sapiens)-специфической миРНК, SEQ ID NO: с 201 по 300 представляют собой последовательности смысловой цепи Plekho1 (Homo sapiens)-специфической миРНК, SEQ ID NO: с 301 по 400 представляют собой последовательности смысловой цепи CTGF (Mus musculus)-специфической миРНК, SEQ ID NO: с 401 по 500 представляют собой последовательности смысловой цепи Cyr61 (Mus musculus)-специфической миРНК, и SEQ ID NO: с 501 по 600 представляют собой последовательности смысловой цепи Plekho1 (Mus musculus)-специфической миРНК.
В соответствии с настоящим изобретением миРНК предпочтительно представляет собой CTGF-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: с 1 по 10, 35, 42, 59, 602, 603, 604, с 301 по 303, с 305 по 307, 309, 317, 323 и 329;
Cyr61-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: с 101 по 110, 124, 153, 166, 187, 197, 409, 410, 415, 417, 418, 420, 422, 424, 427 и 429;
Plekho1-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: с 201 по 210, 212, 218, 221, 223, с 504 по 507, 514, 515 и с 522 по 525.
Более предпочтительно, миРНК в соответствии с настоящим изобретением представляет собой CTGF-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 5, 8, 9, 35, 42, 59, 601, 602, 604, 301, 303, 307 и 323;
Cyr61-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 102, 104, 107, 108, 124, 153, 166, 187, 197, 410, 422 и 424;
Plekho1-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: с 206 по 209, 212, 218, 221, 223, 507, 515 и 525.
Наиболее предпочтительно, миРНК в соответствии с настоящим изобретением представляет собой CTGF-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 42, 59, 602 и 323;
Cyr61-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 124, 153, 187, 197 и 424; или Plekho1-специфическую миРНК, имеющую в качестве смысловой цепи любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 212, 218, 221, 223 и 525.
В частности, было получено подтверждение того, что некоторые из CTGF-, Cyr61- или Plekhol-специфических миРНК человека в соответствии с настоящим изобретением могут одновременно ингибировать экспрессию CTGF, Cyr61 или Plekho1 мышей.
миРНК, способная одновременно ингибировать экспрессию CTGF, Cyr61 или Plekho1 человека и мышей, предпочтительно включает смысловую цепь CTGF-специфической миРНК в соответствии с SEQ ID NO: 6 или 8, смысловую цепь Cyr61-специфической миРНК в соответствии с SEQ ID NO: 102, 104 или 105, или смысловую цепь Plekho1-специфической миРНК в соответствии с SEQ ID NO: 204, 207 или 208.
Наиболее предпочтительно, миРНК включает смысловую цепь CTGF-специфической миРНК в соответствии с SEQ ID NO: 6, смысловую цепь Cyr61-специфической миРНК в соответствии с SEQ ID NO: 102 или смысловую цепь Plekho1-специфической миРНК в соответствии с SEQ ID NO: 207.
Смысловая цепь или антисмысловая цепь миРНК в соответствии с настоящим изобретением предпочтительно содержит от 19 до 31 нуклеотида, и миРНК включает смысловую цепь, имеющую любую последовательность, выбранную из SEQ ID NO: с 1 по 604, и комплементарную ей антисмысловую цепь.
Поскольку CTGF-, Cyr61- или Plekho1-специфическая миРНК в соответствии с настоящим изобретением содержит последовательность оснований, которая разработана таким образом, что может комплементарно соединяться с мРНК, кодирующей соответствующий ген, экспрессия соответствующего гена может быть эффективно ингибирована. Кроме того, CTGF-, Cyr61- или Plekho1-специфическая миРНК в соответствии с настоящим изобретением может включать «свисающий конец», который представляет собой конструкцию, включающую один или два или более непарных нуклеотидов на 3'-конце миРНК, и может включать различные модификации миРНК для обеспечения устойчивости нуклеиновой кислоты к действию лиазы и уменьшения неспецифического иммунного ответа для улучшения стабильности in vivo. Модификация первого олигонуклеотида или второго олигонуклеотида, образующих миРНК, может представлять собой одну или более комбинаций, выбранных из модификации, в которой группа -ОН при 2'-атоме углерода в структуре сахара в одном или нескольких нуклеотидах заменена на -СН3(метил), -ОСН3(метокси), -NH2, -F(фтор), -O-2-метоксиэтил, -О-пропил, -O-2-метилтиоэтил, -О-3-аминопропил, -О-3-диметиламинопропил, -O-N-метилацетамидо или -О-диметиламидооксиэтил; модификации, в которой кислород в структуре сахара в нуклеотидах заменен на серу; и модификацию нуклеотидных связей на фосфоротиоатные или боранофосфатные, метил-фосфонатные связи, или может представлять собой модификацию пептидо-нуклеиновой кислоты (PNA), модификацию замкнутой нуклеиновой кислоты (LNA) или модификацию незамкнутой нуклеиновой кислоты (UNA) (Ann. Rev. Med. 55, 61-65 2004; US 5,660,985; US 5,958,691; US 6,531,584; US 5,808,023; US 6,326,358; US 6,175,001; Bioorg. Med. Chem. Lett. 14: 1139-1143, 2003; RNA, 9: 1034-1048, 2003; Nucleic Acid Res. 31: 589-595, 2003; Nucleic Acids Research, 38(17) 5761-5773, 2010; Nucleic Acids Research, 39(5) 1823-1832, 2011).
CTGF-, Cyr61- и/или Plekho1-специфическая миРНК в соответствии с настоящим изобретением может ингибировать экспрессию соответствующего гена и значительно ингибировать экспрессию соответствующего белка.
Настоящее изобретение также обеспечивает конъюгат, в котором гидрофильный материал и гидрофобный материал конъюгированы к обоим концам миРНК, для эффективной доставки in vivo и улучшения стабильности миРНК, специфической к гену, связанному с респираторными заболеваниями, в частности, CTGF-, Cyr61- или Plekho1-специфической миРНК.
В конъюгате миРНК, в котором гидрофильный материал и гидрофобный материал соединены с миРНК, самособирающаяся наночастица образуется путем гидрофобного взаимодействия гидрофобного материала (смотри публикацию корейского патента №1224828), при этом самособирающаяся наночастица обладает преимуществами, состоящими в том, что эффективность внутренней доставки и стабильность in vivo являются исключительно высокими, и одн