Внутриклеточная доставка
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и медицине, а именно к безвекторной микрожидкостной платформе для внутриклеточной доставки в цитозоль эукариотической клетки соединения или композиции. Предложены микрожидкостные системы для обеспечения разрывов в клетке и способы доставки груза в клетку. Микрожидкостные системы включают устройство, в частности микрожидкостный канал, содержащее деформирующее клетку сужение, и компонент, обеспечивающий продвижение клеток. Диаметр сужения составляет 20-99% от диаметра клетки и индуцирует в клетке достаточно крупные разрывы, чтобы груз прошел через них. Способы доставки груза в клетку с использованием указанной системы обеспечивают доставку ДНК, РНК, миРНК или белка в первичные фибробласты и стволовые клетки, антигена или РНК в первичные иммунные клетки, квантовых точек, углеродных нанотрубок или лекарственных средств в клетку-мишень. Изобретения позволяют исключить модификацию желаемого груза, пригодны для доставки чувствительных грузов, а также обеспечивают прямую доставку груза в цитозоль, избегая эндосомального компартмента, не приводят к изменению состояния дифференцировки или активности обработанной клетки. 5 н. и 40 з.п. ф-лы, 45 ил., 4 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет временной заявки США №61/548013, поданной 17 октября 2011 года, и временной заявки США №61/684301, поданной 17 августа 2012 года, содержание каждой из которых включено в настоящее описание в качестве ссылки.
ЗАЯВЛЕНИЕ О ФЕДЕРАЛЬНО СПОНСИРУЕМОМ ИССЛЕДОВАНИИ
Настоящее изобретение было осуществлено по меньшей мере частично при поддержке правительства по гранту 5 RC1 EB011187-02, выданному National Institute of Health. Правительство имеет определенные права на настоящее изобретение.
УРОВЕНЬ ТЕХНИКИ
Разработка многих фармацевтических препаратов в большой степени сфокусирована на низкомолекулярных лекарственных средствах. Эти лекарственные средства называются так вследствие их относительно небольшого размера, который позволяет им свободно диффундировать в организме, достигая их мишени. Эти молекулы также способны проникать через в ином случае непроницаемую клеточную мембрану по большей части беспрепятственно. Однако лекарственные средства следующего поколения на основе белков, ДНК или РНК не могут беспрепятственно проходить через клеточную мембрану и, таким образом, для облегчения их доставки требуется клеточная модификация. В общепризнанных способах используются химические вещества и электрические импульсы для прохождения через мембрану и доставки материала в цитоплазму. Надлежащая внутриклеточная доставка является критической стадией в этом исследовании, разработке и осуществлении лекарственных средств следующего поколения.
Существующие способы часто трудно разработать и они являются высокоспецифическими в отношении их конкретного применения. Более того, существующие способы не направлены надлежащим образом на многие клинически важные типы клеток, такие как стволовые клетки и иммунные клетки. Таким образом, существует потребность в более надежном и точном способе, способном удовлетворить потребности современных биологических/медицинских исследований.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение основано на неожиданном открытии, что контролируемое повреждение, например, осуществление воздействия на клетку сжатия, быстрого растягивания, быстрого сдавливания или импульса с высоким усилием сдвига приводит к захвату молекул в цитоплазму клетки из окружающей клеточной среды. Таким образом, изобретение относится к безвекторной микрожидкостной платформе для внутриклеточной доставки прямо в цитозоль эукариотической клетки материалов, например, соединения или композиции. Устройство является пригодным в качестве универсального и широко применимого лабораторного инструмента для доставки желаемых молекул в клетки-мишени. Доставка молекул в клетку с использованием способов, описанных в настоящем описании, является пропорциональной, например, линейно или монотонно скорости клеток через область сужения и/или сдавления. Например, 50 мкл суспензии клеток проходит через устройство за несколько секунд. Пропускная способность находится в диапазоне от 1 клетка/секунда на канал (или даже менее) до более чем 1000 клеток/секунда на канал. Типичные скорости клеток через сужение включают от 10 мм/секунда до 500 мм/секунда, хотя скорость клеток может составлять вплоть до 10 м/c (или даже выше). Дополнительные каналы можно помещать параллельно для увеличения общей пропускной способности системы.
Захват молекулы происходит посредством диффузии, а не эндоцитоза, т.е. груз (соединение(я), подлежащее доставке в клетку) находится в цитоплазме, а не в эндосомах после прохождения через устройство. В эндосомах после обработки клеток груз появляется в небольшом количестве или он не появляется. Например, крупные молекулы захватываются медленнее, чем молекулы меньших размеров. Контролируемое растяжение клеток и скорость движения клеток через сужение приводит к более высокой доставке молекул-мишеней при сохранении жизнеспособности и целостности клеток. После обработки жизнеспособность клеток составляет 70-100%, например, типичная жизнеспособность составляет 90% после обработки. При сравнении было показано, что предшествующие способы доставки с использованием высоких уровней сдвига отдельно в течение секунд или миллисекунд приводят к низкой жизнеспособности клеток после обработки. В противоположность предшествующим способам, способы по изобретению подвергают клетки сдвиговому импульсу в диапазоне 100-1000 Па в течение очень короткого периода времени (приблизительно 100 микросекунд) по мере того, как клетка проходит через сужение. Однако настоящие способы существенно отличаются от предшествующих способов. В настоящих способах предпочтительно происходит полная механическая деформация клетки по мере того, как она проходит через сужение, что может обеспечить сдвиговые усилия, отличающиеся от предшествующих способов. В предпочтительных вариантах осуществления клетки не подвергают воздействию электрического тока. В других вариантах осуществления используют комбинированную обработку, например, механическую деформацию с использованием устройства, описанного в настоящем описании, с последующей или предшествующей электропорацией (тип осмотической трансфекции, при которой используют электрический ток для обеспечения временных отверстий в клеточных мембранах, позволяя вхождение нуклеиновых кислот или макромолекул).
Груз представляет собой соединение или композицию, подлежащие доставке в клетку. Например, груз может включать белки, флуоресцентные красители, квантовые точки, углеродные нанотрубки, молекулы РНК, молекулы ДНК, антигены и другие макромолекулы, наночастицы и композиции.
Ширина сужения устройства, длина суженной части, геометрия области входа и глубина трубки устройства влияют на доставку молекул в клетку. Предпочтительно ширина суженной области трубки составляет не менее 4 мкм в диаметре, и длина суженной части трубки предпочтительно составляет 40-50 мкм. Длина суженной части, как правило, не превышает 90 мкм. Диаметр суженной части соответствует типу клетки, подлежащей обработке. Как описано ниже, диаметр является меньшим, чем диаметр клетки (например, 20-99% от диаметра клетки). Многие клетки имеют диаметр 5-15 мкм, например, дендритные клетки имеют диаметр 7-8 мкм. Например, диаметр области сужения составляет 4,5, 5, 5,5, 6 или 6,5 мкм для обработки единичных клеток. В другом примере размер/диаметр области сужения для обработки яйцеклетки человека составляет от 6,2 мкм до 8,4 мкм, хотя возможны сужения большего и меньшего размера (диаметр яйцеклетки человека составляет приблизительно 12 мкм). В другом примере эмбрионы (например, кластеры из 2-3 клеток) обрабатывают с использованием диаметра сужения от 12 мкм до 17 мкм.
Устройство и способы пригодны для разработки и изготовления вакцин с использованием специализированных антигенпредставляющих клеток, таких как дендритные клетки. Например, способ стимуляции представления антигена осуществляют, подвергая дендритную клетку контролируемому повреждению, такому как временное сжатие или импульс с высоким сдвиговым усилием, и контактируя дендритную клетку с раствором, содержащим антиген-мишень. Способ обеспечивает высоко активированные антигенпредставляющие клетки по сравнению с предшествующими способами стимуляции. Изготовление вакцины осуществляют, пропуская дендритные клетки или другие антигенпредставляющие клетки через содержащее сужение устройство (тем самым, подвергая клетки явлению быстрого растяжения), а затем инкубируя клетки в растворе, содержащем груз, например, антиген. Клетки подвергают периодическому культивированию в культуральной среде, содержащей один или несколько антигенов, после быстрой деформации клеток, однако клетки можно контактировать с антигеном до, в процессе и/или после явления/процесса быстрой деформации.
В циркулирующем буфере необязательно используют поверхностно-активные вещества (например, 0,1-10% масс./масс.) (например, полоксамер, сыворотка животного, белок-альбумин). На доставку молекул в клетки не влияет присутствие поверхностно-активных веществ; однако поверхностно-активные вещества необязательно используют для уменьшения закупорки устройства в процессе эксплуатации.
Устройство изготавливают из кремния, металла (например, нержавеющая сталь), пластмассы (например, полистирол), керамики или любого другого материала, пригодного для гравирования рельефа микронного масштаба и включает одну или несколько трубок или каналов, через которые проходят клетки. Кремний является особенно пригодным, поскольку способы формирования микрорельефа являются налаженными для этого материала, таким образом, проще изготовить новые устройства, изменить конструкцию и т.д. Кроме того, жесткость кремния может обеспечить преимущество над более мягкими субстратами, такими как полидиметилсилоксан (PDMS), например, более высокие уровни доставки. Например, устройство включает 2, 10, 20, 25, 45, 50 75, 100 или более каналов. Микрорельеф на устройстве формируют гравированием на кремнии. Клетки продвигают, например, проталкивают, через каналы или трубки с использованием давления. Клеточный привод может обеспечивать давление. Клеточный привод может включать, например, нагнетающий насос, газовый баллон, компрессор, вакуумный насос, шприц, шприцевой насос, перистальтический насос, ручной шприц, пипетку, поршень, капиллярный действующий элемент и гравитацию. В качестве альтернативы каналам клетки можно пропускать через сужение в форме сети или близко помещенных пластин. В любом случае, ширина сужения, через которое проходят клетки, составляет 20-99% от ширины или диаметра клетки, подлежащей обработке, в ее естественном, т.е. не подвергнутом стрессу, состоянии. Температура может влиять на захват композиций и влиять на жизнеспособность. Способы осуществляют при комнатной температуре (например, 20°C), физиологической температуре (например, 39°C), температуре, превышающей физиологическую температуру, или сниженной температуре (например, 4°C), или при температурах между этими иллюстративными температурами.
После контролируемого повреждения клетки посредством сужения, растяжения и/или импульса с высоким усилием сдвига клетки инкубируют в растворе для доставки, который содержит соединение или молекулу, которые желают ввести в клетку. Контролируемое повреждение может характеризоваться как небольшой, например диаметром 200 нм, дефект в клеточной мембране. Для закрытия повреждения, вызванного прохождением через сужение, период восстановления для клеток составляет порядка нескольких минут. Период доставки составляет 1-10 минут или более, например, 15, 20, 30, 60 минут или более, причем 2-5 минут являются оптимальными при работе при комнатной температуре. Более длительные периоды инкубации в растворе для доставки необязательно обеспечивают увеличенный захват. Например, данные показали, что после 5 минут клетки захватывают мало дополнительного материала или не захватывают его.
Таким образом, изобретение относится к решению длительно существовавших проблем в области доставки лекарственного средства к клеткам и устранению недостатков предшествующих способов.
Что касается доставки материала в эукариотическую клетку, клетки можно классифицировать на две основных категории:
1) Простые для доставки (ETD) клетки: Большинство доступных химических и вирусных способов относятся к этой категории. Простые для доставки клетки часто не имеют прямого клинического значения.
2) Трудные для доставки (DTD) клетки: Высокое клиническое значение. Достижения в технологии доставки могут значительно облегчить/ускорить разработку новых способов терапии. Эта категория включает стволовые клетки, первичные клетки и иммунные клетки. Ожидается, что рынок доставки DTD значительно вырастет по мере ускорения разработки новых терапевтических средств на основе РНК, стволовых клеток и белков в последующие годы.
Способы, описанные в настоящем описании, оказались особенно пригодными для областей разработки DTD, хотя некоторые способы можно использовать для клеток ETD. Кроме того, они облегчают доставку материалов (таких как квантовые точки, углеродные нанотрубки и антитела), которые нельзя эффективно доставить никаким другим способом как в клетки ETD, так и в клетки DTD.
Как правило, в одном аспекте вариант осуществления изобретения может относиться к микрожидкостной системе для обеспечения разрывов клеточной мембраны, причем система включает микрожидкостный канал, определяющий просвет и имеющий такую конфигурацию, что клетка, суспендированная в буфере, может проходить через него, где микрожидкостный канал включает сужение, где диаметр сужения является функцией диаметра клетки.
Варианты осуществления изобретения также могут обеспечить один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки, проходящей через него. Поперечное сечение канала выбрано из группы, состоящей из округлого, эллиптического, удлиненного щелевого, квадратного, шестиугольного и треугольного. Сужение включает область входа, центральную точку и область выхода. Область входа определяет угол сужения, где угол сужения оптимизирован для уменьшения закупорки канала. Микрожидкостная система, кроме того, включает множество микрожидкостных каналов, расположенных параллельно, например, 2, 5, 10, 20, 40, 45, 50, 75, 100, 500, 1000 или более.
Как правило, в другом аспекте варианты осуществления изобретения также обеспечивают способ доставки соединения в клетку, причем способ включает предоставление клетки в суспензии или суспендирование клетки и груза в растворе, пропускание раствора через микрожидкостный канал, который включает сужение, изменение размера сужения в зависимости от диаметра клетки, пропускание клетки через сужение так, чтобы к клетке применялось давление, вызывающее разрывы в клетке, достаточно крупные, чтобы груз прошел через них, и инкубацию клетки в растворе в течение заданного периода времени после того, как он пройдет через сужение.
Варианты осуществления изобретения также могут обеспечивать один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки. Поперечное сечение микрожидкостного канала выбрано из группы, состоящей из кругового, эллиптического, удлиненного щелевого, квадратного шестиугольного и треугольного. Прохождение раствора включает прохождение раствора через область вхождения, центральную точку и область выхода из сужения. Кроме того, способ включает уменьшение закупорки микрожидкостного канала путем корректирования угла сужения в области входа. Прохождение раствора включает прохождение раствора через множество микрожидкостных каналов, расположенных параллельно.
Как правило, в другом аспекте варианты осуществления изобретения также могут обеспечить способ доставки соединения в клетку, причем способ включает предоставление клетки в растворе или суспендирование клетки в растворе, прохождение раствора через микрожидкостный канал, который включает сужение, изменение размера сужения в зависимости от диаметра клетки, прохождение клетки через сужение так, чтобы к клетке применялось давление, вызывающее разрывы в клетке, и инкубацию клетки в растворе, содержащем груз, в течение заданного периода времени после того, как он проходит через сужение, где разрывы являются достаточно большими, чтобы груз проходил через них.
Варианты осуществления изобретения также обеспечивают один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки. Поперечное сечение микрожидкостного канала выбрано из группы, состоящей из кругового, эллиптического, удлиненного щелевого, квадратного шестиугольного и треугольного. Прохождение раствора включает прохождение раствора через область вхождения, центральную точку и область выхода из сужения. Кроме того, способ включает уменьшение закупорки микрожидкостного канала путем корректирования угла сужения в области входа. Прохождение раствора включает прохождение раствора через множество микрожидкостных каналов, расположенных последовательно и параллельно. Инкубация включает инкубацию клетки в течение от 0,0001 секунды до 20 минут (или даже более). Давление представляет собой давление сдвига и сдавления.
Как правило, в другом аспекте, варианты осуществления изобретения также обеспечивают способ доставки соединения в клетку, причем способ включает предоставление клетки в растворе или суспендирование клетки в растворе, деформацию клетки так, чтобы в мембране клетки возникали разрывы, и инкубацию клетки в растворе с грузом после деформации клеток.
Варианты осуществления изобретения также могут обеспечить один или несколько из следующих признаков. Деформация клетки включает деформацию клетки в течение от 1 мкс до 10 мс, например, 10 мкс, 50 мкс, 100 мкс, 500 мкс и 750 мкс. Инкубацию проводят в течение от 0,0001 секунд до 20 минут, например, 1 секунды, 30 секунд, 90 секунд, 270 секунд и 900 секунд.
Различные варианты осуществления изобретения могут обеспечить одну или несколько из следующих возможностей. По сравнению с предшествующими способами можно достигать большей точности и масштабируемости. Доставка материала к клетке может быть автоматизирована. Материал, такой как белки, РНК, миРНК (siRNA), пептиды, ДНК и не проникающий краситель можно вводить в клетку, такую как эмбриональные стволовые клетки или индуцированные плюрипотентные стволовые клетки (iPSC), первичные клетки или иммортализованные клеточные линии. Устройство и способы пригодны для любого типа клеток, и размер области сужения адаптируют к размеру клетки, подлежащей обработке. Устройства и способы могут обеспечить значительные преимущества. Например, экспериментальные искажения в настоящих системах могут быть снижены по сравнению с предшествующими способами. Доставляемые количества материала могут быть постоянными для популяции клеток. Клетки можно индивидуально обрабатывать, а не обрабатывать партией. Изобретение также продемонстрировало довольно уникальную возможность доставлять различные наночастицы и белки в цитозоль. Существующие способы являются недостаточно надежными и недостаточными в отношении выполнения таких функций.
Что касается доставки чувствительных грузов, например, белки (особенно крупные белки, например, более 30, 50, 100, 150, 200, 300, 400, 500 кДа или более), квантовые точки или другие грузы, которые являются чувствительными к электричеству или повреждаются под воздействием электричества, надежно доставляются в клетки при сохранении целостности и активности чувствительного груза. Таким образом, устройство и способы имеют значительные преимущества над существующими способами, такими как электропорация, которая подвергает композиции груза воздействию электричества (тем самым, повреждая груз) и приводят к низкой жизнеспособности (например, 505 или более клеток, как правило, погибают после электропорации). Другим преимуществом способа быстрого растяжения/деформации является то, что стволовые клетки или клетки-предшественники становятся восприимчивыми к захвату груза без изменения состояния дифференцировки или активности обработанной клетки. В дополнение к доставке композиций в цитоплазму клетки для терапевтических целей, например, изготовления вакцин, способ используют для введения молекул, например, больших молекул, содержащих поддающийся обнаружению маркер, для мечения внутриклеточных структур, таких как органеллы, или для мечения внутриклеточных компонентов для целей диагностики или визуализации.
Различные варианты осуществления изобретения также могут обеспечить одну или несколько из следующих возможностей. ДНК можно доставлять в подлежащие доставке дозы клетки, такие как стволовые, первичные, иммунные клетки. Можно проводить доставку очень крупных плазмид (даже целых хромосом). Можно без труда проводить количественную доставку в клетку известного количества генной конструкции для исследования уровня экспрессии представляющего интерес гена и ее чувствительности к концентрации. Можно проводить доставку известных количеств последовательностей ДНК вместе с известным количеством ферментов, которые усиливают рекомбинацию ДНК, для достижения более простой/более эффективной стабильной доставки, гомологичной рекомбинации и сайт-специфического мутагенеза. Способы и устройства, описанные в настоящем описании, также могут быть пригодными для количественной доставки РНК для более эффективных/наглядных исследований РНК. Также можно без труда проводить доставку малой интерферирующей РНК (миРНК) в цитоплазму клетки.
Различные варианты осуществления изобретения также могут обеспечить одну или несколько из следующих возможностей. РНК можно доставлять в клетку для подавления РНК без необходимости в липосомах. Известные количества молекул РНК вместе с известными количествами молекул dicer можно доставлять для обеспечения стандартизованной эффективной РНК в множестве клеточных линий в различных условиях. мРНК можно доставлять в клетки для исследования аспектов регуляции экспрессии генов на посттрансляционном уровне. Могут быть возможными известные количества метки для РНК в целях исследования времени полужизни РНК и клеток. Можно достигать универсальной доставки белка. Известные количества белков-меток можно доставлять для исследований времени полужизни в клетках. Можно осуществлять доставку белков-меток в область расположения исследуемого белка. Известные количества меченых белков можно доставлять для исследования белок-белковых взаимодействий в клеточной среде. Можно осуществлять доставку меченых антител в живые клетки для иммунного окрашивания и вестерн-блоттинга на основе флуоресценции.
Различные варианты осуществления изобретения также могут обеспечивать одну или несколько из следующих клинических или исследовательских возможностей. Можно достигать количественной доставки лекарственных средств в клеточных моделях для улучшения скрининговых исследований и исследований дозировок. Способ можно использовать в качестве высокопроизводительного способа скрининга активности белка в цитозоле, чтобы помочь идентифицировать белковые терапевтические средства или понять механизмы заболевания. Такие применения в настоящее время строго ограничиваются современными способами доставки белков вследствие их неэффективности. Устройства и способы пригодны для внутриклеточной доставки лекарственных средств в конкретную подгруппу циркулирующих клеток крови (например, лимфоциты), высокопроизводительной доставки сахаров в клетки для улучшения криоконсервации клеток, особенно ооцитов, направленной клеточной дифференцировки посредством введения белков, мРНК, ДНК и/или факторов роста, доставки генетического или белкового материала для индукции перепрограммирования клеток для получения клеток iPS, доставки ДНК и/или ферментов рекомбинации в эмбриональные стволовые клетки для разработки линий трансгенных стволовых клеток, доставки ДНК и/или ферментов рекомбинации в зиготы для получения трансгенных организмов, активации DC-клеток, получения iPSC, и дифференцировки стволовых клеток, доставки наночастиц для диагностики и/или механических исследований, а также введения квантовых точек. Также с использованием устройств и способов, описанных в настоящем описании, модифицируют клетки кожи, используемые для пластической хирургии.
Способ стимуляции представления антигена с использованием способа доставки антигена и/или иммуностимулирующих молекул обеспечивает антигенпредставляющие клетки, например, дендритные клетки, с увеличенными уровнями активности по сравнению с традиционными способами стимуляции, тем самым обеспечивая увеличенные уровни опосредуемого T и B-клетками иммунитета в отношении антигена-мишени. Таким образом, такой способ можно использовать в качестве средства активации иммунной системы в ответ на злокачественную опухоль или инфекции.
Для целей скрининга, визуализации или диагностики устройство используют в способе мечения клеток. Способ мечения клеток осуществляют, подвергая клетку контролируемому повреждению и контактируя клетки с раствором, содержащим поддающийся обнаружению маркер, где указанное повреждение включает временное сужение или импульс высокого сдвига. Поддающийся обнаружению маркер включает флуоресцентную молекулу, радионуклид, квантовые точки, золотые наночастицы или магнитные гранулы.
До изобретения манипулирование со стволовыми клетками для введения экзогенных композиций было трудным. Устройство и способы, описанные в настоящем описании, например, для пропускания стволовых клеток или клеток-предшественников, таких как индуцированные плюрипотентные стволовые клетки (iPSC), через канал с сужением, не индуцируют дифференцировку, но надежно индуцируют захват композиции в клетку. Например, в такие клетки вводят факторы дифференцировки. После захвата введенных факторов клетки проходят путь дифференцировки, определяемый введенным фактором, без осложнений, ассоциированных со способом, посредством которого фактор(ы) был введен в клетку.
В дополнение к отдельным клеткам, даже очень крупным клеткам, например яйцеклеткам, диаметром приблизительно 200 мкм, кластеры клеток, например, кластеры из 2-5 клеток, таких как эмбрион, содержащий 2-3 клетки, обрабатывают для захвата заданных композиций. Размер отверстия корректируют соответствующим образом, т.е. так, чтобы ширина сужения была немного ниже размера кластера. Например, ширина канала составляет 20-99% от ширины кластера клеток.
Клетки или кластеры клеток очищают/выделяют или обогащают желаемым типом клеток. Дендритные клетки или другие клетки, например, иммунные клетки, такие как макрофаги, B-клетки, T-клетки или стволовые клетки, такие как эмбриональные стволовые клетки или iPS, используемые в способах, очищают или увеличивают в количестве. Например, клетки выделяют или увеличивают в количестве посредством экспрессии на них маркеров клеточной поверхности или других идентифицирующих характеристик. Дендритные клетки идентифицируют и выделяют благодаря экспрессии ими β-интегрина, CD11c или других идентифицирующих маркеров клеточной поверхности. Что касается клеток, термин "выделенный" означает, что клетка по существу свободна от других типов клеток или клеточного материала, с которыми она встречается в природе. Например, образец клеток конкретного типа тканей или фенотипа является "по существу чистым", когда популяция клеток в нем составляет по меньшей мере 60%. Предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 99% или 100% препарата составляет популяция клеток. Чистоту измеряют подходящим стандартным способом, например, активируемой флуоресценцией сортировкой клеток (FACS).
Композиции груза, такие как полинуклеотиды, полипептиды или другие средства, являются очищенными и/или выделенными. В частности, как используют в рамках изобретения, "выделенная" или "очищенная" молекула нуклеиновой кислоты, полинуклеотид, полипептид или белок, являются по существу свободными от другого клеточного материала или культуральной среды при продуцировании рекомбинантными способами или химических предшественников или других химических веществ, когда они химически синтезированы. Очищенные соединения имеют по меньшей мере 60% по массе (масса сухого вещества) представляющего интерес соединения. Предпочтительно препарат имеет по меньшей мере 75%, более предпочтительно по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 99% по массе представляющего интерес соединения. Например, очищенное соединение представляет собой соединение, которое имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 98%, 99% или 100% (масс./масс.) желаемого соединения по массе. Чистоту измеряют любым подходящим стандартным способом, например, колоночной хроматографией, тонкослойной хроматографией или высокоэффективной жидкостной хроматографией (ВЭЖХ). Очищенный или выделенный полинуклеотид (рибонуклеиновая кислота (РНК) или дезоксирибонуклеиновая кислота (ДНК)) является свободным от генов или последовательностей, которые фланкируют его в его встречающемся в природе состоянии. Примеры выделенной или очищенной молекулы нуклеиновой кислоты включают: (a) ДНК, которая является частью встречающейся в природе молекулы геномной ДНК, но не фланкируется обеими последовательностями нуклеиновой кислоты, которые фланкируют эту часть молекулы в геноме организма, в котором она встречается в природе; (b) нуклеиновую кислоту, встроенную в вектор или в геномную ДНК прокариотического или эукариотического организма так, чтобы полученная молекула не была идентична какому-либо встречающемся в природе вектору или геномной ДНК; (c) отдельную молекулу, такую как кДНК, геномный фрагмент, фрагмент, продуцируемый полимеразной цепной реакцией (ПЦР), или фрагмент рестрикции; и (d) рекомбинантную нуклеотидную последовательность, которая является частью гибридного гена, т.е. гена, кодирующего слитый белок. Выделенные молекулы нуклеиновой кислоты в соответствии с настоящим изобретением дополнительно включают молекулы, продуцируемые синтетически, а также любые нуклеиновые кислоты, которые изменены химически и/или которые имеют модифицированные основные цепи.
Суспензионный раствор представляет собой любой физиологический или совместимый с клеткой буфер или раствор. Например, суспензионный раствор представляет собой клеточную культуральную среду или фосфатно-солевой буфер. Груз представляет собой тот же самый или отличающийся суспензионный раствор, который также содержит композицию, предназначенную для доставки внутрь клетки.
Преимущества устройства включают избегание модификации желаемого груза и отсутствие необходимости в воздействии на груз каких-либо электромагнитных полей или других форм стресса. Что касается электропорации, было показано, что этот способ повреждает белки и является неэффективным в отношении доставки. Этот существенный недостаток не является проблемой в случае способа, описанного в настоящем описании; способ по настоящему изобретению особенно пригоден для доставки чувствительных грузов, например белков, в частности, крупных белков (например, от 40 кДа до 70 кДа, и вплоть до 120, 130, 150, 200 кДа или более), крупных конструкций нуклеиновых кислот (например, плазмиды и другие конструкции, содержащие полимеры нуклеиновой кислоты размером 1 т.п.н., 2 т.п.н., 5 т.п.н. или более и вплоть до целых хромосом), крупных соединений, а также квантовых точек (например, диаметром 12 нм) и других материалов, которые известны тем, что они являются чувствительными и легко повреждаются под воздействием электричества. Например, поверхностные лиганды на наночастице или квантовой точке могут повреждаться или могут становиться заряженными в ответ на электрическое поле, что, таким образом, приводит к агрегации частиц, тем самым ограничивая/устраняя их функциональность. Другим преимуществом способа контролируемого повреждения является время контактирования клеток с композицией для доставки. Особое значение для белков, которые являются чувствительными к протеазам, температурам, а также электричеству, имеет то, что клетки контактируют с раствором груза после обработки и в течение относительно короткого периода времени по сравнению с предшествующими способами. Микрожидкостный характер устройства также требует меньших рабочих объемов, тем самым экономя дорогостоящие исходные материалы и/или клетки. Устройство также может быть сопряжено с существующими способами доставки, такими как электропорация или липосомы, для обеспечения усиленной доставки относительно каждого способа по отдельности.
Функциональная активность доставляемого груза обратно коррелирует со сдвиговой нагрузкой на жидкость, т.е. физическая нагрузка на мембрану клетки, такая как растяжение клеточной мембраны, опосредует захват груза в большей степени, чем усилие сдвига. Общепринятые способы доставки наночастиц могут приводить к большему количеству материала, получающему доступ к внутриклеточной среде клетки; однако эти способы обеспечивают меньшую активность доставляемого материала по сравнению со способами, описанными в настоящем описании, вследствие того факта, что предшествующие способы приводят к изоляции доставляемого материала в эндосомах. Способы, описанные в настоящем описании, обеспечивают прямую доставку в цитозоль соединений/композиций, так чтобы меньшее количество груза, доставляемое в клетку, обеспечивало больший уровень функциональной активности доставляемых молекул вследствие их доступности для других компонентов цитозоля. Например, предшествующие способы доставки наночастиц обеспечили в 2-10 раз большее количество доставляемого материала в клетки, но с небольшой или отсутствием функциональной активности доставляемого материала вследствие изоляции в эндосомах. Устройства и способы по изобретению преодолевают этот недостаток предшествующих способов внутриклеточной доставки вследствие избегания эндосомального компартмента.
Дополнительные преимущества и признаки включают временной масштаб обработки и скорости клеток, которые являются значительно более высокими, чем для предшествующих подходов. Более того, другие способы не сдавливают клетки настолько, насколько настоящие способы, например, как определяют по размеру (диаметру) клетки относительно размера (диаметра) сужения (в качестве % от диаметра клетки). Это быстрое, мощное, но сублетальное, сдавление или деформация обеспечивает лучшие результаты в отношении прямого захвата груза в цитозоль клетками. Деформация клеток является быстрой, т.е. происходит в течение по существу от 1 мкс до 1 мс. Как правило, индуцированный чрезмерной деформацией стресс клетки может быть летальным для клетки, хотя в то же время недостаточный стресс не индуцирует разрывов в клетке. Таким образом, настоящее изобретение относится к способам и системам, которые обеспечивают достаточный стресс для индукции временных разрывов, но не чрезмерный стресс, чтобы разрывы оказались постоянными и летальными для клетки.
Любые из описанных выше способов осуществляют in vitro, ex vivo или in vivo. Для применений in vivo устройство может быть имплантировано в просвет сосуда, например, встроенный стент. Эти и другие возможности изобретения, а также само изобретение, станут более понятными после обзора следующих чертежей, подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1A представлена схематическая диаграмма микрожидкостной системы. Клетки подвергают воздействию доставляемого материала (груза) после пропускания через сужение.
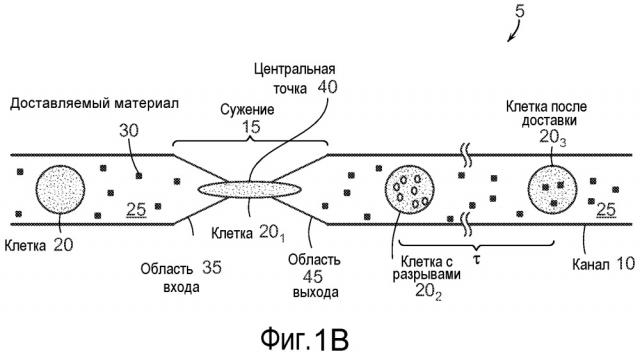
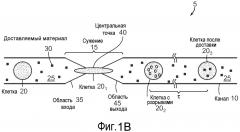
На фиг. 1B представлена схематическая диаграмма микрожидкостной системы. Клетки подвергают воздействию доставляемого материала (груза) на протяжении всего процесса посредством суспендирования клеток в растворе, который включает доставляемый материал (груз) (например, клетки подвергают воздействию доставляемого материала до и после пропускания через сужение).
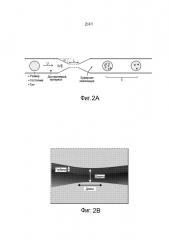
На фиг. 2A представлена схематическая диаграмма варианта осуществления микрожидкостной системы.
На фиг. 2B представлена иллюстрационная диаграмма микрожидкостной системы, на которой изображены глубина, ширина и длина.
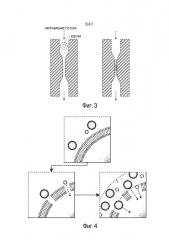
На фиг. 3 представлена схематическая диаграмма микрожидкостной системы.
На фиг. 4 представлена схематическая диаграмма, на которой показаны разрывы клеточной стенки.
На фиг. 5 представлена фотография микрожидкостной системы.
На фиг. 6 представлена фотография микрожидкостной системы.
На фиг. 7 представлена фотография микрожидкостной системы.
На фиг. 8A-8B представлены графики, на которых показаны иллюстративные результаты, полученные для микрожидкостной системы.
На фиг. 9 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 10 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 11 представлен график, на котором показаны иллюстративные результаты, полученные для