Локусы функциональности fad2 и соответствующие специфичные к участку-мишени связывающие белки, способные индуцировать направленные разрывы
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу интегрирования интересующей последовательности нуклеиновой кислоты в ген FAD2 клетки, включающему сайт-специфическое расщепление гена FAD2 клетки растения с использованием нуклеазы с цинковыми пальцами. Также раскрыта сайт-специфическая нуклеаза с цинковыми пальцами для применения в модифицировании гена FAD2. Изобретение позволяет эффективно интегрировать интересующую последовательность нуклеиновой кислоты в клетку растения. 2 н. и 5 з.п. ф-лы, 24 ил., 14 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по временной патентной заявке США № 61/697886, поданной 7 сентября 2012 года, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к композициям и способам для применения в технологии рекомбинантных растений (например, для получения трансгенного растения). Более конкретно, настоящее изобретения относится к клеткам растений и к растениям, включающим локусы в их геномах, которые можно использовать для сайт-специфического внесения любой представляющей интерес нуклеиновой кислоты.
УРОВЕНЬ ТЕХНИКИ
Многие растения генетически трансформируют экзогенными нуклеиновыми кислотами (например, трансгенами) для внесения желаемых признаков, например, для повышения сельскохозяйственной ценности. Примеры повышения сельскохозяйственной ценности, которое может быть достигнуто с помощью генетической трансформации, включат: улучшение питательных качеств, увеличение урожая, устойчивость к паразитам или заболеваниям, устойчивость к засухе и стрессовым факторам, улучшение садоводческих качеств (например, улучшение пигментации и/или роста), устойчивость к гербицидам, продуцирование полезных для промышленности соединений и/или материалов в растении и/или продуцирование фармацевтических веществ. Внесение клонированных генов в клетки растений и восстановление стабильных фертильных трансгенных растений можно использовать для осуществления генетической модификации растения, стабильной на протяжении множества поколений, и, тем самым, для получения возможности создания способами генной инженерии сельскохозяйственной культуры.
В способах генетической трансформации и получения трансгенного растения экзогенную ДНК, как правило, случайным образом вносят в ядерную или пластидную ДНК эукариотической клетки растений, после чего проводят выделение клеток, содержащих встроенную экзогенную ДНК, и последующую регенерацию стабильно трансформированного растения. Трансгенные растения, как правило, получают с помощью технологии опосредуемой Agrobacterium трансформации. Успех этих способов способствовал разработке других способов внесения представляющей интерес молекулы нуклеиновой кислоты в геном растения, таких как опосредуемый PEG захват ДНК в протопласты, бомбардировка микроснарядами и опосредуемая кремниевой нитью трансформация.
Однако во всех из этих способов трансформации растений экзогенные нуклеиновые кислоты, встраивающиеся в геном растения, встраиваются в геном клетки растения случайным образом и в непрогнозируемом числе копий. Terada et al. (2002) Nat Biotechnol 20(10):1030; Terada et al. (2007) Plant Physiol 144(2):846; D'Halluin et al. (2008) Plant Biotechnology J. 6(1):93. Например, трансгены часто встраиваются в форме повторов последовательности либо целого трансгена, либо его частей. Такая картина комплексного встраивания часто неблагоприятно влияет на уровень экспрессии встроенной нуклеиновой кислоты (например, посредством разрушения транскрибируемой РНК с помощью механизмов посттрансляционного сайленсинга генов, или вследствие индукции метилирования встроенной ДНК). Также на уровень экспрессии встроенной нуклеиновой кислоты часто влияет расположение участка встраивания. Более того, встраивание экзогенной ДНК может оказывать эффект разрушения на область генома, где происходит встраивание, и, тем самым, может влиять и нарушать нормальную функцию этой области-мишени, вызывая нежелательные побочные эффекты. Комбинация факторов, включая указанные выше, приводит к широкому варьированию уровня экспрессии трансгена или экзогенной ДНК (и общего агрономического качества) между различными клетками растений и линиями растений, даже теми из них, которые созданы одними и теми же способами. Поскольку встраивание является случайным, практикующий специалист не может контролировать эти эффекты, когда он или она пытается получить новое растение с желаемыми характеристиками.
Указанные выше соображения указывают на то, что, когда исследуют эффекты внесения конкретной нуклеиновой кислоты в растение, необходимо получить и проанализировать большое количество линий трансгенных растений, чтобы достигнуть значимых результатов. Аналогично, при получении трансгенного растения, содержащего конкретную встроенную нуклеиновую кислоту, чтобы получить трансгенное растение с желаемым фенотипом, должна быть создана большая группа независимо полученных линий трансгенных растений для возможности селекции линии растений с оптимальной экспрессией нуклеиновой кислоты и с минимальными побочными эффектами на общий фенотип и функциональность трансгенного растения или с их отсутствием. Эти практические соображения приобретают дополнительную важность в случае трансгенных растений, созданных путем встраивания множества экзогенных нуклеиновых кислот (т.е. стэкинга генов). В таких растениях явления, такие как посттрансляционный сайленсинг генов, могут усиливаться.
В попытках контроля встраивания трансгена в растения было разработано несколько способов. См., например, Kumar and Fladung (2001) Trends Plant Sci. 6:155-9. В основе этих способов лежит основанное на гомологичной рекомбинации встраивание трансгена, которое успешно использовали как в прокариотах, так и в низших эукариотах. Paszkowski et al. (1988) EMBO J. 7:4021-6. Однако до недавнего времени в растениях преобладающий механизм встраивания трансгенов был основан на незаконной рекомбинации, которая вовлекает малую гомологию между рекомбинирующими цепями ДНК. Основной проблемой в этом случае, таким образом, является обнаружение и селективное получение редких событий гомологичной рекомбинации, которые маскируются значительно более эффективными событиями встраивания вследствие незаконной рекомбинации. Более того, даже если осуществлено селективное получение и обнаружение заданных событий гомологичной рекомбинации, событие должно быть нацелено в желаемую область генома хозяина для достижения максимальной пользы этой стратегии.
Например, предполагаемой пользой направленной генетической трансформации является уменьшение вариабельности экспрессии трансгена от события к событию, по сравнению с событиями трансформации, которые достигнуты случайным встраиванием. Следующей предполагаемой пользой является значительное снижение количества событий, требуемых для скрининга внесенных нуклеиновых кислот, сортировки конструкций трансформации и достижения событий, которые приводят к желаемым общим характеристикам полученного трансгенного растения. Критическим фактором, требуемым для реализации этой пользы, является идентификация конкретных положений в геноме, где функциональность трансгена является постоянной и, если возможно, где неблагоприятные эффекты растения-хозяина устранены или минимизированы.
Недавно были описаны способы и композиции для направленного расщепления геномной ДНК. Такие события направленного расщепления можно использовать, например, для индукции направленного мутагенеза, для индукции направленных делеций в последовательностях ДНК клеток, и для облегчения направленной рекомбинации и встраивания в заданном хромосомном локусе. См., например, Umov et al. (2010) Nature 435(7042):646-51; публикации патентов США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20090263900; 20090117617; 20100047805; 20110207221; 20110301073; 2011089775; 20110239315; 20110145940 и международную публикацию WO 2007/014275, содержание которых включено в качестве ссылок в полном объеме для всех целей. Расщепление можно проводить с использованием специфических нуклеаз, таких как модифицированные способами инженерии нуклеазы с цинковыми пальцами (ZFN), подобные активаторам транскрипции эффекторные нуклеазы (TALEN), или с использованием системы CRISPR/Cas с модифицированной способами инженерии crRNA/tracr РНК ("единая РНК-гид") для обеспечения специфического расщепления. В публикации патента США № 20080182332 описано применение неканонических нуклеаз с цинковыми пальцами (ZFN) для направленной модификации геномов растений; в публикации патента США № 20090205083 описана опосредуемая ZFN направленная модификация локуса EPSPS растений; в публикации патента США № 20100199389 описана направленная модификация локуса Zp15 растений и в публикации патента США № 20110167521 описана направленная модификация генов растений, вовлеченных в биосинтез жирных кислот. Кроме того, в Moehle et al. (2007) Proc. Natl Acad, Sci. USA 104(9):3055-3060 описано использование сконструированных ZFN для направленного добавления гена в конкретный локус. В публикации патента США 20110041195 описаны способы получения гомозиготных диплоидных организмов.
Однако остается потребность в композициях и способах для модификации и/или модулирования экспрессии генов FAD2 в растениях, включая получение растений с направленными вставками желаемых трансгенов в локус FAD2.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам для модулирования экспрессии генов FAD2 (например, в растениях, водорослях и грибах) и к применению этих локусов в качестве участков для направленного введения представляющей интерес последовательности нуклеиновой кислоты (например, экзогенной последовательности нуклеиновой кислоты) в клетку-хозяина. В некоторых вариантах осуществления клетка-хозяин может содержать один или несколько геномов с одной или несколькими последовательностями FAD2 (например, гомологи или паралоги), любые или все из которых могут быть селективно модифицированы и/или разрушены. В конкретных примерах настоящее изобретение относится к генам FAD2A, FAD2A'', FAD2C и FAD2C', а также к соответствующим гомологам или паралогам, в Brassica napus (т.е. в линии B. napus DH12075) и к их применению в качестве локусов для направленного встраивания представляющей интерес последовательности нуклеиновой кислоты. Как описано в настоящем описании, хотя гены FAD2 вовлечены в биосинтез жирных кислот в хозяине, их модификация или разрушение (например, вследствие встраивания экзогенной нуклеиновой кислоты в кодирующую последовательность FAD2) неожиданно могут не иметь неблагоприятных эффектов или могут иметь минимальные неблагоприятные эффекты на полученный организм хозяина.
Также в настоящем описании описано применение одного или нескольких конкретных локусов FAD2 в тандеме с полипептидом, способным осуществлять расщепление и/или встраивание конкретных последовательностей нуклеиновой кислоты в локусы FAD2. Примеры применения локусов FAD2 в тандеме с полипептидом, способным осуществлять расщепление и/или встраивание локусов FAD2, включают полипептид, выбранный из группы, состоящей из белков с цинковыми пальцами, мегануклеаз, TAL-доменов, TALEN, РНК-направляемых CRISPR-Cas9, рекомбиназ, лейциновых молний, CRISPr/Cas и других полипептидов, известных в данной области. Конкретные примеры включают химерный ("слитый") белок, содержащий полипептид с сайт-специфическим ДНК-связывающим доменом и полипептид с доменом расщепления (например, нуклеаза), такой как белок ZFN, содержащий полипептид с цинковыми пальцами и полипептид нуклеазы Fok1. Например, в настоящем описании описана демонстрация эффективности и специфичности in vitro и in vivo конкретных ZFN, сконструированных для связывания и индукции двухцепочечных разрывов в FAD2A, FAD2A', FAD2C, FAD2C' и в их комбинациях без расщепления соответствующих гомологов или паралогов. В некоторых вариантах осуществления конкретные локусы FAD2 можно использовать с любым из указанных выше полипептидов для обеспечения сайт-специфического встраивания представляющей интерес нуклеиновой кислоты, которая впоследствии экспрессируется в хозяине, оказывая минимальное неблагоприятное влияние на агрономическую функциональность хозяина.
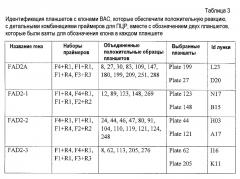
В некоторых аспектах в рамках настоящего изобретения описаны полипептиды, содержащие ДНК-связывающий домен, который специфически связывается с геном FAD2. В некоторых вариантах осуществления такой полипептид также может содержать нуклеазный домен (домен расщепления) или половинный домен (например, ZFN, рекомбиназа, транспозаза или хоминг-эндонуклеаза, включая хоминг-эндонуклеазу с модифицированным ДНК-связывающим доменом, TAL-доменами, TALEN, РНК-направляемыми CRISP-Cas9), и/или лигазный домен, так что полипептид может индуцировать направленный двухцепочечный разрыв и/или способствовать рекомбинации представляющей интерес нуклеиновой кислоты в области разрыва. В конкретных вариантах осуществления ДНК-связывающий домен, который нацелен на локус FAD2, может представлять собой расщепляющий ДНК функциональный домен. В некоторых вариантах осуществления указанные выше полипептиды можно использовать для внесения экзогенной нуклеиновой кислоты в геном организма хозяина (например, виды растений или животных) в одном или нескольких локусах FAD2. В определенных вариантах осуществления ДНК-связывающие домены содержат белок с цинковыми пальцами, который имеет один или несколько цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или более цинковых пальцев) и который может быть модифицированным способами инженерии (не является встречающимся в природе) так, чтобы он связывался с любой последовательностью в гене FAD2. Любой из белков с цинковыми пальцами, описанных в настоящем описании, может связываться с участком-мишенью в кодирующей последовательности гена-мишени или в соседних последовательностях (например, промоторы или другие элементы экспрессии). В определенных вариантах осуществления белок с цинковыми пальцами связывается с участком-мишенью в гене FAD2, например, как показано в таблице 5. Распознаваемые спиральные области иллюстративных связывающих FAD2 цинковых пальцев представлены в таблице 4. Один или несколько связывающих доменов в виде цинковых пальцев, являющихся компонентами белка с цинковыми пальцами, могут представлять собой канонические (C2H2) цинковые пальцы или неканонические (например, C3H) цинковые пальцы (например, N-концевой и/или C-концевой цинковый палец может представлять собой неканонический палец).
Также в настоящем описании описаны способы разрушения или редактирования гена FAD2. Кроме того в настоящем описании описаны генетически модифицированные организмы-хозяева (например, трансгенные растения), получаемые способами согласно вариантам осуществления изобретения. В конкретных примерах трансгенный организм, получаемый способом согласно одному варианту осуществления изобретения, может представлять собой, но не ограничивается ими, водоросль, гриб, однодольное растение, двудольное растение и т.д.
Гены FAD2, описанные в настоящем описании, могут включать гены, встречающиеся в любом растении, водоросли или грибе, которые могут иметь один или несколько генов FAD2.
Указанные выше и другие признаки станут более понятными из представленного ниже подробного описания нескольких вариантов осуществления, которое предоставлено с отсылкой на прилагаемые чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1, панели с A по E, представлено выравнивание последовательностей гена FAD2 (SEQ ID NO: 5-8), проведенное с использованием AlignX®.
На фиг. 2 представлена схема, на которой показано филогенетическое дерево последовательностей генов FAD2, полученное с использованием Jalview v 2.3 на основе расстояний, полученных методом ближайшего связывания.
На фиг. 3 представлена карта плазмиды pDAB104010, которая является репрезентативной экспрессирующей кассетой для нуклеаз с цинковыми пальцами. План этой конструкции сходен с другими экспрессирующими кассетами для ZFN, где домены цинковых пальцев 24828 и 24829 заменены альтернативными доменами цинковых пальцев, которые описаны выше.
На фиг. 4 представлен иллюстративный график с множеством кривых, демонстрирующий количество считанных последовательностей с делециями в заданном участке ZFN на 10000 считанных последовательностей. На оси X на графике представлено количество удаленных оснований, на оси Y представлено количество считанных последовательностей, и на оси Z представлено кодируемое цветом обозначение образца, как описано справа на графике. Конкретный представленный пример представляет собой пример локуса 1 семейства генов FAD2, которое содержит 3 участка-мишени для ZFN: A, B и C, с четырьмя представителями семейства генов и двумя контрольными трансфекциями, оцениваемыми в качестве контрольных образцов A и B. Линии, приведенные сверху вниз (от A-контроль_FADA' сверху легенды до C_образец_FAD2C снизу легенды) представлены на графике от наиболее близкой к обозначенной оси X (A_контроль_FADA') до наиболее удаленной от обозначенной оси X (C_образец_FAD2C).
На фиг. 5, панели A и B, представлено нацеливание ZFN на гены FAD2. На фиг. 5A представлен график, на котором представлены данные нацеливания ZFN на локус 4 семейства генов FAD2. Локус содержит два участка ZFN и две необходимые контрольных трансфекции. На фиг. 5B представлен конкретный контекст последовательности (SEQ ID NO: 471-480), окружающий участок-мишень для ZFN, где обозначены FAD2A и C, содержащие тринуклеотидные повторы C, T и G, что приводит к наблюдаемому увеличению однонуклеотидных делеций при секвенировании локусов FAD2A и C.
На фиг. 6 представлена карта плазмиды pDA000130.
На фиг. 7 представлена карта плазмиды pDAS000031.
На фиг. 8 представлена схема, демонстрирующая участки связывания праймеров и зонда на трансгене-мишени для анализа в целях оценки числа копий трансгена.
На фиг. 9 представлен файл Sequencher, демонстрирующий домен ZFN, распознающий ДНК FAD2A (bc12075_Fad2a-r272a2 и bc12075_Fad2a-278a2) и участки связывания специфических праймеров для ZFN (FAD2A.UnE.F1 и FAD2A.UnE.R1) и эндогенных праймеров (FAD2A/2C.RB.UnE.F1 и FAD2A/2C.RB.UnE.R1).
На фиг. 10 представлена схема, демонстрирующая участки связывания праймеров на эндогенной и трансгенной мишени, используемых для обнаружения встраивания трансгенов FAD2A с помощью полной HDR.
На фиг. 11 представлена схема, где участки рестрикции эндонуклеазой pn1 встречаются в полностью отредактированном локусе FAD2A, и где связываются зонды для саузерн-блоттинга FAD2a 5', hph и FAD2A 3'.
На фиг. 12 представлено расположение и размер фрагментов Kpn1, зондов FAD2A 5', hph, FAD2A 3' и ожидаемый исход анализа с использованием саузерн-блоттинга для растений, в которых произошло встраивание ETIP в локус FAD2A посредством HDR.
На фиг. 13 представлены репрезентативные данные оценки числа копий с помощью q-ПЦР. В левом столбце представлены данные, полученные для известного растения T0 с одной случайной вставкой, которое использовали в качестве калибровочного образца, относительно которого все другие образцы "нормализовывали". В правом столбце представлено известное трансгенное растение T0 с 5 вставками трансгенов. Число встраиваемых копий для обоих растений определяли с использованием саузерн-анализа. В остальных столбцах предоставлены оценки числа копий для предполагаемых трансгенных растений. Столбцы обозначены как; контроль с 1 копией, 310420, 311819, 311821, 311822, 311823, 311824, 311827, 312524, 312525, 312526, 312527, 312529, 312530, 312532, 313810, 313811, 313905, 313941, 313942, 313944 и контроль с 5 копиями. Столбцы можно использовать для определения оцененного числа копий каждого трансгенного растения. При использовании программного обеспечения для оценки числа копий, растения дикого типа, нетрансформированные растения и контроли только с плазмидой не дают результата о числе копий, поскольку они не обладают Cq как для мишени hph, так и для мишени HMG 7/7.
На фиг. 14 представлена карта плазмиды pDAS000129.
На фиг. 15 представлена схема встраивания pDAS000129 в локус FAD2A.
На фиг. 16 представлена карта плазмиды pDAS000097.
На фиг. 17 представлена карта плазмиды pDAS000389.
На фиг. 18 представлена карта плазмиды pDAS000391.
На фиг. 19 представлена карта плазмиды pDAS000392.
На фиг. 20 представлена карта плазмиды pDAS000393.
На фиг. 21 представлена карта плазмиды pDAS000394.
На фиг. 22 представлена карта плазмиды pDAS000395.
На фиг. 23 представлена карта плазмиды pDAS000396.
На фиг. 24 представлена карта плазмиды pDAS000397.
ПОСЛЕДОВАТЕЛЬНОСТИ
Последовательности нуклеиновых кислот представлены с использованием стандартных буквенных сокращений для нуклеотидных оснований, как определено в 37 C.F.R. § 1.822. Показана только одна цепь каждой последовательности нуклеиновой кислоты, однако понятно, что комплементарная цепь охватывается при любом указании на представленную цепь.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор нескольких вариантов осуществления
Варианты осуществления изобретения демонстрируют подход для направленного встраивания экзогенных нуклеиновых кислот (например, трансгенов) в геном хозяина без значительного неблагоприятного влияния на другие фенотипы хозяина, помимо тех из них, на которые воздействует встроенная нуклеиновая кислота. Некоторые варианты осуществления можно использовать для "стэкинга" множества нуклеиновых кислот в одном геноме хозяина. Такой подход требует разработки и внедрения четырех взаимосвязанных технологий: технологии нацеливания, позволяющие внесение двухцепочечных разрывов в конкретные положения в геномной ДНК (см., например, Puchta et al. (1993) Nucleic Acids Res. 21:5034-40; Siebert and Puchta (2002) Plant Cell 14:1121-31; D'Halluin et al. (2008) Plant Biotechnol. J. 6(1):93-102; Cai et al. (2009) Plant Mol. Biol. 69(6):699-709; ShuHa et al. (2009) Nature 459(7245):437-41); Shan et al. (2103) Nature Biotechnol. 31:686-680; Le et al. (2013) Nature Biotechnol 31: 688-691; Nekrasov et al. (2013) Nature Biotechnol. 31: 691-693, Ainely et al. (2013) Plant Biotechnol. J. (On Line 19 Aug); технологии доставки, позволяющие доставку оптимизированной экзогенной (донорной) нуклеиновой кислоты (Bibikova et al. (2003) Science 300(5620):764); технологии встраивания, вовлекающие модификацию генов хозяина (расположенных в каскадах либо гомологичной рекомбинации, либо NHEJ), чтобы увеличить частоты HDR или NHEJ для направленного встраивания донорной ДНК; аналитические инструменты для увеличения количества и охарактеризации событий направленного встраивания; и определенные положения в геноме желаемого хозяина ("локусы функциональности"), которые генетически хорошо определены и которые поддерживают стабильную экспрессию генов на протяжении поколений без значительного неблагоприятного влияния на трансформированный организм хозяина. Также см. патентные публикации США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20090263900; 20090117617; 20100047805; 20110207221; 20110301073; 2011089775; 20110239315; 20110145940; 20080182332; 20090205083; 20100199389; 20110167521. Например, в растениях локус функциональности представляет собой локус, в котором отрицательное влияние на агрономические или качественные свойства трансгенного растения, когда трансген встроен в локус, являются незначительными или отсутствуют.
В вариантах осуществления, описанных в настоящем описании, используется неожиданное открытие, что гены FAD2 растений являются локусами функциональности для направленного встраивания экзогенных нуклеиновых кислот (например, ген(ы); некодирующие последовательности ДНК, такие как сконструированные способами инженерии подушки для встраивания (ELP) (заявка США 12/011735) и сконструированная способами инженерии платформа для встраивания трансгена (ETIP) (находящаяся на рассмотрении заявка США № 61/697882); и элемент(ы) трансформации растений). Характер повсеместной распространенности локусов FAD2 в растениях и данные о том, что изменение или нокаут FAD2 в каноле, кукурузе, подсолнечнике, пшенице, хлопке и сое не приводит к ухудшению агрономических или качественных признаков, идентифицируют локусы FAD2 в качестве широкого класса локусов функциональности среди коммерчески значимых видов растений.
В некоторых вариантах осуществления используется сайт-специфическое расщепление двухцепочечной ДНК в локусе FAD2, например, путем доставки и экспрессии специфичного к участку-мишени белка, распознающего и расщепляющего ДНК. В конкретных примерах такой специфичный к FAD2 распознающий и расщепляющий ДНК белок может представлять собой, например, но не ограничиваясь этим, ZFN; TALEN; РНК-направляемые CRISPR-Cas9, рекомбиназу (например, рекомбиназы Cre, Hin, RecA, Tre и FLP); мегануклеазу и созданный способами инженерии белок, происходящий из любого из вышеуказанных белков или их эквивалентов. На расщепление можно влиять с использованием системы CRISPR Cas с модифицированной способами инженерии crRNA-tracr РНК ("единая РНК-гид") для направления на специфическое расщепление. В некоторых вариантах осуществления такой двухцепочечный разрыв можно репарировать путем встраивания донорной нуклеиновой кислоты в участок расщепления в локусе функциональности FAD2, например, с помощью направляемой гомологией репарации (HDR) или связывания негомологичных концов (NHEJ).
Настоящее описание иллюстрирует применимость локусов FAD2 в качестве локусов функциональности, например, путем описания локуса FAD2A, 2A', 2C или 2C в каноле (Brassica napus), и соответствующих специфичных к FAD2 ZFN, которые можно использовать для встраивания экзогенной нуклеиновой кислоты в локус FAD2A, 2A', 2C или 2C.
Варианты осуществления настоящего изобретения направлены на множество нерешенных проблем в данной области. Например, селективность подхода направленного встраивания, описанного в настоящем описании, может снижать или устранять необходимость в многократных испытаниях в полевых условиях, требуемых для устранения нежелательных трансгенных событий, которые являются дорогостоящими вследствие вовлеченных ресурсов и обременительных нормативных требований в этой области. Более того, подходы направленного встраивания ДНК, описанные в настоящем описании, могут быть особенно полезными в процессе стэкинга трансгенов.
Хотя нативную нуклеотидную последовательность в эндогенном локусе FAD2 можно использовать для прямого нацеливания представляющей интерес нуклеиновой кислоты, в некоторых вариантах осуществления нуклеиновая кислота может быть сначала нацелена по меньшей мере на один локус FAD2 хозяина так, чтобы встраивание других молекул представляющих интерес нуклеиновой кислоты облегчалось. В других примерах можно использовать нуклеотидные последовательности, которые не являются гомологичными нативным последовательностям организма хозяина (например, по существу случайным образом полученные последовательности нуклеиновой кислоты), которые фланкируют участок распознавания ДНК (например, участки распознавания цинковыми пальцами).
II. Термины
Как используют в настоящей заявке, включая формулу изобретения, термины в единственном числе и формы единственного числа включают множественное число упоминаемых объектов, если контекст явно не указывает на иное. Таким образом, например, указание на "растение" также относится к множеству растений. Более того, в зависимости от контекста, использование термина "растение" также может относиться к генетически сходному или идентичному потомству этого растения. Аналогично, термин "нуклеиновая кислота" может относиться к множеству копий молекулы нуклеиновой кислоты. Аналогично, термин "зонд" может относиться к множеству сходных или идентичных молекул зондов.
Числовые диапазоны включают числа, определяющие диапазон, и прямо включают каждую целочисленную и нецелочисленную долю в определенном диапазоне. Если нет иных указаний, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в данной области.
Чтобы упросить обзор различных вариантов осуществления, описанных в настоящем описании, предоставляется следующее пояснение конкретных терминов:
Выделенный: "выделенный" биологический компонент (такой как нуклеиновая кислота или белок) по существу отделен, получен отдельно или очищен от других биологических компонентов в клетке организма, в котором компонент встречается в природе (т.е. другие хромосомные и внехромосомные ДНК и РНК и белки), с осуществлением химического или функционального изменения компонента (например, нуклеиновая кислота может быть выделена из хромосомы посредством разрушения химических связей, соединяющих нуклеиновую кислоту с остальной ДНК в хромосоме). Молекулы нуклеиновой кислоты и белки, которые являются "выделенными", включают молекулы нуклеиновой кислоты и белки, очищенные стандартными способами очистки. Также термин охватывает нуклеиновые кислоты и белки, полученные посредством рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновой кислоты, белки и пептиды.
Скрещивание: как используют в рамках изобретения в отношении растений, термин "скрещивание" или "скрещенный" относится к слиянию гамет посредством опыления с образованием потомства (например, клеток, семян и растений). Этот термин охватывает как половое скрещивание (т.е. опыление одного растения другим), так и селфинг (т.е. самоопыление, например, с использованием пыльцы и яйцеклетки одного и того же растения).
Обратное скрещивание: способы обратного скрещивания можно использовать для введения последовательности нуклеиновой кислоты в растения. Этот способ широко используется в течение десятилетий для введения новых признаков в растения. N. Jensen, Ed. Plant Breeding Methodology, John Wiley & Sons, Inc., 1988. В типичном протоколе обратного скрещивания исходный представляющий интерес сорт (рекуррентный родитель) скрещивают со вторым сортом (нерекуррентный родитель), который содержит представляющую интерес последовательность нуклеиновой кислоты, подлежащую переносу. Затем потомство, полученное с помощью этого скрещивания, вновь скрещивают с рекуррентным родителем, и процесс повторяют до тех пор, пока не получат растение, где по существу все из желаемых морфологических и физиологических характеристик рекуррентного родительского растения воспроизведены в преобразованном растении, в дополнение к перенесенной последовательности нуклеиновой кислоты из нерекуррентного родителя.
Интрогрессия: Как используют в рамках изобретения, термин "интрогрессия" относится к переносу аллеля (или модифицированного аллеля, содержащего экзогенную нуклеиновую кислоту) в генетический фон конкретного локуса. В некоторых вариантах осуществления интрогрессия конкретной формы аллеля в локусе может происходить путем передачи аллеля по меньшей мере одному потомку посредством полового скрещивания между двумя родителями одного и того же вида, где по меньшей мере один из родителей имеет конкретную форму аллеля в его геноме. Потомство, содержащее конкретную форму аллеля, можно повторно скрещивать с линией, имеющей желаемый генетический фон. Потомство обратного скрещивания можно выбирать по конкретной форме аллеля, чтобы получить новый сорт, где конкретная форма аллеля является фиксированной в генетическом фоне. В некоторых вариантах осуществления интргрессия конкретной формы аллеля может происходить посредством рекомбинации двух донорных геномов (например, в слитом протопласте), где по меньшей мере один из донорных геномов имеет конкретную форму аллеля в его геноме. Интрогрессия может вовлекать передачу конкретной формы аллеля, которая может представлять собой, например, но не ограничиваясь этим, разрушенный или модифицированный аллель, трансген; PTU и ELP.
Зародышевая плазма: как используют в рамках изобретения, термин "зародышевая плазма" относится к генетическому материалу отдельного растения, группы растений (например, линия, сорт и семейство растений), и клона, происходящего из растения или группы растений. Зародышевая плазма может быть частью организма или клетки, или она может быть отдельной (например, выделенной) от организма или клетки. Как правило, зародышевая плазма обеспечивает генетический материал с конкретным молекулярным составом, который является основной наследуемых качеств растения. Как используют в рамках изобретения, "зародышевая плазма" относится к клеткам конкретного растения; семени; ткани конкретного растения (например, ткань, из которой можно выращивать новые растения); и происходящим не из семян частям конкретного растения (например, листья, стебель, пыльца и клетки). Как используют в рамках изобретения, термин "зародышевая плазма" является синонимом "генетического материала" и его можно использовать для обозначения семени (или другого растительного материала), посредством которого растение может быть размножено. "Банк зародышевой плазмы" может относиться к организованной коллекции различных семян или другого генетического материала (где каждый генотип является уникально идентифицированным), из которого можно культивировать известный сорт и из которого можно получать новый сорт.
Ген: как используют в рамках изобретения, термин "ген" (или "генетический элемент") может относиться к наследуемой геномной последовательности ДНК, имеющей функциональную значимость. Ген может представлять собой нативную нуклеиновую кислоту или нуклеиновую кислоту, которая была встроена в геном. Термин "ген" также можно использовать для обозначения, например, но не ограничиваясь этим, кДНК и/или мРНК, кодируемой наследуемой последовательностью геномной ДНК.
Молекула нуклеиновой кислоты: как используют в рамках изобретения, термин "молекула нуклеиновой кислоты" может относиться к полимерной форме нуклеотидов (т.е. рибонуклеотиды, дезоксирибонуклеотиды и/или модифицированная форма любого из вышеуказанных). Этот термин включает как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК, и их синтетические формы и смешанные полимеры. Термин включает любую топологическую конформацию, включая одноцепочечную, двухцепочечную, частично дуплексную, триплексную, шпилечную, кольцевую и замкнутую конформации. Молекула нуклеиновой кислоты может включать любой или оба типа из встречающихся в природе и модифицированных нуклеотидов. Такие нуклеотиды могут быть связаны вместе встречающимся в природе и/или не встречающимися в природе нуклеотидными связями.
Молекулы нуклеиновой кислоты могут быть модифицированы химически или биохимически, или они могут содержать дериватизированные нуклеотидные основания, как будет хорошо понятно специалистам в данной области. Такие модификации включают, например, но не ограничиваясь ими: метки; метилирование; замена одного или нескольких встречающихся в природе нуклеотидов аналогом; и межнуклеотидные модификации (например, незаряженные связи, например, метилфосфонаты, фосфотриэфиры, фосфорамидаты и карбаматы; заряженные связи, например, фосфоротиоаты и фосфородитиоаты; выступающие группы, например, пептиды; интеркаляторы, например, акридиновые и псораленовые хелаторы; алкилаторы; и модифицированные связи, например, альфа-аномерные нуклеиновые кислоты).
Экзогенный: "экзогенная" молекула представляет собой молекулу, которая не является нативной для определенной системы (например, зародышевая плазма, сорт, элитный сорт и/или растение) в отношении нуклеотидной последовательности и/или положения полинуклеотида в геноме (т.е. локуса) (и в отношении аминокислотной последовательности и/или клеточной локализации полипептида). В вариантах осуществления экзогенные или гетерологичные полинуклеотиды или полипептиды могут представлять собой молекулы, которые искусственным образом предоставлены биологической системе (например, клетка растения, ген растения, конкретный вид или сорт растений, и/или хромосома растения) и они не являются нативными для конкретной биологической системы. Таким образом, обозначение нуклеиновой кислоты как "экзогенная" может указывать на то, что нуклеиновая кислота произошла из источника, отличного от природного источника, или оно может указывать на то, что нуклеиновая кислота имеет неприродную конфигурацию, генетическое положение или расположение элементов.
Напротив, например, "нативная" или "эндогенная" нуклеиновая кислота представляет собой нуклеиновую кислоту (например, ген), которая не содержит элемент нуклеиновой кислоты, отличный от элементов, обычно присутствующих в хромосоме или другом генетическом материале, в котором нуклеиновая кислота в норме встречается в природе. Транскрипт эндогенного гена кодируется нуклеотидной последовательностью в ее природном хромосомном локусе и не предоставляется искусственным образом клетке.
Функционально связанный: первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, когда промотор влияет на транскрипцию или экспрессию кодирующей последовательности. При рекомбинантной продукции функционально связанные последовательности ну