Анти-неr2 антитело и его конъюгат
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению анти-HER2 антитела и конъюгата анти-HER2 антитела и низкомолекулярного медицинского средства, и может быть использовано в медицине. Полученное антитело и его конъюгат, а также фармацевтическую композицию на их основе применяют для лечения и профилактики рака. Также рассмотрены полинуклеотид, комбинация полинуклеотидов и экспрессионные векторы. Кроме того, описано применение антитела и фармацевтических композиций в приготовлении лекарственного средства для лечения или профилактики рака. Изобретение позволяет получить противораковое лекарственное средство, нацеленное на HER2, для пациентов со сверхэкспрессирующими HER2 опухолями или другими экспрессирующими HER2 релевантными заболеваниями, которые не имеют или имеют слабый ответ на терапию с Герцептином. 12 н. и 6 з.п. ф-лы, 18 ил., 6 табл., 13 пр.
Реферат
Область техники
[01] Настоящее изобретение относится к новому HER2 антителу или его функциональным фрагментам, содержащим сконструированные тяжелые цепи и легкие цепи. Настоящее изобретение дополнительно относится к конъюгатам усовершенствованного HER2 антитела c низкомолекулярными лекарственными средствами. Настоящее изобретение дополнительно относится к применению антитела и конъюгатов в получении лекарственного средства для лечения опухолей.
Уровень техники
1. Краткий обзор HER2
[02] ErbB2, также известный как HER2/neu, является вторым членом семейства EGFR, который образует гетеродимер с другими тремя членами в семействе EGFR, так что он проявляет биологическую функцию. К настоящему времени лиганд, который может непосредственно связывать ErbB2, все еще не был обнаружен. Ген neu, кодирующий ErbB2, первоначально был выделен из крысиной нейробластомы. Гомологичный neu ген в человеческих соматических клетках, известный как HER2, расположен на хромосоме 17q21.1. Кодируемый продукт представляет собой ErbB2, который составлен из 1255 аминокислот с молекулярной массой приблизительно 185 кДа, в котором положения 720-987 принадлежат активному домену тирозинкиназы. В добавление к роли посредством сигнального пути PI3K и MAPK, ErbB2 может также снижать экспрессирование циклина D и c-myc, посредством чего снижать экспрессирование ингибитора ациклин-зависимой киназы (cdk) p27kipl, таким образом приводя к клеточной пролиферации, являющейся результатом ингибирования активности cdk2 [1].
[03] В ходе в возрастающей степени расширяющихся и углубляющихся исследований было обнаружено, что HER2 экспрессирован или сверхэкспрессирован в различных опухолях. До настоящего времени было сообщено, что позитивный уровень экспрессирования, уровень сверхэкспрессирования HER2 в некоторых опухолях и у некоторых людей, у которых HER2 сверхэкспрессирован, является следующим: рак яичников, 45%, 21%, 23316 человек [2]; рак молочной железы, 58%, 38%, 223112 человек [3]. Вследствие этого, существует острая необходимость в клинической практике для эффективных лекарственных средств, нацеленных на HER2 для лечения злокачественной опухоли. По настоящее время коммерчески доступные моноклональные антитела, которые нацелены на HER2, включают Трастузумаб и Пертузумаб.
2. Трастузумаб и Пертузумаб
[04] Герцептин® (Трастузумаб), разработанный Genentech, является гуманизированным моноклональным антителом, которое нацелено на HER2. В 1998 Трастузумаб в комбинации с паклитакселом был одобрен US FDA в качестве лечебного режима для лечения первой линии метастатического рака молочной железы со сверхэкспрессированным HER2/neu, или в качестве единственного лекарственного средства для лечения метастатического рака молочной железы с сверхэкспрессированным HER2/neu, который ранее был подвержен по меньшей мере одному циклу химиотерапии. Трастузумаб не только обладает высокой аффинностью к HER2 рецептору, но также разрешает проблему иммуногенности вызванной посредством применения полученного из мышей антитела по отношению к человеческому организму. Результаты клинических испытаний демонстрируют, что применение только Трастузумаба имеет уровень эффективности 11,6%~16%, тогда как его комбинированная терапия с химическими лекарственными средствами имеет уровень эффективности вплоть до 50%. По сравнению с только химиотерапией указанная комбинация предоставляет пациентам с рецидивирующим раком молочной железы на поздней стадии более продолжительный срок жизни и сниженную смертность.
[05] Другим лекарственным антителом, которое нацелено на HER2 является пертузумаб [4], который также был разработан Genentech. Пертузумаб связывается с областью II внеклеточного домена HER2 рецептора, ингибируя образование димера, посредством чего ингибируя рецептор-опосредованный сигнальный путь, при этом Трастузумаб (Герцептин) связывается с областью IV внеклеточного домена HER2 рецептора. Пертузумаб был одобрен US FDA 8 июня, 2012, для лечения пациентов с HER2-позитивным метастатическим раком молочной железы на поздней стадии (см. CN101023100B).
3. Конъюгаты антитело-лекарственное средство
[06] Моноклональному антителу было уделено все больше и больше внимания из-за его характеристик высокой специфичности к мишени, низкого побочного эффекта и тому подобного. Однако, при использовании отдельно его лечебный эффект ограничен. В настоящее время, наиболее успешными лекарственными средствами на основе моноклонального антитела против опухоли являются средства против лимфоцитомы, такой как хроническая неходжкинская лимфоцитома (НХЛ). Фаза II клинического исследования Ритуксана, направленного на НХЛ, демонстрирует, что общий уровень ответа составлял только 6%. Для Герцептина® против метастатического рака молочной железы только 15% имеют ответ. Следовательно, большинство лекарственных моноклональных антител используют в комбинации с химиотерапией. Например, Ритуксан используют в комбинации со стандартной химиотерапией для лечения хронической лимфоцитомы, что может увеличить уровень эффективности вплоть до 90%. По настоящее время основным путем для увеличения лечебного эффекта моноклонального антитела являются конъюгаты антитело-лекарственное средство.
[07] Конъюгат антитело-лекарственное средство принадлежит к типу нового противоракового “биологического реактивного” лекарственного средства, которое составлено из трех частей: антитело, цитотоксин и линкер, который соединяет две части. Моноклональное антитело объединено с цитотоксином посредством химического объединения. Таким образом, конъюгат антитело-лекарственное средство специфически распознает рецептор на поверхности раковых клеток и связывается с рецептором посредством использования нацеливающего моноклонального антитела, и затем конъюгат проникает в клетки, и предотвращает пролиферирование раковых клеток и убивает раковые клетки посредством использования протеазы в клетках, которые могут высвобождать цитотоксин. Технология объединения антитело-лекарственное средство делает низкомолекулярное лекарственное средство и биологический белок слитыми вместе, что может обладать преимуществами обоих и значительно увеличивать действенность лекарственных средств, снижать побочные эффекты, и таким образом она преобразуется в новое поколение терапевтического продукта.
[08] Первым успешным примером в клинической практике нацеленного конъюгата антитело-лекарственное средство является Гемтузумаб озогамицин (Wyeth, коммерческое название: Милотарг). Милотарг является первым одобренным конъюгатом моноклональное антитело-лекарственное средство. Это лекарственное средство составлено из анти-CD33 антитела, Калихимицина (лекарственное средство, которое разрушает ДНК) и химического линкера AcBut. Милотарг является лекарственным средством, в котором гуманизированное анти-CD33 IgG4 объединено с противопухолевым лекарственным средством Калихимицином, для лечения острой миелоидной лейкемии [5]. Милотарг является первым поколением конъюгата антитело-лекарственное средство, который имеет три критичных дефекта в технологии: во-первых, линкер, используемый для связывания токсина, является очень неустойчивым, время полужизни которого составляет только два дня, что приводит к сильной потере токсина и высокому токсическому побочному эффекту в клинической практике; во-вторых, антитело объединено с линкером через аминогруппу лизина, тем не менее, имеют место десятки лизинов на поверхности антитела, и места объединения являются случайными, что частично воздействует на действенность лекарственных средств; что более существенно, так как технология объединения то время не являлась сформировавшейся, только 50% антитела могут связаться с лекарственным средством, что приводит в результате к неудовлетворительной действенности лекарственных средств в клинической практике; в-третьих, используемое антитело представляет собой IgG4, у которого имеется недостаток антителозависимой клеточноопосредованной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC). Вследствие этого, через десять лет после появления на рынке, Милотарг был снят с продажи из-за высокого токсического побочного эффекта и ограниченного лечебного эффекта.
[09] Вторым успешным примером в клинической практике нацеленного конъюгата антитело-лекарственное средство является новое лекарственное средство для лечения лимфомы Ходжкина. Так как оно имело очень хороший лечебный эффект, оно было одобрено US FDA в 2011 после проведения лишь фазы II клинического испытания. Это лекарственное средство было разработано Seattle Genetics в качестве нового нацеленного конъюгата антитело-лекарственное средство (ADC), который является нацеленным лечением для двух типов пациентов с лимфомой, экспрессирующей антиген CD30. Этот конъюгат антитело-лекарственное средство, брентуксимаб ведотин, составлен из моноклонального антитела против CD30, ингибитора микротрубочек (MMAE) и дипептидного химического линкера. Этот конъюгат антитело-лекарственное средство имеет характеристики низкого побочного эффекта и эффективного ингибирования лимфомы. В фазе II клинического испытания в одной группе, 102 пациента возрастом от 15 до 77 лет (средний возраст=31) с рецидивирующей или рефрактерной лимфомой Ходжкина, получали лечение с брентуксимабом ведотином, и серединное лечение содержит 9 циклов. Когда серединный курс лечения составлял 6,7 месяцев, общий уровень ответа составлял 73%. Когда серединный курс лечения составлял 20,5 месяцев, полный уровень ответа оставлял 34%; у 40% пациентов, которые получали лечение, был достигнут частичный ответ [7]. Наиболее частой нежелательной реакцией является повреждение периферического нерва. Успех этого лекарственного средства предполагает технологическую осуществимость и очень благоприятные перспективы нацеленного конъюгата антитело-лекарственное средство.
[10] Другим успешным примером нацеленного конъюгата антитело-лекарственного средства является T-DM1 против злокачественного рака молочной железы, разработанный Genentech Inc. [8]. Моноклональным антителом этого конъюгата антитело-лекарственное средство является анти-HER2 (ErbB2) антитело на поверхности клеток рака молочной железы, которое объединено с цитотоксином, ингибитором микротрубочек DM1. Результат в фазе III клинического испытания этого лекарственного средства демонстрирует более сильный лечебный эффект, чем химиотерапия, и более низкий побочный эффект. У таких пациентов с раком молочной железы, которые получали лечение с химиотерапевтическими лекарственными средствами Герцептином и таксанами ранее, все еще прогрессировали заболевания. Однако получение лечения конъюгатом антитело-лекарственное средство может значительно продлевать продолжительность выживания пациентов с HER2-позитивным раком молочной железы с предпосылкой того, что заболевание не ухудшится [9]. На основании хорошего лечебного эффекта этого лекарственного средства лекарственное средство было одобрено US FDA 22 февраля, 2013, для лечения пациентов с HER2-позитивным метастатическим раком молочной железы на поздней стадии (см. CN100482281C).
[11] Хотя Герцептин является крупным достижением в истории лечения сверхэкспрессирующего HER2 рака молочной железы, в отношении которого уже были предприняты попытки различных противораковых лечений, около 85% пациентов не имели или имели только слабый ответ на терапию с Герцептином [11]. Было продемонстрировано, что HER2 экспрессирован или сверхэкспрессирован в различных опухолях. Таким образом, имеет место острая потребность в клинической практике для разработки противораковых лекарственных средств, нацеленных на HER2, для таких пациентов со сверхэкспрессирующими HER2 опухолями или другими экспрессирующими HER2 релевантными заболеваниями (включая не только рак молочной железы), которые не имеют или имеют только слабый ответ на терапию с Герцептином.
[12] Следовательно, имеет место острая потребность в клинической практике для разработки лекарственного средства, нацеленного на HER2. Данное изобретение предоставляет техническое решение для удовлетворения этой потребности.
Сущность изобретения
[13] В одном аспекте настоящее изобретение относится к антителу или его функциональным фрагментам, которые могут специфически связываться с HER2. В частности, антитело содержит тяжелую цепь и легкую цепь, в которых:
(i) тяжелая цепь содержит три области CDR, из которых по меньшей мере одна из CDR областей имеет аминокислотную последовательность, как показано в SEQ ID NO: 1, 2 или 3, или имеет по меньшей мере 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательности с SEQ ID NO: 1, 2 или 3; и
(ii) легкая цепь содержит три области CDR, из которых по меньшей мере одна из CDR областей имеет аминокислотную последовательность, как показано в SEQ ID NO: 4, 5 или 6, или имеет по меньшей мере 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательности с SEQ ID NO: 4, 5 или 6.
[14] В конкретном варианте осуществления антитело содержит тяжелую цепь и легкую цепь, в которых:
(i) тяжелая цепь содержит три области CDR, каждая из которых имеет аминокислотную последовательность, как показано в SEQ ID NO: 1, 2 и 3, соответственно; и/или
(ii) легкая цепь содержит три области CDR, каждая из которых имеет аминокислотную последовательность, как показано в SEQ ID NO: 4, 5 и 6, соответственно.
[15] В предпочтительном варианте осуществления настоящее изобретение относится к антителу, секретируемому из гибридомных клеток (депонированных в China General Microbiological Culture Collection Center (расположенном в Institute of Microbiology, Chinese Academy of Sciences, No. 3, 1st Beichen West Rd., Chaoyang District, Beijing 100101, P. R.China) 22 августа, 2013, под номером доступа 8102 (CGMCC No. 8102)), или антителу, полученному из него (дата переноса в Будапештский договор - 29 октября, 2013). В другом предпочтительном варианте осуществления настоящее изобретение относится к антителу, секретируемому из клеток яичника китайского хомячка (CHO) (депонированы в China General Microbiological Culture Collection Center (расположенный в Wuhan University, Luojia Mountain, Wuchang District, Wuhan City, Hubei 430072, P. R.China) 6 ноября, 2013, под номером доступа C2013170 (CCTCC C2013170)) или антителу, полученному из него.
[16] В другом аспекте настоящее изобретение относится к выделенному полинуклеотиду, кодирующему антитело согласно настоящему изобретению.
[17] В дополнительном аспекте настоящее изобретение относится к комбинации выделенных полинуклеотидов, которая содержит полинуклеотид, кодирующий легкую цепь антитела согласно настоящему изобретению или его функциональные фрагменты, и полинуклеотид, кодирующий тяжелую цепь антитела согласно настоящему изобретению или его функциональные фрагменты.
[18] В дополнительном аспекте настоящее изобретение относится к экспрессионному вектору, который содержит полинуклеотид в соответствии с настоящимнастоящим изобретением или комбинацию полинуклеотидов в соответствии с настоящимнастоящим изобретением, в котором полинуклеотид функционально соединяется с регуляторной последовательностью, которая позволяет, чтобы полипептид, кодируемый полинуклеотидом, экспрессировался в клетке-хозяине или бесклеточной экспрессирующей системе.
[19] В другом аспекте настоящее изобретение относится к конъюгату, содержащему антитело согласно настоящему изобретению или его функциональные фрагменты, которые объединены с одним или более терапевтических агентов. Предпочтительно терапевтический агент является цитотоксическим лекарственным средством (таким как антиметаболиты, противопухолевые антибиотики, алкалоиды), иммунопотенциаторы или радиоактивные изотопы. Более предпочтительно терапевтический агент выбран из майтанзиноидов (таких как Ансамитоцин или Мертансин), доластатина и их производных. Наиболее предпочтительно терапевтический агент выбран из MMAE (Монометил ауристатин E) и MMAF (Монометил ауристатин F). В других вариантах осуществления терапевтический агент может также быть выбран из приведенных в таблице 1 ниже.
| Таблица 1Список доступных терапевтических агентов в конъюгатах согласно настоящему изобретению | ||
| Аббревиатура | Полное название | Тип/Механизм действия |
| MMAE | Монометил ауристатин E | Ингибитор полимеризации мономеров тубулина [12] |
| Производное MMAE | ||
| MMAE | Монометил ауристатин E | Ингибитор полимеризации мономеров тубулина [12] |
| Производное MMAF | ||
| DM1 | Производное M4 мертансина | Деполимеризация микротрубочек [15] |
| DM4 | Производное M4 мертансина | Деполимеризация микротрубочек [15] |
| Дуокармицин | Дуокармицин | Связывающий ДНК агент [13] |
| Калихеамицин | Калихеамицин | Связывающий малую бороздку ДНК агент [13] |
| PBDA | Пирролибензодиазепины | Связывающий ДНК агент [13] |
| Доксорубицин | Доксорубицин | Ингибитор топоизомеразы [13] |
| Алкалоиды барвинка | Алкалоиды барвинка | [13] |
| Метотрексат | Метотрексат | [13] |
| Винбластин | Винбластин | Деполимеризация микротрубочек [13] |
| Даунорубицин | Даунорубицин | [13] |
[20] В некоторых конкретных вариантах осуществления терапевтический агент объединен с указанным антителом или его функциональными фрагментами через линкер. Линкер, используемый в настоящем изобретении, может быть соединен с антителом любыми способами, известными в данной области, предпочтительно соединен посредством тиола и/или амина. В конкретном предпочтительном варианте осуществления антитело согласно настоящему изобретению соединено с линкером посредством тиола. Линкер, используемый в настоящем изобретении, может являться расщепляемым линкером (то есть, линкер может быть разрушен in vivo milieu) или нерасщепляемым линкером. В некоторых вариантах осуществления линкер согласно настоящему изобретению выбран из расщепляемых линкеров, предпочтительно из пептидного, гидразонового и дисульфидного линкеров, таких как малеимидокапроил-валин-цитруллин-п-аминобензилоксикарбонил (сокращенно обозначаемый в настоящем описании mc-vc-pAB или vc). В других вариантах осуществления линкер согласно настоящему изобретению выбран из нерасщепляемых линкеров, таких как малеимидокапроил (сокращенно обозначаемый в настоящем описании mc). В других вариантах осуществления линкер может также быть выбран из приведенных в таблице 2 ниже.
| Таблица 2Список доступных линкеров в конъюгатах согласно настоящему изобретению | ||
| Аббревиатура | Полное название | Тип/Механизм действия |
| Mc | Малеимидокапроил | нерасщепляемый[12] |
| mc-vc-pAB | Малеимидокапроил валин цитруллин п-аминобензил | расщепляемый[12] |
| 3-MPA | 3-малеимидопропионовая кислота | нерасщепляемый[12] |
| Mal-di-EG-OPFP | Перфторфенил 3-(2-(2-(3-(2,5-диоксо2,5-дигидро-1H-пиррол-1-ил)пропанамидо)этокси)этокси)пропаноат | нерасщепляемый[14] |
| Mal-di-EG-OSu | 2,5-диоксопирролидин-1-ил3-(2-(2-(2,5-диоксо2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)пропаноат | нерасщепляемый[14] |
| Mal-Tri-EG-OSu | 2,5-диоксопирролидин-1-ил3-(2-(2-(2-(2,5-диоксо2,5-дигидро-1H-пиррол-1-ил)этокси)этокси)этокси пропаноат | нерасщепляемый[14] |
| Mal-Tetra-EG-OSu | 2,5-диоксопирролидин-1-ил1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-3-оксо-7,10,13,16-тетраокса-4-азанонадекан-19-оат | нерасщепляемый[14] |
| Br-di-EG-OSu | 2,5-диоксопирролидин-1-ил3-(2-(2-(2-бромацетамидо)этокси)этокси)пропаноат | нерасщепляемый[14] |
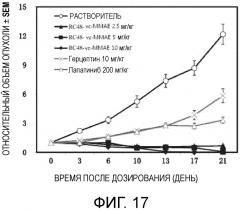
| Py-ds-prp-OSu | 2,5-диоксопирролидин-1-ил 3-(пиридин-2-илдисульфанил)пропаноат | восстанавливаемый[14] |
| Py-ds-Prp-OPFP | перфторфенил 3-(пиридин-2-илдисульфанил)пропаноат | восстанавливаемый[14] |
| Py-ds-dmBut-OSu | 2,5-диоксопирролидин-1-ил 4-метил-4-(пиридин-2-илдисульфанил)пентаноат | восстанавливаемый[14] |
| Py-ds-dmBut-OPF | перфторфенил 4-метил-4-(пиридин-2-илдисульфанил)пентаноат | восстанавливаемый[14] |
| SMCC | N-сукцинимидил 4-(малеимидометил)циклогексанкарбоксилат | нерасщепляемый[15] |
| MBS | эфир 3-малеимидобензойной кислоты и N-гидроксисукцинимида | нерасщепляемый[13] |
| SATA | S-(N-сукцинимидил)тиоацетат | нерасщепляемый[13] |
| SPDP | N-сукцинимидил 3-(2-пиридилдитио)пропионат | восстанавливаемый[13] |
| SMPT | [(N-сукцинимидилокси карбонил)-1-метил-1-(2-пиридилдитио)толуол | восстанавливаемый[13] |
[21] В другом аспекте настоящее изобретение относится к конъюгату антитело-лекарственное средство, имеющему общую формулу Ab-(L-U)n, в которой Ab представляет антитело в соответствии с настоящимнастоящим изобретением или его функциональные фрагменты, L представляет линкер (например, mc-vc-pAB или mc), U представляет терапевтический агент (предпочтительно терапевтический агент выбран из цитотоксического лекарственного средства, иммунопотенциаторов и радиоактивных изотопов; более предпочтительно терапевтический агент выбран из майтанзиноидов, доластатина и его производных; наиболее предпочтительно терапевтический агент выбран из MMAE и MMAF), и n представляет целое число от 1 до 8 (например, 1, 2, 3, 4, 5, 6, 7 или 8). Линкер, используемый в настоящем изобретении, может являться расщепляемым линкером (то есть, линкер может быть разрушен in vivo) или нерасщепляемым линкером.
[22] В дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, которая содержит антитело в соответствии с настоящимнастоящим изобретением или его функциональные фрагменты и/или конъюгат в соответствии с настоящимнастоящим изобретением, а также фармацевтически приемлемый носитель.
[23] В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака (в особенности HER2-позитивного рака), который включает введение антитела, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора, конъюгата и/или фармацевтической композиции в соответствии с настоящим изобретением в терапевтически эффективном количестве пациенту.
[24] В дополнительном аспекте настоящее изобретение относится к применению антитела, полинуклеотида, комбинации полинуклеотидов, экспрессионного вектора, конъюгата и/или фармацевтической композиции в соответствии с настоящим изобретением в получении лекарственного средства для лечения или профилактики рака.
[25] В дополнительном аспекте настоящее изобретение относится к антителу, полинуклеотиду, комбинации полинуклеотидов, экспрессионному вектору, конъюгату и/или фармацевтической композиции в соответствии с настоящим изобретением, которые используются для лечения или профилактики рака. Предпочтительно рак является HER2-позитивным раком. Более предпочтительно рак выбран из рака молочной железымолочной железы, рака яичника или рака желудка. Более предпочтительно рак является Лапатиниб- и/или Герцептин-резистентным раком, таким как Лапатиниб- и/или Герцептин-резистентный рак молочной железымолочной железы, раком яичника или раком желудка.
[26] В дополнительном аспекте настоящее изобретение относится к клетке гибридомы, которая была депонирована в China General Microbiological Culture Collection Center 22 августа, 2013 под номером доступа 8102 (дата переноса в Будапештский договор - 29 отября, 2013).
[27] В дополнительном аспекте настоящее изобретение относится к клетке CHO, которая была депонирована в China General Microbiological Culture Collection Center 6 ноября, 2013, под номером доступа C2013170.
[28] В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство (ADC), который может лечить рак. Конъюгат содержит моноклональное антитело, которое способно специфически связываться с поверхностным рецептором раковой клетки, низкомолекулярное лекарственное средство с цитотоксическим эффектом, а также линкер, который может связывать вышеупомянутые две части вместе посредством ковалентной связи. Настоящее изобретение также относится к применению этих конъюгатов в производстве медицинского средства для лечения рака молочной железы и/или рака яичника и/или рака желудка.
[29] В некоторых конкретных вариантах осуществления настоящее изобретение относится к конъюгату антитело-лекарственное средство, который имеет общую формулу Ab-(L-U)n, в которой Ab представляет моноклональное антитело, нацеленное на HER2, L выбран из mc-vc-pAB или mc, U выбран из MMAE или MMAF, и n представляет целое число от 1 до 8.
[30] В частности, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, в котором области CDR тяжелой цепи являются такими, как показано в SEQ ID NO. 1, SEQ ID NO. 2 и SEQ ID NO. 3, соответственно.
[31] В частности, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, в котором области CDR легкой цепи являются такими, как показано в SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, соответственно.
[32] Более конкретно, гуманизированным антителом, нацеленным на HER2, как раскрыто в настоящем изобретении, является RC48, которое является секретируемым из клеток, депонированных в China General Microbiological Culture Collection Center 6 ноября, 2013, под номером доступа C2013170.
[33] Трастузумаб (Герцептин®) является рекомбинантным гуманизированным моноклональным антителом, селективно нацеленным на внеклеточный домен человеческого рецептора эпидермального фактора роста-2 (HER2), в основном используемого для лечения HER2-позитивного рака. Гуманизированное антитело RC48 согласно настоящему изобретению является рекомбинантным человеческим HER2 антителом, которое способно связываться с внеклеточным доменом HER2 с высокой аффинностью. В in-vitro экспериментах и in vivo моноклональное антитело RC48 демонстрирует высокую способность ингибировать пролиферацию сверхэкспрессирующих HER2 человеческих опухолевых клеток.
[34] Двумя низкомолекулярными цитотоксинами, задействованными в настоящем изобретении, являются MMAE (Монометил ауристатин E) или MMAF (Монометил ауристатин F) (см. фиг. 6), которые являются двумя видами ингибирующей клеточный тубулин малой молекулы. Настоящее изобретение также относится к двум видам линкеров: Малеимидокапроил (сокращенно обозначаемый в настоящем описании mc) и Малеимидо-Капроил-Валин-Цитруллин-п-АминоБензилокси (сокращенно обозначаемый в настоящем описании mc-vc-pAB, который также представлен просто посредством vc в названии конъюгата) (см. фиг. 7); первый линкер является нерасщепляемым, тогда как второй является расщепляемым, и соответствующие конъюгаты демонстрируют различную стабильность и время полужизни in vivo. Следующие три конъюгата антитело-лекарственное средство образованы моноклональным антителом RC48, соединенным с линкером через цистеин: RC48-vc-MMAE (см. фиг. 8), RC48-vc-MMAF (см. фиг. 9) и RC48-mc-MMAF (см. фиг. 10).
[35] Конъюгат согласно настоящему изобретению имеет связывающую способность антиген-антитело, сопоставимую in vitro с голым антителом RC48 и T-DM1. В анализе жизнеспособности клеток его цитотоксичность является значительно более высокой, чем цитотоксичность голого антитела RC48, Герцептина, T-DM1, в котором клетки, используемые в эксперименте, включают клеточный штамм высоко экспрессирующего HER2 рака молочной железы SK-BR-3 (Фиг. 12) и клеточный штамм высоко экспрессирующего HER2 рака молочной железы рака яичника SK-OV-3 (Фиг. 13). В экспериментах на животных с трансплантационной моделью опухоли у голых мышей конъюгат согласно настоящему изобретению имеет значительный противопухолевый эффект для несущей опухоль BT474 человеческого рака молочной железы голой мыши (Фиг. 14), и предпочтительный конъюгат демонстрирует значительную противопухолевую активность для несущей Герцептин®- и Лапатиниб-резистентную опухоль голой мыши, с эффектом, значительно лучшим, чем у позитивных контрольных лекарственных средств (Фиг. 15); при этом конъюгат антитела согласно настоящему изобретению неожиданно демонстрирует противопухолевый эффект для несущей трансплантационную опухоль рака яичника и рака желудка голой мыши (Фиг. 16 и фиг. 17). Посредством эксперимента in vivo на мыши, определено, что максимальные переносимые дозы конъюгата согласно настоящему изобретению являются следующими: RC48-mc-MMAF: >150 мг/кг, RC48-vc-MMAF: 60 мг/кг, RC48-vc-MMAE: 100 мг/кг, соответственно. Дополнительно, осуществляли тестирование эффективности посредством использования модели трансплантационной опухоли человеческого рака яичника голых мышей, и было обнаружено, что во время введения лекарственного средства, посредством наблюдения изменения объемов модели опухоли мышей и массы тела мышей per se, действенность конъюгата значительно выше, чем действенность голого антитела и T-DM1. Более того, массы тела мышей были увеличены (Фиг. 18), что демонстрирует хорошую действенность с низкой токсичностью и высокую эффективность. Конъюгат предоставляет новый вариант выбора лекарственного средства для лечения HER2-позитивного рака, резистентного к лекарственному HER2 антителу рака, резистентного к ингибитору тирозинкиназы рака и других релевантных заболеваний.
[36] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются выделенными.
[37] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются моноклональным антителом.
[38] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются гуманизированным антителом.
[39] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты имеют ADCC активность.
[40] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты имеют CDC активность.
[41] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты специфически связываются с HER2, при этом по существу не связываются с EGFR, HER3 и HER4.
[42] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты являются антителом IgG1κ.
[43] В некоторых конкретных вариантах осуществления антитело в соответствии с настоящим изобретением или его функциональные фрагменты пригодны для лечения или профилактики рака, при котором рак сверхэкспрессирует HER2.
Краткое описание чертежей
[44] Фиг. 1 представляет фигуру ДСН-ПААГ-электрофореза очищенного человеческого рекомбинантного белка HER2-ECD, который окрашен с кумасси бриллиантовым голубым. Каждую лунку нагружали с 10 нг.
[45] Фиг. 2 представляет фигуры анализа ДСН-ПААГ-электрофореза cRC48, RC48, в котором каждую лунку нагружали с 2 нг антитела.
[46] Фиг. 3 демонстрирует связывающую аффинность между гуманизированным антителом RC48 и HER2-ECD, определенную посредством анализа ELISA, и рассчитанную константу связывающей аффинности Kd. Герцептин и cRC48 использовали в качестве контроля в этом анализе.
[47] Фиг. 4A представляет анализ связывающей способности гуманизированного анти-HER2 антитела RC48 с HER2+ клетками (SK-BR3, BT474) и HER2- клетками (MDA-MB468) посредством проточной цитометрии. Фиг. 4B демонстрирует анализ связывающей способности анти-HER2 антитела с клеточным поверхностным антигеном BT474 посредством проточной цитометрии при различных концентрациях антитела. Анти-HER2 антитело включает Герцептин, cRC48, RC48. В общей сложности анализировали 5×104 клеток.
[48] Фиг. 5 показывает, что RC48 демонстрирует только специфическую связывающую аффинность с HER2, но не с EGFR, HER3 и HER4.
[49] Фиг. 6 демонстрирует молекулярные структуры антитубулина, MMAE и MMAF.
[50] Фиг. 7 демонстрирует молекулярные структуры химических линкеров, mc-vc-pAB и mc.
[51] Фиг. 8 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-vc-MMAE).
[52] Фиг. 9 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-vc-MMAF).
[53] Фиг. 10 демонстрирует молекулярную структуру конъюгата антитело RC48-лекарственное средство (RC48-mc-MMAF).
[54] Фиг. 11 демонстрирует противопухолевый эффект RC48, направленного на трансплантационную модель опухоли человеческого рака молочной железы BT474.
[55] Фиг. 12 демонстрирует рост ингибирующего эффекта конъюгата RC48, направленного на HER2-позитивную клетку SK-BR-3.
[56] Фиг. 13 демонстрирует рост ингибирующего эффекта конъюгата RC48, направленного на HER2-позитивную клетку SK-OV-3.
[57] Фиг. 14 демонстрирует противопухолевый эффект конъюгата RC48, направленного на несущую опухоль человеческого рака молочной железы BT474 модель голой мыши.
[58] Фиг. 15 демонстрирует лечебные эффекты RC48-vc-MMAE, T-DM1, направленных на Герцептин- и Лапатиниб-резистентные трансплантационные опухоли человеческого рака молочной железы BT-474/L1.9 у голой мыши.
[59] Фиг. 16 демонстрирует противопухолевый эффект конъюгата RC48, направленного на трансплантационную модель опухоли человеческого рака яичника SK-OV-3.
[60] Фиг. 17 демонстрирует лечебные эффекты RC48-vc-MMAE, Герцептина, Лапатиниба, направленных на трансплантационные опухоли человеческого рака желудка NCI-N87 у голой мыши.
[61] Фиг. 18 демонстрирует эффект различных конъюгатов антитело-лекарственное средство на массы тела мышей.
Описание конкретных вариантов осуществления
Определения
[62] Если не указано иное, все из технических терминов, используемых в настоящем описании, имеют такие же значения, как понимает специалист в данной области. В отношении определений и терминов в данной области, специалист может консультироваться в Current Protocols in Molecular Biology (Ausubel) для больших подробностей. Аббревиатура аминокислотного остатка является стандартным трехбуквенным и/или однобуквенным кодом, используемым в данной области, который представляет одну из 20 обычных L-аминокислот.
[63] Хотя в настоящем изобретении используется числовой диапазон и приближенное значение параметра в широком смысле, количество, как показано в конкретном примере, приведено настолько точно, насколько возможно. Однако, любое число само по себе до некоторой степени неминуемо включает о