Способ получения производных 4-(бензофуран-2-ил)бутан-2-она
Иллюстрации
Показать всеИзобретение относится к способу получения производных 4-(бензофуран-2-ил)бутан-2-она формулы 1а-к, заключающийся в домино-реакции 2-гидроксибензиловых спиртов с 2-замещенными фуранами в 1,2-дихлорэтане в присутствии трифторметансульфоновой кислоты при нагревании. Полученные производные 4-(бензофуран-2-ил)бутан-2-она 1a-к с выходами 75-97%. Эти соединения представляют интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения. 2 табл., 10 пр.
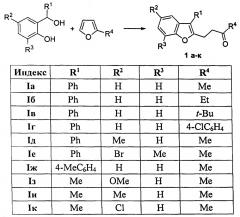
1 R2 R3 R4 Iа Ph H H Me Iб Ph H H Et Iв Ph H H t-Bu Iг Ph H H 4-ClC6H4 Iд Ph Me H Me Iе Ph Br Me Me Iж 4-MeC6H4 H H Me Iз Me OMe H Me Iи Me Me H Me Iк Me Cl H Me
Реферат
Изобретение относится к области органической химии – синтезу гетероциклических соединений, производных 4-(бензофуран-2-ил)бутан-2-она, представляющих интерес в качестве исходных соединений для получения веществ фармацевтического назначения.
Изобретение относится к разработке способа получения производных 4-(бензофуран-2-ил)бутан-2-она общей формулы Iа-к, которые являются привлекательными объектами для медицинской химии. Данные соединения могут быть использованы в синтезе аналогов природного терпеноида суджикуроджинола В, обладающего противобактериальной активностью [S. Arihara, A. Umeyama, S. Bando, S. Imoto, M. Ono, K. Yoshikawa, Chem. Pharm. Bull, 2004, 52, 463-465].
| Индекс | R1 | R2 | R3 | R4 |
| Iа | Ph | H | H | Me |
| Iб | Ph | H | H | Et |
| Iв | Ph | H | H | t-Bu |
| Iг | Ph | H | H | 4-ClC6H4 |
| Iд | Ph | Me | H | Me |
| Iе | Ph | Br | Me | Me |
| Iж | 4-MeC6H4 | H | H | Me |
| Iз | Me | OMe | H | Me |
| Iи | Me | Me | H | Me |
| Iк | Me | Cl | H | Me |
К настоящему времени синтетическая доступность производных 4-(бензофуран-2-ил)бутан-2-она ограничена отсутствием эффективных общих методов синтеза этих соединений.
Один из методов получения основан на декарбоксилировании альфа-этоксикарбонильных производных 4-(бензофуран-2-ил)бутан-2-она под действием минеральных кислот [A.N. Grinev, L.S. Sarkisova, V.M. Lyubchanskaya, L.M. Alekseeva, Chem. Heterocycl. Compd., 1983, 19, 1154-1157], однако данный метод характеризуется низким выходом конечного продукта. Другой подход основан на реакции сопряженного присоединения бензофуранов к альфа, бета-непредельным кетонам в присутствии хлорида золота (III) [Z. Li, Z. Shi, C. He, J. Organomet. Chem., 2005, 690, 5049-5054], или эфирата трехфтористого бора [J.-M. Poirier, G. Dujardin, Heterocycles, 1987, 25, 399-407]. Наиболее хорошо изученным является метод, основанный на конденсации 2-замещенных фуранов с салициловыми альдегидами и последующей рециклизации образующихся 2-(2-гидроксибензил)фуранов в присутствии минеральных кислот [A.V. Butin, O.N. Kostyukova, F.A. Tsiunchik, M.G. Uchuskin, O.V. Serdyuk, I.V. J. Heterocycl. Chem., 2011, 48, 684-690; V.T. Abaev, A.V. Gutnov, A.V. Butin, Chem. Heterocycl. Compd., 1998, 34, 529-532; A.V. Butin, G.D. Krapivin, V.E. Zavodnik, V.G. Kul'nevich, Chem. Heterocycl. Compd., 1993, 29, 524-533; A.V. Butin, V.E. Zavodnik, V.G. Kul'nevich, Chem. Heterocycl. Compd., 1992, 28, 835-836]. Отсутствие возможности варьирования заместителя в 3-ем положении образующегося бензофурана накладывает существенные ограничения на использование этого метода. Его модификация [A.V. Gutnov, A.V. Butin, V.T. Abaev, G.D. Krapivin, V.E. Zavodnik, Molecules, 1999, 4, 204-218] позволяет преодолеть указанное ограничение, однако требует дополнительной стадии и снижает общую эффективность процесса. Один из современных методов синтеза производных 4-(бензофуран-2-ил)бутан-2-она основан на реакции кросс-сочетания карбоновых кислот и аллиловых спиртов, сопровождающейся декарбоксилированием исходных соединений и изомеризацией конечных аллиловых спиртов в соответствующие кетоны [L. Huang, J. Qi, X. Wu, K. Huang, H. Jiang, Org. Lett., 2013, 15, 2330-2333].
Перечисленные методы синтеза производных 4-(бензофуран-2-ил)бутан-2-она ограничены доступностью исходных соединений и использованием дорогостоящих катализаторов на основе солей драгоценных металлов.
В основе заявляемого метода лежит описанная ранее кислотно-катализируемая рециклизация 2-(2-гидроксибензил)фуранов, приводящая к производным 4-(бензофуран-2-ил)бутан-2-она [A.V. Gutnov, A.V. Butin, V.T. Abaev, G.D. Krapivin, V.E. Zavodnik, Molecules, 1999, 4, 204-218].
Задача изобретения – разработка нового эффективного метода получения производных 4-(бензофуран-2-ил)бутан-2-она Iа-к, позволяющего расширить номенклатуру исходных соединений для синтеза потенциальных биологически активных веществ.
Техническим результатом является создание простого и эффективного метода синтеза производных 4-(бензофуран-2-ил)бутан-2-она, позволяющего получать целевые продукты с высоким выходом при широком варьировании заместителей в бензофурановом ядре, что, в конечном счете, снимает ряд ограничений и недостатков известных методов.
Технический результат достигается в результате обработки раствора доступных 2-гидроксибензиловых спиртов и 2-замещенных фуранов при нагревании в 1,2-дихлорэтане трифторметансульфокислотой.
| Индекс | R1 | R2 | R3 | R4 |
| Iа | Ph | H | H | Me |
| Iб | Ph | H | H | Et |
| Iв | Ph | H | H | t-Bu |
| Iг | Ph | H | H | 4-ClC6H4 |
| Iд | Ph | Me | H | Me |
| Iе | Ph | Br | Me | Me |
| Iж | 4-MeC6H4 | H | H | Me |
| Iз | Me | OMe | H | Me |
| Iи | Me | Me | H | Me |
| Iк | Me | Cl | H | Me |
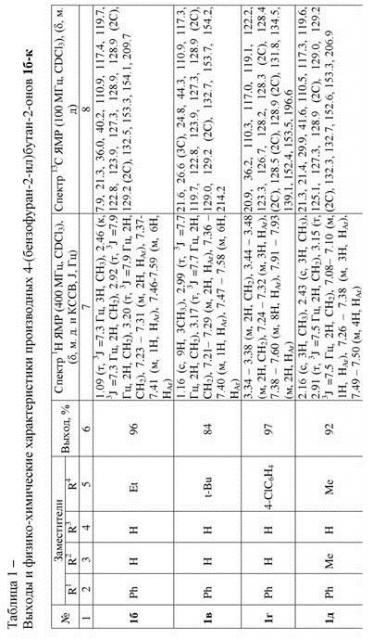
Выходы продуктов реакции и спектральные характеристики производных 4-(бензофуран-2-ил)бутан-2-она Iа-к приведены в таблице 1.
Полученный технический результат позволяет получать желаемые продукты Iа-к с высокими выходами. Необходимо отметить, что метод имеет широкую область применения, что выражается в возможности варьирования различных заместителей в исходных соединениях, а следовательно – получения широкого ряда замещенных 4-(бензофуран-2-ил)бутан-2-онов, являющихся исходными субстратами для синтеза потенциально биологически активных соединений.
Совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 4-(3-фенилбензофуран-2-ил)бутан-2-она 1а.
Пример 1
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 96% (127 мг).
Rf = 0.54 (этилацетат/петролейный эфир, 1:3)
Спектр 1Н ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 2.19 (с, 3Н, СН3), 2.95 (т, 3J = 7.6 Гц, 2H, CH2), 3.20 (т, 3J = 7.6 Гц, 2H, CH2), 7.24-7.33 (м, 2Н, HAr), 7.39-7.43 (м, 1Н, HAr), 7.48-7.61 (м, 6Н, HAr).
Спектр 13C ЯМР (CDCl3), (δ, м. д.): 21.1, 29.9, 41.5, 100.9, 117.4, 119.7, 122.8, 123.9, 127.3, 128.8, 128.9 (2C), 129.1 (2C), 132.4, 153.1, 154.1, 206.9.
Пример 2
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (2.2 мкл, 0.025 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 87% (115 мг).
Пример 3
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (8.8 мкл, 0.1 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 94% (124 мг).
Пример 4
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 70 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 90% (119 мг).
Пример 5
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 60 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 85% (112 мг).
Пример 6
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 90 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 96% (127 мг).
Пример 7
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 100 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 90% (119 мг).
Пример 8
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в этаноле (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 62% (83 мг).
Пример 9
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в бензоле (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 89% (117 мг).
Пример 10
К раствору 2-[гидрокси(фенил)метил]фенола (100 мг, 0.5 ммоль) и 2-метилфурана (58 мкл, 0.75 ммоль) в 1,4-диоксане (2 мл) добавляют трифторметансульфокислоту (4.4 мкл, 0.05 ммоль) и перемешивают при температуре 80 °С в течение 60 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой 4-(3-фенилбензофуран-2-ил)бутан-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО «Сорбполимер») фракция 5-40 мкм, элюент - дихлорметан:петролейный эфир (1:15). Выход 88% (116 мг).
В таблице 2 приведены данные о влиянии условий проведения реакции на 4-(3-фенилбензофуран-2-ил)бутан-2-она 1а (примеры 1-10).
Как видно из таблицы 2, результат, а именно получение 4-(3-фенилбензофуран-2-ил)бутан-2-она, может быть достигнут при использовании 10 мол.% TfOH в качестве катализатора. Увеличение или снижение количества катализатора не приводит к увеличению выхода соответствующего продукта. Оптимальная температура проведения реакции 80 °С, а оптимальным растворителем для проведения реакции является 1,2-дихлорэтан.
Таблица 2 – Влияние реакционных условий на выход целевого 4-(3-фенилбензофуран-2-ил)бутан-2-она 1а.
| Пример | Растворитель | TfOH, мол.% | Температура, °С | Выход, % |
| 1 | 1,2-дихлорэтан | 10 | 80 | 96 |
| 2 | 1,2-дихлорэтан | 5 | 80 | 87 |
| 3 | 1,2-дихлорэтан | 20 | 80 | 94 |
| 4 | 1,2-дихлорэтан | 10 | 70 | 90 |
| 5 | 1,2-дихлорэтан | 10 | 60 | 85 |
| 6 | 1,2-дихлорэтан | 10 | 90 | 96 |
| 7 | 1,2-дихлорэтан | 10 | 100 | 90 |
| 8 | этиловый спирт | 10 | 80 | 62 |
| 9 | бензол | 10 | 80 | 89 |
| 10 | 1,4-диоксан | 10 | 80 | 88 |
Методом 1 получен ряд производных 4-(3-фенилбензофуран-2-ил)бутан-2-она 1а-к с выходами 75-97%.
Способ получения производных 4-(бензофуран-2-ил)бутан-2-она общей формулы I,
характеризующийся тем, что смесь доступных 2-гидроксибензиловых спиртов и 2-замещенных фуранов обрабатывают трифторметансульфоновой кислотой в 1,2-дихлорэтане при нагревании.