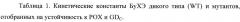Способ ультравысокопроизводительного скрининга клеток или микроорганизмов и средство для ультравысокопроизводительного скрининга клеток или микроорганизмов
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен способ ультравысокопроизводительного скрининга клеток или микроорганизмов, а также представляющее собой биосовместимую двойную эмульсию вода-масло-вода средство для ультравысокопроизводительного скрининга клеток или микроорганизмов. Способ включает микрофлюидную генерацию капель биосовместимой двойной эмульсии вода/масло/вода методом последовательной эмульсификации в микрофлюидных чипах, инкубирование указанной эмульсии до появления флуоресцентного сигнала, скринирование с использованием флуоресцентного клеточного сортера, отбор популяции капель с заданным уровнем флуоресценции и анализ с использованием секвенирования. Причём генерацию осуществляют с использованием водной фазы, несущей библиотеку клеток или микроорганизмов, водной фазы, несущей необходимые для детекции активности фенотипа флуорогенный субстрат или репортерную клеточную линию, масляной фазы и внешней водной фазы. Изобретения обеспечивают монодисперстность капель биосовместимой двойной эмульсии вода/масло/вода. 2 н. и 2 з.п. ф-лы, 30 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии и фармацевтики.
Современная биотехнология и фармацевтика являются крайне высокотехнологичными областями, чьи успехи тесно связаны с разработкой новых принципов поиска различных видов биологической активности. Возможности, которые открывает нам «пост-геномная» эра, позволяют выявлять новые мишени для поиска терапевтических агентов [1], а также осуществлять виртуальный скрининг потенциальных кандидатов лекарственных препаратов in silico [2].
Несмотря на колоссальные перспективы методов молекулярного моделирования, данный подход не является универсальным, т.к. ресурсы существующих в настоящее время суперкомпьютеров не позволяют рассчитывать взаимодействия биомолекул de novo и используют различные приближения, требующие наличия кристаллической структуры мишени, ее динамики, а также четкого понимания механизма ее действия [3]. Комбинаторные методы скрининга, основанные на эксперименте, напротив, не требуют никаких дополнительных данных для поиска новой биологической активности, так как базируются на предположении о том, что достаточно большая выборка различных вариантов за счет своего разнообразия уже содержит в себе искомую активность и задача исследователя состоит лишь в том, чтобы эффективно отобрать ее из общего пула вариантов [4].
Несмотря на уникальные возможности поиска биологической активности in silico de novo, подавляющее большинство современных препаратов получено на основе комбинации методов компьютерного моделирования и высокопроизводительного скрининга лекарственных кандидатов [5]. В настоящее время высокопроизводительный скрининг осуществляется на базе автоматизированных роботизированных станций [6], однако существует очевидная тенденция к переходу биотехнологических платформ на формат "лаборатории-на-чипе", основанный на современных успехах в области микрофлюидики [7]. Использование микрофлюидики приводит к миниатюризации оборудования, уменьшению расходов на реагенты и эксплуатацию. Происходит многократное увеличение производительности и осуществляется переход к ультравысокопроизводительному скринингу [8] за счет использования микрофлюидных капельных технологий. Несмотря на значительные успехи ряда мировых центров [8-13], в вопросах технологии формирования микрофлюидных потоков, систем отбора и идентификации активных клонов существует еще достаточное количество нерешенных проблем.
Изобретение относится к созданию универсальной ультравысокопроизводительной микрофлюидной платформы для скрининга различных типов биокаталитической и биологической активности клеток, белков.
В настоящее время существует множество разнообразных ультравысокопроизводительных подходов, позволяющих эффективно отбирать различные биомолекулы, обладающие высокоспецифичным и высокоаффинным связыванием с целевыми молекулами-мишенями: скрининг с использованием микросфер [14], рибосомный дисплей [15], фаговый дисплей [16, 17], бактериальный дисплей [18], дрожжевой дисплей [19], дисплей на клетках млекопитающих [20], SELEX [21]. В то же время разработка ультравысокопроизводительных методов, направленных на отбор химической или биологической активности, в отличие от связывания, зачастую сопряжена с большими трудностями. Прежде всего, данные методы не универсальны и в каждом отдельном случае имеют ряд серьезных недостатков, принципиально ограничивающих их применение. В частности, многие из них применимы лишь для скрининга активности, связанной с образованием ковалентной связи [22, 23]. Другие требуют вовлечения дополнительных молекулярно-биологических механизмов, таких как преимущество скорости роста или возникновение выживаемости в процессе селекции [24-26]. Некоторые методы используют специфические субстраты, образующие флуоресцентные продукты, заякоренные на клеточной стенке (или обладающие высокой гидрофобностью), в результате протекания биохимической реакции, катализируемой селектируемым ферментом [27, 28], что позволяет отбирать наиболее активные клетки по флуоресценции продукта с использованием флуоресцентно-активированного клеточного сортинга (FACS). Таким образом, для создания универсальной технологии отбора на активность в каплях в общем виде требуется решение двух принципиально важных задач:
1) детекции активности на уровне единичных капель;
2) возможности отбора единичных активных капель из смеси.
Наиболее простое решение этих задач было впервые продемонстрировано в работе [29]. В качестве аналитического сигнала для высокочувствительной детекции биокаталитической активности была использована флуоресценция, а отбор капель эмульсии производился при помощи стандартного клеточного сортера (FACS). При этом наиболее принципиальным усовершенствованием предыдущей технологии был переход от однократной эмульсии вода-в-масле к двойной эмульсии вода-в-масле-в-воде. Это позволяет непосредственно анализировать индивидуальную биокаталитическую активность изолированных генов.
Дальнейшее усовершенствование технологии эмульсионного скрининга связано с усовершенствованием самих компартментов - капель эмульсии. Дело в том, что изначально [30] стадии генерации как однократной, так и двойной эмульсии проводились с использованием гомогенизаторов. Несмотря на то, что использование гомогенизаторов позволяет быстро получать большие количества капель, данная технология имеет ряд принципиальных недостатков:
- стохастическая генерация капель эмульсии приводит к высокой полидисперсности;
- получаемая двойная эмульсия является мультикомпартментной (т.е. зачастую одна капля несет несколько изолированных капель);
- генерация эмульсии протекает в жестких условиях высокого сдвигового стресса.
Данные недостатки существенно снижают чувствительность данного метода скрининга (т.к. разные по размеру и гранулярности капли имеют разный объем и рассеяние, а следовательно, приводят к разным условиям протекания реакций внутри капель), значительно снижают максимальную производительность (т.к. доля капель целевого размера и гранулярности составляет 1-5%) и не позволяют заключать в капли различные биологические объекты, чувствительные к эмульсификации (клетки млекопитающих, многие виды микроорганизмов, а также многоклеточные организмы).
Решением перечисленных выше проблем является использование микрофлюидных технологий генерации эмульсии. Современные успехи в области микрофлюидики основаны на использовании микрофлюидных чипов - миниатюрных устройств, состоящих из каналов и текстур размером от нескольких десятков до нескольких микрометров [31], позволяющих реализовать концепцию "лаборатории-на-чипе".
Инкапсуляция живых клеток и микроорганизмов в индивидуальных каплях микрофлюидной эмульсии представляет большой интерес, так как открывает уникальные возможности для изучения уникальных свойств индивидуальных объектов среди их популяционного разнообразия. Успехи в этой области связаны с разработкой инертных органических жидкостей и биосовместимых эмульсификаторов. Наиболее простым решением этой проблемы является использование минерального масла и высокоэффективных биосовместимых эмульсификаторов на основе полисилоксанов (например, цетил полиэтиленгликоль/полипропиленгликоль-10/1 диметикон) [30, 32]. Данный подход был успешно применен для компартментализаци живых клеток факультативных анаэробов (бактерий Escherichia coli, Bacillus subtilis и дрожжей Saccharomyces cerevisiae), а также проведения бесклеточной in vitro транскрипции/трансляции. В то же время минеральное масло сильно ограничивает транспорт газов [33], что является принципиальным недостатком, ингибирующим рост микроорганизмов и затрудняющим его использование для инкапсуляции клеток млекопитающих и многочисленных видов аэробных бактерий.
Многочисленные фторуглеродные соединения - "фторуглеродные масла" (перфторуглеродные амины (FC-40, FC-70), перфторуглеводороды (перфтороктан, перфтордекалин), перфторпроизводные простых эфиров (HFE-7100, HFE-7500) и их смеси (FC-77)) представляют более удобную альтернативу минеральному маслу. Среди всех технических жидкостей, фторуглеродные масла обладают наиболее высокой газопроницаемостью, обеспечивающей эффективное дыхание клеток в каплях. Кроме того, они представляют собой "альтернативную фазу", т.е. обладают чрезвычайно низкой растворимостью в воде, углеводородах и жирах, что приводит к их инертности и биосовместимости. Имея плотность (1.6-1.9 г/см3), значительно превышающую плотность воды, фторуглеродные масла образуют двойную эмульсию, склонную к седиментации, что позволяет легко осуществлять ее сбор и реинжекцию. Стабилизация биосовместимых фторуглеродных микрофлюидных эмульсий может осуществляться с использованием неионных фторуглеродных поверхностно-активных веществ [34]. Получаемые в результате капли обладают высокой стабильностью и могут играть роль универсальных микрокомпартментов, обеспечивающих не только выживаемость, но и культивацию клеток дрожжей [34], а также линий клеток человека (причем как суспензионных Jurkat, так и адгезионных НЕK293Т) и, более того, рост, развитие и размножение в том числе и многоклеточных организмов, таких как С.elegans [35].
Использование возможностей направленной манипуляции над движением отдельно взятой капли в каналах чипа [36, 37] открыло принципиально новый взгляд на возможности микрофлюидики для ультравысокопроизводительного скрининга активности. В предыдущих работах отсутствовала стадия селекции, основанной непосредственно на анализе активности в индивидуальной капле. В то же время преимущество микрофлюидных технологий заключается в том числе и в возможности осуществлять полный цикл отбора улучшенной биокаталитической активности в чипе [8]. Использование микрофлюидной платформы для инкапсуляции индивидуальных дрожжевых клеток в каплях биосовместимой эмульсии, их инкубации и сортинга в чипе позволило проводить скрининг активности клеток с производительностью более 2000 событий в секунду.
Использование аналогичной микрофлюидной платформы для направленной эволюции арилсульфатазы Pseudomonas aeruginosa привело к 6 кратному увеличению ее каталитической активности по отношению к синтетическому флуорогенному фосфонату за один раунд отбора из библиотеки представительностью порядка 106 вариантов [9]. В данной работе, на основании индивидуальной активности клеточных лизатов единичных бактериальных клеток в каплях, проводился отбор наиболее активных вариантов с производительностью порядка 1000 событий в секунду. Процедура скрининга основана на экспрессии рекомбинантного фермента в клетках Е. coli, их последующего лизиса и повторной трансформации для проведения следующих раундов отбора. Таким образом, в отличие от предыдущей, данная платформа имеет ряд ограничений, лимитирующих ее практическое применение.
Известна заявка США №2016/0169788 на получение патента на изобретение в котором описан состав масляной фазы, использованной для генерации биосовместимой эмульсии, которая совпадает с масляной фазой, использованной в настоящей заявке. Однако в заявке США используется однократная эмульсия.
Перечень иллюстраций:
Рис. 1. Микрофлюидная платформа для ультравысокопроизводительного скрининга в каплях микрофлюидной двойной эмульсии.
Рис. 2. Генерация двойной микрофлюидной эмульсии методом последовательной эмульсификации в микрофлюидных чипах.
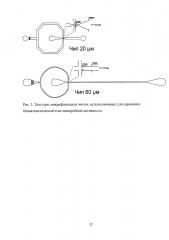
Рис. 3. Текстуры микрофлюидных чипов, использованных для скрининга биокаталитической и антимикробной активности.
Рис. 4. Микрофлюидный чип для генерации капель 20 мкм, предназначенный для инкапсуляции бактериальных клеток в каплях двукратной эмульсии: чертеж (сверху слева) и фотография (сверху справа) общего вида микрофлюидного чипа. Чертеж (снизу слева) и микроскопия (снизу справа) текстуры перекрестия микрофлюидного чипа. Размер бара (нижний левый угол) 0.1 мм.
Рис. 5. Микрофлюидный чип для генерации капель 60 мкм, предназначенный для инкапсуляции бактериальных клеток в каплях двукратной эмульсии: чертеж (сверху слева) и фотография (сверху справа) общего вида микрофлюидного чипа. Чертеж (снизу слева) и микроскопия (снизу справа) текстуры перекрестия микрофлюидного чипа. Размер бара (нижний левый угол) 0.1 мм.
Рис. 6. Заполнение капель микрофлюидной эмульсии клетками.
Рис. 7. Дрожжевой дисплей биокатализаторов.
Рис. 8. Схемы и кинетические константы ферментативных реакций, использованных для скрининга биокатализаторов в каплях.
Рис. 9. Схема ультравысокопроизводительного скрининга биокатализаторов в каплях двойной эмульсии.
Рис. 10. Микроскопия смеси 1:10 активных и неактивных клеток. Изображение получено в результате наложения микроскопии видимого света, а также флуоресцентной микроскопии зеленой флуоресценции продукта ферментативной реакции и красной флуоресценции mCherry. Приведенная шкала составляет 100 мкм.
Рис. 11. Анализ капель двойной эмульсии с инкапсулированными клетками, несущими Fab-фрагмент антитела, биокатализатор и искусственные библиотеки, содержащие 10% и 1% активных клеток с заякоренным биокатализатором на примере ЕК с использованием метода проточной цитофлуориметрии.
Рис. 12. Чашки, несущие колонии, регенерированные из капель до и после отбора с использованием FACS.
Рис. 13. Зависимость доли активных клеток, а также степени обогащения от разведения активных клеток неактивными.
Рис. 14. Специфический отбор каждого из биокатализаторов из смеси ферментов.
Рис. 15. (А) Кристаллическая структура БуХЭ. Каталитическая триада S198-H438-Е325 обозначена серым цветом, мутированная последовательность 284-TPLSV-288 обозначена желтым. (Б) Активность индивидуальных клонов библиотеки до отбора и после отбора с использованием гейтов G1-G3 с различным уровнем флуоресценции капель. Врезка демонстрирует распределение капель, несущих контрольные клетки (серый), библиотеку (красный), а также БуХЭ дикого типа (синий) по флуоресценции, а также уровень флуоресценции гейтов G1-G3, использованных для отбора.
Рис. 16. Мутанты БуХЭ с различным уровнем активности приводят к образованию капель с различным уровнем флуоресценции.
Рис. 17. Отбор мутантов БуХЭ с различным уровнем активности. Доля мутантов до и после отбора (А) для смеси 1:1:1:1 и (Б) для смеси 1:1:1:1000, а также соответствующее обогащение (В) и (Г). Звездочка означает, что данный клон (cl 3) не был идентифицирован в отобранной популяции.
Рис. 18. Схема взаимодействия БуХЭ и ФОТ, а также структурные формулы использованных ФОТ. Кi - константа ингибирования, k1 - константа скорости фосфилирования, k2 - константа скорости самореактивации.
Рис. 19. (А) Кинетика ингибирования параоксоном БуХЭ дикого типа (WT), мутанта cl 19, отобранного на GDC, и мутантов cl 14 и cl 15, отобранных на устойчивость к РОХ. (Б) Мутант cl 14, в отличие от WT, демонстрировал каталитический гидролиз POX-R. Концентрация обоих ферментов 0.45 мкМ.
Рис. 20. (А) Схема скрининга попарных взаимодействий для отбора бактерий, ингибирующих рост S. aureus, в каплях биосовместимой двойной микрофлюидной эмульсии. (Б) Микроскопия капель, несущих смесь клеток S. aureus+S. venezuelae и S. aureus+E.coli. Изображения получены в результате микроскопии видимого света, флуоресцентной микроскопии зеленой флуоресценции S. aureus (жертва), красной флуоресценции S. venezuelae (эффектор слева) и дальне-красной флуоресценции Е. coli (эффектор справа), а также их общего наложения (перекрытие). Приведенная шкала составляет 100 мкм.
Рис. 21. Чашки, несущие колонии бактерий, регенерированные из капель до и после отбора с использованием FACS. S. aureus, окрашенные в зеленый цвет, были идентифицированы благодаря их зеленой флуоресценции, Е. coli - дальне-красной флуоресценции, a S. venezuelae - по специфической морфологии колоний.
Рис. 22. (А) Степень обогащения убийц S. venezuelae в случае, если их доля в популяции составляет 10 и 1%, а также сожителей Е. coli с долей в популяции 1%. (Б) Отбор капель, обладающих наименьшим уровнем зеленой флуоресценции, приводит к отбору капель, несущих S. venezuelae, а также пустых капель, снижающих эффективность отбора.
Рис. 23. Степень обогащения убийц S. venezuelae в случае, если их доля в популяции составляет 10 и 1% с использованием в качестве клеток-жертв S. aureus и Е. coli.
Рис. 24. Идентификация бактерий микробиоты ротовой полости, ингибирующих рост S. aureus. (А) Образование зон просветления на чашках с индивидуальными колониями микробиоты ротовой полости, покрытых слоем агара с S. aureus. (Б) Отбор наиболее эффективных бактерий-ингибиторов на чашках.
Рис. 25. Усовершенствованная схема отбора бактерий, ингибирующих рост S. aureus, среди представителей микробиоты ротовой полости.
Рис. 26. Предсказание родов бактерий, ингибирующих рост S. aureus, по результатам 16S рРНК секвенирования.
Рис. 27. Клоны стрептококков, отобранные с использованием микрофлюидной платформы (капли), демонстрировали значительно более эффективное ингибирование роста S. aureus, чем клоны, полученные с использованием платформы Ваксмана (чашки).
Рис. 28. P. aeruginosa ингибировали рост культуры S. aureus даже при попадании в нее единичных клеток P. aeruginosa.
Рис. 29. Фракционирование хлороформного экстракта культуральной среды Р. aeruginosa, ингибирующей рост S. aureus, и анализ ингибирующей активности полученных фракций.
Рис. 30. (А) Синергическое ингибирование роста S. aureus фракциями 1 и 6, полученными в результате фракционирования с использованием высокоэффективной обращенно-фазовой хроматографии. (Б) Основные действующие вещества фракций 1 и 6, идентифицированные с использованием масс-спектрометрии.
Подробное описание изобретения
Задачей изобретения является создание универсальной платформы для ультравысокопроизводительного скрининга с использованием принципа in vitro компартментализации в каплях двойной эмульсии. Для решения этой задачи был создан способ ультравысокопроизводительного скрининга биологических объектов, основанный на микрофлюидной генерации капель, что обеспечивает их монодисперсность. Монодисперсность эмульсии, в свою очередь, приводит к одинаковым концентрациям реагентов, а также одинаковым условиям проведения реакций в каплях, что позволяет многократно снизить соотношение «сигнал/шум» (signal/noise ratio) в процессе скрининга т.е. повысить чувствительность и специфичность отбора. Микрофлюидная генерация эмульсии позволяет обеспечить мягкие условия инкапсуляции, что позволяет, в свою очередь, использовать ее для живых клеток, а контролируемые условия генерации позволяют заключать в каплях эмульсии заданное количество клеток или других микроскопических биообъектов.
Для проведения скрининга в каплях микрофлюидной двойной эмульсии (Рис. 1) необходимо подобрать некий высоко специфический механизм, активируемый искомым фенотипом. Активированный механизм должен приводить к изменению флуоресценции, используемой в качестве аналитического сигнала. Микрофлюидная компартментализация библиотеки фенотипов вместе с механизмом в каплях биосовместимой двойной эмульсии вода-масло-вода приводит множеству индивидуальных микрокомпартментов, в которых может происходить активация механизма, приводящая к изменению флуоресценции. После этого фенотипы-активаторы подвергаются отбору с использованием флуоресцентно-активированного клеточного сортинга (FACS), после чего они могут быть проанализированы напрямую без культивации методом широкомасштабного секвенирования (что принципиально важно в случае некультивируемых и медленнорастущих микроорганизмов) или подвергнуты культивации. Культивируемые фенотипы-активаторы в последствии подвергаются генотипическому, фенотипическому, структурному и функциональному анализу.
Генерация двойной микрофлюидной эмульсии проводилась методом последовательной эмульсификации в микрофлюидных чипах (Рис. 2). Контроллер давления осуществлял подачу сжатого воздуха в 4 резервуара с жидкостями: водной фазой, несущей библиотеку фенотипов; водной фазой, несущей механизм; масляной фазой и внешней водной фазой. Давление сжатого воздуха вызывало течение жидкостей по тефлоновым трубочкам, ведущим в чип. Скорость течения жидкостей определялась контроллерами потока, соединенными петлей обратной связи с контроллером давления, таким образом, контроллер автоматически поддерживал заданную скорость потока за счет увеличения или уменьшения давления в резервуарах. Непосредственно перед входом в чип потоки водных фаз, несущих библиотеку фенотипов и механизм, соединялись и попадали в гидрофобизированный чип. В гидрофобном чипе поток объединенной внутренней водной фазы разбивался на отдельные капли в потоке масляной фазы, и полученная в результате однократная эмульсия вода/масло попадала в гидрофильный чип. В гидрофильном чипе поток эмульсии вода/масло разбивался на отдельные капли двойной эмульсии вода/масло/вода в потоке внешней водной фазы.
В качестве внутренней водной фазы могут быть использованы раствор фосфатносолевого буфера, трис-HCl, ионы двухвалентных металлов, ростовые среды. В качестве масляной фазы могут быть использованы минеральные масла с эмульсификатором 3% Abil ЕМ 180 или 2% Pico-Surf2 во фторуглеродном масле Novec7500. Внешняя водная фаза может содержать 50 мМ натрий или калий фосфатный буфер, 2%Pluronic и 0,1% Mowiol 23-88.
Поверхности каналов чипов должны иметь более высокую смачиваемость по отношению к дисперсионной среде, в противном случае генерация эмульсии нестабильна. Для химической модификации были использованы гидрофобизирующие реагенты (трихлороктадецилсилан или Aquapel), а для стабилизации гидрофильной поверхности был использован поливиниловый спирт. В качестве масляной фазы было использовано минеральное масло или фторуглеродное масло. Минеральное масло обладает высокой вязкостью, снижает транспорт газов и приводит к флотирующей эмульсии, что затрудняет его применение. В свою очередь фторуглеродные масла HFE-7500 и FC-40 обладали значительно меньшей вязкостью, что позволило использовать их для генерации двойной эмульсии диаметром 20 мкм. Высокая газопроницаемость фторуглеродных масел была использована для скрининга, совмещенного с культивацией, а высокая плотность приводила к образованию седиментирующей эмульсии, более удобной для отбора. Для того чтобы обеспечить биосовместимость эмульсии, были использованы высокомолекулярные поверхностно-активные вещества, обладающие чрезвычайно низкой способностью к межфазному транспорту: Abil ЕМ 180 для минерального масла, Pico-Surf 2 для фторуглеродного масла и Pluronic F-127 для внешней водной фазы. Разрушение отобранной после FACS эмульсии происходило за счет ее высыхания на чашке с питательной средой, что приводило к 90±20% выживаемости дрожжевых клеток.
Для микрофлюидной компартментализации были использованы микрофлюидные чипы из полидиметилсилоксана, полученные с использованием технологии мягкой литографии (Рис. 3). Использование двух чипов для однократной эмульсификации оказалось значительно технологичнее, чем одного чипа для генерации двойной эмульсии, ввиду их взаимозаменяемости и существенно более простой технологии химической модификации. Разбиение потока дисперсной фазы происходило в самом узком месте чипа, где встречались потоки несмешивающихся жидкостей. Использованные чипы имели размер каналов 20 мкм (Рис. 4) и 60 мкм (Рис. 5), что позволяло генерировать двойную микрофлюидную эмульсию диаметром 20-90 мкм. Уменьшение размеров каналов чипа приводит к увеличению производительности. Генерация микрофлюидной двойной эмульсии происходила с производительностью ≈25000 событий в секунду в чипе с размером каналов 20 мкм и ≈3000 событий в секунду в 60 мкм чипе.
Как уже упоминалось ранее, благодаря монодисперсности микрофлюидной эмульсии, заполнение ее капель дискретными объектами происходит в соответствии с распределением Пуассона (Рис. 6).
Таким образом, чем ниже степень заполнения λ, тем выше чистота отбора за счет снижения вероятности попадания двух и более клеток в одну каплю. В то же время при λ<0.3 доля заполненных капель стремительно падает, что снижает эффективность скрининга. Для λ=0.1 капли, несущие одну клетку, составляют 95.1% от общего числа заполненных капель, тем не менее 90.5% капель при этом остаются пустыми. Таким образом, для достижения компромисса между чистотой и эффективностью скрининга наиболее оптимальным является диапазон 0.3<λ<0.7. Для скрининга биокатализаторов была использована степень заполнения λ=0.5, что соответствует максимальной чистоте отбора 78.7%. С другой стороны, в том случае если требуется, чтобы все капли были заполнены (что было использовано для клеток S. aureus в случае отбора антибиотической активности), необходимо использовать λ>>1. Для λ=10, использованного для заполнения капель клетками S. aureus, доля пустых капель составляет <0.005%.
Скрининг биокаталитической активности в каплях микрофлюидной двойной эмульсии
Дрожжевой дисплей биокатализаторов и высокочувствительная детекция биокаталитической активности
Ранее для скрининга биокатализаторов в каплях за счет in vitro компартментализации использовались подходы, основанные на in vitro транскрипции/трансляции, лизисе индивидуальных бактериальных клеток в каплях, а также бактериальном и дрожжевом дисплее [8]. Из всех вышеупомянутых, дрожжевой дисплей представляет собой наиболее универсальный подход, так как позволяет обеспечить фолдинг сложных белков, образование правильных дисульфидных связей, а также обеспечить их гликозилирование, что было принципиально важно в случае рчБуХЭ, продукция которой в активном виде возможна исключительно в эукариотических клетках.
Для того, чтобы иметь возможность впоследствии легко идентифицировать клетки, обладающие активностью, мы использовали красный флуоресцентный белок-репортер mCherry, в то же время необходимо, чтобы количество mCherry и фермента коррелировали. Для этого их экспрессия проводилась с использованием одного промотора, а последовательности mCherry и фермента были разделены "самопроцессирующимся" F2A пептидом, обеспечивающим одновременную продукцию mCherry и фермента с использованием одного мРНК транскрипта за счет процесса "пропуска" (skipping) рибосомы. Таким образом, генетическая конструкция, использованная для дрожжевого дисплея биокатализаторов (Рис. 7А) содержала метанол-идуцибельный промотор алкогольоксидазы АОХ1, последовательность красного флуоресцентного белка-репортера mCherry, "самопроцессирующийся" F2A пептид, лидерный пептид человеческого сывороточного альбумина (ЧСА) для внеклеточного транспорта, фермент, эпитоп гемагглютинина (НА) для иммунофлуоресцентной детекции заякоренного фермента и последовательность SAG1, соединенную серин-глициновым линкером, обеспечивавшую заякоревание фермента на дрожжевой клетке.
Для демонстрации универсальности платформы были использованы три различных фермента демонстрирующие фосфодиэстеразную (дезоксирибонуклеаза I - ДНКаза), протеазную (энтеропептидаза - ЭК) и эстеразную (бутирилхолинэстераза - БуХЭ) активность (Рис. 7Б). Иммунофлуоресцентное окрашивание свидетельствовало о том, что все три фермента продуцировались в заякоренном виде (наблюдался ореол флуоресценции) на поверхности дрожжевых клеток. В то же время mCherry демонстрировал внутриклеточную локализацию (наблюдалась равномерная флуоресценция клеток). Дрожжи, продуцировавшие заякоренные ферменты, и контрольные дрожжи, продуцировавшие Fab-фрагмент антитела, были проанализированы на наличие биокаталитической активности с использованием соответствующих субстратов (реактива Эллмана в случае БуХЭ, Gly-(Аsp)4-Lys-нафтиламида в случае ЭК и FAM-AAAAAAACCCCCCCATATAGCGCGTTTTTTT-RTQ1 в случае ДНКазы) и было показано, что все биокатализаторы продуцировались в активном виде.
Для проведения скрининга в каплях необходимо, чтобы продукт ферментативной реакции обладал высокой гидрофильностью (что исключает его транспорт через слой масла во внешнюю водную фазу), а также спектром возбуждения/эмиссии флуоресценции, соответствующим возбуждающим лазерам и эмиссионным фильтрам клеточного сортера. Ввиду того, что дрожжи, несущие заякоренные ферменты, обладали красной флуоресценцией, для флуоресценции продукта был использован зеленый (530/30 нм) и голубой (450/50 нм) канал флуоресценции. Для трех ферментов были использованы разные флуорогенные субстраты (Рис. 8), действовавшие по принципу FRET-пары, нефлуоресцентного амида, и сопряженной реакции, в которой продукт классической реакции, катализируемой БуХЭ, вступал в реакцию с нефлуоресцентным субстратом с образованием флуоресцентного аддукта.
Ферменты обладали каталитической эффективностью по отношению к данным флуорогенным субстратам, различавшейся приблизительно в 100 раз. Для суспензии клеток, несущих заякоренный биокатализатор, соотношение скоростей ферментативного и самопроизвольного гидролиза составляло от 550 до 85, что через сутки инкубации приводило к соотношению сигнал/фон от 33 до 6.5 при проведении реакции в лунках 384 луночной плашки. Иммунофлуоресцентное окрашивание и цитофлуориметрия с использованием флуоресцентных шаров, несущих стандартное количество флуорофора, показали, что на поверхности одной дрожжевой клетки находится 7000±3000 молекул биокатализатора, что позволило оценить ферментативные константы заякоренных биокатализаторов. Эффективность отбора биокатализаторов из смеси активных и неактивных клеток.
Для оценки эффективности скрининга биокатализаторов были использованы искусственные смеси активных (продуцирующих заякоренный фермент и красный флуоресцентный белок-репортер mCherry) и неактивных (продуцирующих Fab-фрагмент антитела и не имеющих флуоресцентного репортера) дрожжевых клеток (Рис. 9).
Компартментализация смеси активных и неактивных клеток вместе с флуорогенным субстратом в каплях микрофлюидной двойной эмульсии приводила к образованию двух популяций с различным уровнем флуоресценции продукта. Отбор капель, обладавших наибольшим уровнем флуоресценции, с использованием FACS приводил к обогащению активными клетками. Микрофлюидная эмульсия обладала высокой монодисперсностью (Рис. 10), а накопление продукта реакции происходило исключительно в каплях, несущих активные дрожжевые клетки.
Для того, чтобы оценить эффективность отбора (степень обогащения) с использованием методики скрининга библиотек биокатализаторов методом проточной цитофлуориметриии с последующим сортингом (FACS) в эмульсионной системе вода-масло-вода для каждого биокатализатора был проведен модельный скрининг искусственных библиотек биокатализаторов. В одинаковых условиях производилась запаковка четырех образцов вместе с соответствующим флуорогенным субстратом: 1) дрожжи с заякоренным Fab-фрагментом антитела (капли в которых идет только фоновый уровень реакции), 2) дрожжи с заякоренным биокатализатором (капли в которых идет только каталитический гидролиз субстрата), 3) Смесь биокатализатор/Fab 1:10, 4) Смесь биокатализатор/Fab 1:100. После запаковки образец подвергался анализу и сортингу с использованием прибора BD FACSAria III (Рис. 11).
После протекания реакции в каплях с использованием FACS в режиме максимальной чистоты скрининга производился отбор популяции капель, обладавших высоким уровнем флуоресценции, с производительностью в диапазоне 10000-20000 событий в секунду. Отобранные капли высевались на чашки и через 2-3 дня наблюдалось образование дрожжевых колоний. Колонии, полученные из капель до и после отбора, перекалывались на чашки с метанолом, где происходила индукция экспрессии флуоресцентного репортера (Рис. 12). В результате наблюдалось эффективное обогащение каждого из биокатализаторов.
Для того чтобы определить, как эффективность скрининга зависит от соотношения активных и неактивных клеток, были проведены отборы биокатализаторов из смесей с различным соотношением активных и неактивных клеток в диапазоне 1:10-1:105 (Рис. 13).
Степень обогащения активных клеток из смеси с неактивными была близка к теоретическому пределу в случае разведений 1:10 и 1:100. Даже для разведения 1:105 наблюдалось более 35% активных клонов после одного раунда отбора, что всего в 2 раза меньше, чем теоретический максимум.
Таким образом, для клеток, обладающих биокаталитической активностью, была показана чрезвычайно высокая эффективность отбора из смеси активных и неактивных клеток с использованием лишь одного раунда скрининга. Селективность отбора биокатализаторов из смеси биокатализаторов с разной специфичностью или различным уровнем активности.
Для проведения скрининга биокатализаторов из смеси с различной субстратной специфичностью мы использовали "искусственную библиотеку активностей", представляющую собой смесь дрожжей, несущих по отдельности каждый из трех использованных ранее биокатализаторов, разведенную в 100 раз неактивными клетками. Таким образом, доля клеток каждого типа активности составляла менее 1% в смеси. "Библиотека активностей" была отобрана на каждый тип активности отдельно с использованием соответствующего флуорогенного субстрата (Рис. 14).
Каждый из типов биокаталитической активности был селективно отобран на заданную ферментативную активность с эффективностью, близкой к теоретическому максимуму, без обогащения клетками, несущими другой тип активности.
Для того чтобы изучить как эффективность и селективность отбора зависит от активности биокатализатора, была использована библиотека БуХЭ. Библиотека имела представительность порядка 3×105 вариантов и содержала 5 подряд идущих аминокислотных замен в последовательности БуХЭ дикого типа (WT) 284-TPLSV-288 ацил-связывающей петли, расположенной недалеко от активного центра фермента (Рис.15А). Введение аминокислотных замен существенно снизило активность клонов. Средняя активность библиотеки составляла менее 0.5% от активности БуХЭ дикого типа. Дрожжи, несущие заякоренные мутанты БуХЭ, были инкапсулированы вместе с флуорогенным субстратом в каплях микрофлюидной двойной эмульсии. Полученные в результате капли обладали различным уровнем флуоресценции и были отобраны с использованием трех гейтов G1-G3 с различным уровнем флуоресценции G1>G2>G3 (Рис. 15Б).
Анализ активности индивидуальных клонов, полученных до и после отбора, свидетельствует об эффективности отбора в случае использования каждого из трех гейтов. В то же время клоны, отобранные из капель с наибольшим уровнем флуоресценции, обладали наибольшим уровнем активности. Таким образом, было качественно показано, что разработанная платформа может быть использована для отбора биокатализаторов с разным уровнем одинаковой активности.
Для того чтобы количественно оценить эффективность отбора биокатализаторов с различным уровнем одинаковой активности, были использованы три клона с различным уровнем ферментативной активности, отобранных с помощью гейтов G1-G3. Сl 13, отобранный из G3, обладал незначительным уровнем активности (1.1% от БуХЭ дикого типа), демонстрировав приблизительно в 2 раза большую активность в 384 луночной плашке по сравнению с контрольными клетками. Сl 8 и cl 3 были отобраны из G2 и G1 соответственно и обладали 5.4 и 55% от активности БуХЭ дикого типа. Компартментализация cl 3, cl 8, cl 13 и контрольных клеток вместе с субстратом в каплях приводила к образованию четырех популяций с разным уровнем флуоресценции, соответствовавших разным уровням накопления продукта: сумного, cl 8 - средне, cl 13 - мало (Рис. 16).
Мутанты БуХЭ cl 3, cl 8 и cl 13, а также контрольные клетки (Fab) были смешаны друг с другом в равном соотношении и в соотношении 1:1:1:1000 и отобраны с использованием гейтов «Много», «Средне», «Мало» (Рис. 16), соответствовавших высокой, средней и низкой флуоресценции продукта. Для соотношения 1:1:1:1 мы наблюдали специфическое обогащение каждого из мутантов БуХЭ с эффективностью, близкой к теоретическому максимуму (Рис.17А, В). В то же время в случае соотношения 1:1:1:1000 обогащение cl 3, cl 8 также происходило с эффективностью, близкой к максимальной, в то время как эффективность обогащения cl 13 была приблизительно на порядок ниже (Рис. 17 Б, Г).
Таким образом, концентрация клеток, обладающих в 384 луночной плашке активностью в 2 раза выше, чем у контрольных клеток, должна быть не менее 0.1%, чтобы они могли быть отобраны за 1 раунд скрининга. В то ж