Модуляторы протеин-тирозинкиназы и способы их применения
Иллюстрации
Показать всеИзобретение относится к новому соединению формулы I или его фармацевтически приемлемой соли, которые ингибируют киназную активность рецептора эпидермального фактора роста (EGFR) или его мутантных форм, выбранных из (i) L858R, (ii) Т790М, (iii) как L858R, таги Т790М, (iv) delE746_A750 или (v) как delE746_A750, так и Т790М, или активность ALK. Соединения могут быть использованы для лечения, предупреждения, или для замедления или предупреждения дебюта, или прогрессирования рака, метастазирования рака, сердечно-сосудистого заболевания, иммунологического расстройства или глазного расстройства. Рак, обусловленный EGFR, представляет собой немелкоклеточный рак легкого (NSCLS), глиобластому, рак поджелудочной железы, рак головы и шеи (например, плоскоклеточную карциному), рак молочной железы, колоректальный рак, эпителиальный рак, рак яичников, рак предстательной железы или аденокарциному. В формуле I
X представляет собой NR16; R16 представляет собой Н; Y представляет собой галоген или незамещенный или галогензамещенный С1-6алкил; Z представляет собой О или CR20R21; и каждый R20 или R21 независимо представляет собой Н; R1 представляет собой гидрокси, N(R8)(R9), C(O)OR8, С1-4алкил, 5-6-членный насыщенный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота или азота и кислорода; каждый R8 и R9 независимо представляет собой Н, С1-С4алкил, гидрокси-С1-4алкил, ди(С1-С4алкил)амино-С1-С4алкил, 4-6-членный насыщенный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, который может быть замещен С2алкенилкарбонильной группой, С3-С6-циклоалкил; R2 представляет собой Н; R3 представляет собой Н; R4 представляет собой Н, С1-6алкокси, галоген, 5-6-членный -О-гетероциклил с 1-2 гетероатомами, выбранными из азота и кислорода или -NR24(CH2)PNR24R25; и Р равен 0, 1, 2 или 3, и каждый R24 или R25 независимо представляет собой Н, незамещенный С1-6алкил; R5 представляет собой Н, F, C1-6алкил, галогеналкил, С1-6алкокси, галогенС1-6алкокси, (диС1-С4алкил)аминоС1-6алкокси, -NR15C(O)(CH2)nCR17=CR18R19, -NR15C(O)(CH2)nCR17=CH(CH2)mNR18R19, m или n независимо равен 0; и каждый из R15, R17, R18 или R19 независимо отсутствует, представляет собой -Н; R7 представляет собой Н, галоген, С1-6алкил, С1-6алкокси, -NR22C(O)CR23=CR10R11, -NR22C(O)CR23(CH2)sCHR10Rl1, , где n=0, m=1, один из R18 и R19 независимо отсутствует, а другой представляет собой 3-6-членный азотсодержащий насыщенный гетероциклил или аминогруппу, замещенную С1-С4алкилом; -NR22C(O)CR23=CR10(CH2)sR11, -NR22C(O)CR23(CH2)sNR10(CH2)tNR10R11 или -NR22C(O)(CH2)sCR23=CH(CH2)tNR10R11, каждый s равен 0, 1 или t независимо равен 1, 2; каждый из R10, R11, R22 или R23 независимо представляет собой Н, С1-4алкил; или представляет собой 5- или 6-членное гетероциклическое кольцо, содержащее 1, 2 гетероатома, независимо выбранных из N или О, при этом гетероциклическое кольцо является незамещенным или замещенным С1-С4алкилом, С1-С3алкилкарбонилом, ди(С1-С4алкил)аминогруппой; или R10 и R11 вместе с атомами, к которым они присоединены, объединяются с образованием 3-, 4-, 5- или 6-членного насыщенного гетероциклического кольца, необязательно содержащего дополнительный атом кислорода, которое является незамещенным или замещенным; и каждый s или t независимо равен 0, 1, 2 или 3; или R6 объединяется с R7 с образованием 6-членного гетероциклического кольца с атомом азота и кислорода, который может быть замещен по атому азота акрилоильной группой; или R6 представляет собой Н, галоген, 4-6-членный гетероциклил с 1-2 гетероатомами в цикле, выбранными из азота и кислорода, необязательно замещенный С1-С4ацильной группой, акрилоильной группой, ди(С1-С4алкил)аминогруппой; или R6 представляет собой -OR13, -O-NR12R13, -NR12R13, -O(CH2)rR13, -O(CH2)rNR12R13, -NR12(CH2)rNR12R13, -NR12(CH2)rR13, -(CH2)rNR12R13 или -CH2O(CH2)rNR12R13; или R6 представляет собой
; и каждый R12, R13 независимо представляет собой Н, С1-С4алкил, С3-С6циклоалкил, необязательно замещенный ди(С1-С4алкил)аминогруппой, 4-6-членный гетероциклил с 1-2 гетероатомами, выбранными из азота и кислорода, и необязательно замещенный галоген-С1-С4алкилом; r равен 0, 1, 2 или 3; каждый А1 или А2 независимо представляет собой СН или N; и R14 представляет собой С1-С4алкил. 5 н. и 49 з.п. ф-лы, 3 табл., 150 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к гетероциклическим соединениям пиримидина, которые модулируют мутант-селективную киназную активность рецептора эпидермального фактора роста (EGFR) для модуляции таких видов клеточной деятельности как пролиферация, дифференциация, запрограммированная смерть клеток, миграция и хемоинвазия. Более конкретно, настоящее изобретение предусматривает пиримидины, которые селективно ингибируют, регулируют и/или модулируют киназный рецептор, в частности, модулируют активность разных мутантных EGFR, связанную с изменениями в таких видах клеточной деятельности, как указано выше, фармацевтические композиции, содержащие производное пиримидина, а также способы лечения заболеваний, ассоциированных с протеинкиназной ферментативной активностью, в частности, киназной активностью EGFR, в том числе немелкоклеточного рака легкого, включающие введение производного пиримидина.
Предпосылки изобретения
Рецептор эпидермального фактора роста (EGFR, Erb-Bl) относится к семейству белков, вовлеченных в пролиферацию нормальных и злокачественных клеток (Artega, C. L., J. Clin Oncol 19, 2001, 32-40). Сверхэкспрессия рецептора эпидермального фактора роста (EGFR) присутствует по меньшей мере в 70% форм рака у человека (Seymour, L. K., Curr Drug Targets 2, 2001, 117-133), таких как формах немелкоклеточной карциномы легкого (NSCLC), формах рака молочной железы, глиомах, плоскоклеточной карциноме области головы и шеи и раке предстательной железы (Raymond et al., Drugs 60 Suppl 1, 2000, discussion 41-2; Salomon et al., Crit Rev Oncol Hematol 19, 1995, 183-232; Voldborg et al., Ann Oncol 8, 1997, 1197-1206). Таким образом, EGFR-TK является широко признанной как важная цель для синтеза и разработки соединений, которые могут специфично связываться и ингибировать тирозинкиназную активность и ее путь сигнальной трансдукции в раковых клетках, и, таким образом, могут служить в качестве либо диагностических, либо терапевтических средств. Например, обратимо действующий ингибитор тирозинкиназы EGFR (EGFR-TK), TARCEVARTM, одобрен FDA для лечения NSCLC и распространенного рака поджелудочной железы. Также были одобрены и другие целевые молекулы к EGFR, в том числе LAPATINIBRTM и IRESSARTM.
Эффективность эрлотиниба и гефитиниба является ограниченной при введении пациентам с любой формой рака легкого. При применении эрлотиниба и гефитиниба в лечении пациентов с любой формой рака легкого (выбранных не за наличием/отсутствием активированного (мутантного) EGFR) вероятность сморщивания опухоли (частоты объективного ответа) составляет 8-10%, а среднее время прогрессирования опухоли составляет примерно 2 месяца {Shepherd et al. NEJM 2004, Thatcher et al. Lancet 2005}. В 2004 было обнаружено, что формы рака легкого с соматическими мутациями в EGFR сопровождались значительными клиническими ответами после лечения с помощью гефитиниба и эрлотиниба {Paez et al. Science 2004; Lynch et al. NEJM 2004; Pao et al. PNAS 2004}. Соматические мутации, идентифицированные до настоящего времени, включают точечные мутации, при которых в экспрессируемом белке изменен один аминокислотный остаток (например, L858R, G719S, G719C, G719A, L861Q), а также небольшие делеции внутри рамки считывания в екзоне19 или вставки в екзоне20. Соматические мутации в EGFR были обнаружены у 10-15% пациентов с NSCLC, представителей европеоидной расы, и у 30-40% пациентов с NSCLC, представителей азиатского населения. Мутации EGFR чаще присутствуют у никогда не куривших людей, женщин, пациентов с аденокарциномой и пациентов восточноазиатской этнической группы {Shigematsu et al. JNCI 2005}. Данные группы пациентов предварительно клинически идентифицировали как те, что с наибольшей вероятностью получат эффект от гефитиниба или эрлотиниба {Fukuoka et al. JCO 2003; Kris et al. JAMA 2003 и Shepherd et al. NEJM 2004}. До настоящего времени опубликовано шесть проспективных клинических исследований лечения пациентов с мутациями EGFR, ранее не проходивших курс химиотерапии, с помощью гефитиниба или эрлотиниба {Inoue et al. JCO 2006, Tamura et al. Br. J Cancer 2008; Asahina et al., Br. J. Cancer 2006; Sequist et al., JCO 2008}. В целом в ходе этих исследований перспективно идентифицировали и лечили больше чем 200 пациентов с мутациями EGFR. Вместе они демонстрируют радиографическую частоту объективного ответа в диапазоне от 60-82% и среднее время прогрессирования от 9,4 до 13,3 месяцев для пациентов, которых лечили с помощью гефитиниба и эрлотиниба. Эти результаты являются в 3-4 раза больше тех, которые наблюдали при химиотерапии на основе платины (20-30% и 3-4 месяца, соответственно) в отношении распространенного NSCLC {Schiller, et al. JCO 2002}. В недавно завершенной III фазе клинических исследований пациенты с диагнозом NSCLC с мутантным EGFR, ранее не проходившие курс химиотерапии, имели значительно длиннее период (отношение рисков = 0,48 (95% CI; 0,36-0,64); p<0,0001) выживаемости без прогрессирования заболевания (PFS) и частоту объективного ответа опухоли (71,3 в сравнении с 47,2%; p=0,0001) при лечении с помощью гефитиниба по сравнению с традиционной химиотерапией {Mok et al. ESMO meeting 2008}. В свою очередь пациенты с NSCLC, который происходил от EGFR дикого типа, имели худший результат в случае, когда они принимали гефитиниб по сравнению с химиотерапией в качестве их первичного лечения распространенного NSCLC {Mok et al. ESMO meeting 2008}. Таким образом, благодаря мутациям EGFR обеспечивают важный способ отбора пациентов с NSCLC для терапии (ингибиторами EGFR TKI), которая является более эффективной, чем традиционная системная химиотерапия. Мутации EGFR регулярно оценивают у пациентов с NSCLC во многих клинических центрах.
Вопреки первичным клиническим результатам от гефитиниба/эрлотиниба для пациентов с NSCLC с накоплением мутаций EGFR, у большинства, если не у всех пациентов окончательно развивался прогрессирующий рак во время получения терапии на основе этих средств. В первичных исследованиях рецидивных образцов идентифицировали вторичную мутацию EGFR, а именно T790M, что представляет гефитиниб и эрлотиниб неэффективными ингибиторами киназной активности EGFR {Kobayashi et al. NEJM 2005 и Pao et al. PLOS Medicien 2005}. Последующие исследования продемонстрировали, что T790M мутация EGFR была обнаружена примерно в 50% опухолей (24/48) пациентов, у которых развилась приобретенная стойкость к гефитинибу или эрлотинибу {Kosaka et al. CCR 2006; Balak et al. CCR 2006 и Engelman et al. Science 2007}. Это вторичное генетическое изменение происходит в остатке 'проводника' ('gatekeeper') и в аналогичном положении других аллелей вторичной устойчивости при заболеваниях, которые лечили с помощью ингибиторов киназы (например, T315I в ABL при стойкой к иматинибу CML).
При первичной идентификация EGFR T790M также определили, что необратимый ингибитор EGFR, а именно CL-387,785, все еще может ингибировать EGFR, даже когда он обладает T790M мутацией. Последующие исследования продемонстрировали, что другие необратимые ингибиторы EGFR, а именно EKB-569 и HKI-272, также могут ингибировать фосфорилирование EGFR с T790M и рост EGFR-мутантных клеточных линий NSCLC, накапливающих T790M мутацию {Kwak et al. PNAS 2005; Kobayashi et al. NEJM 2005}. Эти необратимые ингибиторы EGFR являются подобными по химической структуре к обратимым ингибиторам, гефитинибу и эрлотинибу, но отличаются тем, что они содержат акцептор Михаэля, который позволяет им ковалентно связываться с Cys 797 в EGFR. T790M мутация не исключает связывание необратимых ингибиторов; вместе с тем она предоставляет стойкость к обратимым ингибиторам, в частности, путем увеличения аффинности фермента к ATP, по меньшей мере в L858R/T790M-мутантном EGFR {Yun et al., PNAS 2008}. Необратимые ингибиторы преодолевают этот механизм стойкости, поскольку единожды ковалентно связавшись, они больше не находятся в конкуренции с ATP. Эти наблюдения привели к клиническим испытаниям необратимых ингибиторов EGFR для пациентов, развивших приобретенную стойкость к гефитинибу или эрлотинибу. Три таких средства (HKI-272, BIBW2992 и PF00299804) находятся в данный момент в рамках клинических испытаний. Тем не менее, согласно доклиническим исследованиям до настоящего времени можно предположить, что эти средства не являются оптимальными при ингибировании EGFR вариантов, несущих T790M мутацию.
Недавние исследования на мышиной модели рака легкого, опосредованного L858R/T790M в EGFR, демонстрируют, что разновидности форм рака у этих мышей (бронхиальные опухоли) были нечувствительные к монотерапии с помощью HKI-272 {Li et al. Cancer Cell 2007}. Таким образом, даже в этой модели, обусловленной исключительно EGFR, монотерапия с помощью HKI-272 неспособна вызвать регрессию опухоли. Это представляет резкий контраст по отношению сильного действия монотерапии эрлотинибом на мышиные модели рака легкого, которые содержат только активирующие мутации EGFR {Ji et al. Cancer Cell 2006}, и показывает, что HKI-272 может также быть неэффективным для некоторых пациентов с NSCLC, с T790M в EGFR. Похожие результаты исследований были опубликованы для BIBW 2992 (Li et al. Oncogene 2008) Кроме того, IC50 для HKI-272, необходимая чтобы ингибировать рост клеток Ba/F3, накапливающих EGFR T790M вместе с разными делеционными мутациями в экзоне 19, варьирует от 200-800 нМ, в то время как значение Cmax в I фазе испытания составляло только приблизительно 200 нМ {Yuza et al. Cancer Biol Ther 2007; Wong et al. CCR 2009 in press}. Таким образом, в этом отношении действительно существует необходимость совершенствовать более эффективные целевые средства для EGFR, способные ингибировать EGFR с T790M.
Основным ограничением всех существующих ингибиторов EGFR является проявление токсичности в нормальных тканях. Поскольку ATP аффинность EGFR T790M является подобной WT EGFR, концентрация необратимого ингибитора EGFR, необходимая для ингибирования EGFR T790M, также может эффективно ингибировать WT EGFR. Класс-специфичные виды токсичности существующих ингибиторов киназы EGFR, а именно кожная сыпь и диарея, являются результатом ингибирования WT EGFR в тканях без рака. Эта токсичность, в результате ингибирования WT EGFR, исключает повышение дозы существующих средств до уровней концентрации в плазме, что будет эффективно ингибировать EGFR T790M. Значительным успехом может быть идентификация ингибитора, специфичного к мутантному EGFR, который был бы менее эффективным в отношении дикого типа EGFR. Такое средство скорее всего могло бы быть клинически более эффективным, а также потенциально более приемлемым в качестве терапевтического средства для пациентов с раком.
Киназа анапластической лимфомы (ALK) относится к рецепторной тирозинкиназе (RTK) суперсемейства киназных белков. Экспрессия ALK в здоровых тканях взрослого человека ограничена эндотелиальными клетками, перицитами и реже - нервными клетками. Онкогенные, конститутивно активные белки слияния ALK экспрессируются при анапластической крупноклеточной лимфоме (ALCL) и при воспалительных миофибробластических опухолях (IMT). ALK также недавно была связана в качестве онкогена для небольшой части случаев немелкоклеточного рака легкого и нейробластомы (Choi et al., Cancer Res 2008; 68: (13); Webb et al., Expert Rev. Anticancer Ther. 9(3), 331-356, 2009).
Анапластические крупноклеточные лимфомы (ALCL) являются подтипом высокодифференцированного семейства неходжкинских лимфом с различной морфологией, иммунофенотипом и прогнозом. ALCL предположительно возникают из T клеток и, в редких случаях, могут также характеризоваться B клеточным фенотипом. Кроме того, насчитывается 40% случаев, для которых клетка-предшественница остается неизвестной и которую классифицируют как "нулевую". Впервые описанная в качестве гистологического объекта согласно способу, Stein et al., основанном на экспрессии CD30 (Ki-1), ALCL была представлена как системное заболевание, поражающее кожу, кости, мягкие ткани и другие органы, с вовлечением лимфатических узлов или без вовлечения лимфатических узлов. ALCL может быть разделена по меньшей мере на два подкласса, которые характеризуются наличием или отсутствием хромосомной перестройки между генным локусом киназы анапластической лимфомы (ALK) и разными партнерами по слиянию, такими как нуклеофосмин (NPM). Примерно 50-60% случаев ALCL ассоциированы с хромосомной транслокацией t(2;5)(p23;q35), в результате которой генерируется гибридный ген, включающий внутриклеточный домен тирозинкиназного рецептора ALK соединенного с NPM. Полученный белок слияния NPM-ALK характеризуется конститутивной тирозинкиназной активностью и проявляет свойства трансформировать разные типы гематопоэтических клеток in vitro, а также обеспечивает формирование опухоли in vivo.
NPM-ALK, вариант онкогенного белка слияния киназы анапластической лимфомы, который образуется в результате хромосомной транслокации, является вовлеченным в патогенез анапластической крупноклеточной лимфомы (Pulford K, Morris SW, Turturro F. Anaplastic lymphoma kinase proteins in growth control and cancer. J Cell Physiol 2004; 199: 330-58). Роли аберрантной экспрессии конститутивно активных химерных белков ALK в патогенезе ALCL были четко определены (Weihua Wan, et al. Anaplastic lymphoma kinase activity is essential for the proliferation and survival of anaplastic large cell lymphoma cells. Blood First Edition Paper, prepublished online October 27, 2005; DOI 10.1182/blood-2005-08-3254). NPM-ALK вовлечен в дисрегуляцию клеточной пролиферации и апоптоз лимфомных клеток ALCL (Pulford et al., 2004).
Другие менее частые партнеры по слиянию с ALK, например, тропомиозин-3 и тяжелая цепь клатрина, также были идентифицированы в ALCL, а также в CD30-негативной диффузной крупноклеточной лимфоме. Несмотря на едва заметную разницу в сигнальном пути и некоторых биологических функциях, все слияния, по-видимому, трансформируют фибробласты и гемопоэтические клетки. Обширный анализ лейкемогенного потенциала NPM-ALK на животных моделях дополнительно подтверждал роли NPM-ALK и других перестроек ALK в развитии ALK-позитивной ALCL и других заболеваний.
Белки слияния ALK также были обнаружены в клеточных линиях и/или первичных образцах, представляющих множество других опухолей, включающих воспалительную миофибробластическую опухоль (IMT), нейроэктодермальные опухоли, глиобластомы, меланому, рабдомиосаркомные опухоли и формы желудочной плоскоклеточной карциномы (см. обзор Webb TR, Slavish J, et al. Anaplastic lymphoma kinase: role in cancer pathogenesis and small-molecule inhibitor development for therapy. Expert Rev Anticancer Ther. 2009; 9(3): 331-356). Недавно, ALK также связали с небольшим процентом таких форм рака, как рак груди, колоректальный и немелкоклеточный рак легкого (Lin E, Li L, et al. Exon Array Profiling Detects EML4-ALK Fusion in Breast, Colorectal, and Non-Small Cell Lung Cancers. Mol Cancer Res 2009; 7(9): 1466-76).
Примерно 3-7% опухолей легкого накапливают слияния ALK и множество различных перестроек ALK было описано для NSCLC. Большинство этих вариантов ALK слияния состоят из участков гена белка, подобного белку иглокожих, ассоциированного с микротрубочками 4 (EML4) с геном ALK. По меньшей мере девять разных вариантов слияния EML4-ALK были идентифицированы при NSCLC (Takeuchi et al. Multiplex reverse transcription-PCR screening for EML4-ALK fusion transcripts.Clin Cancer Res.2008,15(9):3143-9). Кроме того, партнеры по слиянию, отличные от EML4, также были идентифицированы, включая KIF5B-ALK (Takeuchi et al. KIF5B-ALK, a novel fusion oncokinase identified by an immunohistochemistry-based diagnostic system for ALK-positive lung cancer. 2009, 15(9):3143-9) и TFG-ALK (Rikova et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer. Cell 2007,131(6):1190-203).
Разные N-концевые партнеры по слиянию способствуют димеризации и, следовательно, конститутивной киназной активности. Нисходящий сигнальный путь слияний ALK приводит к активации клеточных каскадов реакций, как известно, участвующих в росте клеток и пролиферации клеток (Mosse et al. Inhibition of ALK signaling for cancer therapy. Clin Cancer Res. 2009, 15(18):5609-14).
Краткое описание изобретения
Настоящее изобретение относится к гетероциклическим соединениям пиримидина, применимым в качестве ингибиторов EGFR или ALK, а также для лечения состояний, опосредованных EGFR или ALK. Соединения согласно настоящему изобретению характеризуются общей структурой формулы I или фармацевтически приемлемыми солями:
Формула I,
и
X отсутствует, представляет собой O, S или NR16; R16 представляет собой H или C1-6алкил;
Y представляет собой галоген, OH, NH2, CN, N3, NO2 или замещенный или незамещенный C1-6алкил;
Z представляет собой O, S, NR20 или CR20R21; и каждый R20 или R21 независимо представляет собой H, галоген, замещенный или незамещенный C1-6алкил или замещенный или незамещенный C1-6алкокси;
R1 представляет собой гидрокси, N(R8)(R9), N(R8)(CH2)N(R8)(R9), N(R8)(R9)CO(R9), N(R8)CO(R9), C(O)R8, C(O)OR8, C(O)NH2, C(O)NH(R8), C(O)N(R8)(R9), алкил, галогеналкил, арил, арилалкил, алкокси, гетероарил, гетероциклил или карбоциклил, каждый из которых может быть необязательно замещен; каждый R8 и R9 независимо представляет собой H, гидрокси, алкил, алкенил, винил, гетероциклил, циклоалкил или карбоциклил, каждый из которых может быть необязательно замещен;
R2 представляет собой H, F или C1-4алкил; или
R2 и R1 вместе с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из P, N, O или S, при этом гетероциклическое кольцо является незамещенным или замещенным;
R3 представляет собой H, галоген или 5- или 6-членное гетероциклическое кольцо, содержащее 1 или 2 атома N, при этом гетероциклическое кольцо является незамещенным или замещенным; или
R2 и R3 вместе образуют 5-12-членное замещенное или незамещенное гетероциклическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, независимо выбранных из N или O;
R4 представляет собой H, C1-6алкокси, C3-6алкенилокси, C3-6циклоалкилокси, галоген, -O-гетероциклил, гетероциклил или -NR24(CH2)PNR24R25, каждый из которых может быть необязательно замещен; и P равен 0, 1, 2 или 3, и каждый R24 или R25 независимо представляет собой H, галоген, замещенный или незамещенный C1-6алкил или замещенный или незамещенный C1-6алкокси;
R5 представляет собой H, F, C1-6алкил, галогеналкил, C1-6алкокси, циклоалкилокси, -NR15C(O)(CH2)nCR17=CR18R19, -NR15C(O)(CH2)nOCHR17R18, -NR15C(O)(CH2)nCR17(CH2)mCHR18R19, -NR15C(O)(CH2)nCR17=CH(CH2)mNR18R19, -NR15C(O)CR17(CH2)mNR18(CH2)nNR18R19, -NR15C(O)(CH2)nCHR17R18, -NR15C(O)(CH2)nCR17(CH2)mCHR18R19 или , каждый из которых может быть необязательно замещен; или представляет собой 5- или 6-членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из N или O, при этом гетероциклическое кольцо является незамещенным или замещенным; и каждый из R15, R17, R18 или R19 независимо отсутствует, представляет собой -H, -OH, -NH2, галоген, алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероалкил, гетероциклил, связь или гетероарил, каждый из которых может быть необязательно замещен; и каждый m или n независимо равен 0, 1, 2 или 3;
R7 представляет собой H, галоген, C1-6алкил, C1-6алкокси, C3-6алкенилокси, C3-6циклоалкилокси, -OC(O)N(R10)(R11), -NR10C(O)OR11, -NR22C(O)CR23=CR10R11, -NR22C(O)CR23(CH2)sCHR10R11, , -NR22C(O)CR23=CR10(CH2)sR11, -NR22C(O)CR23(CH2)sNR10(CH2)tNR10R11 или -NR22C(O)(CH2)sCR23=CH(CH2)tNR10R11, каждый из которых может быть необязательно замещен; или представляет собой 5- или 6- членное гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, независимо выбранных из N или O, при этом гетероциклическое кольцо является незамещенным или замещенным; и каждый из R10, R11, R22 или R23 независимо представляет собой H, алкил, алкенил, алкинил и гетероалкил, гетероциклил, циклоалкил, циклоалкилокси, гетероалкил или связь, каждый из которых может быть необязательно замещен; или R10 и R11 вместе с атомами, к которым они присоединены, объединяют с образованием 3-, 4-, 5- или 6-членного гетероциклического кольца, которое является замещенным или незамещенным; и каждый s или t независимо равен 0, 1, 2 или 3;
R6 объединяют с R7 с образованием 6-членного гетероциклического кольца, или представляет собой H, галоген, -CN, -NO2, циклоалкил, гетероалкил, гетероциклил, гетероциклический-CO-алкил, гетероциклический-CO-алкенил, гетероарил, -R12, -OR13, -O-NR12R13, -NR12R13, -NR12-NR12R13, -NR12-OR13, -C(O)GR13, -OC(O)GR13, -NR12C(O)GR13, -SC(O)GR13, -NR12C(=S)GR13, -OC(=S)GR13, -C(=S)GR13, -YC(=NR12)GR13, -GC(=N-OR12)GR13, -GC(=N-NR12R13)GR13, -GP(=O)(GR12)(GR13), -NR12SO2R13, -S(O)rR13, -SO2NR12R13, -NR1SO2NR12R13, -O(CH2)rR13, -O(CH2)rNR12R13, -NR12(CH2)rNR12R13, -NR12(CH2)rR13, -(CH2)rNR12R13 или -CH2O(CH2)rNR12R13, каждый из которых может быть необязательно замещенным, или
;
каждый G независимо представляет собой связь, -O-, -S- или -NR15; и каждый R12, R13 или R15 независимо представляет собой H, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероалкил, гетероциклил или гетероарил, каждый из которых может быть необязательно замещен;
r равен 0, 1, 2 или 3;
каждый A1 или A2 независимо представляет собой CH или N; и R14 представляет собой алкил, алкокси, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероалкил, гетероциклил или гетероарил, каждый из которых может быть необязательно замещен.
Настоящее изобретение дополнительно предусматривает некоторые предпочтительные технические решения в отношении соединения формулы (I).
В некоторых вариантах осуществления формулы (I) Y представляет собой галоген или замещенный или незамещенный C1-6алкил.
В некоторых вариантах осуществления формулы (I) Y представляет собой галоген, метил или метил, замещенный галогеном.
В некоторых вариантах осуществления формулы (I) Y представляет собой Cl или CF3.
В некоторых вариантах осуществления формулы (I) Y представляет собой CH3.
В некоторых вариантах осуществления формулы (I) X представляет собой NR16.
В некоторых вариантах осуществления формулы (I) R16 представляет собой H.
В некоторых вариантах осуществления формулы (I) Z представляет собой O или CH2.
В некоторых вариантах осуществления формулы (I) Z представляет собой O.
В некоторых вариантах осуществления формулы (I) r равен 0, 1 или 2.
В некоторых вариантах осуществления формулы (I) r равен 3.
В некоторых вариантах осуществления формулы (I) каждый R6 независимо представляет собой H, галоген, -R12, -OR13 или -NR12R13, каждый из которых может быть необязательно замещен.
В некоторых вариантах осуществления формулы (I) каждый R6 объединяют с R7 с образованием 6-членного гетероциклического кольца, необязательно замещенного H, гидрокси, алкилом, алкенилом, гетероциклилом, циклоалкилом, -OR13, -C(O)R12, -NR12R13 или карбоциклилом; или R6 представляет собой -O(CH2)rR13, -O(CH2)rNR12R13, -NR12(CH2)rNR12R13, -NR12(CH2)rR13, -(CH2)rNR12R13 или -CH2O(CH2)rNR12R13, каждый из которых может быть необязательно замещен с помощью замещенного или незамещенного C1-6алкила, замещенного или незамещенного C2-6алкенила, замещенного или незамещенного C2-6алкинила, галогеналкила, галогена, замещенного или незамещенного алкокси, -NH2, -NCH3CH3 или -NHCH3.
В некоторых вариантах осуществления формулы (I) каждый R12, R13 или R15 независимо представляет собой H, (C1-6)алкил, (C2-6)алкенил, (C3-6)циклоалкил или (C3-6)гетероциклил, каждый из которых может быть необязательно замещен.
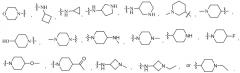
В некоторых вариантах осуществления формулы (I) каждый R6 независимо представляет собой -OH, -OEt, -NH2, -NHCH3, -NCH3CH3,
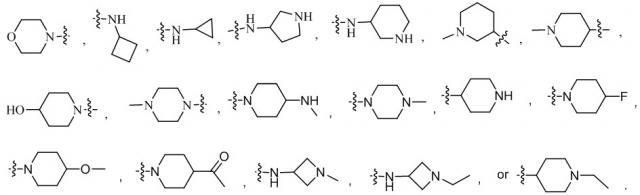
В некоторых вариантах осуществления формулы (I) каждый R6 независимо представляет собой -H, -F, , , , , , , , , , , , , , , , , , , или .
В некоторых вариантах осуществления формулы (I) каждый R2 и R3 независимо представляет собой водород или галоген.
В некоторых вариантах осуществления формулы (I) как R2, так и R3 представляют собой водород.
В некоторых вариантах осуществления формулы (I) R1 представляет собой гидрокси, N(R8)(R9), алкил, алкокси или галогеналкил, каждый из которых может необязательно быть замещенным.
В некоторых вариантах осуществления формулы (I) каждый R8 и R9 независимо представляет собой H, гидрокси, C1-6алкил, C2-6алкенил.
В некоторых вариантах осуществления формулы (I) каждый R8 или R9 независимо представляет собой метил или винил.
В некоторых вариантах осуществления формулы (I) каждый R8 и R9 независимо представляет собой гетероциклил, циклоалкил или карбоциклил, каждый из которых может быть необязательно замещен.
В некоторых вариантах осуществления формулы (I) каждый R1 независимо представляет собой -OH, -OEt, -NHOH, -NH2, -NHCH3, -NCH3CH3, -NHCH2CH2NCH3CH3, -NHCH2CH2OH,
В некоторых вариантах осуществления формулы (I) каждый R1 независимо представляет собой -CH2CH3, , , , , или .
В некоторых вариантах осуществления формулы (I) все из R2, R3 и R5 представляют собой H.
В некоторых вариантах осуществления формулы (I) R4 представляет собой C1-6алкокси, C3-6алкенилокси или C3-6циклоалкилoкси.
В некоторых вариантах осуществления формулы (I) R4 представляет собой водород, -OCH3, -OEt, или .
В некоторых вариантах осуществления формулы (I) R4 представляет собой галоген, -O-гетероциклил, гетероциклил или -NR24(CH2)PNR24R25, каждый из которых может быть необязательно замещен; и P представляет собой 1 или 2, каждый R24 или R25 независимо представляет собой C1-6алкил, C1-6алкокси, -NHOH, -NH2, NHCH3, NCH3CH3или галоген.
В некоторых вариантах осуществления формулы (I) R4 представляет собой водород, F, -OCH3, , , или .
В некоторых вариантах осуществления формулы (I) R5 представляет собой H, галогеналкил, C1-6алкокси, -NR15C(O)(CH2)nCR17=CR18R19, -NR15C(O)(CH2)nOCHR17R18, -NR15C(O)(CH2)nCR17=CH(CH2)mNR18R19, -NR15C(O)CR17(CH2)mNR18(CH2)nNR18R19 или -NR15C(O)(CH2)nCHR17R18, каждый из которых может быть необязательно замещен с помощью C1-6алкокси, -NH2, -NHCH3, -NCH3CH3, -NHOH, C1-6алкила, галогена или связи; и каждый из R15, R17, R18 или R19 независимо отсутствует, представляет собой -H, C1-6алкил, алкенил, C1-6алкокси, -NHOH, -NH2, -NHCH3, -NCH3CH3, связь или C3-6гетероциклил; и каждый m или n независимо равен 0, 1 или 2.
В некоторых вариантах осуществления формулы (I) R5 представляет собой H, метил, метил, замещенный галогеном, метокси, , , , , , , , или .
В некоторых вариантах осуществления формулы (I) R7 представляет собой H, C1-6алкил, -NR22C(O)CR23=CR10R11, -NR22C(O)CR23(CH2)sCHR10R11, -NR22C(O)CR23=CR10(CH2)sR11, -NR22C(O)CR23(CH2)sNR10(CH2)tNR10R11 или -NR22C(O)(CH2)sCR23=CH(CH2)tNR10R11, каждый из которых может быть необязательно замещен; и каждый из R10, R11, R22 или R23 независимо представляет собой H, алкил, алкенил, гетероциклил, циклоалкил, циклоалкилoкси, гетероалкил или связь, каждый из которых может быть необязательно замещен с помощью C1-6алкила, алкокси, гетероциклила, циклоалкила, циклоалкилoкси, гетероалкила или связи; и каждый s или t независимо равен 0, 1 или 2.
В некоторых вариантах осуществления формулы (I), где R7 представляет собой H, C1-6алкил, , , , , , , , , , , , или .
В некоторых вариантах осуществления формулы (I) соединение представлено формулой II:
Формула II.
Настоящее изобретение дополнительно предусматривает некоторые предпочтительные технические решения в отношении соединения формулы (II).
В некоторых вариантах осуществления формулы (II) X представляет собой NH.
В некоторых вариантах осуществления формулы (II) Y представляет собой галоген или галогеналкил.
В некоторых вариантах осуществления формулы (II) Y представляет собой Cl или CF3.
В некоторых вариантах осуществления формулы (II) Y представляет собой C1-6алкил.
В некоторых вариантах осуществления формулы (II) Y представляет собой CH3.
В некоторых вариантах осуществления формулы (II) R1 представляет собой -OH, -OEt, -NHOH, -NH2, -NHCH3, -NCH3CH3, -NHCH2CH2NCH3CH3, -NHCH2CH2OH,
В некоторых вариантах осуществления формулы (II) каждый R1 независимо представляет собой -CH2CH3, , , , , или .
В некоторых вариантах осуществления формулы (II) все из R2, R3, R5 и R7 представляют собой H.
В некоторых вариантах осуществления формулы (II) все из R2, R3 и R5 представляют собой H.
В некоторых вариантах осуществления формулы (II) R5 представляет собой H, метил, замещенный галогеном, метокси, , , , , , , , или .
В некоторых вариантах осуществления формулы (II) R4 представляет собой водород, F, -OCH3, , , или .
В некоторых вариантах осуществления формулы (II) каждый R6 независимо представляет собой -OH, -OEt, -NHOH, -NH2, -NHCH3 или -NCH3CH3.
В некоторых вариантах осуществления формулы (II) каждый R6 независимо представляет собой -H, -F, , , , , , , , , , , , , , , , , , , или .
Настоящее изобретение дополнительно предусматривает некоторые предпочтительные технические решения в отношении соединения формулы (I) или формулы (II), при этом соединение представляет собой
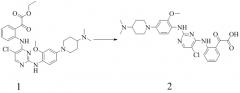
1) этил-2-(2-(5-хлор-2-(4-(4-(диметиламино)пиперидин-1-ил)-2-метоксифениламино)пиримидин-4-иламино)фенил)-2-оксоацетат;
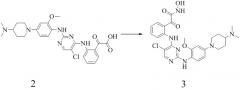
2) 2-(2-(5-хлор-2-(4-(4-(диметиламино)пиперидин-1-ил)-2-метоксифениламино)пиримидин-4-иламино)фенил)-2-оксоуксусную кислоту;
3) 2-(2-(5-хлор-2-(4-(4-(диметиламино)пиперидин-1-ил)-2-метоксифениламино)пиримидин-4-иламино)фенил)-N-гидрокси-2-оксоацетамид;
4) 2-(2-(5-хлор-2-(4-(4-(диметиламино)пиперидин-1-ил)-2-метоксифениламино)пиримидин-4-иламино)фени