Производные щавелевой кислоты, их использование в качестве хемосенсибилизаторов в комбинированной противоопухолевой терапии с цитостатиками при лечении лейкозов и лекарственно-устойчивых лейкозов, способ получения производных щавелевой кислоты
Иллюстрации
Показать всеИзобретение относится к производным щавелевой кислоты общей формулы RC(O)-C(O)R, где R=СН3СН(-NH)C(O)ONa и Ph-CH2CH(-NH)C(O)ONa, которые могут найти применение при лечении лекарственно-резистентных опухолей. Изобретение относится также к указанным производным щавелевой кислоты в качестве хемосенсибилизаторов в комбинированной терапии опухолей с фенотипом лекарственной устойчивости и средств повышения эффективности при проведении комбинированной терапии лейкоза Р388, а также к способу их получения. 4 н.п. ф-лы, 2 табл., 4 пр.
Реферат
Изобретение относится к области физиологически активных веществ и касается производных щавелевой кислоты, которые в комбинации с цитостатиками позволяют лечить резистентные опухоли, полученные в процессе проведения химиотерапии злокачественных новообразований. В настоящее время эта проблема является социально значимой проблемой. В этой связи синтез новых веществ, которые позволили бы лечить лекарственно-резистентные опухоли, является очень актуальным.
Задачей настоящего изобретения является расширение ассортимента средств воздействия на живой организм, конкретно синтез производных щавелевой кислоты формулы I RC(O)-C(O)R, где R = CH3CH(-NH)C(O)ONa (1); Ph-CH2CH(-NH)C(O)ONa (2), которые в сочетании с известными цитостатиками позволяют лечить лекарственно-резистентные опухоли. Если учесть, что в медицинской практике в настоящее время отсутствуют эффективные лекарственные средства для лечения лекарственно-резистентных опухолей, то синтез предлагаемых нами соединений является весьма актуальной задачей. Другой задачей изобретения является разработка способа получения предлагаемых соединений. Включение соединений, представленных выше, в комбинированную терапию злокачественных опухолей в сочетании с этопозидом позволяет повысить химиотерапевтическую чувствительность опухолей.
Поставленная задача достигается тем, что оксалилдихлорид обрабатывают метиловым эфиром аминокислоты с последующим отделением метилового эфира оксалилдиаминокислоты и обработкой водным раствором гидроксида натрия в среде метанола с получением соединений общей формулы I. Целевой продукт при этом выделяют путем фильтрования. Использование натриевых солей соединений 1 и 2 необходимо для того, чтобы вещество было хорошо растворимо в воде, что необходимо для введения производных щавелевой кислоты в виде водных растворов.
Существо изобретения характеризуется следующими примерами.
Метиловый эфир оксалилдиаланина (1)
К суспензии 8.35 г гидрохлорида метилового эфира DL-аланина в 150 мл хлороформа прибавляли 16.72 г триэтиламина. Затем реакционную смесь охлаждали до 0°С и по каплям прибавляли 2.6 мл оксалилдихлорида. Температуру реакционной смеси поднимали до комнатной и перемешивали еще 1.5 часа. Реакционную массу переносили в делительную воронку и добавляли 75 мл 2%-ного раствора NaHCO3, хлороформенный слой отделяли, а водный экстрагировали хлороформом 4×50 мл. Хлороформенные экстракты объединяли, просушивали над MgSO4. Отгоняли при пониженном давлении хлороформ. Получено 4.54 г бесцветного кристаллического вещества (58%). Т.пл. 125-126°С. Найдено (%): С 45,95; Н 6.07; N 11.09. C10H16N2O6. Вычислено (%): С 46.15; Н 6.15; N 10.76. Спектр ЯМР1Н (ДМСО-d6, м.д, J, Гц): 9.02 (д, 2Н, NH, J3H-H=6.2), 4.38 (м, 2Н, СН), 3.64 (с, 6Н, ОСН3), 1.35 (д, 6Н, СН3, J3H-H=7.3).
Динатриевая соль оксалилдиаланина (1а)
К 50 мл нагретого до 60°С этанола при интенсивном перемешивании прибавляли 2 г (0,0077 моль) метилового эфира оксалилдиаланина. К полученному раствору прибавляли раствор 0.8 г гидроксида натрия в 25 мл этанола. После смешивания реагентов реакционную массу перемешивали в течение 1 часа при 60°С и охлаждали до комнатной температуры. Выпавший бесцветный осадок динатриевой соли оксалилдиаланина отфильтровывали и промывали 15 мл диэтилового эфира. Получено 2.05 г (0,0074 моль) бесцветных кристаллов (96%). Т.пл > 250°С. Найдено (%): С 34.46, Н 3.91, N 9.84, Na 16.49. C8H10N2O6Na2. Вычислено (%): С 34.78, Н 3.62, N 10.14, Na 16.67.
Метиловый эфир оксалилдифенилаланина (2)
К раствору 5,215 г гидрохлорида L-фенилаланина в 50 мл хлороформа при охлаждении до 0°С и перемешивании прибавляли 6,7 мл триэтиламина и по каплям 2,2 мл оксалилдихлорида. После смешения реагентов реакционную массу перемешивали при 55°С в течение 2 часов. Охладив до нормальных условий, перенесли реакционную массу в делительную воронку. После промывки 2% раствором NaHCO3 2×30 мл хлороформенный раствор высушивали над сульфатом магния MgSO4 и отгоняли CHCl3 при пониженном давлении, в остатке получили 3,6 г (0,0088 моль) бесцветного кристаллического вещества - метилового эфира оксалилдифенилаланина (72%), т.пл. 157°С. Найдено (%): С 64.52, Н 5.31; N 6.60. C22H24N2O6. Вычислено (%): С 64.07; Н 5.83; N 6.80. Спектр ЯМР 1Н (ДМСО-d6, м.д, J, Гц): 8.93 (д, 2Н, NH, J3H-H=8.3); 7.24 (м, 1Н, о-СН-аром); 7.20 (м, 1Н, п-СН-аром); 7.15 (м, 1Н, м-СН-аром.); 4.54 (д.д.д., 1Н, СН, J3H-H=9.4,8.3, 5.2); 3.63 (с, 3Н, ОСН3); 3.12 (д.д. 2Н, СН2, J3H-H=13.9, 5.2); 3.07 (д.д., 1Н, CH2, J3H-H=13.9, 9.4).
Динатриевая соль оксалилдифенилаланина (2а)
Суспендировали 3,9 г (0,0095 моль) метилового эфира оксалилдифенилаланина в 40 мл Н2О. Добавили при перемешивании растертый NaOH 0,95 г (0,0236 моль) и, нагрев реакционную массу до 60°С, перемешивали до полного растворения твердой фазы. По окончании гомогенизации перемешивали еще 1 час, затем, охладив до нормальных условий, выливали водный раствор в 100 мл изопропанола. Выпавший продукт отфильтровывали, промывали 5 мл серного эфира и высушивали. Получили 3,49 г (0,008 моль) белого кристаллического вещества. Выход 85%.
Биологические испытания
Изучение противоопухолевой активности проводилось на исходном штамме лейкоза Р388 мышей. Это асцитный лимфолейкоз, перевивка которого осуществляется путем внутрибрюшинного введения 106 клеток/мышь мышам-гибридам линии BDF1. Лекарственно-устойчивые опухоли были получены in vivo на мышах этой же линии путем постепенного увеличения дозы лекарственных препаратов на каждой генерации. Перевивка этих штаммов осуществлялась таким же числом клеток. В работе использовали следующие лекарственно-резистентные опухоли:
Р388/руб - штамм Р388, устойчивый к рубомицину, обладает генотипом и фенотипом МЛУ;
Р388/цф - штамм Р388, устойчивый к циклофосфану, обладает фенотипом ЛУ;
P388/cPt - штамм Р388, устойчивый к цисплатину, обладает фенотипом ЛУ;
СПЖ - средняя продолжительность жизни животных в сутках;
ILS (%) - увеличение средней продолжительности жизни животных (количественная оценка чувствительности к терапии):
ILS (%) = [(СПЖопыт - СПЖконтр) : СПЖконтр] × 100,
где СПЖопыт и СПЖконтр - средняя продолжительность жизни в опытной и контрольной группах, соответственно;
ЛУ - лекарственная устойчивость;
МЛУ - множественная лекарственная устойчивость.
Дозы традиционных противоопухолевых препаратов в наших экспериментах были значительно снижены по сравнению с их терапевтическими дозами: доза циклофосфана (Цф) - в 5 раз, цисплатина (cPt) - в 6,8 раза, этопозида - в 6 раз, адриамицина (ADR) - в 4 раза.
Синтезированные нами соединения вводились животным в дозах, составляющих 1/3 от их LD50 (доза, вызывающая гибель 50% животных), в стерильной дистиллированной воде.
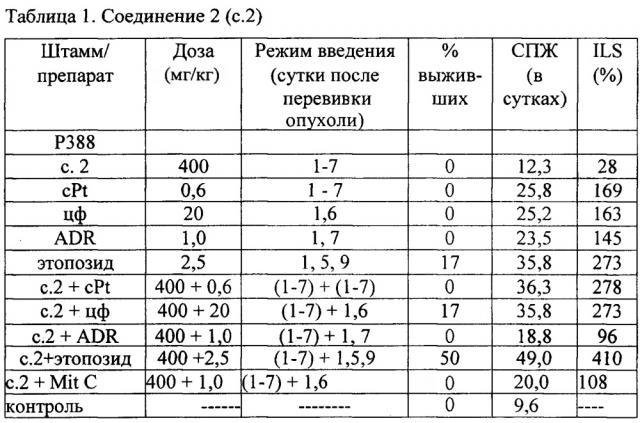
Лечение лейкоза Р-388
Данные таблицы 1 показывают, что на штамме лейкоза Р388 соединение 2 не обладает активностью в монотерапии, но повышает эффективность ряда известных цитостатиков, применяемых в уменьшенных дозах. Так, соединение 2 увеличивало эффективность цисплатина и циклофосфана на 110%, этопозида - на 137%. В последнем случае увеличивалось и число выживших животных от 17% до 50%.
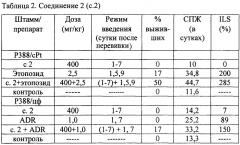
Лечение лекарственно-резистентных штаммов лейкоза Р-388
По данным таблицы 2, на лекарственно-устойчивых опухолях соединение 2 собственной эффективностью не обладало, но при комбинированном применении с известными цитостатиками, применяемыми в значительно сниженных дозах, проявляло хемосенсибилизирующие свойства. Так, на штамме P388/cPt при совместном применении 2 с этопозидом 50% животных выживало, а показатель ILS остальных животных составлял 285%. На Р388/цф наш модулятор при комбинации с адриамицином увеличивал эффективность последнего на 61%.
Следует особо отметить, что во всех экспериментах по комбинированной терапии нашими соединениями-модуляторами и традиционными противоопухолевыми цитостатиками последние применялись в дозах, значительно меньших, чем их терапевтические дозы. Это очень важно, т.к. высокая токсичность этих препаратов общеизвестна, поэтому возможность применения их в уменьшенных дозах, а значит, и с меньшей токсичностью, но с высоким эффектом, позволит увеличить продолжительность лечения больных с большим положительным выходом.
Таким образом, получены новые, ранее неизвестные, оксалилпроизводные щавелевой кислоты в сочетании с аланином и дифенилаланином, которые в комбинированной терапии с традиционными противоопухолевыми препаратами существенно повышают их терапевтический эффект на штамме лейкоза Р388 мышей, а также на лекарственно-резистентных штаммах лейкоза Р-388.
1. Производные щавелевой кислоты общей формулы I RC(O)-C(O)R, где R=СН3СН(-NH)C(O)ONa (1), Ph-CH2CH(-NH)C(O)ONa (2).
2. Производные щавелевой кислоты по п.1 в качестве хемосенсибилизаторов в комбинированной терапии опухолей с фенотипом лекарственной устойчивости.
3. Производные щавелевой кислоты по п.1 в качестве средств повышения эффективности при проведении комбинированной терапии лейкоза Р388.
4. Способ получения производных щавелевой кислоты по п.1 путем воздействия на гидрохлорид метилового эфира соответствующей аминокислоты оксалилдихлоридом с последующим отделением метиловых эфиров оксалилдиаминокислот, их обработкой гидроксидом натрия в среде спирта и выделением целевых продуктов.