Способ получения йопамидола
Иллюстрации
Показать всеИзобретение относится к способам синтеза йодсодержащих контрастных веществ, конкретно к способу получения Йопамидола (II), который включает указанную ниже реакцию, где Х представляет собой OR2 или R3, и R2 и R3 представляют собой С1-С6линейный или разветвленный алкил, С3-С6циклоалкил, C6арил, необязательно замещенный группой, выбранной из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, трет-бутила и фенила. Способ включает стадии a)-c). На стадии a) осуществляют взаимодействие соединения (I) с ацилирующим агентом (S)-2-(ацетилокси)пропаноилхлоридом в реакционной среде для получения N-(S)-2-(ацетилокси)пропаноильного производного соединения (I). На стадии b) осуществляют гидролиз промежуточного соединения со стадии а) с водным раствором при рН, составляющем от 0 до 7, с помощью добавления воды или разбавленного щелочного раствора, освобождение гидроксилов от борсодержащих защитных групп, получение ацетилоксипроизводного соединения (II) и необязательное восстановление борпроизводного. На стадии c) осуществляют щелочной гидролиз ацетилоксипроизводного соединения (II), восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II). Предлагаемый способ позволяет проводить реакцию в одном реакционном сосуде и повысить общий выход Йопамидола (II), а также обеспечивает восстановление и повторное применение реагирующего вещества, используемого в качестве гидроксильной защитной группы. Изобретение относится также к способу получения Йопамидола (II) исходя из 5-нитроизофталевой кислоты (5-NIPA), соединению формулы (I) и его применению в синтезе Йопамидола (II). 4 н. и 25 з.п. ф-лы, 14 пр.
Реферат
Настоящее изобретение относится к области органической химии, в частности к синтезу йодсодержащих контрастных веществ, более определенно, к применению оксикислот бора и их производных в качестве защитных групп. Настоящее изобретение также обеспечивает соединения, пригодные в качестве промежуточных соединений в вышеуказанном синтезе.
УРОВЕНЬ ТЕХНИКИ
Контрастные вещества или контрастные средства представляют собой вещества, которые могут изменить способ, в котором анализируют область при медицинской визуализации. В частности, они способны изменить контрастность органа, повреждения или любой другой окружающей структуры, чтобы сделать видимыми такие детали, которые другим способом было бы трудно обнаружить или оценить.
Контрастные вещества в основном используются в области радиологии или ядерно-магнитно-резонансной диагностики. В зависимости от области применения данные производные представляют структурные особенности, такие как в случае молекул, пригодных в качестве контрастных веществ для рентгеноструктурного анализа, присутствие одного или более атомов с большим атомным номером (например, йода или бария).
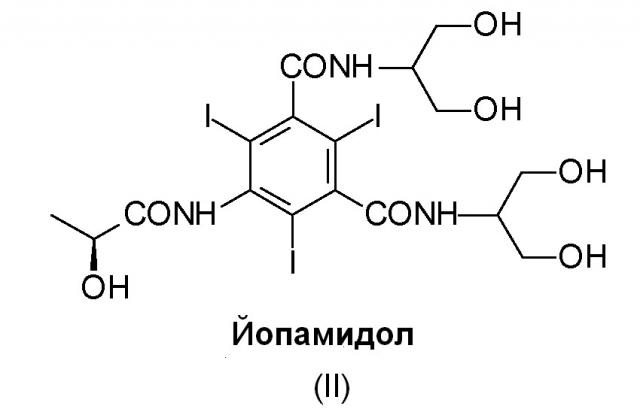
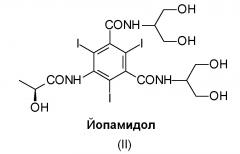
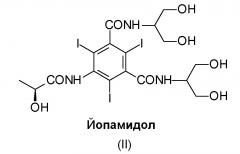
Йопамидол (N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-5-[(2S)(2-гидрокси-1-оксопропил)амино]-2,4,6-трийодо-1,3-бензолдикарбоксамид) (II), структурная формула которого приведена ниже, представляет собой одно из многочисленных трийодзамещенных диагностических средств, коммерчески доступных и широко используемых для этой цели:
Широкое применение данного соединения в диагностике вызывает необходимость для производителей рассмотреть простой и удобный синтез в промышленном масштабе.
Йопамидол и его синтез впервые были раскрыты в GB1472050.
Несколько синтетических подходов были описаны за прошедшее время: они в основном характеризуются превращением ароматических аминопроизводных в соответствующие карбоксамиды с помощью взаимодействия с подходящим производным α-гидроксикислоты, смотри, например: WO 02/44132, WO 02/44125, WO 96/37459, WO 96/37460, патент США 5,362,905, WO 97/47590, WO 98/24757, WO 98/28259 и WO 99/58494.
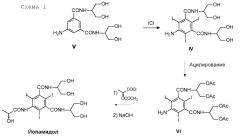
5-Амино-N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-1,3-бензолдикарбоксамид (V) представляет собой ключевое промежуточное соединение в синтезе Йопамидола. Как показано на Схеме 1 ниже, где был обобщен синтез предшествующего уровня техники, его йодирование обеспечивает промежуточное соединение 5-амино-N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-2,4,6-трийодо-1,3-бензолдикарбоксамид (IV), который может дополнительно взаимодействовать с подходящими ацилирующими агентами, такими как уксусный ангидрид с целью защиты гидроксильных групп (как описано, т.е. в WO 02/44132 или в WO 00/050385) и предотвращения их взаимодействия с N-(S)-2-(ацетилокси)пропаноилхлоридом (2-ацетилоксипропаноилхлоридом) в последующей реакции. С помощью ацетилирования более реакционно-способных карбоксамидо-гидроксигрупп предотвращается применение избытка хлорида 2-ацетилоксипропаноила. Тем не менее, защитная группа после окончательного снятия защитной группы с помощью NaOH теряется и не может быть повторно использована.
Кроме того, чтобы защитить гидроксильные группы, требуется избыток уксусного ангидрида, и его присутствие в смеси является несовместимым в следующей стадии реакции. В дальнейшем, необходимы дополнительные стадии осаждения и кристаллизации.
Основной недостаток данного подхода связан с выделением промежуточного соединения (VI) для получения твердого вещества в подходящей кристаллической форме. Данная методика может привести к потере 10% выхода.
Существует необходимость экономически целесообразного синтеза Йопамидола, в частности синтеза, обеспечивающего восстановление и повторное применение реагирующего вещества, используемого в качестве гидроксильной защитной группы.
Существует также необходимость в обеспечении синтеза, который, по меньшей мере, на последних стадиях предоставляет одно- или многостадийную реакцию, которую проводят в одном реакционном сосуде, чтобы избежать выделения промежуточных соединений и повысить общий выход. Кроме того, восстановление реагирующих веществ вместе с уменьшенным образованием и удалением отходов представляют собой крайне желательные задачи, принимая во внимание положительный конечный баланс реакции.
Производные бора известны в качестве защитных агентов в химическом синтезе.
GB2331098 и HR Bjørsvik, H Priebe, J Cervenka, AW Aabye, T Gulbrandsen и AC Bryde (A Selective Process for N-Alkylation in Competition with O-Alkylation: Boric Acid, Borax, and Metaborate as a Cheap and Effective Protecting Group Applicable for Industrial-Scale Synthetic Processes; Organic Process Research and Development 2001, 5, 472-478) раскрывают способ N-алкилирования соединений, содержащих 1,2 и/или 1,3-диольные структуры. Йодсодержащие контрастные вещества раскрыты как определенный вариант осуществления. Для предотвращения конкуренции O-алкилирования в данном документе описано применение оксикислоты бора в качестве диольных защитных агентов. Также могут быть использованы соли и сложные эфиры. Реакцию, включающую диольную защиту с помощью оксикислоты бора, проводят в воде. После завершения реакции N-алкилирования проводят снятие защитной группы диола.
Другое характерное использование оксикислот бора применительно к йодсодержащим контрастным средствам раскрыто в Journal of Hazardous Materials 205-206 (2012) 10-16 (I Rustighia, I Donatia, M Ferluga, C Campa, AE Pasqua, M Rossi, S Paoletti; Borate complexes of X-ray iodinated contrast agents: Characterization and sorption studies for their removal from aqueous media). Авторы показывают эффективное применение оксикислот бора в качестве средств для удаления йодсодержащих контрастных средств из сточных вод. Данный аддукт имеет хорошую стабильность при щелочном рН и адсорбируется на ионообменной смоле Dowex 1Х4, из которой он десорбируется с помощью использования ряда десорбирующих агентов, главным образом солей.
Сущность изобретения
В настоящее время были обнаружены борсодержащие защитные группы, которые являются универсальными и пригодными для эффективного повторного использования. Новые защитные борсодержащие функциональные группы обеспечивают одно- или многостадийный синтез, который проводят в одном реакционном сосуде без выделения промежуточных соединений, предоставляя восстановление и повторное использование защитных функциональных групп и значительное увеличение общих выходов способа.
Кроме того, данные защитные группы могут быть восстановлены и повторно использованы в способе, и это представляет собой значительное преимущество с точки зрения экономической эффективности всего способа и с учетом экологических проблем.
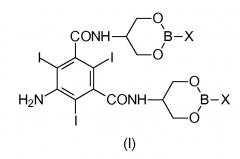
Задача настоящего изобретения состоит в обеспечении промежуточного соединения, представляющего собой Соединение формулы (I)
в которой Х представляет собой OR2 или R3, и в которой R2 и R3 представляют собой С1-С6линейный или разветвленный алкил, С3-С6циклоалкил, C6арил, необязательно замещенный группой, выбранной из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, трет-бутила и фенила.
Другой целью настоящего изобретения является способ получения Йопамидола формулы (II),
включающий следующую реакцию, обобщенную на Схеме 2:
в которой различные группы представляют собой, как определено выше, и включающий следующие стадии:
a) взаимодействие Соединения (I) с ацилирующим агентом (S)-2-(ацетилокси)пропаноилхлоридом в реакционной среде для получения N-(S)-2-(ацетилокси)пропаноильного производного Соединения (I);
b) гидролиз промежуточного соединения со стадии а) с водным раствором при рН в диапазоне от 0 до 7, предпочтительно от 6 до 7 с помощью добавления воды или разбавленного щелочного раствора, такого как гидроксид натрия или гидроксид калия, освобождение гидроксилов от борсодержащих защитных групп, получение ацетилоксипроизводного Соединения (II) и необязательно восстановление борпроизводного;
c) щелочной гидролиз ацетилоксипроизводного Соединения (II), восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II).
В первом предпочтительном варианте осуществления в соединении формулы (I) Х представляет собой OR2, в которой R2 представляет собой, как определено выше, и предпочтительно выбран из группы, состоящей из: этила, н-пропила и н-бутила.
Во втором предпочтительном варианте осуществления в Соединении формулы (I) Х представляет собой R3, в которой R3 представляет собой, как определено выше, и предпочтительно выбран из группы, состоящей из: бутила, изобутила, изопентила, н-пентила, н-гексила, циклопентила, циклогексила или фенила, необязательно замещенного метилом, этилом, н-пропилом, изопропилом, н-бутилом, втор-бутилом, трет-бутилом или фенилом.
На стадии а) вышеупомянутого способа указанная реакционная среда представляет собой органический растворитель, выбранный из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, N,N-диэтилацетамида, N,N-диметилпропионамида, N-метилпирролидона, N-этилпирролидона, тетраметилмочевины, N,N'-диметилэтиленмочевины (DMEU), N,N'-диметилпропиленмочевины (DMPU), необязательно в смеси с несмешивающимся с водой органическим растворителем, в настоящем описании определенным, как сорастворитель.
На стадии b) после гидролиза борзащитных групп восстановление борпроизводного может быть проведено с помощью хроматографии или с помощью экстракции растворителем. В случае использования хроматографии можно применить соответствующую специальную смолу для удаления бора. Например, подходящая смола содержит диольные группы и предназначена для комплексообразования с борной или бороновой кислотой и последующего удаления. Предпочтительная смола представляет собой смолу, содержащую функциональные группы N-метил(полигидроксигексил)амина, также называемую метилглюкамин. Коммерчески доступным примером такой смолы является Amberlite® IRA743. Тем не менее, другие смолы могут быть выбраны из коммерчески доступных смол, например, или эквивалентные, или аналогичные колонки, такие как Duolite ES-371, Diaion CRB 02, Dowex BSR 1, Purolite S 108 и Purolite S110. Дополнительная информация представлена в Подробном Описании ниже. Гидролиз борсодержащих защитных групп проводится с помощью добавления воды.
Тем не менее, восстановление борпроизводных предпочтительно проводят с помощью экстракции растворителем, в частности, когда в соответствии со Схемой 3 и реагентом 3 R3 представляет собой бутил, фенил или метилзамещенный фенил (толильную группу), бутил или когда используют бороксин Формулы III, и R3 имеет то же значение, как и в случае с реагентом 3.
В целом, способ получения Йопамидола в соответствии с настоящим изобретением представлен на следующей Схеме 3:
На Схеме 3, которая описывает синтез Йопамидола (II) из 5-амино-N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-2,4,6-трийодо-1,3-бензолдикарбоксамида (IV), Х представляет собой, как определено выше, и на первой стадии реакции числа 1; 2; 3 представляют собой реагенты в отдельных, альтернативных вариантах осуществления. На схеме не показано, но частью настоящего изобретения является также альтернативный реагент бороксин Формулы III.
В соответствии с настоящим изобретением термины «борпроизводное», «борпроизводные» или «борсодержащая защитная группа» означают соединения бора, которые используют в соответствии со Схемой 3 выше, с исходным Соединением (IV) для получения Соединения (I); также как соединения, полученные в результате гидролиза промежуточного соединения (I) и последующего освобождения гидроксилов от борсодержащих защитных групп. Данные борпроизводные могут быть необязательно восстановлены в вышеуказанной стадии с) и повторно использованы в способе. Термины «борпроизводное» или «борпроизводные» обычно содержат оксикислоты бора (такие как борная кислота и бороновая кислота), их сложные эфиры и бороксин.
В соответствии с первым предпочтительным вариантом осуществления настоящего изобретения и ссылаясь на Схему 3, промежуточное Соединение (I), в котором Х представляет собой OR2, получают с помощью взаимодействия Соединения (IV) с одной из борных кислот в спирте R2OH или борным эфиром В(OR2)3, в которой R2 представляет собой, как определено выше.
В соответствии со вторым предпочтительным вариантом осуществления настоящего изобретения и также ссылаясь на Схему 3, промежуточное Соединение (I), в котором Х представляет собой R3, получают с помощью взаимодействия Соединения (IV) с бороновой кислотой R3-B(OH)2, в которой R3 представляет собой, как определено выше. Альтернативно данный второй предпочтительный вариант осуществления, не показанный на Схеме 3, но часть настоящего изобретения достигается с помощью взаимодействия Соединения (IV) с бороксином формулы (III)
в которой R3 представляет собой, как определено выше.
В одном варианте осуществления настоящего изобретения указанный способ получения Йопамидола (II) включает:
х) взаимодействие Соединения формулы (IV) с эфиром борной кислоты B(OR2)3, в которой R2 представляет собой, как определено выше (см. Схему 3 выше, реагент 2), для получения промежуточного соединения формулы (I), раскрытого выше;
а) обработку указанного промежуточного соединения Соединения (I) (S)-2-(ацетилокси)пропаноилхлоридом для получения N-(S)-2-(ацетилокси)пропаноильного производного Соединения (I)
b) высвобождение борной кислоты; и
c) восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II) с помощью щелочного гидролиза.
В указанном способе эфир борной кислоты может быть восстановлен для последующего применения. В связи с этим борную кислоту, полученную на конечной стадии, восстанавливают, подвергают взаимодействию со спиртом R2-OH, в которой R2 представляет собой, как определено выше, и повторно используют в новом способе.
В варианте осуществления стадии восстановления указанную борную кислоту обрабатывают подходящей смолой, такой как смола, специфичная для борной кислоты, например, коммерчески доступная AmberliteTM IRA743, подразумевая, что специалист в данной области техники сможет выбрать соответствующий способ для восстановления борной кислоты, обращаясь к общеизвестным знаниям в данном вопросе.
В другом варианте осуществления настоящего изобретения указанный способ получения Йопамидола (II) включает:
х') взаимодействие Соединения (IV) с борной кислотой со спиртом R2OH, в которой R2 представляет собой, как определено выше (см. Схему 3 выше, реагент 1), для получения промежуточного соединения формулы (I), раскрытого выше;
а) обработку указанного промежуточного соединения (I) (S)-2-(ацетилокси)пропаноилхлоридом для получения N-(S)-2-(ацетилокси)пропаноильного производного Соединения (I)
b) высвобождение борной кислоты; и
c) восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II) с помощью щелочного гидролиза.
В указанном способе борная кислота и спирт образуют соответствующий эфир борной кислоты in situ, и способ может быть проведен, как и в случае объясненного выше, с использованием эфира борной кислоты. Эфир борной кислоты затем восстанавливают для последующего применения, как показано выше.
Способ может быть проведен в периодическом режиме или в целях удобства в непрерывном режиме.
В другом варианте осуществления настоящего изобретения в Соединении формулы (I) Х представляет собой R3, как определено выше, и представляет собой предпочтительно фенильную, метилзамещенную фенильную, метильную или бутильную группу.
В соответствии с данным вариантом осуществления примерный способ получения Йопамидола (II) продемонстрирован на вышеприведенной Схеме 3, реагент 3.
Указанный способ включает:
х'') взаимодействие Соединения формулы (IV) с бороновой кислотой R3-B(OH)2 или бороксином (III), в которой R3 представляет собой, как определено выше, и предпочтительно выбран из фенила, метилзамещенного фенила, метила и бутила, для получения промежуточного соединения формулы (I);
а) обработку указанного промежуточного соединения (I) (S)-2-(ацетилокси)пропаноилхлоридом для получения ацетилоксипроизводного Соединения (I)
b) высвобождение бороновой кислоты;
c) восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II) с помощью щелочного гидролиза.
В указанном способе бороновая кислота может быть восстановлена для последующего применения. В связи с этим бороновую кислоту, полученную на конечной стадии, восстанавливают с помощью двух возможных подходов: с помощью экстракции органическим несмешивающимся с водой растворителем, например, 4-метил-2-пентаноном, 2-пентаноном, 3-пентаноном, дибутиловым эфиром, 2-метилтетрагидрофураном, циклопентилметиловым эфиром, метилизопропилкетоном, метилизопентилкетоном, этилацетатом, бутилацетатом, пентилацетатом, изопентилацетатом, изопропилацетатом, удаления растворителя и повторного использования восстановленной бороновой кислоты в способе, или в качестве альтернативы, как описано выше, для комплексообразования с борной или бороновой кислотой, то есть с помощью обработки конечной реакционной смеси смолой, подходящей для удаления бора, такой как упомянутые на стадии с) выше, среди которых, например, Amberlite® IRA 743.
Способ восстановления может быть проведен в периодическом режиме или в целях удобства в непрерывном режиме. В предпочтительном варианте осуществления фенилбороновую, п-толилбороновую или н-бутилбороновую кислоты используют и повторно используют.
В другом варианте осуществления в Соединении формулы (I) Х представляет собой R3, как определено выше, предпочтительно фенил, метилзамещенный фенил, метил или бутил. Более предпочтительно в Соединении формулы (I) R3 представляет собой фенил.
Получение соединения формулы (I) в качестве промежуточного соединения при получении Йопамидола (II) также может быть проведено, как раскрыто в предшествующем варианте осуществления, но с использованием бороксина формулы (III) вместо бороновой кислоты. Трифенилбороксин и триметилбороксин являются предпочтительными бороксинами, и R3 в соединении (I) представляет собой предпочтительно фенил или метил. В соответствии с данным вариантом осуществления фенилбороновая кислота или метилбороновая кислота высвобождаются при гидролизе гидроксильных групп, освобожденных от борсодержащего защитного фрагмента, и бороновые кислоты могут быть восстановлены для последующего применения, как раскрыто выше.
Соединение (I) может быть выделено и охарактеризовано, как будет описано более подробно ниже. Соответственно, соединение формулы (I) представляет собой дополнительную цель настоящего изобретения, также как его применение в качестве промежуточного соединения в синтезе Йопамидола (II).
После завершения защиты ОН, которая предпочтительно достигается с помощью дистилляции воды, проводят стадию ацетилирования на Соединении (I), предпочтительно в растворителе, выбранном из группы, состоящей из: N,N-диметилформамида, N,N-диметилацетамида (DMAC), N,N-диэтилацетамида, N,N-диметилпропионамида, 1-метил-2-пирролидона, 1-этил-2-пирролидона, тетраметилмочевины, N,N'-диметилэтиленмочевины (DMEU), N,N'-диметилпропиленмочевины (DMPU). Предпочтительно, используют N,N-диметилацетамид, и, более предпочтительно, N,N-диметилацетамид имеет очень низкое содержание воды или является безводным. Растворитель может также содержать сорастворитель, который представляет собой органический несмешивающийся с водой растворитель, выбранный из: 4-метил-2-пентанона, 2-пентанона, 3-пентанона, дибутилового эфира, 2-метилтетрагидрофурана, циклопентилметилового эфира, метилизопропилкетона, метилизопентилкетона, этилацетата, бутилацетата, пентилацетата, изопентилацетата, изопропилацетата. Предпочтительная смесь растворителя/сорастворителя представлена DMAC и 4-метил-2-пентаноном, 3-пентаноном или 2-пентаноном.
Присутствие сорастворителя на стадии а) является наиболее предпочтительным, когда борзащитные группы должны быть восстановлены позднее с помощью экстракции сорастворителем.
В другом варианте осуществления настоящего изобретения способ может быть проведен исходя из соответствующего Соединения (V).
В соответствии с данным вариантом осуществления целью настоящего изобретения является способ в соответствии со следующей Схемой 4:
Схема 4 описывает синтез Йопамидола (II) из 5-амино-N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-1,3-бензолдикарбоксамида (V); Х представляет собой, как определено выше, и на первой стадии реакции числа 1; 2; 3 представляют собой реагенты в отдельных, альтернативных вариантах осуществления. На схеме не показано, но частью настоящего изобретения является также альтернативный реагент бороксин.
Соединение (V) также могут получить, как описано в WO02/44125 или WO00/029372.
Йодирование ароматического кольца также проводят в соответствии со способами, раскрытыми в многочисленной литературе по синтезу Йопамидола, например, в WO96/037458, WO2009/103666, WO2010/121904, WO2011/154500 и WO2011/003894.
В определенном аспекте и цели настоящего изобретения Соединение (V) получают в соответствии со следующей Схемой 5:
Схема 5 описывает синтез 5-амино-N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-1,3-бензолдикарбоксамида (V) из 5-нитроизофталевой кислоты (5-NIPA), в котором:
i) 5-нитроизофталевую кислоту обрабатывают спиртом R1OH, в которой R1 представляет собой линейный или разветвленный С1-С4алкил, для получения соответствующего диэфира (VI);
ii) 5-нитрогруппу восстанавливают до соответствующей 5-аминогруппы в Соединении (VII);
iii) диэфир взаимодействует с 2-амино-1,3-пропандиолом для получения Соединения (V).
Другой целью настоящего изобретения является способ получения Йопамидола в соответствии со следующей Схемой 6:
Схема 6 описывает синтез Йопамидола (II) из 5-нитроизофталевой кислоты, в котором:
i) 5-нитроизофталевую кислоту обрабатывают спиртом R1OH, в которой R1 представляет собой линейный или разветвленный С1-С4алкил, предпочтительно бутил, для получения диэфира (VI);
ii) 5-нитрогруппу восстанавливают для получения Соединения (VII);
iii) диэфир взаимодействует с 2-амино-1,3-пропандиолом для получения Соединения (V);
iv) Соединение (V) йодируют в положениях 2,4,6 для получения Соединения (IV);
v) Соединение (IV) обрабатывают борной кислотой или ее производным в соответствии с настоящим изобретением для получения Соединения формулы (I) в соответствии с настоящим изобретением;
vi) Соединение формулы (I) окончательно превращают в Йопамидол (II), как описано выше.
Вышеуказанные цели настоящего изобретения и другие варианты осуществления будут подробно раскрыты в следующем описании.
Подробное описание изобретения
Настоящее изобретение раскрывает способ получения Йопамидола (II), включающий следующую реакцию:
в которой Х представляет собой OR2 или R3, и в которой R2 и R3 представляют собой С1-С6линейный или разветвленный алкил, С3-С6циклоалкил, C6арил, необязательно замещенный группой, выбранной из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, трет-бутила и фенила, более предпочтительно фенила, метилзамещенного фенила, метила и бутила,
и включающий следующие стадии:
a) взаимодействие Соединения (I) с ацилирующим агентом (S)-2-(ацетилокси)пропаноилхлоридом в реакционной среде для получения N-(S)-2-(ацетилокси)пропаноильного производного Соединения (I);
b) гидролиз промежуточное соединение со стадии а) с водным раствором при рН в диапазоне от 0 до 7, предпочтительно от 6 до 7 с помощью добавления воды или разбавленного щелочного раствора, такого как гидроксид натрия или гидроксид калия, освобождение гидроксилов от борсодержащих защитных групп, получение ацетилоксипроизводного Соединения (II) и необязательное восстановление борпроизводного;
c) щелочной гидролиз ацетилоксипроизводного Соединения (II), восстановление (S)-2-(гидрокси)пропаноильной группы для получения Йопамидола (II).
В соответствии со стадией а) реакционная среда представляет собой предпочтительно реакционную среду, имеющую минимальное содержание воды, совместимое с реакцией, более предпочтительно безводную реакционную среду.
Реакционную среду обычно выбирают с помощью специалиста в данной области техники, основываясь на общеизвестных знаниях для такого типа реакции. Среда обычно представляет собой органический растворитель, способный растворять Соединение формулы (I) и не затрагивать ацилирующий реагент (S)-2-(ацетилокси)пропаноилхлорид. Предпочтительные примеры органического растворителя, пригодного для использования на данной стадии, представляют собой инертные диполярные апротонные растворители, такие как, например, N,N-диметилформамид, N,N-диметилацетамид, N,N-диэтилацетамид, N,N-диметилпропионамид, 1-метил-2-пирролидон, 1-этил-2-пирролидон, тетраметилмочевина, N,N'-диметилэтиленмочевина (DMEU), N,N'-диметилпропиленмочевина (DMPU).
N,N-Диметилацетамид (DMAC) с низким содержанием воды или безводный является предпочтительным. Органический растворитель, используемый на данной стадии, также может быть в смеси с сорастворителем. Предпочтительные сорастворители выбраны из органических и несмешивающихся с водой сорастворителей, таких как: 4-метил-2-пентанон, 2-пентанон, 3-пентанон, дибутиловый эфир, 2-метилтетрагидрофуран, циклопентилметиловый эфир, метилизопропилкетон, метилизопентилкетон, этилацетат, бутилацетат, пентилацетат, изопентилацетат, изопропилацетат. Предпочтительная смесь растворителя/сорастворителя представлена DMAC и 4-метил-2-пентаноном, 3-пентаноном или 2-пентаноном.
На стадии а) стехиометрическое соотношение между Соединением формулы (I) и хиральным ацилирующим агентом (S)-2-(ацетилокси)пропаноилхлоридом представляет собой соотношение, обычно используемое в синтезе Йопамидола (см., например, GB1472050 Пример 1b). Стехиометрический избыток предпочитается в зависимости от условий реакции.
Влажность воздуха должна быть проконтролирована в окружающей среде реакции, следовательно, предпочтительно проводить реакцию в инертной атмосфере, например, в атмосфере сухого азота или аргона.
Температура реакции обычно представляет собой приблизительно комнатную температуру, даже если более высокие или более низкие температуры могут быть использованы совместимо со стабильностью реагентов и конечного продукта.
Реакцию проводят в течение времени, проходящего от нескольких минут до нескольких дней, обычно от 8 до 30 часов, более удобно от 12 до 30 часов, например, в течение 18 часов. Время реакции зависит от условий реакции: используемого растворителя, соотношения и чистоты реагентов, температуры. Специалист в данной области техники может найти оптимальные условия, обращаясь к своим собственным знаниям и опыту.
Завершение реакции можно обнаружить с помощью стандартных аналитических средств, используемых в органической химии, например, спектрометрического оборудования, например, 1H-ЯМР, ИК; хроматографического оборудования, например, ТСХ, ВЭЖХ, ГЖХ.
С этой целью и ссылаясь на Схему 2, реакционную смесь, полученную на стадии а) способа настоящего изобретения, переносят в водную среду (стадия b). В целях удобства воду (или разбавленный щелочной раствор, такой как раствор NaOH или KOH) добавляют в тот же реакционный сосуд, где была проведена стадия ацилирования а). Перенос органической фазы в другой сосуд, содержащий воду, также может быть осуществлен. Как правило, количество объема или массы воды представляет собой, по меньшей мере, такое же количество органической фазы, предпочтительно выше, например, в 2-3 раза превышающее объем органической фазы, совместимо с последующими действиями и не превышая в разбавлении. Ацетил-Йопамидол защищенные гидроксильные группы затем освобождают от борсодержащих защитных групп с помощью гидролиза, добавляя воду или разбавленные щелочные растворы, такие как разбавленный NaOH или KOH к кислой реакционной смеси.
Восстановление борсодержащих защитных групп после их гидролиза на ацетилоксипроизводном Соединения Формулы (I) на стадии b) может быть проведено с помощью обработки реакционной смеси ионообменной смолой, обычно анионообменной смолой, предпочтительно специфичной для удаления бора, такой как смола с диольными функциональными группами, более предпочтительно с функциональными группами, выбранными из группы, состоящей из: метилглюкамина, диэтаноламинометила предпочтительно на полистирольной матрице, глицидила предпочтительно на метакрилатной матрице, иминодипропиленгликоля, амино-бис(пропан-цис-2,3-диола), гидроксиэтиламинопропиленгликоля. Некоторые смолы, такие как с метилглюкаминовыми функциональными группами являются также коммерчески доступными и могут быть выбраны из каталогов производителей, например, Resindion of Mitsubishi Chemical, Dow Chemical, etc. Типичным примером является Duolite ES-371, предпочтительным примером является AmberliteTM IRA743 от Dow Chemical Company или других поставщиков. Данный вариант осуществления предпочтительно относится к производным борной кислоты: в целях удобства смолу загружают в колонку и фазу элюируют через нее.
В качестве альтернативы и в соответствии с предпочтительным вариантом осуществления, описанным ниже, когда бороновую кислоту, такую как фенилбороновая, п-толилбороновая или бутилбороновая кислота или бороксин (например, фенилбороксин или метилбороксин) используют в качестве борсодержащих защитных групп, восстановление борсодержащих защитных групп проводят с помощью экстракции органическим несмешивающимся с водой растворителем, выбранным из группы, состоящей из: 4-метил-2-пентанона, 3-пентанона, 2-пентанона, дибутилового эфира, 2-метилтетрагидрофурана, циклопентилметилового эфира, метилизопропилкетона, метилизопентилкетона, этилацетата, бутилацетата, пентилацетата, изопентилацетата, изопропилацетата. Предпочтительными экстракционными растворителями являются 4-метил-2-пентанон (МИБК), 3-пентанон или 2-пентанон.
В соответствии с данным вариантом осуществления и Схемой 3 Соединение I предпочтительно получают непосредственно в полярном растворителе в смеси с несмешивающимся с водой органическим растворителем (сорастворителем), пригодным для экстракции борсодержащих защитных групп, как описано ниже. Предпочтительная смесь растворителя/сорастворителя представлена DMAC и 4-метил-2-пентаноном (МИБК), 3-пентаноном или 2-пентаноном (т.е. в соотношении, составляющем от 1:10 до 1:4 масс./масс.).
Бороновую кислоту или бороксин добавляют в незначительном молярном избытке по сравнению с трийодобензолкарбоксамидом (Соединение IV). Суспензию перемешивают и нагревают до 90-95°С, и воду предпочтительно отгоняют для завершения реакции защиты. Образование Соединения I может быть определено, т.е. с помощью 1H-ЯМР.
В соответствии с наиболее предпочтительным вариантом осуществления стадии а)-с) могут затем проводить в одном реакционном сосуде, например, следующим образом: (S)-2-(ацетилокси)пропаноилхлорид добавляют к смеси в атмосфере азота и перемешивают в течение нескольких часов, чтобы получить ацетилоксипропаноильное производное Соединения I. Высвобождение борзащитных групп с помощью гидролиза ацетилоксипропаноильного производного Соединения I обычно получают с (водой или) разбавленным щелочным раствором до нейтрального рН (т.е. составляющего от 5-8), предпочтительно составляющего от 6-7, который обеспечивает хорошую селективность в дополнительном восстановлении борзащитной группы с несмешивающимся с водой растворителем.
Восстановление борзащитной группы, которое обычно является количественным, могут проводить в периодическом или непрерывном режиме. В обоих способах количество органического несмешивающегося с водой растворителя поддерживается в соотношении с соединением бороновой кислоты, составляющем от 1:10 до 1:20, предпочтительно от 1:13 до 1:16, более предпочтительно приблизительно 1:15. В периодическом способе данное количество может быть добавлено за одну или более аликвот.
Полученная таким образом двухфазная смесь содержит водную фазу с ацетил-Йопамидолом, которую восстанавливают для очистки с последующим гидролизом ацетильной группы для получения Йопамидола, в то время как бороновую кислоту отделяют в органической фазе, которую восстанавливают, необязательно предпочтительно дистиллируют для концентрирования борсодержащих защитных групп и повторно используют.
Повторное использование раствора бороновой кислоты может быть осуществлено после добавления предпочтительного растворителя для реакции, т.е. DMAC (5-10% органического раствора) и сорастворителя дистилляции, предпочтительно под вакуумом и при температуре ниже 40°C для достижения концентрации бороновой кислоты приблизительно 10%. Повторно использованный раствор затем может быть применен неограниченно предпочтительно с помощью добавления небольшого количества (т.е. соответствующего 5-20% повторно применяемой бороновой кислоты, присутствующей в органическом растворе) свежей бороновой кислоты.
В качестве следующей стадии или водный раствор, элюированный из колонки, специфичной для удаления бороновой кислоты, или в качестве альтернативы поступающий с экстракции с помощью использования органического растворителя и содержащий N,N'-бис[2-гидрокси-1-(гидроксиметил)этил]-5-[(2S)(2-ацетокси-1-оксопропил)амино]-2,4,6-трийодо-1,3-бензолдикарбоксамид, также известный как ацетил-Йопамидол, затем обессоливают от органических и неорганических солей с помощью использования ионообменных смол.
На стадии с) полученный нейтральный раствор загружают на сильноосновную анионообменную смолу, предпочтительно смолу с триметиламиновыми функциональными группами, связанными с полимерным матричным материалом, таким как Relite® 3ASFB, для высвобождения неочищенного Йопамидола, по существу, как описано в патенте США 5550287 за исключением того, что Йопамидол высвобождается с разбавленным водным раствором сильной кислоты, такой как HCl, H2SO4, причем хлористоводородная кислота является предпочтительной. В качестве альтернативы, высвобождение Йопамидола может быть осуществлено в периодическом режиме при основных условиях, как раскрыто, например, в WO97/30735, Пример 1, т.е. с помощью обработки ацетил-Йопамидол-содержащей смеси в сильнощелочных условиях рН с последующим удалением соли, предпочтительно с помощью хроматографии на ионообменных смолах, предпочтительно сначала на сильнокислотной катионообменной смоле с последующей слабоосновной анионообменной смолой.
Гидролиз ацетил-Йопамидола на сильноосновной анионообменной смоле является более эффективным и, следовательно, является предпочтительным. В соответствии с данным вариантом осуществления способ становится более простым, так как очистку и гидролиз, на практике, проводят в одну стадию.
Продукт дополнительно очищают стандартным способом, например, как описано более подробно в Экспериментальной Части, с помощью кристаллизации с 2-бутанол-водой для фармацевтической степени чистоты в соответствии с национальной или Европейской фармакопеей.
Борную кислоту или ее производное, используемые в вышеуказанных вариантах осуществления способа, восстанавливают, как описано выше, и предпочтительно повторно применяют в способе.
Новое Соединение формулы (I) могут получить в соответствии с различными вариантами осуществления. Например, исходя из Соединения (IV), как