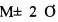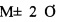Способ прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями. Способ включает лабораторное исследование периферической венозной крови, при этом в качестве контроля культивируют культуру нормальных фибробластов кожи человека (ФБЧ). Во все образцы добавляют 100 мкл среды, ФБЧ и меченную изотопом С14 глюкозу в количестве 1,8-2,2 мг/л среды, в опытные образцы дополнительно добавляют полученную из крови сыворотку в количестве 10% от среды. Через сутки регистрируют радиоактивность образцов, ростстимулирующую активность рассчитывают в процентах как отношение количества зарегистрированных радиоимпульсов в опытных образцах к количеству радиоимпульсов в контроле и, если ростстимулирующая активность составляет 120% и выше, прогнозируют риск озлокачествления узловых образований. Использование изобретения позволяет повысить точность и достоверность прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями за счет выявления определенного порогового уровня ростстимулирующей активности в сыворотке крови пациента. 3 ил., 3 пр.
Реферат
Изобретение относится к медицине, а именно к онкологии, эндокринологии и лабораторной диагностике, и предназначено для прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями.
Изучение процесса формирования и озлокачествления узловых образований при эндокринологических заболеваниях, а также факторов их роста являются одними из приоритетных задач здравоохранения. Известно, что положительный результат лечения может достигать 90-95% при выявлении онкологических заболеваний на ранних стадиях заболевания, а достоверное прогнозирование позволяет принять своевременные профилактические меры. Несвоевременная диагностика онкологических заболеваний связана с затруднениями выявления заболевания на ранней стадии, а прогнозирование развития данных заболеваний на сегодняшний день обладает тремя существенными недостатками: либо низкой чувствительностью, либо предсказательной ценностью, либо высокой стоимостью исследования.
Так, из уровня техники предлагается множество способов и методик для прогнозирования риска озлокачествления образований, в частности исследование биоптата узлового образования.
Так, известен способ прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями, включающий в себя проведение ультразвукового исследования узловых образований, последующую их тонкоигольную аспирационную биопсию и трактовку ее результатов по определенным критериям (Мохорт Т.В., Довгало B.C. Современные рекомендации по диагностике и ведению тиреоидной узловой патологии. Белорусский государственный медицинский университет, Минск, 2012 г., с. 12-19). Данный способ является инвазивным, возможно получение неудовлетворительного или сомнительного цитологического материала с его последующим перезабором.
Определенным направлением в прогнозировании риска развития злокачественных новообразований послужила общепринятая в настоящее время концепция, согласно которой нарушение равновесия между процессами пролиферации и апоптоза является главной причиной формирования опухоли.
Так, из уровня техники известен способ прогнозирования риска развития злокачественных новообразований (Патент RU 2552305 С1, 04.04.2014 г.), наиболее близкий по технической сущности к предлагаемому изобретению и принятый нами за прототип. Способ заключается в лабораторном исследовании периферической венозной крови, а именно в определении абсолютного содержания естественных киллеров (CD16+ лимфоцитов) и концентрации растворимого рецептора апоптоза (sAPO-1). При содержании CD16+ более 0,5×109 кл/л и концентрации sAPO-1 более 4000 пг/мл прогнозируют риск развития злокачественных новообразований. Однако этот способ при наличии у пациента сопутствующих аутоиммунных заболеваний (к примеру, ревматоидного артрита и проч.) из-за дисбаланса в лимфоцитарном звене клеточного иммунитета и наличия большого количества аутоиммунных антител может не позволить получить объективную информацию о прогнозировании малигнизации образования.
Таким образом, существует потребность в достоверном, простом и неинвазивном способе прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями, лишенном вышеуказанных недостатков.
Большой вклад в патологические процессы озлокачествления узловых образований вносят нефизиологически повышенные концентрации различных ростовых факторов, присутствующих как в системном кровотоке человека, так непосредственно в тканях и органах. Факторы роста - это белки с низкой молекулярной массой, способные контролировать рост клеток посредством стимулирования или подавления размножения клеток в тканях или органах.
В настоящее время продолжается изучение механизмов, запускающих и поддерживающих формирование узловых образований у человека, а также патологических процессов, приводящих к озлокачествлению узловых образований в различных органах и тканях.
В литературе представлены данные о ростстимулирующем влиянии in vitro на тиреоциты различных факторов (тиреотропный гормон, циклический аденозин монофосфат (цАМФ), эпидермальный фактор роста (EGF), инсулино-подобный фактор роста (IRF, ИРФ) (Goretzki, Р.Е. Growth regulation of human thyrocytes by thyrotropin, cyclic adenosine monophosphate, epidermal growth factor and insulin-like growth factor / P.E. Goretzki, A. Frilling, D. Simon, M. Rastegar, Ch. Ohmann. // Growth regulation of thyroid gland and thyroid tumors.; eds. P.E. Goretzki, H.D. Ruhеr.- Basel: Karger, 1989. - P. 56-80; Schatz, H. Influence of thyroid stimulating hormone, epidermal growth factor, and insulin-like growth factor I on growth of thyroid cells in vitro / H. Schatz, R. Freiberger, C. Richter, F. Wiss, K. Weber // Growth regulation of thyroid gland and thyroid tumors.; eds. P.E. Goretzki, H.D. Ruher. - Basel: Karger, 1989. - P. 88-97; Goretzki, P.E. Growth regulation of normal thyroids and thyroid tumors in man. / P.E. Goretzki, A. Frilling, D. Simon, H.D. Ruher // Recent Results Cancer Res. -1990. - Vol. 118. - P. 48-63; Konturek, A. Thyroid Growth Factors [Электронный ресурс] / A. Konturek, M. Barczynski // Thyroid growth factors, thyroid and parathyroid diseases - new insights into some old and some new issues.; ed. L. Ward. - Publisher InTech, 2012. - P. 77-86). Продемонстрирована аутокринная секреция инсулино-подобных факторов роста (ИРФ-1 и ИРФ-2) и экспрессии рецептора к ИФР-1 в первичной культуре тиреоидных фолликулярных клеток (нормальных, аденоматозных и клеток папиллярного рака щитовидной железы) (Tode, В. Insulin-like growth factor-I Autocrine secretion by human thyroid follicular cells in primary culture / B. Tode, M. Serio, CM. Rotella, G. Galli, F. Franceschelli, A. Tanini, R. Toccafondi // J. Clin. Endocrinol. Metab. - 1989. - Vol. 69. - P. 621-626; Onoda, N. Autocrine role of insulin-like growth factor (IGF-I) in thyroid cancer cell Line / N. Onoda, E. Ohmura, T. Tsushima, Y. Ohba, N. Emoto, O. Isozaki, Y. Sato, K. Shizume, H. Demura // Eur. J. Cancer. - 1992. - Vol. 28A - P. 1904-1908; Pouliaki, V. Regulation of vascular endothelial growth factor expression by insulin-like growth factor I in thyroid carcinomas. / V. Pouliaki, C.S. Mitsiades, C. McMullan, D. Sykoutri, G. Fanourakis, V. Kotoula, S. Tseleni-Balafouta, D.A. Koutras, N. Mitsiades // J. Clin. Endocr. Metab. - 2003. - Vol. 88 (11). - P. 5392-5398). Известно, что белки семейства инсулино-подобных факторов роста (ИФР) и белки, связывающие инсулино-подобные факторы роста, обладают сходством ряда биологических эффектов с инсулином. Аминокислотные последовательности IGF-1 и IGF-2 гомологичны на 62%, а с инсулином - приблизительно на 50% (Смирнов, А.Н. Элементы эндокринной регуляции / А.Н. Смирнов. - М.: ГЭОТАР-Медиа, 2006. - 352 с). Инсулин, вырабатывается β-клетками поджелудочной железы, после присоединения к инсулиновым рецепторам на поверхности инсулинозависимых клеток (к ним относят гепатоциты, клетки мышц и жировой ткани) он запускает каскад внутриклеточных реакций. В отсутствие инсулина снижается биосинтез белка, что отчасти объясняется уменьшением транспорта аминокислот в мышцы (аминокислоты служат субстратами для глюконеогенеза).
Таким образом, точное и достоверное выявление определенного уровня ростстимулирующих факторов в сыворотке крови пациента с эндокринологическим заболеванием и выявленными узловыми образованиями позволяет судить о риске возможного озлокачествления этих узловых образований.
Техническим результатом настоящего изобретения является повышение точности и достоверности прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями за счет выявления определенного порогового уровня ростстимулирующей активности в сыворотке крови пациента.
Этот технический результат достигается тем, что в предлагаемом способе прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями, включающем лабораторное исследование крови пациента, получают из крови сыворотку, образцы сыворотки культивируют с фибробластами кожи человека в количестве 10% от объема среды, в качестве контроля культивируют культуру нормальных фибробластов кожи человека, при этом во все образцы добавляют меченную изотопом С14 глюкозу в количестве 1,8-2,2 мг/л среды, через сутки регистрируют радиоактивность образцов, ростстимулирующую активность рассчитывают в процентах как отношение количества зарегистрированных радиоимпульсов в опытных образцах к количеству радиоимпульсов в контроле и, если ростстимулирующая активность составляет 120% и выше, прогнозируют риск озлокачествления узловых образований.
Способ осуществляют следующим образом.
У пациента строго натощак производят забор крови из вены или мякоти пальца, получают сыворотку крови путем отстаивания в пробирке или после центрифугирования при 3000 об/мин в течение 15 минут. Для культивирования используют линии клеток фибробластов кожи здоровых людей (ФБЧ) (мы использовали ФБЧ, полученные из лаборатории биотехнологии 1-го МГМУ им. И.М. Сеченова). Культивирование клеток производят в стандартных условиях: во влажной атмосфере, в СО2-инкубаторе при 5% СO2 и 37°С, используя среды DMEM и RPMI 1640 («Gibco») с добавлением 10% эмбриональной телячьей сыворотки ЭТС («Gibco») и антибиотиков стрептомицина и пенициллина («ПанЭко») (это стандартное использование антибиотиков для предотвращения роста микроорганизмов в среде).
При использовании стандартного планшета на 96 лунок в каждую лунку мы добавляли 100 мкл среды, 10 мкл 10% эмбриональной телячьей сыворотки ЭТС («Gibco»), 5*103 клеток ФБЧ и в опытные образцы - 10% от среды сыворотки пациента.
Во все образцы добавляют радиофармпрепарат - меченную изотопом С14 глюкозу в количестве 1,8-2,2 мг/л среды.
После инкубации в течение 24 часов активность (СРМ - количество импульсов в минуту) регистрируют на γ-счетчике. Ростстимулирующую активность рассчитывают в процентах как отношение количества зарегистрированных радиоимпульсов в опытных образцах к количеству радиоимпульсов в контроле и, если ростстимулирующая активность составляет 120% и выше, прогнозируют риск озлокачествления узловых образований.
Среда DMEM содержит глюкозу в концентрации 1 г/л, достаточной и оптимальной для культивирования ФБЧ. Внесение меченной изотопом C14 глюкозы в количестве 1,8-2,2 мг/л среды несущественно меняет концентрацию глюкозы в питательной среде и в то же время позволяет добиться максимального поглощения клетками радиофармпрепарата для последующей объективной регистрации импульсов на счетчике. Это обстоятельство нашло свое обоснование по результатам нашей серии экспериментов по поглощению глюкозы клетками фибробластов кожи мышей и человека.
Известно, что при массовом обследовании при нормальном распределении выборки 95% практически все исследуемые показатели находятся в пределах (сигма - стандартное отклонение). В итоге референсные значения показателя также укладываются в 95% выборки. Для описания всей выборки (99%) в случае нормального распределения используют показатели (оставшиеся). В результате произведенных расчетов было выяснено, что величина ростстимулирующей активности 118% является крайним вариантом в разбросе Соответственно:
Следовательно:
Таким образом, 120% является нижним пределом у значения, указывающего на риск озлокачествления узлового образования в 99% выборки, что подтверждено клиническими наблюдениями, часть из которых приведена ниже.
Пример 1. Пациентка Д., 75 лет, с избыточной массой тела, ИМТ-35 кг/м2, нарушений углеводного обмена не выявлено, при УЗИ щитовидной железы объем железы 14 мл (норма до 18), в нижнем полюсе правой доле изоэхогенное образование с четкой капсулой размером 0,7×0,7 см. Лимфатические узлы шеи не увеличены. ТТГ-2,0 (референсные значения 0,4-4,0) мк Ед/мл, свободный Т4-16,5 (референсные значения 11,5-23,0) пмоль/л.
При проведении исследования по предлагаемому способу ростстимулированная активность по сравнению с контролем составила 70%. Это позволило сделать вывод об отсутствии риска озлокачествления узлового образования у данной пациентки с эндокринологическим заболеванием - узловым зобом.
Пример 2. Пациент Е., 52 лет, с ожирением 1 степени, ИМТ-33 кг/м2, с диагностированным нарушением углеводного обмена (нарушением толерантности к глюкозе), узловым зобом. При УЗИ щитовидной железы объем железы 18 мл (норма до 25), объемное образование в правой доле, размером 0,8×0,7 см, изоэхогенное, контуры ровные, лимфатические узлы шеи не увеличены. Клинически эутиреоз. ТТГ - 2,3(0,4-4,0) мкЕд/мл, свободный Т4-19,0 (11,5-23,0) пмоль/л.
При тонкоигольной биопсии узлового образования щитовидной железы данных за атипичные клетки не получено, картина коллоидного зоба (фиг. 1).
При проведении исследования по предлагаемому способу ростстимулированная активность по сравнению с контролем составила 118%. Это позволило сделать вывод об отсутствии риска озлокачествления узлового образования у данного пациента с эндокринологическим заболеванием щитовидной железы.
Пациенту проведено повторное исследование по способу через 6 месяцев. Отрицательной динамики согласно проведенному исследованию не обнаружено.
Пример 3. Пациент Е., Мужчина, 54 лет, с ожирением 1 степени, ИМТ-31 кг/м2, с диагностированным нарушением углеводного обмена (сахарный диабет 2 типа), узловым зобом 1 степени. При УЗИ щитовидной железы объем железы 16 мл (норма до 25), объемное образование в правой доле, размером 0,9×0,7 см, изоэхогенное, контуры ровные, лимфатические узлы шеи не увеличены. Клинически эутиреоз. ТТГ-2,8 (0,4-4,0) мкЕд/мл, свободный Т4-17,2 (11,5-23,0) пмоль/л.
При тонкоигольной биопсии узлового образования щитовидной железы данных за атипичные клетки не получено.
При проведении исследования по предлагаемому способу ростстимулированная активность по сравнению с контролем составила 138 %. Это позволило сделать вывод о прогнозировании риска озлокачествления узлового образования у данного пациента с эндокринологическим заболеванием щитовидной железы.
Через 1 год при повторном обращении для динамического наблюдения к эндокринологу по данным УЗИ ЩЖ рост узла на 7 мм, при ТАБ - признаки папиллярного рака ЩЖ (фиг. 2). Пациент направлен на оперативное лечение (фиг. 3 - макропрепарат).
Предлагаемый способ определения оценки исходной суммарной ростстимулированной активности на культуре клеток, основанной на определении уровня синтеза белка в культуре клеток под влиянием сыворотки крови человека, добавленной к питательной культуральной среде, позволяет уточнить механизмы формирования и прогрессирования узловых образований, а также прогнозировать их озлокачествление.
Способ прогнозирования риска озлокачествления узловых образований у больных с эндокринологическими заболеваниями, заключающийся в том, что осуществляют лабораторное исследование периферической венозной крови, отличающийся тем, что в качестве контроля культивируют культуру нормальных фибробластов кожи человека (ФБЧ), при этом во все образцы добавляют 100 мкл среды, ФБЧ и меченную изотопом С14 глюкозу в количестве 1,8-2,2 мг/л среды, в опытные образцы дополнительно добавляют полученную из крови сыворотку в количестве 10% от среды, через сутки регистрируют радиоактивность образцов, ростстимулирующую активность рассчитывают в процентах как отношение количества зарегистрированных радиоимпульсов в опытных образцах к количеству радиоимпульсов в контроле и, если ростстимулирующая активность составляет 120% и выше, прогнозируют риск озлокачествления узловых образований.