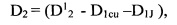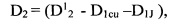Способ определения комплексообразующей активности органических соединений в водных системах по отношению к соединениям железа(iii) или меди(ii)
Иллюстрации
Показать всеИзобретение относится к химии, в частности к контролю качества воды, содержащей органические примеси. Способ заключается в использовании трех емкостей, в первую и вторую помещают исследуемый водный раствор, а в третью емкость помещают контрольный водный раствор, не содержащий органических примесей, во вторую и третью емкости добавляют сульфат меди или сульфат железа и раствор иодида калия, определяют количество выделившегося йода на основании предварительно построенной градуировочной зависимости между содержанием йода в системе и оптической плотностью, измеренной при длине волны 285 нм в кюветах с длиной оптического пути 50 мм. Коэффициент комплексообразующей активности органических соединений Кка в исследуемой водной системе рассчитывается по формуле: Кка=100-(С2*100/С3), %, где С2 - количество йода, выделившегося во второй емкости, содержащей анализируемый раствор; С3 - количество йода, выделившегося в третьей емкости, не содержащей органических примесей - дистиллированной воде; если Кка составляет более 10%, то заключают, что комплексообразующая активность органических соединений в водных растворах высокая. 3 табл., 2 пр.
Реферат
Изобретение относится к химии, в частности к контролю качества воды, содержащей органические примеси. Способ определения может найти применение при количественной оценке свойств органических соединений в водных растворах и имеет более широкие функциональные возможности по сравнению с аналогами.
Известен способ определения химической активности органических соединений в водных растворах, при котором помещают индикаторную пластину в водный раствор и по изменению состава водного раствора определяют химическую активность органического соединения в этом водном растворе [1]. При реализации способа на практике используют три емкости, в две из которых помещают исследуемый водный раствор, а в третью емкость помещают контрольный водный раствор, не содержащий органических примесей, в водные растворы, содержащиеся во второй и третьей емкостях, помещают индикаторные пластины, затем водные растворы в каждой из трех емкостей нагревают до температуры [95÷105]°С, выдерживают при такой температуре в течение [55÷65] минут, охлаждают до температуры [15÷25]° С, фильтруют через мембранный фильтр с размером пор 0,46 мкм, измеряют содержание железа в водных растворах всех трех емкостей, а химическую активность органических соединений водных растворов определяют при помощи коэффициента активности:
ka=ΔFe/Fe1,
где ΔFe=Fe2-Fe1-Fе3,
здесь Fe1 - содержание железа в водном растворе первой емкости;
Fe2 - содержание железа в исследуемом водном растворе второй емкости;
Fe3 - содержание железа в водном растворе третьей емкости.
Описанный выше способ характеризуется трудоемкостью и ограниченными функциональными возможностями, так как не может оценить устойчивость степени окисления комплексообразователя, что является важнейшим свойством для применения результатов к биологическим объектам.
Изобретением решается задача создания способа определения химической активности органических соединений в водных растворах, характеризующегося более широкими функциональными возможностями.
Для решения поставленной задачи в способе определения химической активности органических соединений в водных системах по отношению к соединениям железа(III) или меди(II) в водных системах предлагается использовать три емкости, в первую и вторую помещают исследуемый водный раствор, а в третью емкость помещают контрольный водный раствор, не содержащий органических примесей. Во вторую и третью емкости добавляют сульфат меди или сульфат железа и раствор иодида калия, определяют количество выделившегося иода через одинаковый интервал времени на основании предварительно построенной градуировочной зависимости D=f(C) между содержанием иода в системе (С) и оптической плотностью (D), измеренной при длине волны 285 нм в кюветах с длиной оптического пути 50 мм. Изменения оптической плотности D в первой емкости и в дистиллированной воде в зависимости от введения сульфата меди или сульфата железа, или иодида калия учитываются при расчете количества выделяющегося йода во второй и третьей емкостях. Коэффициент комплексообразующей активности органических соединений Кка в исследуемой водной системе рассчитывается по формуле:
Кка=100-(С2*100/С3), %
где С2 - количество йода, выделившегося во второй емкости, содержащей анализируемый раствор, которое определяют по предварительно полученной зависимости D=f(C) с учетом влияния всех компонентов системы на оптическую плотность:
здесь D2 - оптическая плотность, по которой определяют концентрацию С2,
- оптическая плотность в анализируемом растворе после введения сульфата меди или сульфата железа и раствора иодида калия,
D1cu (D1Fe) - оптическая плотность в анализируемом растворе, находящемся в первой емкости, после введения сульфата меди или сульфата железа,
D1J - оптическая плотность в анализируемом растворе, находящемся в первой емкости, после введения раствора иодида калия;
С3 - количество йода, выделившегося в третьей емкости, не содержащей органических примесей - дистиллированной воде, которое определяют по предварительно полученной зависимости D=f(C) с учетом влияния всех компонентов системы на оптическую плотность:
здесь D3 - оптическая плотность, по которой определяют концентрацию С3,
- оптическая плотность в дистиллированной воде после введения сульфата меди или сульфата железа и раствора иодида калия,
D3cu (D3Fe) - оптическая плотность в дистиллированной воде после введения сульфата меди или сульфата железа,
D3J - оптическая плотность в дистиллированной воде после введения раствора иодида калия.
При совместном присутствии в растворе определенного типа органического вещества и катионов железа(III) или меди(II) образуются комплексные соединения, в которых ионы металлов являются комплексообразователем, а органические соединения - лигандами.
Восстановление железа(III) или меди(II) раствором йодида калия из комплексов с органическими соединениями сопровождается выделением йода:
где L - органический лиганд.
Способность к восстановлению металлов в комплексных соединениях и, следовательно, степень комлексообразующей активности органических соединений оценивается по величине коэффициента комплексообразующей активности - Кка: если Кка составляет более 10%, то комплексообразующая активность органических соединений в водных растворах высокая.
ПРИМЕРЫ ПРАКТИЧЕСКОЙ РЕАЛИЗАЦИИ СПОСОБА
1. Определение комплексообразующей активности лекарственного препарата «Глутаминовая кислота» по отношению к катионам железа(III) или меди(II) в растворах, приготовленных на дистиллированной воде и питьевых подах разного типа.
Глутаминовая кислота - органическое соединение, заменимая аминокислота, которая синтезируется в организме. Особый практический интерес представляет оценка взаимодействия природных органических примесей, присутствующих в питьевых водах, с лекарственными препаратами, которые способны к комплексообразованию с биометаллами (в том числе и ионами железа(III) или меди(II).
Глутаминовая кислота как лекарственный препарат применяется для лечения заболеваний центральной нервной системы и оказывает воздействие на аминокислотный и белковый обмены, обмен углеводов и жиров, на распределение ионов калия и натрия в клетке [2]. Глутаминовая кислота употребляется в виде таблеток, которые запивают питьевой водой. Согласно инструкции по применению глутаминовой кислоты в качестве побочного действия отмечается уменьшение содержания гемоглобина в крови, поэтому противопоказанием к ее использованию является наличие у пациента железодефицитной анемии. Глутаминовая кислота способна к комплексообразованию с Fe(III), Cu(II) [3] - непосредственными участниками синтеза гемоглобина в организме.
По предварительным данным установлено, что природные питьевые воды от разных производителей содержат от 2 до 3 мг/л общего органического углерода. Природные органические примеси в исследуемых водах образуют комплексные соединения с железом(III) и медью(II), но не влияют на восстановительную способность металлов: Кка составляет менее 5%.
В присутствии лекарственного препарата «Глутаминовая кислота» суммарные свойства водной системы существенно изменяются. Результаты экспериментов представлены в табл. 1 и 2.
Примечание. (*) Расчетное значение - 4.5 мг/л.
Примечание. (*) Расчетное значение - 12 мг/л.
Из представленных в табл.1 и 2 данных можно заключить, что эффект снижения способности к восстановлению железа(III) и меди(II) зависит от содержания и свойств органических соединений в растворе, на что существенно влияет тип воды, на которой он приготовлен. Так, например, глутаминовая кислота в растворе на дистиллированной воде при концентрации от 50 до 250 мг/л (по ООУ) не влияет на процесс восстановления железа, несмотря на то, что имеет место образование железоглутаминовых комплексов (Кка = 2.2%). Однако если раствор этой аминокислоты приготовлен на различных видах природных питьевых вод, то снижается способность к восстановлению железа на 73-100%. Эта же тенденция наблюдается и по отношению к меди(II). Взаимодействие меди(II) с глутаминовой кислотой, приготовленной на дистиллированной воде, снижает способность Cu2+ к восстановлению на 9% и 39% при концентрации в растворе от 50 до 100 мг/л (по ООУ) соответственно. Когда растворы глутаминовой кислоты приготовлены на природных водах, то способность меди к восстановлению снижается на 53-88%.
Предложенный методологический подход может быть использован как метод оценки комплексообразующей активности органики природных вод и лекарственных препаратов in vitro с прогнозированием действия на процессы кроветворения.
2. Определение комплексообразующей активности трилона Б и относительной комплексообразующей активности органических примесей питьевых вод
Из анализа данных, представленных в табл. 3, можно заключить, что при использовании типичного комплексообразователя - трилона Б, в концентрациях от 2 до 5 мг/л по ООУ, процент снижения выделения количества йода в системе закономерно увеличивается от 9,5 до 52% соответственно и в среднем составляет 9,5% на единицу ООУ.
В анализируемых питьевых водах концентрация органических примесей составляет от 0,76 до 6,48 мг/л по ООУ, активность по отношению к меди(II) (по величине Кка) изменяется от 5 до 26%. Для того чтобы сопоставить свойства органических примесей в водах различного типа, за «стандарт комплексообразующей активности» выбран раствор трилона Б с концентрацией общего органического углерода (ООУ) 1 мг/л. По отношению к этому раствору относительная комплексообразующая активность составляет от 0,31 до 1,7. На активность органических примесей оказывает существенное влияние обработка исходной воды красным светом.
Вышеперечисленные свойства важно учитывать при анализе этиологических особенностей многих патологий. Например, недостаток меди можно создать алиментарно, если употреблять воду, содержащую органические примеси с высоким комплексообразующим коэффициентом по отношению к этому элементу. А ведь медь - важнейший кофактор синтеза гема в организме человека.
Комплексообразующие свойства органических примесей можно использовать и во благо. Проблема повышения концентрации меди в крови у пациентов, проживающих на территориях, где динамично идет освоение и переработка медно-цинковых руд, стоит на Урале достаточно остро. Одно из оригинальных исследований авторов [4] показало, что применение минеральных вод с высокой комплексообразующей активностью по отношению к меди(II) позволяет достоверно нормализовать повышенный в крови уровень меди уже через 14 дней. Это дало возможность обосновать использование минеральных вод с высокой комплексообразующей активностью в качестве лечебно-профилактического средства для безопасного выведения тяжелых металлов из организма человека в виде натуральных комплексных соединений.
Обобщая изложенное выше, можно заключить, что предложенный способ определения комплексообразующей активности органических соединений по отношению к соединениям железа(III) или меди(II) имеет более широкие функциональные возможности по сравнению с аналогами и позволяет оценивать устойчивость степени окисления комплексообразователя, что особенно важно для применения результатов к биологическим объектам.
Литература
1. Способ определения химической активности органических соединений по отношению к соединениям железа в водных растворах: пат. 2267783 Рос. Федерация / Белоконова Н.А., Корюкова Л.В., Петухова И.О. - №2004113724; заявл. 05.05.04; опубл. 10.01.06, Бюл. №1.
2. Волков М.В., Генин A.M., Глотов Н.А., Маевский Е.И. Глутаминовая кислота. Биохимическое обоснование практического использования. - Свердловск: Ср-Ур. кн. изд-во, 1975. - 119 с.
3. Яцимирский К.Б., Крисе Е.Е., Гвяздовская В.Л. Константы устойчивости комплексов металлов с биолигандами: Справочник. - Киев: Наукова Думка, 1979. - 228 с.
4. Божко Я.Г. Перспективы использования природных минеральных вод в качестве лечебно-профилактического средства для снижения повышенной концентрации меди в крови/ Я.Г. Божко, Н.А. Белоконова. И.А. Плотникова, И.О. Петухова// Успехи современного естествознания. 2013. №9. С. 109-110.
Способ определения комплексообразующей активности органических соединений в водных растворах путем использования трех емкостей, в первую и вторую помещают исследуемый водный раствор, а в третью емкость помещают контрольный водный раствор, не содержащий органических примесей, отличающийся тем, что во вторую и третью емкости добавляют сульфат меди или сульфат железа и раствор йодида калия, определяют количество выделившегося йода через одинаковый интервал времени на основании предварительно построенной градуировочной зависимости D=f(C) между содержанием йода в системе (С) и оптической плотностью (D), измеренной при длине волны 285 нм в кюветах с длиной оптического пути 50 мм, с учетом изменения оптической плотности D в первой емкости и в дистиллированной воде в зависимости от введения сульфата меди или сульфата железа, или йодида калия, затем вычисляют коэффициент комплексообразующей активности органических соединений Кка в исследуемой водной системе по формуле:
, %,
где С2 - количество йода, выделившегося во второй емкости, содержащей анализируемый раствор, которое определяют по предварительно полученной зависимости D=f(C) с учетом влияния всех компонентов системы на оптическую плотность:
D2 - оптическая плотность, по которой определяют концентрацию С2,
- оптическая плотность в анализируемом растворе после введения сульфата меди или сульфата железа и раствора йодида калия,
D1cu (D1Fe) - оптическая плотность в анализируемом растворе, находящемся в первой емкости, после введения сульфата меди или сульфата железа,
D1J - оптическая плотность в анализируемом растворе, находящемся в первой емкости, после введения раствора йодида калия;
С3 - количество йода, выделившегося в третьей емкости, не содержащей органических примесей - дистиллированной воде, которое определяют по предварительно полученной зависимости D=f(C) с учетом влияния всех компонентов системы на оптическую плотность:
D3 - оптическая плотность, по которой определяют концентрацию С3,
- оптическая плотность в дистиллированной воде после введения сульфата меди или сульфата железа и раствора йодида калия,
D3cu (D3Fe) - оптическая плотность в дистиллированной воде после введения сульфата меди или сульфата железа,
D3J - оптическая плотность в дистиллированной воде после введения раствора йодида калия,
если Кка составляет более 10%, то заключают, что комплексообразующая активность органических соединений в водных растворах высокая.