Терапевтическое средство или профилактическое средство против деменции
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается моноклонального антитела, которое специфически связывается с тау-белком, фосфорилированным в остатке серина, соответствующем остатку серина в позиции 413 тау-белка, имеющего аминокислотную последовательность SEQ ID NO: 1, включающего вариабельную область тяжелой цепи с тремя участками, определяющими комплементарность, (CDRs) и вариабельную область легкой цепи с тремя участками, определяющими комплементарность, (CDRs). Группа изобретений также касается способа лечения таупатии, включающего введение пациенту, нуждающемуся в этом, указанного моноклонального антитела. Группа изобретений обеспечивает уменьшение степени проявления патологии в головном мозге и улучшение нарушенной памяти. 2 н. и 7 з.п. ф-лы, 10 пр., 29 ил., 6 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к терапевтическому средству или профилактическому средству против когнитивных расстройств. Конкретнее, изобретение относится к новому антителу против фосфорилированного белка или пептиду, имеющему превосходное действие по улучшению когнитивной функции, и к терапевтическому средству или профилактическому средству против когнитивных расстройств, содержащему антитело против фосфорилированного тау или антиген, который вызывает образование антитела против фосфорилированного тау.
Уровень техники
Когнитивное расстройство является состоянием, при котором развивается ухудшение умственных способностей из-за какой-то приобретенной причины, что вызывает проблемы в социальной адаптации. Когнитивные расстройства классифицируются как нейродегенеративные заболевания, сосудистые когнитивные расстройства, прионные заболевания, инфекционные заболевания, обменные/эндокринные расстройства, травмы и церебральные расстройства, и токсические расстройства (нпл 1). На 2010 в Японии насчитывалось примерно 2,1 миллиона пациентов с когнитивным расстройством с коэффициентом распространенности заболевания примерно 8-10% или даже более 10% среди пожилых людей в возрасте старше 65, и это признается серьезной проблемой в стареющем обществе во всем мире (нпл 2). Данные по заболеваниям, лежащим в основе когнитивных расстройств, показывают, что большую часть составляют нейродегенеративные заболевания, такие как болезнь Альцгеймера (AD) и лобно-височная лобарная дегенерация (FTLD), причем приблизительно 35% приходится на AD, приблизительно 15% на комбинацию AD и болезни мозгового кровообращения, и 5% на нейродегенеративные заболевания, такие как FTLD (нпл 2). Когнитивное расстройство, вызванное нейродегенеративным заболеванием характеризуется медленно развивающимся ухудшением памяти и/или изменением личности, что прогрессирует в течение периода, по меньшей мере в 6 месяцев или более. Типичным фактором при нейродегенеративных процессах, которые показывают высокую степень корреляции со степенью ухудшения когнитивной функции, является присутствие нейрофибриллярных клубков (NFT) (нпл 3).
Тау (белок) представляет собой белок, кодированный геном МАРТ, который локализован на хромосоме 17 (17q21) у человека. Он является одним из связывающих микротрубочки белков, которые в большом количестве экспрессируются в центральной нервной системе. Обнаружено, что тау является главным составляющим белком в спаренных спиральных филаментах и прямых филаментах, формирующих NFT при AD (одном из наиболее известных нейродегенеративных заболеваний), и показано, что он накапливается в клетках при различных невропатологических состояниях. Заболевания, вызванные внутриклеточным накоплением тау, все вместе называются «таупатиями» (нпл 4). Нейродегенеративными заболеваниями, включенными в число таупатий, являются болезнь Альцгеймера (AD), кортикобазальная дегенерация ганглиев (CBD или CBS), прогрессирующий надъядерный паралич, болезнь Пика, аргирофильная зернистая деменция (аргирофильная зернистая болезнь), множественная системная таупатия с деменцией (MSTD), связанная с хромосомой 17 лобно-височная деменция с паркинсонизмом (FTDP-17), деменция с нейрофибриллярными клубками, диффузные нейрофибриллярные клубки с кальцификацией (DNTC), таупатия белого вещества с глобулярными глиальными включениями (WMT-GGI) и лобно-височная лаборная дегенерация с тау-положительными включениями (FTLD-тау), но не-нейродегенеративные заболевания, в том числе инфекционные заболевания, такие как болезнь фон Экономо (постэнцефалитический паркинсонизм) и подострый склерозирующий панэнцефалит, и состояния, вызванные травмой, такие как эцефалопатия боксеров, также включаются в таутопатии (нпл 4).
Было определено, что ген МАРТ кодирует белок, состоящий из 13 экзонов, с несколькими изоформами вследствие альтернативного сплайсинга (нпл 4). Особенностью структуры тау является то, что он содержит N-концевой кислотный домен, содержащий 0-2 повторяющиеся последовательности (N) из 29 аминокислот, в зависимости от альтернативного сплайсинга экзона 2 и экзона 3 (N0-N2), промежуточный домен, обогащенный пролином, и С-концевой связывающий микротрубочки домен (кодированный экзонами 9-12), содержащий 3 (3R) или 4 (4R) повторяющиеся последовательности (R), которые вносят вклад в связывание микротрубочек (нпл 3 и 4). Следовательно, тау имеет 6 характерных изоформ 3R0N (352 аминокислоты) ⋅ 3R1N (381 аминокислота) ⋅ 3R2N (410 аминокислот) ⋅ 4R0N (383 аминокислоты) ⋅ 4R1N (412 аминокислот) и 4R2N (441 аминокислота), зависящие от числа повторяющихся последовательностей из 29 аминокислот (N) и связывающих микротрубочки повторяющихся последовательностей (R), которые он содержит. Из этих изотипов только 3R0N присутствует в головном мозге эмбриона, в то время как в головном мозге взрослого человека присутствуют все 6 изотипов, причем тип 4R является наиболее распространенным (нпл 3). Различие между изотипами 3R и 4R состоит в том, удален ли экзон 10 альтернативным сплайсингом (3R) или присутствует (4R). Поэтому существует несколько изоформ тау, но для идентификации позиции аминокислоты указывают номера аминокислот (1-441) в соответствующих позициях самой длинной изоформы 4R2N (SEQ ID NO: 1). Например, обозначение «Ser413» относится к серину, который является 413-ым аминокислотным остатком в 4R2N (SEQ ID NO: 1), хотя этот серии является 384-ым аминокислотным остатком в 4R1N (SEQ ID NO: 2), 355-ым в 4R0N (SEQ ID NO: 3), 382-ым в 3R2N (SEQ ID NO: 4), 353-им в 3R1N (SEQ ID NO: 5) и 324-ым в 3R0N (SEQ ID NO: 6).
Что касается роли тау в нейродегенеративных заболеваниях то обнаружилось, что существует соотношение между мутациями гена МАРТ и накоплением тау при связанной с 17 хромосомой лобно-височной деменции с паркинсонизмом (FTDP-17). В частности, сообщалось о более чем 40 различных мутациях гена МАРТ, которые связаны с FTDP-17 (нпл 4). Предполагается, что такие генные мутации могут привести к изменениям в пропорции изоформ тау и изменению взаимодействия мутаната тау с микротрубочками, внося таким образом вклад в установление патологии. Однако, в отличие от семейных нейродегенеративных заболеваний, мутации в МАРТ обычно не обнаруживаются при спорадических нейродегенеративных заболеваниях, таких как AD. Более того, одной из особенностей накопления тау при нейродегенеративных заболеваниях является высокая степень модификации путем фосфорилирования. Так, у пациентов, показывающих умеренное ухудшение когнитивной функции (MCI), видна корреляция между уровнями фосфорилированного тау в цереброспинальной жидкости и атрофией гипофиза, что наводит на мысль о том, что фосфорилированный тау является надежным биомаркером нейродегенерации у пациентов с таупатиями (нпл 5). По этой причине были попытки использовать ингибиторы ферментов киназ, и в частности, GSK-3-бета, поскольку эти ферменты вовлечены в фосфорилирование, для того, чтобы ингибировать избыточное фосфорилирование тау, и существует ряд разработок в этой области (нпл 5). Однако, поскольку киназы, такие как GSK-3-бета, являются ферментами, которые вовлечены не только в заболевание, но также и в регулирование функций при нормальных физиологических процессах, побочное действие вызывает беспокойства. Действительно, так как некоторые сайты, где тау фосфорилирован GSK-3-бета, совпадают с сайтами фосфорилирования тау, встречающемся в головном мозге зародыша и здорового человека (нпл 3), существует вероятность влияния на нормальную функцию тау.
Обычно считается, что внеклеточный тау вытекает из клетки в результате гибели дегенерировавших нейронов, но в недавних исследования предположили, что после избыточного внутриклеточного фосфорилирования тау процессируется и активно выделяется из клетки. Полагают, что фосфорилированный тау, секретированный из клетки, дефосфорилируется в некоторых сайтах фосфорилирования, впоследствии действуя на мускариновые рецепторы M1 и М3 окружающих клеток, таким образом промотируя внутриклеточное фосфорилирование тау, и внося свой вклад в стимулирование гибели клетки (нпл 6, нпл 7). В настоящее время все сходится к мнению, что тау функционирует как фактор с внеклеточной активностью, поэтому все больше внимание фокусируется но воздействии на него терапевтическими средствами, типа с лекарственных компонентов, которые представляют собой макромолекулы, такие как антитела, которые не так легко заставить проявить внутриклеточную активность. Однако, как указано выше, секретированный внеклеточно тау может быть частично процессирован и может стать дефосфорилированным, возможно подвергаясь другим модификациям, помимо тех, которые свойственны избыточно фосфорилированному тау, который являлся мишенью. Также предполагается, что лекарственные средства, которые действуют на части дефосфорилированного тау, могут влиять на функцию нормального тау. Таким образом, когда мишенью для антител или подобного должен стать ассоциированный с патологией тау, более важно выбрать сущность, которая будет действовать на специфический для данной патологии сайт, т.е. эпитоп фосфорилированного тау, и выбор эпитопа становится еще более трудным из-за сложности и недостаточности информации.
Сообщалось об изобретениях, относящиеся к иммунотерапии таупатий, где мишенью является белок тау, которые оказывают направленное действие против тау (нпл 5, птл (PTL) 1, птл 2, птл 3). Иммунотерапию проводят с целью вызвать продуцирование специфических антител путем введения пептидных вакцин и т.п., и ожидается, что у них будет мало побочных действий, вследствие их высокой специфичности к белкам-мишеням или пептидам. Сообщается, что улучшается двигательная функция у животных моделей, экспрессирующих мутантный тау за счет вакцинации с использованием частичных пептидов фосфорилированного тау (имеющего аминокислотные остатки, соответствующие фосфорилированным Ser396 и Ser404, и имеющего аминокислотный остаток, соответствующий фосфорилированному Ser262). Однако указанные сообщения являются исследованиями с использованием трансгенных мышей (Tg мыши) с индуцированными генными мутациями, такими как P301L (мутация замена пролина на лейцин в 301-м аминокислотном остатке тау), и хотя такие Tg мыши служат в качестве моделей мутации гена в случае FTDP-17 (семейного нейродегенеративного заболевания), они не репрезентативны для большинства нейродегенеративных заболеваний из числа таупатий, которые не сопровождаются мутациями гена тау, и в частности, спорадических нейродегенеративных заболеваний. Кроме того, так как мыши P301Ltg являются моделями улучшения двигательной функции и не являются моделями, для исследований нарушения когнитивной функции, что вызывает проблему, если вопрос касается когнитивных нарушений у человека (нпл 8), ведь затруднительно понять, можно ли результаты, полученные на таких животных моделях, применить к лечению когнитивных нарушений у людей. В птл 4 исследовали эффект от лечения таупатий с помощью введения антител, которые участвуют во взаимодействии антиген-антитело с тау-пептидом, имеющим фосфорилированный Ser409. Однако пептидные вакцины являются дорогостоящими, требуют высоких общих дозировок и до того как они проявляют свое действие проходит достаточно много времени. Кроме того, действие пептидных вакцин и реактивность иммунного ответа после введения у людей и животных различаются из-за разного генетического фона, и продуцирование эффективных антител не всегда может проявиться у каждого индивидуума. Поэтому, хотя иммунотерапия путем пассивной иммунизации антителами имеет потенциал, очень большое число сайтов в тау фосфорилированы, и фактически не существует информации, касающейся какие антитела для каких сайтов фосфорилирования можно эффективно применять. Кроме того, нельзя считать, что те антитела, которые доступные в настоящее время, имеют достаточную функцию для использования в терапии, основываясь только на их эффективности у животных моделей.
Кроме того, когда в качестве основного компонента терапевтического средства или профилактического средства используется антитело, необходимо также учитывать количество используемого для лечения антитела для того, чтобы избежать побочных эффектов и минимизировать проблемы стоимости лечения, и это особенно важно в отношении доз в случае хронических заболеваний. Например, доза для лечения актемрой® (тоцилизумаб), которая является человеческими антителами против IL-6R, составляет 8 мг на 1 кг массы тела в течение 1-4 недель, и доза для лечения солирисом® (экулизумаб), который представляет собой гуманизированные антитела против комплемента С5, составляет 600-900 мг для введения взрослому человеку в течение 2-4 недель. Это превосходные антитела, разработанные путем отбора из большого числа антител, но их дозировки являются относительно высокими по сравнению с используемыми в настоящее время лекарственными средствами на основе антител. Таким образом, для лекарственных средств на основе антител, которые будут разработаны в будущем, действие должно проявляться при дозировках, равных или меньших, чем указанные. Кроме того, поскольку органом на который воздействуют при лечении когнитивных расстройств, таких как AD, является головной мозг, считается, что антитела, используемые для лечения таких расстройств, имеют меньший фармакологический эффект по сравнению с антителами используемыми для лечения заболеваний с участием других органов, поскольку при системном введении внутривенным или подкожным путем скорость миграции антител из крови в головной мозг достаточно низкая из-за наличия гематоэнцефалического барьера, что составляет главную проблему.
Основными симптомами при когнитивных расстройствах у людей являются ухудшение памяти и ухудшение когнитивной функции, и так как когнитивная функция является особенно важной для основанной на памяти способности к умозаключениям, общения и работоспособности, симптомы когнитивных расстройств это вопрос первостепенной важности. С другой стороны, двигательная функция хотя и является симптомом, обнаруженном при связанной с хромосомой 17 лобно-височной деменции с паркинсонизмом (FTDP-17), необязательно является основным симптомом, проявляющимся при когнитивных расстройствах. Следовательно, основным вопросом, рассматриваемым в случае лечения когнитивных расстройств, является улучшение когнитивной функции. Однако в настоящее время нет способов получения терапевтического средства или профилактического средства против когнитивных расстройств, которое показывает превосходное улучшение или когнитивной функции с использованием подходящих животных моделей ухудшения когнитивной функции, связанного с таупатией, которые необходимы для решения проблемы, очерченной выше, ни какого-либо терапевтического средства или профилактического средства против когнитивных расстройств, которое показывает специфическое и превосходное действие против когнитивных расстройств.
Поэтому в свете таких обстоятельств существует потребность в терапевтическом средстве или профилактическом средстве с сильным эффектом в отношении улучшения когнитивной функции.
Список процитированной литературы
Патентная литература
[Птл 1] US 8012936
[Птл 2] WO 2010/142423
[Птл 3] WO 2010/144711
[Непатентная литература]
[Нпл 1] Kishimoto Т., Takahashi S., STEP Series Seishinka, 2th Edition, p. 103-104, Kaibashobo, 2008
[Нпл 2] Asada Т., Igaku no Ayumi, supplementary volume, "Cognitive disorders", p. 5-10, Ishiyaku Publishing, 2011
[Нпл 3] Alistair Burns, John O'Brien and David Ames, Dementia. 3rd Edition, p. 408-464, 2005
[Нпл 4] Arai, Т., Shinkei Naika, Vol. 72, special number, (Suppl. 6), p. 46-51, 2010
[Нпл 5] Wendy Noble et al., Expert Opin. Drug Discov., Vol. 6, No. 8, p. 797-810, 2011
[Нпл 6] Miguel Diaz-Hernandes et al., Journal of Biological Chemistry, Vol. 285, p. 32539-32548, 2010
[Нпл 7] Venessa Plouffe et al., PLoS ONE, Vol. 7, p. 36873, 2012
[Нпл 8] Alistair Burns, John O'Brien and David Ames, Dementia. 3rd Edition, p. 459, 2005
Раскрытие изобретения
Проблемы, решаемые изобретением
Целью настоящего изобретения является получение терапевтического средства или профилактического средства против когнитивных расстройств, сосредоточенное на тау-фосфорилировании при таупатиях.
Другой целью изобретения является получение терапевтического средства или профилактического средства против когнитивных расстройств, содержащее в качестве активного ингредиента антитела, которые участвуют в специфическом взаимодействии антиген-антитело с тау, фосфорилированном в аминокислотном остатке, находящемся в непосредственной близости от Ser413, или пептид, характеризующийся аминокислотной последовательностью аналогичной аминокислотной последовательности в непосредственной близости от Ser413 и фосфорилированным, по меньшей мере, в одном аминокислотном остатке.
Еще одной целью изобретения является получение моноклонального антитела, обладающего сильным эффектом в отношении улучшения когнитивной функции и способ получения антитела, которое является еще более подходящим для лечения когнитивного расстройства, такого как гуманизированное антитело, где способ основан на анализе структуры моноклонального антитела.
Способы решения проблем
Настоящее изобретение подробно описывается ниже. Белок тау по изобретению включает не только 4R2N, но все 6 типов изоформ. Для удобства, позиции аминокислотных остатков в настоящем изобретении идентифицированы относительно SEQ ID NO: 1, и, например, если упоминается аминокислотный остаток, соответствующей Ser413 в SEQ ID NO: 1, это относится к 413-ому серину SEQ ID NO: 1 (4R2N), или серину, который является 384-ым аминокислотным остатком SEQ ID NO: 2 (4R1N), 355-ым SEQ ID NO: 3 (4R0N), 382-ым SEQ ID NO: 4 (3R2N), 353-им SEQ ID NO: 5 (3R1N) или 324-ым SEQ ID NO: 6(3R0N).
(1) Терапевтическое средство или профилактическое средство против когнитивных расстройств, содержащее в качестве активного ингредиента антитело, которое участвуют во взаимодействии антиген-антитело с тау белком, который фосфорилирован в, по меньшей мере, одном аминокислотном остатке, находящимся в положении, соответствующем позициям 410-421 тау-белка, представленного SEQ ID NO: 1.
(2) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно (1), при этом антитело представляет собой антитело, которое участвуют во взаимодействии антиген-антитело с фосфорилированным тау-белком, характерным для когнитивных расстройств.
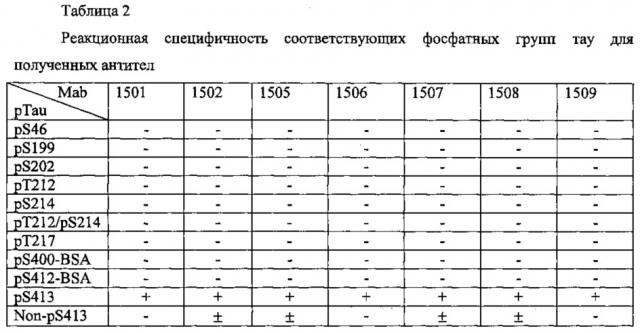
(3) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно (1) или (2), при этом антитело участвуют во взаимодействии антиген-антитело с тау-белком, который фосфорилирован в одном или нескольких сайтах, выбранных из числа Ser412, Ser413, Thr414 и Ser416.
(4) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(3), при этом антитело представляет собой антитело, которое при связывании с тау-белком конкурирует с антителом, содержащим VH, состоящую из аминокислотной последовательности, указанной как SEQ ID NO: 20, и VL, состоящую из аминокислотной последовательности, указанной как SEQ ID NO: 26.
(5) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(3), при этом антитело представляет собой антитело, содержащее VH, состоящую из аминокислотной последовательности, указанной как SEQ ID NO: 20, и VL, состоящую из аминокислотной последовательности, указанной как SEQ ID NO: 26.
(6) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(4), при этом антитело представляет собой антитело, которое участвуют во взаимодействии антиген-антитело с тау-белком, который фосфорилирован в аминокислотном остатке, соответствующем Ser413.
(7) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(6), при этом антитело представляет собой антитело, содержащее последовательности CDR Н-цепи, представленные SEQ ID NO: 7-13, или последовательность CDR Н-цепи, представленную, по меньшей мере, одной из SEQ ID NO: 7-13, или последовательность CDR Н-цепи, имеющую, по меньшей мере, 85% гомологию с, по меньшей мере, одной последовательностью CDR Н-цепи, представленных SEQ ID NO: 7-13, и/или последовательности CDR L-цепи, представленные SEQ ID NO: 14-17, последовательность CDR L-цепи, представленную, по меньшей мере, одной из SEQ ID NO: 14-17, или последовательность CDR L-цепи, имеющую, по меньшей мере, 85% гомологию с, по меньшей мере, одной последовательностью CDR L-цепи, представленных SEQ ID NO: 14-17.
(8) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(7), при этом антитело представляет собой антитело, содержащее вариабельный участок Н-цепи, представленный любой из последовательностей SEQ ID NO: 18-24, или вариабельный участок Н-цепи, содержащий последовательность, имеющую, по меньшей мере, 85% гомологию с любой из последовательностей SEQ ID NO: 18-24, и/или вариабельный участок L-цепи, представленный любой из последовательностей SEQ ID NO: 25-30, или вариабельный участок L-цепи, содержащий последовательность, имеющую, по меньшей мере, 85% гомологию с любой из последовательностей SEQ ID NO: 25-30.
(9) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(8), при этом антитело представляет собой гуманизированное антитело или химерное антитело.
(10) Терапевтическое средство или профилактическое средство против когнитивных расстройств, содержащее в качестве активного ингредиента пептид, который содержит последовательность из, по меньшей мере, 8 последовательных аминокислот из аминокислотной последовательности, состоящей из аминокислотных остатков, соответствующих аминокислотам 410-421 SEQ ID NO: 1, причем, по меньшей мере, один из аминокислотных остатков в пептиде фосфорилирован.
(11) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно (10), при этом, по меньшей мере, один из фосфорилированных аминокислотных остатков в пептиде соответствует аминокислотным остаткам Ser412, Ser413, Thr414 или Ser416 SEQ ID NO: 1.
(12) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно (10) или (11), при этом фосфорилированные аминокислотные остатки в пептиде включают, по меньшей мере, аминокислотный остаток, соответствующий Ser413 SEQ ID NO: 1.
(13) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно любому из (1)-(12), при этом когнитивное расстройство представляет собой таупатию.
(14) Терапевтическое средство или профилактическое средство против когнитивных расстройств согласно (13), при этом таупатия представляет собой болезнь Альцгеймера, кортикобазальную дегенерацию ганглиев, прогрессирующий надъядерный паралич, болезнь Пика, аргирофильную зернистую деменция (аргирофильную зернистую болезнь), множественную системную таупатию с деменцией (MSTD), связанную с хромосомой 17 лобно-височную деменцию с паркинсонизмом (FTDP-17), деменцию с нейрофибриллярными клубками, диффузные нейрофибриллярные клубки с кальцификацией (DNTC), таупатию белого вещества с глобулярными глиальными включениями (WMT-GGI) или лобно-височную лобарную дегенерацию с тау-положительными включениями (FTLD-тау).
(15) Моноклональное антитело, которое участвует во взаимодействии антиген-антитело с пептидом, содержащим последовательность из, по меньшей мере, 8 последовательных аминокислот из аминокислотной последовательности, состоящей из аминокислот 410-421 SEQ ID NO: 1, причем аминокислотный остаток в пептиде, соответствующий Ser413 SEQ ID NO: 1, фосфорилирован.
(16) Антитело направленное на фосфорилированный тау-белок, причем антитело является тем, которое конкурирует с антителом, содержащим VH, состоящий из аминокислотной последовательности, указанной как SEQ ID NO: 20, и VL, состоящий из аминокислотной последовательности, указанной как SEQ ID NO: 26 при связывании с антигеном.
(17) Антитело направленное на фосфорилированный тау-белок, причем антитело является тем, которое содержит VH, состоящий из аминокислотной последовательности, указанной как SEQ ID NO: 20, и VL, состоящий из аминокислотной последовательности, указанной как SEQ ID NO: 26.
(18) Моноклональное антитело, имеющее последовательность CDR Н-цепи, представленные SEQ ID NO: 7-13, последовательность CDR Н-цепи, представленную, по меньшей мере, одной из SEQ ID NO: 7-13, или Н-цепь, содержащую последовательность CDR, имеющую, по меньшей мере, 85% гомологию с, по меньшей мере, одной из последовательностей CDR Н-цепи, представленных SEQ ID NO: 7-13, и/или последовательности CDR L-цепи, представленные SEQ ID NO: 14-17, последовательность CDR L-цепи, представленную, по меньшей мере, одной из SEQ ID NO: 14-17, или L-цепь, содержащую последовательность CDR, имеющую, по меньшей мере, 85% гомологию с, по меньшей мере, одной из последовательностей CDR L-цепи, представленных SEQ ID NO: 14-17.
(19) Моноклональное антитело, содержащее вариабельный участок Н-цепи, представленный любой из последовательностей SEQ ID NO: 18-24, или вариабельный участок Н-цепи, имеющий, по меньшей мере, 85% гомологию с любой из последовательностей SEQ ID NO: 18-24, и/или вариабельный участок L-цепи, представленный любой из последовательностей SEQ ID NO: 25-30, или вариабельный участок L-цепи, имеющий, по меньшей мере, 85% гомологию с любой из последовательностей SEQ ID NO: 25-30.
(20) Моноклональное антитело согласно любому из (15)-(19), при этом антитело представляет собой гуманизированное антитело или химерное антитело.
(21) Пептид, состоящий из последовательности из по меньшей мере 8 последовательных аминокислот из аминокислотной последовательности, состоящей из аминокислотных остатков, соответствующих аминокислотам 410-421 SEQ ID NO: 1, причем, по меньшей мере, один из аминокислотных остатков в пептиде является фосфорилированным.
(22) Пептид согласно (21), при этом, по меньшей мере, один из аминокислотных остатков, соответствующих аминокислотам Ser412, Ser413, Thr414 и Ser416 SEQ ID NO: 1, является фосфорилированным.
(23) Пептид согласно (21) или (22), при этом фосфорилированный аминокислотный остаток представляет собой аминокислотный остаток, соответствующий Ser413 SEQ ID NO: 1.
Эффекты изобретения
Настоящее изобретение обеспечивает терапевтическое средство или профилактическое средство против когнитивных расстройств, содержащее в качестве активного ингредиента антитела, которые участвуют во взаимодействии антиген-антитело специфически с фосфорилированным тау, где взаимодействие происходит по соседству с аминокислотным остатком, соответствующим Ser413 SEQ ED NO: 1; или пептид, содержащий аминокислотную последовательность соответствующую аминокислотной последовательности вблизи Ser413 SEQ ID NO: 1, причем, по меньшей мере, один из аминокислотных остатков является фосфорилированным. Изобретение также обеспечивает моноклональные антитела, имеющие сильный улучшающий эффект на когнитивную функцию, и способ получения антител, которые являются еще более подходящими для лечения когнитивного расстройства, таких как гуманизированные антитела, где способ основан на анализе структуры моноклональных антител.
Краткое описание чертежей
Фиг. 1 представляет собой перечень начальных частей аминокислотных последовательностей изоформ человеческого тау-белка, выровненных с использованием Clusta1W.
Фиг. 2 представляет собой перечень конечных частей аминокислотных последовательностей изоформ человеческого тау-белка, выровненных с использованием Clusta1W.
Фиг. 3 представляет собой график, показывающий специфичность кроличьих поликлональных антител в отношении пептида pSer413.
Фиг. 4 представляет собой график, показывающий результаты предварительного испытания на мышиной модели поликлональных кроличьих антител, распознающих pSer413..
Фиг. 5 представляет собой график, показывающий результаты основного исследовательского испытания на мышиной модели поликлональных кроличьих антител, распознающих pSer413.
Фиг. 6 представляет собой линейный график, показывающий результаты теста «открытое поле» с мышиной моделью, которой вводили поликлональные кроличьи антитела, распознающие pSer413.
Фиг. 7 представляет собой гистограмму, показывающую результаты теста «открытое поле» с мышиной моделью, которой вводили поликлональные кроличьи антитела, распознающие pSer413.
Фиг. 8 представляет собой график, показывающий результаты предварительного испытания на мышиной модели моноклонального мышиного антитела к pSer413 (Та1505).
Фиг. 9 представляет собой гистограмму, показывающую результаты основного исследовательского испытания на мышиной модели моноклонального мышиного антитела к pSer413 (Ta1505).
Фиг. 10 представляет собой линейный график, показывающий результаты теста «открытое поле» с мышиной моделью, которой вводили моноклональное мышиное антитело к pSer413 (Та1505).
Фиг. 11 представляет собой гистограмму, показывающую результаты теста «открытое поле» с мышиной моделью, которой вводили моноклональное мышиное антитело к pSer413 (Ta1505).
Фиг. 12 представляет собой график, показывающий результаты предварительного испытания на мышиной модели мышиного моноклонального антитела, распознающего pSer413, (Та9).
Фиг. 13 представляет собой гистограмму, показывающую результаты основного исследовательского испытания на мышиной модели мышиного моноклонального антитела, распознающего pSer413, (Та9)
Фиг. 14 представляет собой линейный график, показывающий результаты теста «открытое поле» с мышиной моделью, которой вводили мышиное моноклональное антитело, распознающее pSer413, (Та9).
Фиг. 15 представляет собой гистограмму, показывающую результаты теста «открытое поле» с мышиной моделью, которой вводили мышиное моноклональное антитело, распознающее pSer413, (Та9).
Фиг. 16 представляет собой гистограмму, показывающую уровни синаптофизина в гиппокампе у мышиной модели при введении антител Та1505.
Фиг. 17 представляет собой схема, фрагмента, содержащего ген тау.
Фиг. 18 представляет собой график, показывающий результаты предварительного испытания в водном лабиринте мышей с нарушенным запоминанием при обучении (Tau-Tg), которым вводили антитела Та1505.
Фиг. 19 представляет собой гистограмму, показывающую результаты предварительного испытания в водном лабиринте мышей с нарушенным запоминанием при обучении (Tau-Tg), которым вводили антитела Та1505.
Фиг. 20 представляет собой график, показывающий результаты предварительного испытания в водном лабиринте мышей с нарушенным запоминанием при обучении (Tau-Tg), которым вводили антитела Та9.
Фиг. 21 представляет собой гистограмму, показывающую результаты предварительного испытания в водном лабиринте мышей с нарушенным запоминанием при обучении (Tau-Tg), которым вводили антитела Та9.
Фиг. 22 представляет собой фотографии, показывающие иммуногистоокрашивание антителами Та1505 участка гиппокампа СА3 и участка СА23 мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении контроля IgG (1 мг/мышь) или антител Та1505 (1 мг/мышь).
Фиг. 23 представляет собой фотографии, показывающие иммуногистоокрашивание с Та1505 участка парагиппокампальной извилины у мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении контроля IgG (1 мг/мышь).
Фиг. 24 представляет собой фотографии, показывающие иммуногистоокрашивание с Та1505 участка парагиппокампальной извилины у мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении антител Та1505 (1 мг/мышь).
Фиг. 25 представляет собой фотографии, показывающие иммуногистоокрашивание участка гиппокампа СА3 и участка СА23 АТ8 у мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении контроля IgG (1 мг/мышь) или антител Та1505 (1 мг/мышь).
Фиг. 26 представляет собой фотографии, показывающие иммуногистоокрашивание участка парагиппокампальной извилины АТ8 у мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении контроля IgG (1 мг/мышь).
Фиг. 27 представляет собой фотографии, показывающие иммуногистоокрашивание участка парагиппокампальной извилины АТ8 у мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении антител Та1505 (1 мг/мышь).
Фиг. 28 представляет собой график, показывающий количество тау, реагирующего с G2, АТ8, PHF1 и Та1505, в растворимой в TBS фракции головного мозга мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении Та1505 (1 мг/мышь).
Фиг. 29 представляет собой график, показывающий количество тау, реагирующего с G2, АТ8, PHF1 и Та1505, в растворимой в саркозиле фракции головного мозга мышей с нарушенным запоминанием при обучении (Tau-Tg) при введении Та1505 (1 мг/мышь).
Наилучший способ осуществления изобретения
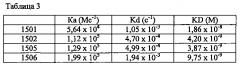
Авторы настоящего изобретения получили антитела, которые участвуют в специфическом взаимодействии антиген-антитело с тау, который фосфорилирован в аминокислотном остатке, соответствующем Ser413 SEQ ID NO: 1, который является сайтом, специфически фосфорилированным при AD. Эти антитела ввели Tg мышам, проявляющим ассоциированное с возрастом ухудшение когнитивной функции, и обнаружили, что когнитивную функцию можно восстановить приблизительно до такого же уровня, как у контрольной группы. С другой стороны, адекватного улучшения когнитивной функции не наблюдают при использовании сравнимой концентрации антител к тау, который фосфорилирован в аминокислотных остатках, соответствующих Ser396 SEQ ID NO: 1, которые имели даже более высокую аффинность к эквивалентному антигену, чем антитела по изобретению. Часть вблизи аминокислотного остатка, соответствующего Ser413 SEQ ID NO: 1, является участком, для которого нет конкретной информации о связи между этой структурой тау и функцией, поэтому совершенно неожиданным является то, что антитела, которые участвуют во взаимодействии антиген-антитело специфически с этой частью, имеют такое сильное улучшающий эффект на когнитивную функцию. Таким образом, в настоящем изобретении впервые показано, что сайт по соседству с аминокислотным остатком, соответствующим Ser396 SEQ ID NO: 1, который до сих пор не вызывал интерес, является важным сайтом для начала ухудшения когнитивной функции при таупатиях, и тем самым было получено настоящее изобретение.
Антитело против фосфорилированного тау
Тау (белок) для целей изобретения включает не только тау-белок человека, представленный SEQ ID NO: 1-6, но также его генетические мутанты. Как пояснялось выше в разделе «Уровень техники», с FTDP-17 (семейном нейродегенеративном заболевании, ассоциированном с когнитивным расстройством) ассоциировано более 40 мутаций, но места мутаций необязательно ограничиваются ими. Более того, белки с мутациями в аминокислотах в местоположениях 1-50, предпочтительно, местоположениях 1-30, предпочтительнее, местоположениях 1-10, такие как ряд мутаций в SEQ ID NO: 1-6, также рассматриваются как тау для цели изобретения. Кроме того, также включаются белки, показывающие, по меньшей мере, 85% гомологию (идентичность) с тау-белком человека, обозначенным как SEQ ID NO: 1, согласно методу BLAST (условия по умолчанию NCBI PBLAST), и их изоформы. Такие белки также включают тау иных видов, чем люди, таких как шимпанзе, макака резус, лошадь, свинья, собака, мышь, кролик и крыса, и могут использоваться для получения терапевтических средств или профилактического средства, имеющих целью такие тау-белки, с целью улучшения когнитивной функции у таких животных.
Номера аминокислот согласно изобретению, т.е. позиции аминокислотных остатков, для удобства обозначаются их номерами в последовательности SEQ ID NO: 1. Так, например, если упоминается аминокислотный остаток, соответствующий Ser413 SEQ ID NO: 1, это относится к серину, который является 413-ым аминокислотным остатком в SEQ ID NO: 1 (4R2N), 384-ым в SEQ ID NO: 2 (4R1N), 355-ым в SEQ ID NO: 3 (4R0N), 382-ым в SEQ ID NO: 4 (3R2N), 353-им в SEQ ID NO: 5 (3R1N) или 324-ым в SEQ ID NO: 6 (3R0N). В таблице 1 показаны позиции аминокислотных остатков для каждой изоформы, которые находятся в одних и тех же соответственных позициях. В таблице 1 позиции аминокислотных остатков для каждой изоформы показаны относительно 410-421 в SEQ ID NO: 1, и соотношения соответственных позиций аминокислотных остатков для других позиций можно легко определить на основе фиг. 1 и фиг. 2, например.
Термин «антитело против фосфорилированного тау» относится к антителу, которое принимает участие во взаимодействии антиген-антитело с тау, который фосфорилирован в аминокислотном остатке в одном или нескольких местоположениях аминокислотной последовательности тау, описанной выше. Фосфорилированные аминокислотные остатки могут представлять собой серин (Ser), треонин (Thr), тирозин (Tyr) или подобные. Также сайт в фософрилированном тау, с которым антитело против фосфорилированного тау взаимодействует по механизму антиген-антитело, предпочтительно является сайтом