Способ определения следовых количеств нитрат-ионов в хлориде стронция
Иллюстрации
Показать всеИзобретение относится к области аналитической химии и может быть использовано при производстве радиофармпрепаратов, в стоматологии и косметологии. Способ определения следовых количеств нитрат-ионов в соли SrCl2 характеризуется тем, что из исходного хлорида стронция получают макроциклический комплекс состава КЭ⋅SrCl2, где КЭ - молекула краун-эфира; облучают макроциклический комплекс КЭ⋅SrCl2 при температуре жидкого азота 77 К с целью образования и стабилизации радикальных продуктов радиолиза, при этом макроциклический комплекс КЭ⋅SrCl2 предварительно вакуумируют в стеклянной ампуле; регистрируют спектры ЭПР радикальных продуктов радиолиза, стабилизированных в облученном макроциклическом комплексе КЭ⋅SrCl2, при температуре в диапазоне 77-110 К, определяют концентрацию дианионов NO32- в исходной соли SrCl2. 3 з.п. ф-лы, 1 ил., 6 пр.
Реферат
Изобретение относится к аналитической химии, в частности к определению содержания следовых количестве нитрат-ионов в хлориде стронция в твердофазном состоянии, и может быть использовано:
- в ядерной медицине при производстве радиофармпрепаратов на основе радионуклида стронций-89, применяемого в виде хлорида стронция для лечения онкологических заболеваний кости, молочной железы, простаты и т.д.;
- в стоматологии, где хлорид стронция включают в композиции средств для обезболивания, для лечения кариеса зубов, а также для снижения чувствительности дентина;
- в косметологии, где хлорид стронция выполняет функцию блокатора раздражения, вызываемого различными химическими агентами.
Использование препаратов на основе хлорида стронция в указанных областях обуславливает повышенные требования к их химической чистоте. В частности, достаточно трудно контролируемой примесью в хлориде стронция являются нитрат-ионы. Следует отметить, что задача определения содержания нитрат-ионов в различных объектах живой и неживой природы, в целом, является весьма актуальной. К настоящему времени разработан ряд методов определения нитрат-ионов в природных и сточных водах, биологических объектах, почвах и т.д., которые основаны на колориметрическом, спектрофотометрическом, масс-спектрометрическом и ЭПР-спектроскопическом анализе проб.
Так, известен колориметрический способ определения нитрат-ионов [SU 1125539 А] с использованием в качестве окрашивающего реагента спиртового раствора бромида 4,5,4,5-дибензо-тиокарбоцианина. Указанный окрашивающий реагент вместе с анализируемым раствором наносят на таблетку неорганического носителя, например, сульфата кальция. Далее проводят визуальное определение присутствия нитрат-ионов по фиолетово-розовому окрашиванию пробы. Средний диапазон определяемых данным методом концентраций нитрат-ионов составляет 1,5-30 мг/л, что свидетельствует о его достаточно низкой чувствительности.
Описан колориметрический способ определения нитрат-ионов в водных растворах [SU 1645891 А1], включающий в себя стадии контакта анализируемой пробы со смесью концентрированной серной кислоты, сульфаминовой кислоты и соли двухвалентного железа в приборе Полежаева, барботирования через данный прибор воздуха с целью десорбции образующегося оксида азота, пропускания образующейся воздушной смеси, содержащей оксид азота, через колонку с окислительной смесью (твердый сорбент, пропитанный 3% раствором двухромокислого калия в 2,5% серной кислоте) и через индикаторную трубку. Содержание в пробе нитрата оценивают по высоте окрашенного слоя в указанной индикаторной трубке. Указанную индикаторную трубку предварительно калибруют, используя стандартные растворы нитрат-иона. Достоинством данного способа является короткое время проведения анализа, находящееся в диапазоне 0,5-2 мин. Недостатком является низкая чувствительность - диапазон определяемых концентраций составляет 200-800 мг/л.
Известен способ и реагент для колориметрического определения нитрат-ионов [патент США №4424277]. Способ включает смешивание анализируемого образца с концентрированной серной кислотой и окрашивающим реагентом формулы 4,4'-RO-С6Н4-С6H4-OR, в которой R представляет собой Н или C1-С6-алкил, в частности 4,4'-дианизолом. Окрашивающий реагент добавляют в виде раствора в ДМСО, ДМФА, кетонах, диоксане, этаноле, пропиленкарбонате и других растворителях, смешивающихся с концентрированной серной кислотой, или в виде твердофазной смеси с фосфатом щелочного металла, таким как додекагидрат трехзамещенного фосфата натрия. Для спектрофотометрического определения нитрат-ионов используют полосу поглощения с максимумом при 730 нм. Определяемая концентрация NO3- составляет 2-200 ч./млн. Недостаток данного способа состоит в необходимости сильного разбавления анализируемого образца (1:60) серной кислотой, что снижает точность определения и приводит к образованию значительных объемов сильнокислых растворов.
Предложен способ и реагент для спектрофотометрического определения нитрат ионов в водных растворах [патент США №4690902]. В качестве окрашивающего реагента используют 2(3),5-дигидроксибензойную кислоту, ее соли с катионами щелочных металлов и аммония, а также сложные эфиры данной кислоты с C1-С6 алифатическими разветвленными и неразветвленными спиртами. В качестве среды для проведения анализа используют концентрированную серную кислоту или смесь концентрированных серной и фосфорной кислот, которая содержит вплоть до 5 мол. % фосфорной кислоты. Концентрация определяемых нитрат-ионов в анализируемом образце находится в диапазоне от 10 до 100 мг/л. Максимум поглощения нитрованного соединения составляет 525 нм в случае 3,5-дигидроксибензойной кислоты и 420 нм в случае 2,5-дигидроксибензойной кислоты.
Известен способ и реагент для колориметрического определения нитрат-ионов [патент США №5236848], в котором в качестве окрашивающего реагента используют резорцинол (1,3-дигидроксибензол) в количестве 0,1-0,2% по массе в виде раствора в смеси концентрированных серной и фосфорной кислот (предпочтительно 9:1 по объему), причем в указанный раствор дополнительно добавляют хлорид-ионы в количестве по меньшей мере 2 г/л. После завершения реакции между нитрат-ионами, присутствующими в анализируемой пробе, и окрашивающим реагентом концентрацию ионов NO3- определяют спектрофотометрически, используя максимум полосы поглощения при 505 нм. Заявляемый диапазон концентраций нитрат-ионов, который можно анализировать указанным способом с применением 1 см кюветы, составляет 0-15 мг/л.
В еще одном спектрофотометрическом способе определения концентрации нитрат- и нитрит-ионов в водной среде используют реакцию нитрования метилового эфира 2-гидроксибензойной кислоты нитрат-ионами, присутствующими в анализируемом образце, с получением 5-нитро-2-гидроксиметилбензойной кислоты, максимум полосы поглощения которой в УФ/видимом диапазоне составляет 410 нм [публикация заявки на патент США №2006/0121621 А1]. Недостатком данного способа является многостадийность подготовки пробы. Кроме того, он применим для определения высоких концентраций NO3-, поскольку диапазон чувствительности данного способа по нитрат-ионам составляет 0,1-1 моль/л.
Известен способ фотометрического определения нитрат-ионов с использованием в качестве окрашивающего реагента раствора 2,6-диацетаминопиридина в концентрированной (65-67%) серной кислоте, причем для устранения мешающего действия галогенид-ионов, присутствующих в анализируемой пробе, предложено в указанный раствор добавлять соединение сурьмы [а.с. 929544]. Оптическую плотность измеряют при λ=385 нм. Диапазон анализируемых концентраций нитрат-ионов составляет 0,04-1,2 мг/л при использовании кюветы с толщиной 3 см.
Общие недостатки колориметрических и спектрофотометрических способов определения концентрации нитрат-ионов, основанных на восстановлении данных ионов в нитрит-ионы воздействием серной кислоты, состоят в следующем.
Указанные способы невозможно использовать для анализа образцов на основе хлорида стронция, поскольку добавление H2SO4 к пробе будет приводить к выпадению осадка нерастворимого в воде сульфата стронция и искажению результатов анализа. Кроме того, следует отметить короткое время жизни продуктов нитрования, другими словами, низкую стабильность окраски реагентов, чувствительность анализа к содержанию воды и хлоридов в концентрированной серной кислоте. Спектрофотометрические способы количественного определения содержания нитрат-ионов в образце требуют приготовления и использования калибровочных растворов нитрат-ионов, а также их периодической проверки.
Известен масс-спектрометрический метод определения следовых количеств неорганических окислителей, включая нитрат-ионы [Е. Sokol, A.U. Jackson, R.G. Cooks. Trace detection of inorganic oxidants using desorption electrospray ionization (DESI) mass spectrometry. Cent. Eur. J. Chem. 2011, V. 9, N5, 790-797]. Указанный способ включает стадии нанесения раствора неорганической соли в смеси метанол/вода (1/1, об./об.) объемом 1,4 мкл на полимерную подложку, высушивания пробы и определения содержания неорганического аниона с помощью масс-спектрометрии с десорбционной ионизацией под действием электрораспыления (DESI масс-спектрометрия). Предел обнаружения для нитрат-ионов составляет 1 нг. Недостаток данного метод заключается в том, что он неприменим для анализа многокомпонентных смесей.
Известно использование спектроскопии электронного парамагнитного резонанса (ЭПР-спектроскопии) для определения нитрит-ионов в биологических образцах [Wennmalm, ; Petersson, Ann-Sofi. Analysis of Nitrite as a Marker for Endotheliurn-Derived Relaxing Factor in Biological Fluids Using Electron Paramagnetic Resonance Spectrometry. Journal of Cardiovascular Pharmacology. 1991, V. 17 (Suppl. 3), S34-S40]. Указанный метод основан на восстановлении NO2- в NO дитионитом и последующем определении монококсида азота ЭПР-спектроскопией. Однако определить нитрат-ионы данным методом невозможно, поскольку NO3- не конвертируется в NO дитионитом.
Наиболее близким к заявляемому техническому решению является колориметрический метод определения массовой доли нитратов и других окислителей, основанный на анализе обесцвечивания раствора индигокармина в присутствии нитрат-ионов и концентрированной серной кислоты, описанный в ГОСТ 4140-74 «Реактивы. Стронций хлористый 6-водный. Технические условия». Предварительно стронций удаляют из анализируемого раствора действием на раствор анализируемой пробы раствором серной кислоты. Выпавший сульфат стронция отфильтровывают. Содержание примеси нитрат-ионов в хлориде стронция определяют визуально, сравнивая окраску анализируемого и стандартного растворов. Диапазон определяемых концентраций примесей нитрат-ионов в хлориде стронция, определяемый данным методом, составляет 3.2-10-7 моль/г. Недостатком данного способа является нестабильность раствора индигокармина, требующая его периодической проверки.
Техническая задача заявляемого изобретения состоит в повышении чувствительности определения нитрат-ионов, присутствующих в хлориде стронция, и исключении необходимости периодической проверки реагентов, используемых для проведения анализа. Указанная техническая задача решается предлагаемым способом определения следовых количеств нитрат-ионов в хлориде стронция, в котором на первой стадии указанный хлорид стронция превращают в макроциклический комплекс состава КЭ⋅SrCl2, где КЭ представляет собой молекулу краун-эфира, посредством реакции комплексообразования между краун-эфиром и солью стронция в органическом растворителе. Для осуществления данной реакции твердофазный хлорид стронция добавляют в раствор КЭ в органическом растворителе при перемешивании. Предпочтительно количество добавляемого хлорида стронция эквимолярно количеству содержащегося в растворе КЭ. Взаимодействие осуществляют при комнатной температуре в течение промежутка времени от нескольких минут до 2-5 часов. В процессе комплексообразования происходит растворение соли стронция с образованием прозрачного раствора. После завершения данной реакции полученный раствор фильтруют, растворитель упаривают до получения твердого остатка комплекса КЭ⋅SrCl2, который промывают диэтиловым эфиром или гексаном для удаления непрореагировавших количеств краун-эфира и сушат при температуре от 25 до 60°С. В результате получают макроциклический комплекс хлорида стронция. В качестве растворителя для осуществления реакции комплексообразования используют алифатические спирты, кетоны, ароматические углеводороды, ацетонитрил, диметилсульфоксид и галогенированные алканы и алкены. Предпочтительными растворителями являются метанол, этанол и хлороформ. Краун-эфир, используемый для получения макроциклического комплекса с хлоридом стронция, выбирают из группы, включающей 18-краун-6, дициклогексано-18-краун-6 и ди-(трет-бутил-циклогексано-18-краун-6). На второй стадии предлагаемого способа полученный макроциклический комплекс КЭ⋅SrCl2 подвергают радиолизу посредством воздействия ионизирующего излучения. В качестве источника ионизирующего излучения используют рентгеновское излучение, γ-излучение или пучок ускоренных электронов. Облучение комплексов осуществляют при температуре жидкого азота (77 К). Данная температура облучения позволяет стабилизировать образующиеся в результате радиолиза парамагнитные продукты радиолиза. При более высокой температуре облучения указанные парамагнитные продукты радиолиза вступают во вторичные пострадиационные реакции, что приводит к снижению их концентрации в анализируемом облученном образце и искажению результатов. Образцы, подвергаемые радиолизу, предварительно вакуумируют в стеклянных ампулах для проведения ЭПР измерений с целью предотвращения влияния атмосферного кислорода на результаты анализа. На третьей стадии заявляемого способа осуществляют регистрацию спектров ЭПР радикальных продуктов, стабилизированных в облученном макроциклическом комплексе КЭ⋅SrCl2. Регистрацию спектров проводят в температурном интервале 77-110 К, в котором парамагнитные частицы стабильны. На четвертой стадии заявляемого способа определяют площадь сигнала ЭПР и концентрацию NO32- дианионов.
Заявляемый способ определения следовых количеств нитрат-ионов в хлориде стронция характеризуется высокой чувствительностью. Это обусловлено особенностями электронной и химической структуры макроциклических комплексов состава КЭ⋅SrCl2, содержащих в качестве примесей в своей кристаллической решетке анионы NO3-. При облучении данных комплексов поглощение энергии ионизирующего излучения на ранних стадиях радиолиза происходит всеми компонентами системы, а именно краун-эфиром, катионом стронция и анионом, пропорционально их электронным долям. Это приводит к ионизации соответствующих компонентов с образованием органических, неорганических парамагнитных продуктов и свободных электронов. Свободные электроны селективно захватываются нитрат-анионами. Это приводит к переносу энергии ионизирующего излучения, поглощенной хлорид-ионом и краун-эфиром, на примесные NO3- анионы с образованием NO32- дианионов, дающих характерный, узкий сигнал в спектрах электронного парамагнитного резонанса (ЭПР).
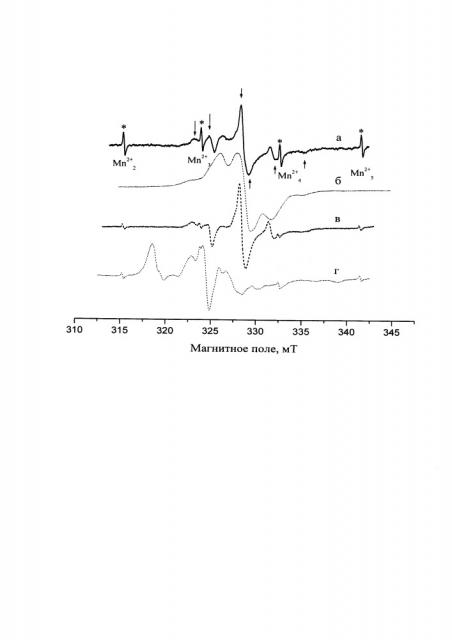
Указанный сигнал NO32- дианионов отмечен стрелками на чертеже, на котором даны иллюстративные спектры ЭПР облученных образцов комплекса ДЦГ 18К6⋅SrCl2 (а), комплекса ДЦГ18К6⋅SrCl2, полученного из предварительно очищенного хлорида стронция (б), комплекса ДЦГ18К6⋅ Sr(NO3)2 (в) и хлорида стронция SrCl2 (г). Символом (*) на чертеже отмечены линии сигнала Mn2+, используемого в качестве стандарта.
Сигнал ЭПР NO32- дианионов выделяют из зарегистрированного экспериментального спектра ЭПР, определяют его площадь и получают, таким образом, концентрацию NO32- дианионов в образце хлорида стронция. Сигнал NO32- дианионов в спектре ЭПР можно использовать как для качественного, так и для количественного определения NO3- анионов в исходном образце хлорида стронция. Благодаря специфическим характеристикам сигнала ЭПР NO32-, метод электронного парамагнитного резонанса позволяет определять данные дианионы при их содержании в образце вплоть до 1011-1013 частиц. Указанная чувствительность соответствует концентрации нитрат-ионов в исходном хлориде стронция в диапазоне 1011-10-9 моль/г, что существенно превосходит чувствительность способов определения содержания нитрат-ионов предшествующего уровня техники.
ПРИМЕРЫ
Пример 1
В качестве анализируемого реагента использовали «Стронций хлористый, 6-водный» марки чда. Согласно паспорту реагента содержание нитратов, хлоратов и других окислителей (NO3) составляло 0,002 масс. %. Навеску хлорида стронция 1.3 г (0.012 моль) добавляли к раствору 0,21 г (8⋅10-4 моль) краун-эфира 18К6 в 7.5 мл хлороформа и выдерживали при комнатной температуре в течение 5 ч. Избыток хлорида стронция отфильтровывали, а хлороформ выпаривали. Твердое вещество промывали гептаном для удаления остатков "свободного" ДЦГ18К6. Полученный комплекс ДЦП8К6⋅SrCl2 помещали в стеклянную ампулу для ЭПР-спектроскопии, в течение 30 мин облучали рентгеновским излучением с энергией 20 кэВ при температуре жидкого азота 77 К и регистрировали спектры ЭПР. В зарегистрированном спектре ЭПР, показанном на чертеже а, наблюдали сигналы NO32- дианионов.
Пример 2
Анализ хлорида стронция проводили аналогично примеру 1 за исключением того, что в качестве краун-эфира на стадии комплексообразования использовали 0.3 г (8⋅10-4 моль) краун-эфира ДЦГ18К6. Был зарегистрирован спектр ЭПР, аналогичный показанному на чертеже а.
Пример 3
Анализ хлорида стронция проводили аналогично примеру 1 за исключением того, что в качестве краун-эфира на стадии комплексообразования использовали 0.39 г (8⋅10-4 моль) краун-эфира ДтБЦП 8К6. Был зарегистрирован спектр ЭПР, аналогичный показанному на чертеже а.
Пример 4
Проводили дополнительную очистку хлорида стронция с целью удаления следовых количеств нитрат-ионов. Шестиводный хлорид стронция (13 г, 0.48 моль) растворяли в 10 мл воды. К данному раствору добавляли раствор гидрокарбоната натрия (8 г, 0.095 моль) в воде (100 мл). Полученный SrСО3 отфильтровывали и промывали. Проводили взаимодействие полученного карбоната стронция с соляной кислотой (36.91% масс.). После превращения выделения СО2 отфильтровывали избыток карбоната, фильтрат выпаривали при 70-80°С, получая кристаллический хлорид стронция. Выделенный SrCl2 дегидратировали при 115-125°С. Далее синтез комплекса ДЦГ18К6⋅SrСl2 и его анализ на содержание нитрат-анионов проводили аналогично Примеру 1. Спектр ЭПР комплекса с хлоридом стронция, прошедшего «карбонатную» обработку, приведен на чертеже б. В данном спектре ЭПР сигналы NO32- дианионов отсутствовали, что свидетельствует о количественном извлечении нитрат-ионов из хлорида стронция в результате дополнительной очистки.
Пример 5
Анализировали содержание нитрат-ионов в образце нитрата стронция Sr(NO3)2. Анализ проводили аналогично примеру 1 за исключением того, что на стадии комплексообразования использовали 2.6 г (0.012 моль) Sr(NO3)2 и 0.3 г (8⋅10-4 моль) ДЦГ18К6 в качестве соли и краун-эфира соответственно. Спектр облученного образца приведен на чертеже в. В зарегистрированном спектре ЭПР наблюдали интенсивные сигналы NO32- дианионов.
Пример 6
Анализировали содержание нитрат-ионов в образце хлорида стронция SrCl2 аналогично примеру 1 за исключением того, что стадию комплексообразования с краун-эфиром не проводили. В ампулу для ЭПР-спектроскопии помещали соль SrCl2. Спектр облученного образца приведен на чертеже г. Сигнал, соответствующий NO32- дианионам, в зарегистрированном спектре отсутствует. Это свидетельствует о необходимости стадии образования комплекса SrCl2 с краун-эфиром с заявляемом способе.
1. Способ определения следовых количеств нитрат-ионов в соли SrCl2, характеризующийся тем, что:
из исходного хлорида стронция получают макроциклический комплекс состава КЭ⋅SrCl2, где КЭ - молекула краун-эфира;
облучают макроциклический комплекс КЭ⋅SrCl2 при температуре жидкого азота 77 К с целью образования и стабилизации радикальных продуктов радиолиза, при этом макроциклический комплекс КЭ⋅SrCl2 предварительно вакуумируют в стеклянной ампуле;
регистрируют спектры ЭПР радикальных продуктов радиолиза, стабилизированных в облученном макроциклическом комплексе КЭ⋅SrCl2, при температуре в диапазоне 77-110 К,
определяют концентрацию дианионов NO32- в исходной соли SrCl2.
2. Способ по п. 1, отличающийся тем, что краун-эфир выбран из группы, включающей 18-краун-6, дициклогексано-18-краун-6 и ди-(трет-бутил-циклогексано)-18-краун-6.
3. Способ по п. 1, отличающийся тем, что облучение макроциклического комплекса КЭ⋅SrCl2 проводят с использованием ионизирующего излучения, включающего рентгеновское излучение, гамма-излучение или пучки ускоренных электронов.
4. Способ по п. 1, отличающийся тем, что концентрацию дианионов NO32- определяют двойным интегрированием зарегистрированных спектров ЭПР.