Фармацевтическая композиция на основе фукоидана для перорального применения и способ её получения
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описана фармацевтическая композиция на основе фукоидана для перорального применения, выполненная в виде таблеток, и описан способ ее получения. Композиции включает в качестве вспомогательных веществ следующие компоненты при их соотношении, мас.%: фукоидан 33-37, наполнители 50-60, смесь разрыхлителей 4,0-10,0, глиданты 0,5-10, лубриканты 0,5-1. Способ получения композиции включает последовательное смешивание наполнителей со смесью разрыхлителей и глидантом, добавление фукоидана, увлажнение полученной смеси, влажное гранулирование, сушку при температуре 40-45°С, повторное гранулирование, опудривание лубрикантами, таблетирование. Заявленное изобретение обеспечивает повышенную биологическую доступность фукоидана в таблетках. 2 н. и 5 з.п. ф-лы, 4 ил., 3 табл., 7 пр.
Реферат
Изобретение относится к медицинской и лечебно-профилактической практике, к химико-фармацевтической и пищевой промышленности.
Фукоиданы - сложные разветвленные гетерополисахариды, обнаруженные в составе бурых водорослей и некоторых иглокожих. Основным моносахаридом фукоидана является L-фукопираноза [Ушакова Н.А., Морозевич Г.Е., Устюжанина Н.Е. и др. Антикоагулянтная активность Фукоиданов из бурых водорослей. Биомедицинская химия, 2008; 54(5): 597-606].
Фукоидан не токсичен и обладает широким спектром биологической активности, для него установлено антикоагулянтное, противовоспалительное, противовирусное, антиадгезивное, противоопухолевое, антиоксидантное и гиполипидемическое действие [Ушакова и др. 2008; Одинец А.Г., Татаринова Л.В. Фукоидан: современные представления о его роли в регуляции углеводного обмена. Лечебное дело. 2016; 49(3): С. 40-44; Fitton J.H. Therapies from fucoidan; multifunctional marine polymers. Mar. Drugs. 2011; 9: 1731-1760]. Одним из наиболее важных видов активности фукоиданов является гепариноподобная - антикоагулянтная и антитромбическая, обуславливающая возможность их использования как заменителей гепарина. Недостатки гепаринотерапии, к которым относятся риск развития ряда осложнений, в том числе возникновение кровотечений, тромбоцитопения, тромбозы, риск иммунных осложнений, аллергические реакции, головокружение, тошнота, диарея, анорексия, временное выпадение волос [Oduah E.I., Linhardt R.J., Sharfstein S.T. Heparin: past, present, and future. Pharmaceuticals. 2016; 9(3): 38; Зырянов C.K., Белоусов Ю.Б. Новые антикоагулянты: повышение эффективности или снижение безопасности. Атеротромбоз. 2013; (1): 38-43], а также то, что гепарин является лекарственным препаратом животного происхождения, делают актуальным создание новых антикоагулянтных средств, лишенных этих недостатков.
Известно средство, обладающее антикоагулянтным и иммунотропным действием, представляющее собой фукоидан, полученный путем экстракции водой бурой водоросли Fucus evanescens при температуре 20-60°С с последующим осаждением этанолом, с молекулярной массой 20000-40000 дальтон (Да), и содержащее нейтральные моносахариды: фукозы 70-80%, галактозы 2-9%, ксилозы 5-10% и глюкозы 2-7%, а также - сульфатов - 20-22%. Фукоидан как в большой, так и в малой дозах стимулирует фагоцитарную и бактерицидную активность нейтрофилов, обладает иммуностимулирующим действием [Патент RU 2247574 С2]. Недостаток указанного средства - в невысокой биологической доступности фукоидана; отсутствии точного перечня вспомогательных веществ для получения лекарственных форм фукоидана, у отдельных пациентов может обнаружиться индивидуальная непереносимость к некоторым его компонентам (вспомогательным веществам).
Существует фармацевтическая композиция для стимуляции и активации остеогенеза, включающая фукоидан в качестве активного ингредиента, и используемая в виде таблеток, капсул, порошка или гранул [Заявка US 20110301119 А1]. Недостаток указанной композиции - в невысокой биологической доступности фукоидана; отсутствии точного перечня вспомогательных веществ для получения лекарственных форм фукоидана, у отдельных пациентов может обнаружиться индивидуальная непереносимость к некоторым его компонентам (вспомогательным веществам).
Известна композиция и способ ее получения для использования в качестве биодобавки, получаемая из одного или нескольких природных полисахаридов (в т.ч. фукоидана) и пробиотических бактерий [Патент US 9415056 В2]. Композиция может использоваться в виде порошка, капсул, желатиновых капсул, таблеток. Недостатком данной композиции является невысокая биологическая доступность фукоидана.
Известен способ получения средства, обладающего антикоагулянтной активностью, путем комплексной переработки фукуса пузырчатого (Fucus vesiculosus) с получением сухого экстракта фукуса и мази на его основе, обладающей антикоагулянтным действием [Патент RU 2506089 С1, дата публикации: 10.02.2014]. Недостатком данного средства является то, что на основе экстракта предложено получать только лекарственную форму для наружного применения.
Таким образом, фукоидан предложено использовать в виде различных лекарственных форм для лечения различных заболеваний. Учитывая широкий спектр патологий, для лечения которых может использоваться фукоидан, а также то, что препараты на его основе могут использоваться не только в стационаре, но и в амбулаторной практике для длительного приема пациентами, разработка пероральных форм фукоидана представляется наиболее актуальной. Известно, что фукоидан при пероральном применении обладает достаточно низкой биодоступностью [Fitton J.H., Stringer D.N., Karpiniec S.S. Therapies from fucoidan; an update. Mar. Drugs. 2015; 13: 5920-5946; Nagamine Т., Nakazato Т., Tomioka S. et al. Intestinal absorption of fucoidan extracted from the brown seaweed, Cladosiphon okamuranos. Mar. Drugs. 2014; 13(1): 48-64], что делает необходимым вести разработку препаратов на его основе с учетом этого факта, обращая пристальное внимание на необходимость увеличения всасывания в желудочно-кишечном тракте.
Большинство из известных композиций с фукоиданом для перорального применения являются комплексными, предлагаются к использованию в качестве биологически активных добавок к пище, состав и технология получения этих композиций, как правило, не учитывает низкую биодоступность фукоидана при его пероральном введении, что может снижать эффективность фукоидана.
Известен способ повышения пероральной биодоступности биологически активных сульфатированных полисахаридов (БАСП), в т.ч. фукоидана, путем предотвращения десульфатирования и характеризующийся тем, что БАСП смешивают с блок-сополимером полиэтиленоксида и полипропиленоксида (блок-сополимер ПЭО/ППО) [Патент RU 2421230 С2]. Раствор блок-сополимера ПЭО/ППО предварительно облучают ионизирующим излучением (используют тормозное γ-излучение, поток ускоренных электронов, ультрафиолетовое излучение). В качестве блок-сополимера ПЭО/ППО используют блок-сополимеры с молекулярной массой 1100-14600 Да и разными значениями гидрофильно-липофильного баланса (ГЛБ). Недостатком данного способа является необходимость использования ионизирующего излучения, что потребует дополнительного специального оборудования и защиты от ионизирующего излучения при внедрении технологии на производстве.
Фармацевтическая композиция для перорального применения, как и известные, выполнена в виде таблеток, характеризуется наличием фукоидана в качестве действующего вещества и вспомогательных веществ.
Технической проблемой изобретения является получение стабильного при хранении препарата фукоидана для перорального введения.
Техническим результатом изобретения является создание композиции для перорального применения, выполненной в виде таблеток, обеспечивающей повышенную биологическую доступность фукоидана.
Технический результат по первому пункту формулы достигается тем, что в качестве вспомогательных веществ композиция содержит следующие компоненты при их соотношении, мас. %:
Фукоидан 33-37
Наполнители 50-60
Смесь разрыхлителей 4,0-10,0
Глиданты 0,5-10
Лубриканты 0,5-1.
Технический результат достигается также тем, что для создания композиции наполнитель выбирают из ряда: глюкоза, лактоза, манноза, сахароза, микрокристаллическая целлюлоза, крахмал, декстрин, кальция фосфат двузамещенный, ксилитол, маннитол или их смеси. В качестве наполнителя могут использовать микрокристаллическую целлюлозу и лактозу в соотношении 20:1. В качестве разрыхлителей (дезинтегрантов) используют смесь кроскармеллозы натрия с капиллярным механизмом действия и нерастворимого набухающего в воде кросповидона. В качестве глидантов выбирают из ряда: крахмал, аэросил, тальк или их смеси. В качестве лубрикантов выбирают из ряда: стеараты или стеарил фумараты натрия, кальция и магния, кислота стеариновая, полиэтиленгликоль с молекулярной массой 4000 Да или 6000 Да, или их смеси.
Способ получения композиции, заявленной в данном изобретении, включает последовательное смешивание наполнителей со смесью разрыхлителей и глидантом, добавление фукоидана, увлажнение полученной смеси, влажное гранулирование, сушку при температуре 40-45°С, повторное гранулирование, опудривание лубрикантами, таблетирование.
Субстанция фукоидана представляет собой коричневый мелкодисперсный порошок горького вкуса, обладающий плохой сыпучестью и сжимаемостью. При производстве таблеток для перорального применения необходимо вводить в состав таблетмассы вспомогательные вещества с целью улучшения ее сыпучести и прессуемости, а также снижения времени распадаемости получаемых таблеток, увеличения всасывания.
Представленный состав и соотношение фукоидана и вспомогательных веществ: фукоидан 33-37%, наполнители 50-60%, смесь разрыхлителей 4,0-10,0%, глиданты 0,5-10%, лубриканты 0,5-1% от массы таблетки, обладает достаточными технологическими и структурно-механическими свойствами, является оптимальным, что подтверждают представленные примеры. Использование смеси двух разрыхлителей, кроскармеллозы натрия и кросповидона, обладающих разными механизмами действия, со смесью микрокристаллической целлюлозы с лактозы, в качестве наполнителя, обеспечивают минимальное время распадаемости. Введение лубриканта стеарилфумарата натрия, благодаря его гидрофильным свойствам, также способствует ускорению дезинтеграции таблетки, увеличению всасывания.
Соотношение и последовательность смешения компонентов композиции, заявленные в способе, а также наличие стадии влажной грануляции, повышают сыпучесть субстанции, позволяют получить таблетки с достаточно высокой дозировкой фукоидана - 250 мг, обладающие высокой биодоступностью. Сушка гранул при 40-45°С обеспечивает сохранение активности фукоидана.
Подтверждение возможности получения данным способом заявленного технического результата - создание композиции для перорального применения, выполненной в виде таблеток, обеспечивающей повышенную биологическую доступность фукоидана, приводится в следующих конкретных примерах и иллюстрируется с помощью фигур.
На фиг. 1 изображена кривая, описывающая высвобождение фукоидана из таблеток в среды, имитирующие различные участки желудочно-кишечного тракта: рН 1.2 и рН 5.7;
на фиг. 2 - кривая «концентрация-время» фукоидана после однократного внутрижелудочного введения крысам исследуемого препарата в различных дозах (, n=5);
на фиг. 3 - тканевая доступность фукоидана после однократного внутрижелудочного введения крысам исследуемого препарата в дозе 100 мг/кг;
на фиг. 4 - влияние многократного перорального введения исследуемых препаратов на анти-Ха активность, IU/мл, (М±m, n=6).
Пример 1
К лактозе (5,00 г) прибавляют кросповидон (10,00 г), кроскармеллозу натрия (8,00 г), кремния диоксид коллоидный (2,00 г), перемешивают, добавляют фукоидан (74,87 г), перемешивают, прибавляют микрокристаллическую целлюлозу (102,57 г), перемешивают. К полученной смеси компонентов при перемешивании добавляют 47 мл воды очищенной. Влажную смесь протирают через гранулятор с диаметром отверстий 3 мм. Сушку влажных гранул проводят в сушильном шкафу при температуре 40-45°С до остаточной влажности 1,0-1,5%. Высушенные гранулы протирают через гранулятор с отверстиями диаметром 1,0 мм. К сухим гранулам добавляют стеарил фумарат натрия (1,0 г), перемешивают. Опудренный гранулят используют для получения таблеток массой 700,0 мг, диаметром 13 мм, с риской и фаской.
Пример 2
Следовали методике примера 1, но вместо стеарил фумарата натрия использовали стеарат магния.
Пример 3
Следовали методике примера 1, но вместо аэросила использовали тальк.
Пример 4
Следовали методике примера 1, но вместо лактозы использовали кальция фосфат двузамещенный.
Пример 5
Биофармацевтическая оценка таблеток фукоидана
Проводили биофармацевтическую оценку таблеток, приготовленных по методике, описанной в примере 1, в тесте растворение.
В тесте растворения использовали среды растворения, имитирующие условия, создающиеся в желудочно-кишечном тракте: 0,1М кислота хлористоводородная с рН 1,2 (условия желудка) и вода с рН 5,7 (условия тонкого кишечника). Эксперименты проведены в двукратной повторности.
Полученные результаты приведены на фиг. 1.
К 45 минуте эксперимента при рН 1,2 и рН 5,7 высвобождается около 73% и 80% действующего вещества соответственно, дальнейшего высвобождения фукоидана практически не наблюдается. Процесс высвобождения фукоидана из таблеток описывается уравнением кинетики первого порядка, R2 составило 0.9778 и 0.9549, соответственно, что позволяет сделать вывод, что высвобождение фукоидана определяется скоростью разрушения матрицы таблетки.
Пример 6
Фармакокинетические свойства при однократном и многократном внутрижелудочном введении крысам.
Фармакокинетические профили фармакологического средства в крови при его внутрижелудочном введении должны быть охарактеризованы такими параметрами, как максимальная концентрация (Сmах), время достижения максимальной концентрации (Тmах), площадь под кривой «концентрация-время» (AUC), среднее время удерживания (MRT), период полувыведения (Т1/2) и показатель скорости всасывания Cmax/AUCt. Параметры фармакокинетики рассчитаны внемодельным методом - методом статистических моментов, т.к. при камерном подходе могут получаться различные фармакокинетические параметры, что в значительной степени может повлиять на результаты исследований.
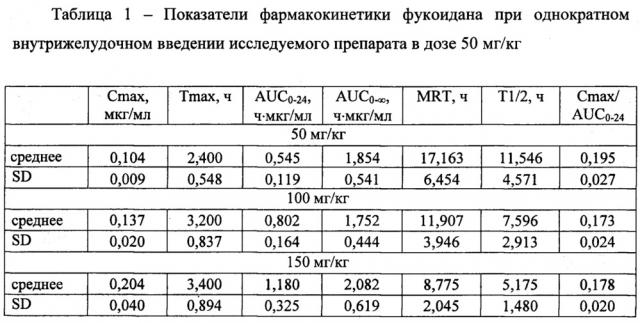
Изучение фармакокинетики раствора, приготовленного по примеру 1, проводили на взрослых аутбредных крысах-самцах при однократном введении на трех уровнях доз - 50, 100 и 150 мг/кг. Отбор крови проводили через 0.5, 1, 2, 3, 4, 5, 6, 8, 24 ч, для каждой дозы на каждой временной точки было использовано по 5 крыс. Количественное содержание функционально-активного фукоидана определяли с помощью хромогенного (оптического) метода определения анти-Ха активности. Метод основан на способности комплекса антитромбина III нейтрализовать активированный фактор Ха. Методика количественного определения была предварительно валидирована.
Установлено, что кинетика обнаружения фукоидана в плазме крови после введения исследуемого препарата в различных дозировках носит схожий характер. Максимальная концентрация действующего вещества в плазме крови наблюдалась в интервале 2-4 часа. Далее наблюдается постепенное снижение концентрации фукоидана в плазме крови. К 8 часу эксперимента после введения препарата в дозе 50 мг/кг в плазме крови обнаружено около 15% от максимальной концентрации фукоидана, после введения препарата в дозах 100 и 150 мг/кг - около 50%. Через 24 часа фукоидан в плазме крови не был обнаружен ни в одной группе (Фиг. 2).
Установлено, что после однократного введения препарата на основе Фукоидана на трех уровнях доз фармакокинетика препарата является линейной в диапазоне доз 50-150 мг/кг. Основной параметр, характеризующий степень биологической доступности препарата, AUC0-t, а также максимальная концентрация Сmах имеют статистически значимые отличия в зависимости от вводимой дозы. Среднее время удержания препарата (MRT) период полувыведения (T1/2) не имеют статистически значимых отличий при изменении дозы препарата и составляют соответственно 8,8-17,2 ч и 5,2-11,5 ч для крыс, в зависимости от вводимой дозы препарата (таблица 1). Абсолютная биодоступность фукоидана из исследуемого препарата составила 7,4%.
После введения препарата на основе Фукоидана действующее вещество интенсивно распределяется в органы с различной степенью васкуляризации (Фиг. 3). Наиболее интенсивное распределение фукоидана наблюдается в сильно васкуляризированные органы (почки, селезенка, печень), и более низкое в умеренно и слабо васкуляризированные органы (мышцы и сальник соответственно). Для слабо васкуляризированных органов тканевая доступность препарата наименьшая. После введения препарата на основе Фукоидана наибольшая концентрация действующего вещества наблюдается в почках.
После введения препарата на основе Фукоидана с мочой выводится около 0,13%, с калом - около 0,02% действующего вещества в неизменном виде.
Многократное введение препарата в течение 5 дней в дозе 100 мг/кг крысам не привело к значимой кумуляции действующего вещества. Статистически значимых различий основных фармакокинетических параметров после однократного и многократного введения препарата не установлено.
Пример 7. Оценка антикоагулянтной активности
В качестве биологической тест-системы использовали кроликов, композицию по примеру 1 вводили многократно перорально, в трех экспериментальных дозах, референтный препарат Сулодексид вводили перорально, в одной дозе. Контрольной группе вводили раствор носителя. Забор крови у кроликов для исследования системы гемостаза проводили до введения препаратов, через 1 час после введения на 1-й, 3-й, 7-й и 10-й дни исследования. В образцах полученной от животных крови определяли показатели: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), тромбиновое время (ТВ), анти-Ха активность и скорость агрегации тромбоцитов. До введения препаратов и на 10-й день исследования определяли время кровотечения по Сухареву.
Исследование антикоагулянтной активности под влиянием фукоиданов in vivo показало дозозависимое пролонгирование времени свертывания крови в ТВ-тесте (Табл. 2) и анти-Ха активности (фиг. 4; где 1 - отличия от исходного уровня исследуемого показателя, тест Фишера, р<0,05; 2 - отличия от контрольной группы в определенной точке забора крови, тест Фишера, р<0,05;), сравнимые с действием препарата сравнения сулодексидом в дозе 80 ЛЕ/кг.
Примечания: * - отличия от исходного уровня исследуемого показателя, тест Фишера, р<0,05; #- отличия от контрольной группы в определенной точке забора крови, тест Фишера, р<0,05.
Оценка времени кровотечения, выполненная по методу Сухарева, показала достоверное увеличение данного показателя на 10-й день исследования в группах, получавших композицию в дозе 100 мг/кг и сулодексид в дозе 80 ЛЕ/кг. В группах, получавших композицию в дозах 20 мг/кг и 50 мг/кг, отмечали тенденцию к увеличению времени полного свертывания (Табл. 3).
Примечание: * - отличия от контрольной группы, тест Фишера.
Способ является простым, технологичным, полученная композиция и ее лекарственная форма обеспечивают биодоступность фукоидана, достаточную для создания необходимой терапевтической концентрации действующего вещества в плазме крови.
Таким образом, заявленное изобретение обеспечивает достижение указанного технического результата, а именно создание композиции для перорального применения, выполненной в виде таблеток, обеспечивающей повышенную биологическую доступность фукоидана.
1. Композиция для перорального применения, выполненная в виде таблеток, проявляющая антикоагулянтную активность и обеспечивающая повышенную биологическую доступность, характеризующаяся наличием фукоидана в качестве действующего вещества и вспомогательных веществ, отличающаяся тем, что в качестве вспомогательных веществ содержит следующие компоненты при их соотношении, мас.%:
| Фукоидан | 33-37 |
| Наполнители | 50-60 |
| Смесь разрыхлителей | 4,0-10,0 |
| Глиданты | 0,5-10 |
| Лубриканты | 0,5-1 |
2. Композиция по п. 1, отличающаяся тем, что для ее создания наполнитель выбирают из ряда: глюкоза, лактоза, манноза, сахароза, микрокристаллическая целлюлоза, крахмал, декстрин, кальция фосфат двузамещенный, ксилитол, маннитол или их смеси.
3. Композиция по п. 1, отличающаяся тем, что для ее создания в качестве наполнителя используют микрокристаллическую целлюлозу и лактозу в соотношении 20:1.
4. Композиция по п. 1, отличающаяся тем, что для ее создания в качестве разрыхлителей используют смесь кроскармеллозы натрия и кросповидона.
5. Композиция по п. 1, отличающаяся тем, что для ее создания в качестве глидантов выбирают из ряда: крахмал, аэросил, тальк или их смеси.
6. Композиция по п. 1, отличающаяся тем, что для ее создания в качестве лубрикантов выбирают из ряда: стеараты или стеарил фумараты натрия, кальция и магния, кислота стеариновая, полиэтиленгликоль с молекулярной массой 4000 Да или 6000 Да, или их смеси.
7. Способ получения композиции по пп. 1-6, включающий последовательное смешивание наполнителей со смесью разрыхлителей и глидантом, добавление фукоидана, увлажнение полученной смеси, влажное гранулирование, сушку при температуре 40-45°C, повторное гранулирование, опудривание лубрикантами, таблетирование.