Сульфопроизводные α-пинена
Иллюстрации
Показать всеИзобретение относится к сульфопроизводным α-пинена, включая их гидраты, сольваты и соли, формулы (I),
где R - радикал пиненовой структуры
R1 - SR; ОН или ;
где звездочкой обозначена связь, через которую осуществляется присоединение к сульфогруппе соединений формулы (I), являющихся биологически активными веществами и полупродуктами в органическом синтезе для получения биологически активных сульфамидов, сульфо- и сульфинхлоридов, эфиров пиненовой структуры. Технический результат - расширение арсенала новых терпеновых сульфопроизводных заданной структуры, востребованных в органическом синтезе биологически активных соединений. 2 пр.
Реферат
Изобретение относится к получению сульфопроизводных α-пинена, в частности миртенсульфокислоты и димиртенилтиолсульфоната.
Сульфокислоты, тиолсульфонаты и их производные используются в качестве полупродуктов в органическом синтезе, в производстве некоторых химико-фармацевтических препаратов. Тиолсульфонаты известны как биологически активные соединения, обладают бактерицидной и фунгицидной активностями [D.R. Hogg. In Comprehensive Organic Chemistry, Vol. 3, Sulphur Compounds. (Eds. D. Barton, W.D. Ollis). Pergamon Press: Oxford (1979)].
Монотерпеноиды являются биологически активными соединениями природного происхождения, обладают бактерицидным, обезболивающим и отхаркивающим действиями. В работе [Л.Е. Никитина, Н.П. Артемова, В.А. Старцева, Природные и тиомодифицированные производные: монография. - Germany: LAP LAMBERT, 2012, 168 с.] описаны данные о противогрибковой активности терпенов, терпеновых спиртов и сульфидов. Показано, что в ряду терпен-спирт-сульфид противогрибковая активность повышается, однако применение сульфидов ограничивается ввиду высокой токсичности. Введение в структуру терпена сульфогруппы позволяет снизить токсичность и повысить растворимость в воде, сохранив при этом биологическую активность. Так, сульфокамфорная кислота используется в производстве лекарственных препаратов, обладающих коронарорасширяющей способностью, антибактериальной активностью, болеутоляющим свойством (сульфокамфокаин, полусинтетические пенициллины и цефалоспорины).
Однако в литературе недостаточно информации о терпеновых сульфокислотах и, особенно, тиолсульфонатах, так как их получение известными способами сульфирования затрудняется многочисленными перегруппировками и осмолением в ходе реакции. Известно некоторое количество терпеновых сульфокислот: карановой [Myslinski Е., Michalek Е. Roczniki Chemii, 1973, 47(2), 285], ментановой [Traynor, Kane, Betkouski, Hirshy. J. Org. Chem., 1979, 44, 1557], изоборнановой и пинановой структур [Лезина О.М., Гребенкина О.Н., Судариков Д.В., Крымская Ю.В., Рубцова С.А., Кучин А.В. ЖОрХ. 2015, 57 (10), 1391].
Аналогов получения заявленных монотерпеновых сульфокислоты и тиолсульфоната выявлено не было.
Задачей настоящего изобретения является синтез новой монотерпеновой сульфокислоты и соответствующего тиолсульфоната, полученных эффективным способом.
Технический результат заключается в расширении арсенала новых терпеновых сульфопроизводных заданной структуры, востребованных в органическом синтезе биологически активных соединений, и в расширении областей применения исходных веществ.
Технический результат достигается получением сульфопроизводных α-пинена структурной формулы (I), в частности, димиртенилтиолсульфоната (RSO2SR) и соответствующей сульфокислоты (RSO3H), включая ее гидраты, сольваты и фармацевтически приемлемые соли:
где R - радикал пиненовой структуры
R1 - SR; ОН или ;
где звездочкой обозначена связь, через которую осуществляется присоединение к сульфогруппе соединений формулы (I), являющихся биологически активными веществами и полупродуктами в органическом синтезе для получения биологически активных сульфамидов, сульфо- и сульфинхлоридов, эфиров пиненовой структуры.
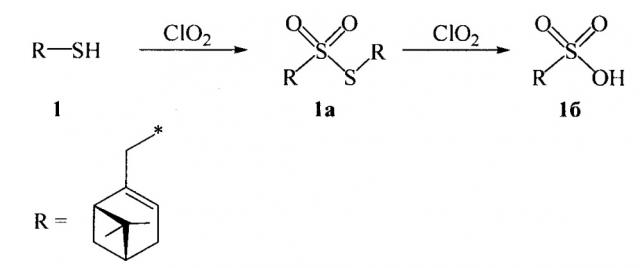
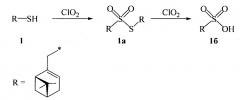
Получение димиртенилтиолсульфоната 1а (схема 1) и соответствующей сульфокислоты 1б осуществляется окислением миртентиола 1 в водно-органическом растворителе диоксидом хлора путем добавления к раствору тиола водного или органического раствора диоксида хлора при мольном соотношении реагентов, равном 1:1÷5 соответственно, при температуре от 0 до 30°С.
Схема 1. Окисление миртентиола
Растворитель для приготовления раствора исходного тиола выбирают из группы спиртов, простых эфиров, алифатических углеводородов, галогенированных алифатических углеводородов, азотсодержащих растворителей; растворитель для экстракции диоксида хлора выбирают из группы галогенированных алифатических углеводородов, простых эфиров, алифатических углеводородов, азотсодержащих растворителей, спиртов или воду.
В качестве исходного субстрата брали оптически чистый тиол 1 ([α]D22 - 46.5 (с 0.1, ЕtOН) (ср. лит.: [α]D22 - 42.6 (с 0.4, СНСl3)), полученный по методике [A. Gadras, J. Dungues, R. Calas, G. Deleris. Regiospecific two-step synthesis of optically active allylic terpenyl thiols // J. Org. Chem., 1984, v. 49, p. 442].
Водный раствор диоксида хлора (СlO2) - промышленный продукт, концентрацию которого определяли титрованием по известной методике [Т.А. Туманова, И.Е. Флис. Физико-химические основы отбелки. М.: Лесная промышленность, 1972, 236].
Способ позволяет получить целевые продукты в одну стадию с сохранением структуры терпенового фрагмента исходного тиола с высоким выходом. Для подбора оптимальных условий синтеза тиолсульфоната 1а и кислоты 1б варьировались природа растворителя, соотношение тиол : диоксид хлора и время реакции. Нами были опробованы такие растворители, как вода, пиридин, дихлорметан, метанол, гексан. Соотношение тиол : диоксид хлора изменялось от 1:0.5 до 1:5, время реакции - от 1 до 4 ч.
Оптимальными являются условия при использовании в качестве растворителя для получения сульфокислоты - пиридин или диметилформамид, для тиолсульфоната - ацетонитрил, а для диоксида хлора - воду при соотношении субстрат : реагент, равном 1:2÷1:3. Использование данных условий приводит к повышению выхода сульфокислоты до 74% (от теоретического), а тиолсульфоната - до 85%. Реакция протекает при комнатной температуре (18-27°С) в течение короткого промежутка времени (1 ч).
ИК спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в тонком слое. Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в растворах CDCl3 (внутренний стандарт - сигнал хлороформа) и D2O с добавлением 4,4-диметил-4-силапентан сульфоната натрия (DSS) в качестве внутреннего стандарта. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1Н-1Н COSY, 1Н-1Н NOESY) и гетероядерных экспериментов (1H-13C HSQC, НМВС). Масс-спектры регистрировали на высокоэффективном жидкостном хроматографе с масс-селективным детектором Thermo finnigan LCQ Fleet (растворитель - CH3OH). Детектирование проводили по положительным и отрицательным ионам.
Получение новых соединений показано на следующих примерах.
Пример 1.
Для получения S-((1R,5S)-6,6-Диметил(бицикло[3.1.1]гепт-2-ен-2-ил)метил)-(1R',5S')-6',6'-диметил(бицикло[3.1.1]гепт-2'-ен-2'-ил)метансульфонотиоата 1а растворяли тиол 1 в CH3CN. Добавляли к нему водный раствор СlO2 в мольном соотношении субстрат : окислитель, равном 1:2/3. Перемешивали в течение 1 ч. Растворитель выпаривали. Сухой остаток делили методом колоночной хроматографии. Выход 85%. - 3.7° (с 0.2; СНСl3). ИК спектр (KBr, v, см-1): 1325, 1128 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.85 с (3Н, Н9'), 0.91 с (3Н, Н9), 1.15-1.31 м (2Н, Н7α, Н7α'), 1.33 с (6Н, H8, H8'), 2.09-2.19 м (2Н, Н5, Н5'), 2.24 д (1Н, Н1', J 5.2 Гц), 2.27-2.54 м (7Н, Н1, Н7β, Н7β', H4α, H4α', H4β, H4β') 3.70-3.79 м (1Н, H10α'), 3.82-3.91 м (1Н, Н10β'), 3.97 к (2Н, H10α,β, J 11.5 Гц), 5.65 с (1Н, H3'), 5.81 с (1Н, H3). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.09 (С9'), 21.21 (С9) 26.05 (С8, С8'), 31.45 (С7'), 31.74 (С7), 31.88 (С4'), 32.03 (С4), 38.23 (С6), 40.06 (С5'), 40.31 (С5), 42.78 (С10'), 45.15 (С1'), 46.20 (С1), 70.20 (С10), 123.33 (С3'), 129.76 (C3), 135.96 (С2'), 140.95 (С2). Найдено, %: С 64.69; Н 8.21; S 17.35. C20H30O2S2. Вычислено, %: С 65.53; Н 8.25; S 17.49.
Пример 2.
Для получения ((1S,5R)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)метансульфоновой кислоты 1б растворяли тиол 1 в пиридине или ДМФА. Добавляли к нему водный раствор СlO2 в мольном соотношении субстрат : окислитель, равном 1:2/3. Перемешивали в течение 1 ч. Реакционную смесь экстрагировали СНСl3 или СН2С12. Водную фазу дополнительно экстрагировали бензолом или гексаном для извлечения солей сульфокислоты, из остатка выпаривали растворитель. Содержание кислоты 1б в сухом остатке составляет 74%. ИК спектр (KBr, v, см-1): 1325, 1128 см-1 (SO2). Спектр ЯМР 1Н (D2O, δ, м.д.): 0.84 с (3Н, Н9), 1.21-1.34 м (1Н, Н7α), 1.26 с (3Н, H8), 2.11-2.19 м (2Н, Н1, Н5), 2.27-2.54 м (3Н, Н7β, H4α, H4β), 3.53-3.65 м (2Н, Я10α,β), 5.21 с (1Н, H3), 10.3 уш.с (1H, ОН). Спектр ЯМР 13С (D2O, δ, м.д.): 20.53 (С9), 25.67 (С8), 31.06, 31.34 (С7, С4), 38.23 (С6), 39.85 (С5), 45.67 (С1), 58.37 (С10), 124.66 (С3), 138.79 (С2). Масс-спектр (ESI, 5 кВ), m/z (Iотн (%)): 215.29 (100) [М-Н]-, 97.00 (48) [С7Н13].
Данные соединения представляют собой как самостоятельные потенциальные биологически активные соединения, так и субстраты для дальнейших модификаций с целью получения новых биологически активных соединений с заданными свойствами (схема 2).
Схема 2. Возможные превращения миртенсульфокислоты и тиолсульфоната.
где R - миртенил; R1 - SR, ОН; R2-R4 - алкил, гетерил.
Сульфопроизводные α-пинена, включая их гидраты, сольваты и фармацевтически приемлемые соли, структурной формулы (I)
где R - радикал пиненовой структуры ;
R1 - SR; ОН или ;
где звездочкой обозначена связь, через которую осуществляется присоединение к сульфогруппе соединений формулы (I), являющихся биологически активными веществами и полупродуктами в органическом синтезе для получения биологически активных сульфамидов, сульфо- и сульфинхлоридов, эфиров пиненовой структуры.