Способ получения препарата фолликулостимулирующего гормона из гипофизов животных
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к способу получения фолликулостимулирующего гормона из аденогипофизов животных. Способ получения фолликулостимулирующего гормона из аденогипофизов животных включает гомогенизацию аденогипофизов животных в буферном растворе в присутствии поверхностно активного вещества Твин-80, ультразвуковое воздействие на гомогенат в присутствии 70%-ного этанола с частотой 20-22 кГц и интенсивностью 5-10 Вт/см2 в течение 3-5 мин, освобождение от балластных белков, выделение, концентрирование гормона с использованием хроматографии и замораживание. Вышеописанный способ позволяет увеличить выход фолликулостимулирующего гормона с высокой биологической активностью. 3 табл., 3пр.
Реферат
Изобретение относится к ветеринарной медицине, в частности к получению гормональных препаратов, используемых для стимуляции половой функции у животных.
В настоящее время известен способ получения препарата фолликулостимулирующего гормона (ФСГ) из гипофизов животных путем их гомогенизации, экстракции и очистки гормона методом дифференциального растворения в растворах сернокислого аммония с концентрацией 56-58% от насыщения (а.с. СССР №413947. Авт. Волынский А.С. и др., 1974 г.).
Существует способ получения ФСГ из гипофизов животных, включающий измельчение, экстрагирование, ионообменную хроматографию и гелевую фильтрацию в присутствии катионообменника СМ-сефадекса при рН среды 5,6-5,7 (патент РФ №2053778. Авт. Романов Ю.Д. и др., 1996 г.).
Известны также способы получения гонадотропных препаратов «Овариотропин» (а.с. СССР №619188. Авт. Чистяков И.Я. и др., 1978 г.) и «Гравотадж» (а.с. СССР №1012913. Авт. Горев Э.Л. и др., 1983 г.).
Общим недостатком всех перечисленных выше способов является то, что они сложные в своем исполнении. При этом полученные препараты содержат много балластных веществ, поэтому имеют низкую биологическую активность.
Известны способы получения препарата ФГС из концентрата мочи женщин в период менопаузы (а.с. СССР №618113. Авт. Ассонова Н.К. и др., 1978 г.; Патент РФ №2059412. Авт. Джузеппе Арпайя и др., 1996 г.). Недостатком данных способов является то, что в качестве исходного сырья используется моча женщин, поэтому они непригодны для получения ФСГ животных.
Существует способ получения препарата ФСГ из аденогипофизов животных, включающий гомогенизацию, экстракцию, осаждение балластных белков, выделение гормона путем ультрафильтрации под давлением, очистку методом ионообменной хроматографии, очистку на мембране физиологическим раствором и отделением от катионита буферным раствором (патент РФ №2062619. Авт. Сеин О.Б. и др., 1996 г.). Недостатком указанного способа является низкий выход конечного продукта.
В качестве прототипа выбран способ получения препарата фолликулостимулирующего гормона из аденогипофизов животных (патент РФ №2438680. Авт. Сеин О.Б. и др., 2012 г.), который включает гомогенизацию, экстракцию, осаждение балластных белков, выделение и концентрацию гормона. При этом гомогенизацию аденогипофизов осуществляют в соотношении 1:6-7 в присутствии буферного раствора с рН 7,0-7,5, который содержит 0,89-0,90% натрия хлорида, 3,2-3,4% сернокислого аммония, 0,1% поверхностно-активного вещества (ПАВ) Твин-80 и воду. Полученный гомогенизат экстрагируют, центрифугируют и отделяют от сопутствующих (балластных) белков путем добавления сернокислого аммония, от которого затем освобождаются путем ультрафильтрации на мембране под давлением. После этого гормон очищают методом ионообменной хроматографии, отделяют от катионита буферным раствором и концентрируют путем замораживания смеси со скоростью 5°С/час.
Недостатком способа-прототипа является то, что при его использовании не происходит полной дезагрегации клеточной ткани аденогипофизов и выхода из нее фолликулостимулирующего гормона, вследствие чего уменьшается выход конечного продукта.
Техническая задача - увеличение выхода препарата ФСГ с высокой биологической активностью.
Решение технической задачи достигается способом, который предусматривает гомогенизацию аденогипофизов до однородной массы в буферном растворе с рН 7,0-7,5 в соотношении 1:6-7 и который содержит 0,89-0,90% натрия хлорида, 3,2-3,4% сернокислого аммония, 0,1% ПАВ Твин-80. В полученный гомогенизат вносят 70%-ный этанол до 1000 мл и подвергают ультразвуковому воздействию с частотой 20-22 кГц, интенсивностью 5-10 Вт/см2 в течение 3-5 мин. Полученную смесь центрифугируют при температуре 2-4°С до расслоения жидкости с образованием плотного осадка. В надосадочную жидкость (фугат) для освобождения от сопутствующих (балластных) белков и других гормонов гипофиза вносят сернокислый аммоний до 35-40% от насыщения и вновь центрифугируют до образования плотного осадка. Для отделения фугата от сернокислого аммония и концентрирования гормона его подвергают ультрафильтрации на мембране под давлением. Очищают гормон методом ионообменной хроматографии. С этой целью катионит КУ-2 предварительно обрабатывают в небольшом количестве физиологического раствора с рН 4,2-4,5 и затем прибавляют к нему сконцентрированный раствор гормона и перемешивают в течение 50-60 мин до полного связывания с катионитом. После этого катионит со связанным гормоном переносят на мембрану и отмывают от балластных белков физиологическим раствором с рН 4,2, до тех пор пока в промывной жидкости белок не обнаруживается. Отделяют гормон от катионита буферным раствором с рН 8,5-9,0. Для концентрации гормона полученную смесь подвергают постепенному замораживанию в рефрижераторе со скоростью 5°С/час. При замораживании растворимая фаза, содержащая ФСГ, находится в нижней части сосуда, и ее отделяют после размораживания раствора. Полученный препарат ФСГ представляет собой прозрачную жидкость с желтоватым оттенком, без запаха и примесей.
Указанные оптимальные соотношения используемых компонентов, режимы гомогенизации и ультразвукового воздействия подбирали экспериментальным путем. Выход за указанные оптимальные пределы сопровождался снижением биологической активности полученного препарата или нахождением ее на неизменном уровне.
Предлагаемый способ отличается от способа-прототипа тем, что применение ультразвукового воздействия обеспечивает более быстрое и полное проникновение буферного раствора во внутриклеточные структуры тканей аденогипофизов и ускоряет массообмен. При этом ультразвуковые волны вызывают кавитацию, разрушают клеточные мембраны и способствуют выделению компонентов клеточного матрикса, в том числе и фолликулостимулирующего гормона, в экстрагент.
Пример. В условиях мясокомбината с использованием специального гильотинного ножа получали гипофизы крупного рогатого скота и отделяли аденогипофизы (переднюю долю). К 100 г аденогипофизов добавляли 700 мл буферного раствора с рН 7,0, содержащего 6,3 г натрия хлорида, 23,8 г сернокислого аммония, 0,7 мл Твин-80, и гомогенизировали до однородной массы. В полученный гомогенизат добавляли 70%-ный этанол до объема 1000 мл и подвергали ультразвуковому воздействию с использованием ультразвукового процессора УЗП-125 с частотой 22 кГц, с интенсивностью 5 Вт/см в течение 5 мин. Затем полученную массу центрифугировали при температуре 2-4°С до расслоения жидкости с образованием плотного осадка. Для освобождения фугата от балластных белков и других гормонов гипофиза в него вносили сернокислый аммоний до 40% от насыщения и вновь центрифугировали до образования плотного осадка. Затем полученный фугат освобождали от сернокислого аммония и проводили концентрирование гормона, для этого его подвергали ультрафильтрации на мембране УАП-200 под давлением. Очищали гормон методом ионообменной хроматографии. С этой целью катионит КУ-2 предварительно обрабатывали в небольшом количестве физиологического раствора с рН 4,2, прибавляли к нему сконцентрированный раствор гормона и перемешивали в течение 60 мин до полного связывания с катионитом. Затем катионит со связанным гормоном переносили на мембрану и отмывали от балластных белков физиологическим раствором с рН 4,2, до тех пор пока в промывной жидкости белок не обнаруживался. Освобождали гормон от катионита буферным раствором с рН 8,5-9,0. Для концентрации гормона полученную смесь подвергали постепенному замораживанию в рефрижераторе со скоростью 5°С/час. После замораживания растворимая фаза, содержащая ФСГ, скапливалась в нижней части сосуда, отделяли ее после размораживания раствора. Полученный концентрированный препарат ФСГ в объеме 500-550 мл представлял собой прозрачную жидкость со слабовыраженным желтоватым оттенком, без запаха и примесей.
Стерильность полученного препарата определяли с использованием сред МПА и Эндо, а токсичность исследовали на лабораторных животных (мышах, крысах, морских свинках). Стандартизацию препарата проводили согласно требованиям ГОСТ Р 50667-94 (Гормоны гонадотропные. Общие технические условия) в сравнении с препаратом ФСГ-п (фирма Schering Corporation, USA), которая показала, что его биологическая активность составляла в 1 мл 60-65 ME (2,5-3,5 Armour Standart).
Расфасовывали изготовленный препарат в стеклянные флаконы по 50 мл, которые закрывали резиновыми пробками и обкатывали алюминиевыми колпачками. Срок годности препарата при температуре 2-5°С составлял 24 мес.
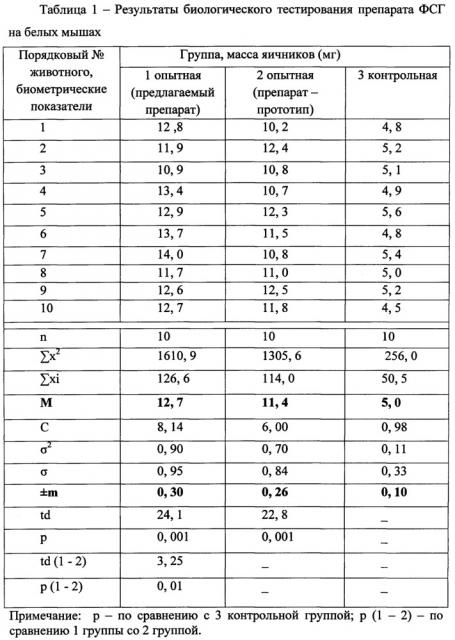
Биологическую активность изготовленного препарата ФСГ определяли на белых мышах и домашних животных. С этой целью было проведено три эксперимента.
Эксперимент 1. В условиях вивария Курской ГСХА было отобрано три группы инфантильных самок белых мышей-аналогов (по 10 голов в каждой) в возрасте 28-29 дней и массой 8,5-9,0 г.
Первой опытной группе в течение 3 дней вводили подкожно разработанный препарат ФГС в дозе 0,25 мл/гол. Одновременно с препаратом ФСГ каждой мышке вводили хорионический гонадотропин (ХГ) в дозе 10 ME (производитель ФГУП «Московский эндокринный завод»).
Второй опытной группе вводили препарат-прототип и ХГ в той же дозировке и кратности, что и животным первой опытной группы. Третья группа мышей являлась контрольной, им инъецировали стерильную дистиллированную воду. Через 72 часа мышей усыпляли, извлекали яичники и определяли их массу на торзионных весах. Массу яичников мышей опытных групп сравнивали с массой яичников контрольных животных и по полученной разнице судили о биологической активности препаратов.
Результаты биологического тестирования гормональных препаратов представлены в таблице 1, из данных которой следует, что у мышей 1 опытной группы после введения изготовленного препарата масса яичников была достоверно (р<0,001) больше по сравнению с животными контрольной и 2 опытной группой (р<0,01), это свидетельствует о более высокой биологической активности препарата ФСГ, изготовленного по предлагаемому способу.
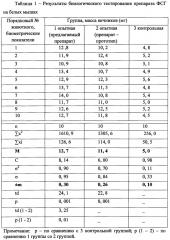
Эксперимент 2. В условиях учебно-опытного хозяйства Курской ГСХА по принципу аналогов было сформировано три группы клинически здоровых коров черно-пестрой породы (по 5 голов в каждой). Первую группу подвергали стимуляции изготовленным препаратом ФСГ. Вторую группу стимулировали препаратом-прототипом. Третью группу обрабатывали препаратом ФСГ-супер (производитель ООО «Агробиомед», Россия).
Обработку коров всех групп препаратами ФСГ проводили с 8 дня полового цикла по 5-дневной схеме в комплексе с 500 мг эстрофана (производитель фирма «Bioveta», Чехия). При этом дозировка препарата ФСГ подбиралась таким образом, чтобы она соответствовала по общей активности 2,5-3,5 Armour Standart. На 13-14 день полового цикла у коров выявляли половую охоту с использованием быка-пробника и проводили искусственное осеменение. На 20 день полового цикла осуществляли нехирургическое извлечение эмбрионов, проводили подсчет их количества с использованием специального устройства (Свидетельство на полезную модель РФ №18909, авт. О.Б. Сеин и др., 2001 г.) и оценивали по качеству согласно требованиям ГОСТ 28424 - 2014 (Эмбрионы крупного рогатого скота. Технические условия. - М.: Стандарт информ, 1915 г.).
Сравнительный анализ показал, что биологическая активность изготовленного препарата была выше, чем активность препарата-прототипа (табл. 2).
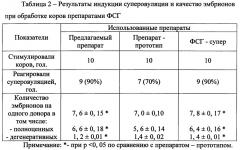
Эксперимент 3. В данном эксперименте использовали изготовленный препарат ФСГ и препарат-прототип для индуцирования полового созревания у ремонтных свинок.
В условиях свинокомплекса ЗАО «Любимовский» Курской области было отобрано три группы неполовозрелых свинок-аналогов 6-месячного возраста по 10 голов в каждой. Животные всех групп содержались в одном помещении и получали одинаковый рацион. Свинок первой опытной группы подвергали фронтальной обработке предлагаемым препаратом ФСГ в дозе 200 МЕ/гол. внутримышечно. Через 72 часа свинкам вводили 750 МЕ/гол. ХГ. Через 24 часа после стимуляции у свинок выявляли половую охоту с использованием хряка-пробника. Свинок второй опытной группы стимулировали препаратом-прототипом по той же схеме, что и животных первой опытной группы. Свинки третьей группы являлись контрольными, им инъецировали стерильную дистиллированную воду.
Результаты эксперимента показали, что после стимуляции предлагаемым препаратом ФСГ у свинок на 7-8 дней раньше наступало половое созревание по сравнению с животными, обработанными препаратом-протипом, и на 18-25 дней раньше по сравнению с контролем. При этом у большинства свинок, подвергавшихся стимуляции предлагаемым препаратом ФСГ, половозрелость появлялась в первые 10 дней после стимуляции, у свинок 2 и 3 групп она «растягивалась» на более продолжительный период (табл. 3).
Таким образом, предлагаемый способ препарата ФСГ из аденогипофизов животных позволяет увеличить выход препарата и повысить его биологическую активность по сравнению с препаратом-прототипом.
Способ получения фолликулостимулирующего гормона из аденогипофизов животных, включающий гомогенизацию аденогипофизов в буферном растворе в присутствии поверхностно-активного вещества Твин-80, освобождение от балластных белков, выделение и концентрацию гормона с использованием ультрафильтрации, хроматографии и замораживания, отличающийся тем, что полученный гомогенизат подвергают ультразвуковому воздействию в присутствии 70%-ного этанола с частотой 20-22 кГц и интенсивностью 5-10 Вт/см2 в течение 3-5 мин.