Средство для лечения глазных заболеваний и способ его применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, в частности к офтальмологии и фармацевтике, а именно к лекарственным средствам для офтальмологического применения. Средство для лечения глазных заболеваний содержит кальций-фосфатные наночастицы с покрытием, включающие активное вещество, и воду. Кальций-фосфатные наночастицы включают аморфную фазу, представляющую собой аморфный фосфат кальция, и кристаллическую структуру, представляющую собой брушит. Покрытие выполнено из хитозана. Наночастицы имеют гидродинамический радиус от 30 до 130 нм, заряд поверхности +16±4 мВ. рН водного раствора составляет 6,2-7,5. Средство может быть выполнено в виде лиофильно высушенного порошка. Полученное средство обладает пролонгированным действием. Новое средство инстиллируют в конъюнктивальную полость в эффективной концентрации 0,1-0,3%. Техническим результатом предлагаемой группы изобретений является возможность снижения дозы и частоты применения офтальмологического средства с уменьшением местных и системных побочных эффектов. 3 н. и 4 з.п. ф-лы, 1 ил., 6 пр., 8 табл.
Реферат
Область техники
Группа изобретений относится к медицине, в частности к офтальмологии и фармацевтике, а именно к лекарственным средствам для офтальмологического применения. В частности, изобретение относится к разработке лекарственного средства на основе кальций-фосфатных частиц, покрытых хитозаном, а также к способу его применения для лечения глазных заболеваний.
Уровень техники
Многие препараты для лечения глазных болезней применяют в виде глазных капель. Однако через роговицу во внутренние структуры глаза проникает лишь 1-5% лекарственного вещества [Achouri D., Alhanout К., Piccerelle Ph., Andrieu V. Recent advances in ocular drug delivery // Drug Development and Industrial Pharmacy. 2012. Early Online: 1-19]. После закапывания происходит быстрая и большая потеря лекарственного препарата вследствие его смыва с поверхности глаза слезой и при моргании [Rabinovich-Guilatt L., Couvreur P., Lambert G., Dubernet C. Cationic vectors in ocular drug delivery // Journal of Drug Targeting. 2004. V. 12. Р. 623-633]. Для попадания во внутренние структуры глаза лекарственное вещество должно проникнуть через роговицу, где наиболее трудно преодолимым барьером является эпителий роговицы. Плотно упакованные клетки многослойного эпителия работают как селективный барьер для низкомолекулярных веществ и препятствуют диффузии макромолекул. При этом длительность контакта лекарственного препарата с роговицей обычно составляет 5-25 мин [Gaikwad D.R., Sakarkar D.M., Kamble P.R., Ghuge G.R., Hattiambire K.P. Recent Advances In Ocular Drug Delivery Systems // Indo American Journal of Pharmaceutical Research. 2013. V. 3. I.4. P. 3216-3232], что сильно ограничивает эффективность действия водных растворов лекарственных средств.
В последние 20 лет появляется все больше работ, в которых предлагается использование более эффективных систем для доставки офтальмологических препаратов в глаз. К ним, в первую очередь, стоит отнести: использование комплексов лекарственных веществ с циклодекстринами [Saari К.М., Nelimarkka L., Ahola V., Loftsson T., Stefansson E. Comparison of topical 0,7% dexamethasone-cyclodextrin with 0.1% dexamethasone sodium phosphate for postcataract inflarnmation.// Graefe's Archive for Clinical and Experimental Ophthalmology. 2006. V. 244. P. 620-626], совместное применение офтальмологических препаратов с агентами, усиливающими проникновение лекарственных средств через биологические мембраны (ЭДТА, таурохолевая и каприновая кислоты) [Sasaki Н., Igarashi Y., Nagano Т., Nishida К., Nakamura J. Different effects of absorption promoters on corneal and conjunctival penetration of ophthalmic β-blockers.// Pharmaceutical Research. 1995. V.12. P.1146-1150], использование полимерных гелей [Khamar B.M. Ophthalmic formulation comprising a β blocker and carbopol. 2001. EP patent 1137407; Ludwig A. The use of mucoadhesive polymers in ocular drug delivery // Advanced Drug Delivery Reviews. V.57. P. 1595-1639], коллоидных систем, содержащих препарат, иммобилизованный на носителе. К последним относятся системы с лекарственными веществами, внедренными в липосомы [Shen Y., Tu J. Preparation and ocular pharmacokinetics of ganciclovir liposomes // AAPS Journal. 2007. V.9. P. 371-377] и наночастицы различной природы [Sahoo S.K, Dilnawaz F., Krishnakumar S. Nanotechnology in ocular drug delivery.// Drug Discovery Today. 2008. V. 13.N.3/4. P. 144-151].
При использовании наночастиц для доставки лекарственного препарата в глаз важны не только такие их свойства, как отсутствие токсичности, биосовместимость и биодеградируемость, но и способность легко проникать через барьер роговицы. Последнее свойство определяется природой частиц и такими характеристиками, как размер и поверхностный заряд (ζ-потенциал). Посредством пиноцитоза через клеточные мембраны способны проникать частицы размером 100-200 нм [Rabinovich-Guilatt L., Couvreur P., Lambert G., Dubernet C. Cationic vectors in ocular drug delivery // Journal of Drug Targeting. 2004. V. 12. Р. 623-633]. Ввиду отрицательного заряда поверхностного муцинового слоя слезной пленки, покрывающей роговицу, через нее лучше проходят положительно заряженные частицы, чем отрицательно заряженные [Liaw J., Rojanasakul Y., Robinson J.R. The effect of drugcharge type and charge density on corneal transport // International Journal of Pharmaceutics. 1992. V. 88. P. 111-124].
Известно использование в качестве носителей лекарственных веществ кальций-фосфатных наночастиц (CaPh-частицы), т.к. они нетоксичны, неиммуногенны и биодеградируемы. В настоящее время показана потенциальная возможность использования CaPh-частиц в биомедицине при фототерапии для лечения рака [Schwiertz J., Wiehe A., S., Gitter В., Epple M. Calcium phosphate nanoparticles as efficient carriers for photodynamic therapy against cells and bacteria. // Biomaterials. 2009. V. 30. P. 3324-3331.] и для создания эффективных вакцин [К. Viswanathan, V. P. Gopinath, Raj G.D. Formulation of Newcastle disease virus coupled calcium phosphatenanoparticles: An effective strategy for oculonasal delivery to chicken.// Colloids and Surfaces B: Biointerfaces. 2014. V. 116. P. 9-16]. Также предложено использовать CaPh-частицы в качестве агентов для трансфекции терапевтических полинуклеотидов в генной терапии (патент США №5460831, 24.10.1995). Однако в этом патенте отсутствуют сведения об использовании CaPh-частиц в качестве носителей для офтальмологических препаратов.
Известно применение CaPh-частиц в офтальмологии. Так, в ряде работ было описано использование CaPh-частиц, покрытых целлобиозой, содержащих блокаторы дофаминовых рецепторов [Не Q., Chu Т-С., Potter D. Biodegradable Calcium Phosphate Nanoparticles as a New Vehicle for Ocular Delivery of a Potential Ocular Hypotensive Agent // Journal of Ocular Pharmacology and Therapeutics. 2002. V. 18. P. 507-514], β-блокатор, тимолол [Шимановская E.B., Безнос О.В., Клячко Н.Л., Кост О.А., Никольская И.И., Павленко Т.А., Чеснокова Н.Б., Кабанов А.В. Получение кальций-фосфатных наночастиц, содержащих тимолол, и оценка их влияния на внутриглазное давление в эксперименте.// Вестник офтальмологии. 2012. №3. С. 15-18] и ингибитор ангиотензин-превращающего фермента (АПФ), лизиноприл [Никольская И.И., Шимановская Е.В., Кост О.А., Чеснокова Н.Б., Павленко Т.А., Безнос О.В., Биневский П.В., Клячко Н.Л., Кабанов А.В. Патент RU 2472471, 2013] для снижения ВГД, а также антиоксидант супероксиддисмутазу [Чеснокова Н.Б., Кост О.А., Никольская И.И., Безнос О.В., Галицкий В.А., Бейшенова Г.А., Клячко Н.Л., Кабанов А.В. «Способ лечения заболеваний глаз, сопровождающихся окислительным стрессом». // RU 2577236 С1, 10.03.2016]. Во всех этих работах в экспериментах in vivo показано усиление и пролонгация действия офтальмологических препаратов, включенных в частицы, по сравнению с их водными формами. Следует отметить, что эти частицы имели отрицательный заряд поверхности, вследствие чего можно сделать предположение, что эффект действия препаратов в подобных системах можно улучшить, используя частицы с положительным ζ-потенциалом.
Так, в качестве покрывающего агента для CaPh-частиц может быть использован положительно заряженный биосовместимый и биоразлагаемый биополимер - хитозан. Продукты деградации хитозана, такие как глюкозамин или N-ацетилглюкозамин, усваиваются в организме [Хитин и хитозан: природа, получение и применение.// Материалы проекта CYTEDIV.14: «Хитин и хитозан из отходов переработки ракообразных». Под ред. M.Sc. AnaPastordeAbram. Изд.: Российское хитиновое общество. 2010, 292 с.]. Важным свойством хитозана является его мукоадгезивность и способность увеличивать проникновение больших молекул через слизистые поверхности, а наноразмерные частицы на хитозановой основе способны преодолевать различные физиологические барьеры [Manjusha Rani, Anuja Agarwal, Yuvraj Singh N. Review: chitosan based hydrogel polymeric beads - as drug delivery system.//Bioresourses. 2010. V.5. No 4. P. 3550-3558; Da Silva SB., Ferreira D., Pintado M., Sarmento B. Chitosan-based nanoparticles for rosmarinic acid ocular delivery-In vitro tests.// Int. J. Biol. Macromol. //2015. V. 84. P. 112-120.; Menchicchi D., Fuenzalida JP., Bobbili КВ., Hensel A., Swamy MJ., Goycoolea FM. Structure of chitosan determines its interactions with mucin.// Biomacromol. 2014. V. 15. №10. P.:3550-3558], в том числе барьер роговицы [Salamanca A., Diebold Y., Calonge M., Garcia-Vazquez C., Callejo S., Vila A., Alonso M. Chitosan Nanoparticles as a Potential Drug Delivery System for the Ocular Surface: Toxicity, Uptake Mechanism and In Vivo Tolerance.// Investigative Ophthalmology & Visual Science. 2006. V. 47. P. 1416-1425.; Campos A., Diebold Y., EdisonL., Carvalho S., A., Alonso M. Chitosan Nanoparticles as New Ocular Drug Delivery Systems: in Vitro Stability, in Vivo Fate, and Cellular Toxicity.//Pharmaceutical Research. 2004. V. 21. P. 803-810].
В последнее время хитозан находит все более широкое применение в медицине при получении особо прочных пленок, волокон, микрокапсул и микросфер с включенными в них лекарственными веществами, ферментами, которые могут быть использованы при диагностике и лечении разнообразных заболеваний [Большаков И.Н. Инновационные аспекты применения хитозана в медицине // Рыбпром. 2010. Т. 2. С. 42-47]. Кроме того, также показано возможное использование хитозана в качестве покрывающего агента для частиц различной природы для применения в офтальмологии. Так, антибактериальный препарат даптомицин, применяемый для лечения эндофтальмита (гнойное воспаление тканей глазного яблока), вызванного метициллин-устойчивым золотистым стафилококком, оказался более эффективным при его включении в наночастицы на основе альгината, покрытых хитозаном [Costa JR., Silva NC., Sarmento В., Pintado M. Potential chitosan-coated alginate nanoparticles for ocular delivery of daptomycin.//Eur. J. Clin. Microbiol. InfectDis. 2015. V. 34. N. 6. P. 1255-1262]. Поликапролактоновые частицы с хитозановым покрытием показали как лучшее проникновение внедренного в них флюоресцентного красителя через роговицу по сравнению с непокрытыми частицами [Calvo P., Thomas С., Alonso M.J., Vila-Jato J.L., Robinson, J.R. Study of the mechanism of interaction of poly(ε-caprolactone) nanocapsules with the cornea by confocal laser scanning microscopy.// International Journal of Pharmaceutics. 1994, V. 55. P. 283-291; De Campos A.M., Sanchez A., Gref R., Calvo P., Alonso M.J. The effect of a PEG versus a chitosan coating on the interaction of drug colloidal carriers with the ocular mucosa.// European Journal of Pharmaceutical Sciences. 2003. V. 20. P. 73-81], так и более быструю адсорбцию на бычьем муцине при полном отсутствии адсорбции для непокрытых частиц [ Mazzarino L., L., P., Lemos-Senna E., Borsali R. On the mucoadhesive properties of chitosan-coated polycaprolactone nanoparticles loaded with curcumin using quartz crystal microbalance with dissipation monitoring.// Journal of Biomedical Nanotechnology. 2013. V. 9. P. 1-8]. Также положительный эффект сродства к слизистой оболочке глаза за счет использования хитозана в качестве покрывающего агента наблюдался для альгинат-хитозановых частиц [Ramesh С.Nagarwal, Rakesh Kumar, Pandit J.K. Chitosan coated sodium alginate-chitosan nanoparticles loaded with 5-FU for ocular delivery: In vitro characterization and in vivo study in rabbit eye.// European Journal of Pharmaceutical Sciences. 2012. V. 47. P. 678-685].
Таким образом, показано, что использование хитозана в качестве покрывающего агента открывает широкие возможности потенциального применения таких частиц в офтальмологии для доставки различных лекарственных препаратов во внутренние среды глаза. Преимуществом кальций-фосфатных частиц является то, что они обладают высокой биологической совместимостью, т.к. кальций и фосфат являются неотъемлемой частью костей и зубов млекопитающих, и их получают из водных растворов.
Ближайшим аналогом предлагаемого изобретения являются кальций-фосфатные наночастицы, покрытые целлобиозой, содержащие тимолол, предназначенные для снижения внутриглазного давления. Включение тимолола в кальций-фосфатные наночастицы пролонгировало гипотензивное действие тимолола на 1-3 часа. [Шимановская Е.В., Безнос О.В., Клячко Н.Л., Кост О.А., Никольская И.И., Павленко Т.А., Чеснокова Н.Б., Кабанов А.В. Получение кальций-фосфатных наночастиц, содержащих тимолол, и оценка их влияния на внутриглазное давление в эксперименте.// Вестник офтальмологии. 2012. №3. С. 15-18].
Раскрытие изобретения
Задачей настоящего изобретения является создание средства для лечения глазных заболеваний, обладающего более пролонгированным действием.
Техническим результатом предлагаемого изобретения является возможность снижения доз и частоты применения офтальмологических средств с уменьшением местных и системных побочных эффектов.
Технический результат достигается за счет получения CaPh-частиц, включающих активное вещество, покрытых хитозаном и введением в конъюнктивальную полость полученных частиц, имеющих заряд поверхности (+16±4), с радиусом от 30 до 130 нм в диапазоне концентраций 0,1%-3%.
Поставленная задача решается предлагаемым средством для лечения глазных заболеваний, включающим активное вещество и кальций-фосфатные наночастицы с покрытием, при этом в качестве наночастиц используют кальций-фосфатные частицы, в составе которых показано присутствие как аморфной фазы, представляющей собой аморфный фосфат кальция, так и кристаллической структуры, представляющей собой брушит, а покрытие выполнено из хитозана. Заявляемые наночастицы с покрытием имеют гидродинамический радиус от 30 до 130 нм, заряд поверхности +16±4 мВ, а рН раствора составляет 6,2-7,5.
Предпочтительно использовать хитозан, обладающий растворимостью при нейтральных значения рН.
Предпочтительно, что заявляемое средство дополнительно содержит целевые добавки.
Предпочтительно в качестве целевых добавок использовать буферные агенты, и/или 0,15 М хлористый натрий, и/или консерванты, и/или загустители.
Поставленная задача также решается средством для лечения глазных заболеваний, представляющим собой лиофильно высушенный порошок, полученный из вышеописанного водного раствора.
Также поставленная задача решается в способе лечения глазных заболеваний, включающем инсталляции в конъюнктивальную полость заявляемого средства в эффективном количестве. Частоту и длительность использования выбирают в зависимости от характера и степени выраженности заболевания.
Введение в состав заявляемого средства натрия хлорида и буфера проводят с целью создания комфортной для клеток конъюнктивы среды, не вызывающей их повреждения или чувства жжения в глазу.
Для заявляемого средства выбирается хитозан, обладающий растворимостью при нейтральных рН, а именно в диапазоне от 6,2 до 7,5.
В предлагаемом изобретении в качестве активного вещества могут быть использованы известные лекарственные средства в известных количествах, применяемые в офтальмологии по своему назначению. В качестве активного вещества могут быть использованы любые соединения, используемые для лечения глазных болезней в виде глазных капель [Рациональная фармакотерапия в офтальмологии: Рук. для практикующих врачей/ Е.А. Егоров, В.Н. Алексеев, Ю.С. Астахов и др.; под общ. ред. Е.А. Егорова. - М: Литтерра, 2004. - 954 с.].
Термин «лечение» в контексте изобретения следует понимать в широком смысле, в котором он означает улучшение течения заболевания, замедление прогрессирования заболевания, частичное или полное восстановление функций глаз или устранение патологического состояния, а также отдаление нежелательных последствий, вызванных патологическим состоянием.
Для получения CaPh-частиц использовали методику, описанную нами в работе [Шимановская Е.В., Никольская И.И., Биневский П.В., Безнос О.В., Клячко Н.Л., Павленко Т.А., Чеснокова Н.Б., Кост О.А. Лизиноприл в составе кальций-фосфатных наночастиц как перспективный антиглаукомный препарат // Российские нанотехнологии. 2014. Т. 9. №3-4. С. 100-106]. Исследование фазового состава частиц методом рентгеноспектрального микроанализа показало присутствие как аморфной фазы, представляющей собой аморфный фосфат кальция со строением Cax(PO4)y*zH2O, так и кристаллической структуры, представляющей собой гидратированную форму гидрофосфата кальция (брушит), со строением CaHPO4*2Н2О.
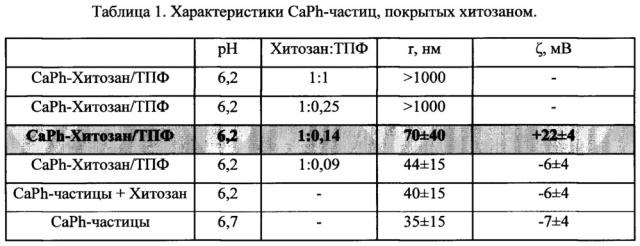
При покрытии частиц хитозаном использовался метод ионотропного гелеобразования, при котором необходимо добавлять вспомогательные реагенты, имеющие несколько отрицательно заряженных групп, например триполифосфат натрия (ТПФ) [Tiyaboonchai W. Chitosan Nanoparticles: A Promising System for Drug Delivery.// Naresuan University Journal. 2003. V.11. I.3. Р. 51-66]. В этом случае образование ионных мостиков происходит в результате взаимодействия отрицательно заряженных фосфатных групп ТПФ и положительно заряженных аминогрупп хитозана. В каждом конкретном случае в зависимости от природы и характеристик используемого хитозана необходимо подбирать соотношение ТПФ и хитозана, поскольку от этого зависят как размер, так и ζ-потенциал получаемых частиц. Были апробированы различные массовые соотношения хитозана (молекулярный вес 85 кДа и степень деацетилирования 89%) и ТПФ от 1:1 до 1:0,09 соответственно при фиксированной концентрации солей. В результате было подобрано оптимальное соотношение хитозан:ТПФ 1:0,14, при использовании которого образовывались частицы с положительным ζ-потенциалом +22 мВ.
Для CaPh-частиц с хитозановым покрытием с включенными лекарственными препаратами показана неизменность размера и ζ-потенциала как при хранении в растворе при 4°С, так и в лиофильно высушенном состоянии при -20°С в течение по крайней мере 3 месяцев. Частицы также остаются стабильными при их концентрировании в 20 раз.
Краткое описание чертежей
На фиг. 1 представлены данные по снижению ВГД при инсталляциях в глаза кроликов раствора тимолола и тимолола, включенного в CaPh-частицы, покрытые хитозаном. Показано среднее изменение ВГД после однократной инсталляции тимолола в частицах ( - опыт) и в водной форме ( - контроль). Области значений U-критерия Манна-Уитни: * - Uэмп≤U0,05 (различия достоверны), ** - Uэмп>U0,05 (различия недостоверны).
Осуществление изобретения
Представленные ниже примеры конкретного осуществления изобретения приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа по изобретению и не ограничивают заявляемое изобретение.
Значения рН раствора предлагаемого препарата, которые не вызывают местно-раздражающего действия, составляют от 6,2 до 7,5.
В качестве активно действующих веществ для демонстрации реализации заявляемого технического решения для включения в частицы были выбраны широко применяемый антиглаукомный препарат, тимолол и ингибитор ангитензин-превращающего фермента, лизиноприл, который также снижает внутриглазное давление (ВГД).
Способ осуществляют следующим образом.
Для приготовления растворов и включения в CaPh-частицы использовали субстанцию тимолола (Диафарм, Россия) и лизиноприла (Sigma, США). Лекарственные препараты включают в частицы на стадии их получения. К 4,55 мл 12,5 мМ раствора Na2HPO4 и 0,91 мл 15,6 мМ цитрата натрия добавляли необходимое количество лекарственного препарата (например, 1% лизиноприл, 0,5% тимолол), затем рН полученного раствора доводили до рН 6,7. После этого одновременно с включением ультразвукового гомогенизатора Bandelin Sonopuls (Германия) добавляли 4,55 мл 12,5 мМ раствора CaCl2. Озвучивание проводили в постоянном режиме в течение 30 минут при охлаждении. Затем полученные частицы покрывали хитозаном.
Проводят покрытие частиц, содержащих лекарственный препарат, хитозаном: к исходному раствору, содержащему CaPh-частицы, при комнатной температуре и при постоянном интенсивном перемешивании добавляли водный раствор хитозана (рН 6,8) с концентрацией 1 мг/мл в объемном соотношении исходный раствор: хитозан 2:1. Затем, не прекращая перемешивания, по каплям добавляли водный раствор триполифосфата натрия (ТПФ) фирмы «Acros» (США) с концентрацией 1 мг/мл при массовых соотношениях хитозана и ТПФ 1:0,14. После добавления ТПФ смесь оставляют перемешиваться на ночь при комнатной температуре.
Оценку эффективности включения лизиноприла или тимолола в CaPh-частицы, покрытые хитозаном, проводили следующим образом. Частицы, содержащие лекарственные препараты, отделяли от раствора фильтрацией через мембраны Microcon 30 кДа центрифугированием при 9000 g в течение 5 минут. В прошедшем через мембрану растворе количество несвязавшегося с частицами препарата оценивалось следующими методами. Для тимолола по оптической плотности его растворов при длине волны λ=295 нм. Коэффициент молярного поглощения тимолола ε295=6 300 М-1см-1 был определен нами из независимого эксперимента. Для лизиноприла по модифицированной методике [Svedas V., Galaev I., Borisov I., Berezin I. The interaction of amino acids with o-phtaldialdehide: a kinetic study and spectrophotometric assay of the reaction product.// Analytical Biochemistry. 1980. V. 101. P. 188-195], основанной на реакции взаимодействия свободной аминогруппы ингибитора с ортофталевым альдегидом и N-ацетил-L-цистеином с образованием хромофорного соединения с максимумом поглощения λmax=340 нм. Коэффициент молярного поглощения был определен из независимого эксперимента и составил ε340=6 650 M-1см-1.
Изучение кинетики десорбции лизиноприла и тимолола из частиц в экспериментах in vitro проводили следующим образом. На шесть мембран Microcon 30 кДа помещали по 0,5 мл раствора частиц с включенными в них препаратами и осаждали частицы центрифугированием при 9000 g в течение 5 минут. Затем объем над мембранами был одновременно доведен до первоначального (0,5 мл) 0,15 М раствором NaCl и суспензии инкубировали в течение 5, 10, 20, 30, 40, 60 мин при комнатной температуре, после чего каждый раствор вновь центрифугировали. Количество высвободившегося препарата определяли в фильтратах, как указано выше. Каждую серию экспериментов проводили не менее 3 раз.
Для экспериментов in vivo тимолол-содержащие CaPh-частицы, покрытые хитозаном, полученные в результате синтеза, были сконцентрированы в 10 раз на фильтрующих мембранах Microcon 30 кДа.
Для полученных частиц были определены размер, ζ-потенциал, процент внедрения препаратов.
Как показали проведенные эксперименты размер и ζ-потенциал частиц практически не изменяется. Полученное средство инсталлируют в конъюнктивальную полость в принятом для конкретного препарата режиме.
Глазные капли получали следующим образом. В химически чистый стерильный стакан помещали навеску 10 мг действующего вещества, вносили 3,2 мл деионизованной воды. Перемешивали на магнитной мешалке до полного растворения. Раствор имел бесцветную окраску. Затем проводили стерильную фильтрацию раствора через фильтры «Millipore» 0,22 мкм.
Адекватную модель глаукомы у животных воспроизвести невозможно, а имеющиеся модели глазной гипертензии не отражают процессы, протекающие при глаукоме. Поэтому для оценки гипотензивного действия различных препаратов принято использовать нормотензивных кроликов, поскольку физиологическое действие на них гипотензивных средств больше соответствует действию этих препаратов у больных глаукомой [Глушков Р.Г., Машковский М.Д., Бунин А.Я. и др. Антиглаукоматозное средство. Патент РФ A61F 9/00, №97105474/14 от 10.04.1999; Orihashi М, Shima Y, Tsuneki Н, Kimura I. Comparative study on the combined effects of bunazosin and nipradilol or timolol on intraocular pressure in normotensive rabbits // Jpn J Ophthalmol. 2005; 49(6):523-6].
Нами была проведена сравнительная оценка влияния на ВГД у нормотензивных кроликов CaPh-частиц, покрытых хитозаном с включенными препаратами, снижающих внутриглазное давление (β-адреноблокатор тимолол и ингибитор АПФ лизиноприл), как с водными растворами препаратов, так и с включенными в CaPh-частицы, покрытые целлобиозой. Предварительно было показано, что закапывание CaPh-частиц с этими двумя покрытиями без гипотензивной субстанции в глаза кроликов три раза в день в течение недели не приводит к изменению ВГД и не вызывает раздражения конъюнктивы и роговицы.
В работе было задействовано 15 кроликов (30 глаз) породы шиншилла, самцов, весом 2-2,5 кг. ВГД измеряли при помощи автоматического тонометра для ветеринарии Tonovet (Icare, Финляндия).
1) сравнение гипотензивного эффекта суспензии тимолол содержащих CaPh-частиц, покрытых хитозаном, таких же частиц, покрытых целлобиозой, и 0,5% раствора тимолола.
В серии было 3 группы по 5 кроликов:
группа, получавшая инсталляции раствора тимолола;
группа, получавшая инсталляции раствора CaPh-частиц, содержащих тимолол, покрытых хитозаном;
группа, получавшая инсталляции раствора CaPh-частиц, содержащих тимолол, покрытых целлобиозой;
2) сравнение гипотензивного эффекта раствора лизиноприл содержащих CaPh-частиц, покрытых хитозаном, таких же частиц, покрытых целлобиозой, и 2% раствора лизиноприла. Группы кроликов составлялись аналогично I серии.
Исследуемые вещества закапывали по 30 мкл в оба глаза с помощью дозатора. Каждую серию экспериментов воспроизводили трижды после двухнедельного перерыва.
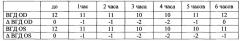
Серия 1. В группе животных, получавших инсталляции CaPh-частиц с тимололом, покрытых хитозаном, максимальное снижение ВГД наблюдалось через 4 ч и равнялось 3,17 мм против 2,25 мм для 0,5% раствора тимолола, т.е. максимальное снижение ВГД при включении тимолола в частицы, покрытые хитозаном, увеличивалось на 40,9% (р<0,05).
В группе животных, получавших инсталляции CaPh-частиц с тимололом, покрытых целлобиозой, максимальное снижение ВГД наблюдалось через 3 ч, равнялось 2,81 мм против 2,25 для 0,5% раствора тимолола, т.е. максимальное снижение ВГД при включении тимолола в частицы увеличивалось на 24,9% (р<0,05).
Через 6 ч в группе, получавшей тимолол, ВГД было ниже нормы на 1,2 мм, в группе, получавшей тимолол в CaPh-частицах, покрытых целлобиозой, - на 2 мм, а в группе, получавшей тимолол в CaPh-частицах, покрытых хитозаном, - на 2,33 мм.
При более длительном наблюдении (в течение 8 ч) в группе, получавшей инсталляции тимолола, включенного в CaPh-частицы, покрытые хитозаном, ВГД и через 8 часов оставалось достоверно ниже нормы в среднем на 1,33 мм (р<0,01), т.е. включение тимолола в CaPh-частицы, покрытые хитозаном, приводит к существенной пролонгации гипотензивного эффекта тимолола по сравнению с частицами, покрытыми целлобиозой.
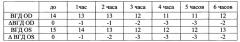
Серия 2. В группе животных, получавших инсталляции CaPh-частиц с лизиноприлом, покрытых хитозаном, максимальное снижение ВГД наблюдалось через 4 ч и равнялось 3,86 мм против 1,7 мм для 2% раствора лизиноприла, т.е. максимальное снижение ВГД при включении лизиноприла в частицы, покрытые хитозаном, увеличивалось более чем в 2 раза (р<0,05).
В группе животных, получавших инсталляции CaPh-частиц с лизиноприлом, покрытых целлобиозой, максимальное снижение ВГД наблюдалось через 3 ч и равнялось 2,45 мм против 1,7 мм для 2% раствора лизиноприла, т.е. включение лизиноприла в частицы, покрытые целлобиозой, увеличивало максимальное снижение ВГД на 44% (р<0,05).
В группе, получавшей раствор лизиноприла, ВГД через 6 ч оставалось на 1,4 мм ниже нормы, в группе, получавшей лизиноприл в CaPh-частицах, покрытых целлобиозой, - на 3 мм, а в группе, получавшей лизиноприл в CaPh-частицах, покрытых хитозаном, - на 3,5 мм (р<0,05).
Таким образом, включение эффективного и широко применяемого в медицине препарата для снижения ВГД тимолола в CaPh-частицы приводит к достоверному усилению и пролонгации его гипотензивного эффекта. При включении тимолола в CaPh-частицы, покрытые хитозаном, эффект усиления гипотензивного действия тимолола и его пролонгация существенно больше, чем при его включении в CaPh-частицы, покрытые целлобиозой. Более продолжительное и более сильное гипотензивное действие препарата позволяет применять его реже и в меньших концентрациях, что снижает вероятность возникновения побочных эффектов и улучшает качество жизни пациентов.
Пример №1. Кролик №3. Инсталляция 0,5% раствора тимолола.
До закапывания препарата кролику в течение двух недель ежедневно проводили измерение ВГД для того, чтобы приучить к процедуре, и для определения фоновых значений ВГД. Наши предварительные исследования показали, что парный глаз не может быть контрольным, потому что при закапывании гипотензивного препарата давление в парном глазу также несколько снижается. Во всех экспериментах ВГД после инсталляции исследуемого вещества сравнивали с его исходным значением (Δ ВГД). Инсталляции проводили с помощью автоматического дозатора в количестве 30 мкл в каждый глаз. После измерения исходного ВГД в оба глаза, начиная с правого, закапывали 0,5% раствор тимолола в фосфатном буфере. ВГД в обоих глазах измеряли через 1, 2, 3, 4, 5 и 6 часов после закапывания.
Как видно из приведенных данных, под влиянием инсталляции 0,5% раствора тимолола у кролика №3 ВГД снижалось в течение 5 часов на 2 мм рт. ст., через 6 часов ВГД практически нормализовалось.
Пример №2. Кролик №7. Инсталляция 0,5% тимолола в кальций-фосфатных частицах, покрытых целлобиозой, средний гидродинамический радиус частиц 80 нм. Метод исследования тот же, что в примере №1
После инсталляции 0,5% тимолола в частицах, покрытых целлобиозой, ВГД у кролика №7 было снижено в течение 5 часов на 3 мм рт. ст., а через 6 часов еще не достигало исходного уровня, и было ниже его на 2 мм рт ст.
Пример №3. Кролик №12. Инсталляция 0,5% тимолола в кальций-фосфатных частицах, покрытых хитозаном, средний радиус частиц 80 нм
Метод исследования тот же, что в примере №1
У кролика №3 после инсталляции 0,5% раствора тимолола в частицах, покрытых хитозаном, в течение 5 часов давление было снижено на 4-5 мм рт. ст., через 6 часов - на 3-4 мм рт. ст., а через 8 часов - на 2 мм рт. ст.
Пример №4. Кролик №2. Инсталляция 2% раствора лизиноприла
Метод исследования тот же, что в примере №1
У кролика №18 после инсталляция 2% лизиноприла в течение 4 часов ВГД было снижено на 2 мм рт.ст, а через 6 ч - на 1 мм рт. ст.
Пример №5. Кролик №9. Инсталляция 2% раствора лизиноприла в кальций-фосфатных частицах, покрытых целлобиозой, средний радиус частиц 190 нм.
Метод исследования тот же, что в примере №1
У кролика №25 после инсталляции 2% раствора лизиноприла в течение 3-х часов ВГД было снижено на 3-4 мм рт. ст., а через 6 часов - на 2 мм рт. ст.
Пример №6. Кролик №15. Инсталляция 2% лизиноприла в кальций-фосфатных частицах, покрытых хитозаном, средний радиус 80 нм.
Метод исследования тот же, что в примере №1
У кролика №29 после инсталляции 2% лизиноприла в частицах в течение по крайней мере 5 часов ВГД было снижено на 5-6 мм рт. ст. и после 6 ч оставалось ниже нормы на 4 мм рт. ст.
На представленной фиг. 1 видно, что снижение ВГД под влиянием тимолола в частицах происходит несколько медленнее, чем под влиянием простого раствора. Это может быть связано с тем, что хитозан обладает высокими мукоадгезивными свойствами и может при введении депонироваться в слизистых оболочках. При закапывании в глаз частицы контактируют со слизистой конъюнктивы и муциновым слоем слезной пленки, где и могут задерживаться, что, в свою очередь, может приводить к некоторому замедлению поступления препарата во внутренние структуры глаза. Возвращение ВГД до исходного уровня после инсталляции тимолола в составе CaPh-частиц, покрытых хитозаном, отмечено через 24 часа.
Таким образом, приведенные примеры свидетельствуют, что внедрение препаратов, снижающих внутриглазное давление (тимолола и ингибитора АПФ лизиноприла) в кальций-фосфатные частицы усиливает и пролонгирует их действие на внутриглазное давление по сравнению с действием этих веществ в виде простых растворов.
Покрытие частиц хитозаном приводит к большему усилению и пролонгации гипотензивного действия, чем покрытие целлобиозой.
Внедрение препаратов в кальций-фосфатные частицы, покрытые хитозаном, с очевидностью позволяет снизить дозу и частоту применения препарата, что приведет к уменьшению местных и системных побочных эффектов и улучшит качество жизни больных глаукомой.
Полученные кальций-фосфатные частицы с нанесенным покрытием могут быть использованы сразу или могут быть оставлены в суспензии для дальнейшей обработки, включающей лиофильное высушивание.
1. Средство для лечения глазных заболеваний, содержащее кальций-фосфатные наночастицы с покрытием, включающие активное вещество, отличающееся тем, что оно дополнительно содержит воду, в качестве наночастиц использованы кальций-фосфатные наночастицы, включающие аморфную фазу, представляющую собой аморфный фосфат кальция, и кристаллическую структуру, представляющую собой брушит, а покрытие выполнено из хитозана, при этом наночастицы имеют гидродинамический радиус от 30 до 130 нм, заряд поверхности +16±4 мВ, а pH водного раствора составляет 6,2-7,5.
2. Средство по п. 1, отличающееся тем, что хитозан обладает растворимостью при нейтральных значения pH.
3. Средство по п. 1, отличающееся тем, что оно дополнительно содержит целевые добавки.
4. Средство по п. 3, отличающееся тем, что в качестве целевых добавок используют буферный агент, и/или 0,15 М хлористый натрий, и/или консерванты.
5. Средство для лечения глазных заболеваний, содержащее кальций-фосфатные наночастицы с покрытием, включающие активное вещество, отличающееся тем, что оно представляет собой лиофильно высушенный порошок, полученный из водного раствора по п. 1.
6. Способ лечения глазных заболеваний, характеризующийся тем, что в конъюнктивальную полость инсталлируют средство по любому из пп. 1-5 в эффективной концентрации 0,1-0,3%.
7. Способ лечения по п. 6, характеризующийся тем, что частоту и длительность использования выбирают в зависимости от характера и степени выраженности заболевания.