Иммуногистохимический способ выявления симпатических и парасимпатических структур на гистологических препаратах
Иллюстрации
Показать всеИзобретение относится к нейробиологии и медицине и может быть использовано при изучении парасимпатической и симпатической иннервации разных органов и тканей в норме и при патологии. Иммуногистохимический способ выявления симпатических и парасимпатических структур на гистологических срезах различных органов заключается в том, что на предметное стекло монтируют три последовательных серийных парафиновых среза толщиной 5-7 мкм, первый срез окрашивают маркером PGP 9.5, второй срез окрашивают маркером ТН, а третий срез окрашивают маркером Syn, затем все срезы докрашивают астровым или толуидиновым синими, а после заключения препарата в полистирол производят микрофотографирование и сравнение полученных изображений. 7 ил.
Реферат
Изобретение относится к нейробиологии и медицине, а именно к иммуногистохимическим исследованиям, и может быть использовано при изучении парасимпатической и симпатической иннервации разных органов и тканей в норме и при патологии.
В последние годы методы иммуногистохимии заняли важное место среди методов морфологической диагностики. Их разработка и совершенствование важны как для научных работников, так и для практикующих специалистов здравоохранения. Исчерпывающая информация о применении некоторых современных методических приемов изложена в серии руководств, изданных в последние годы под редакцией профессора РАН Д.Э. Коржевского (2014).
Несмотря на то что для изучения периферической нервной системы отечественными [Ноздрачев А.Д., Чумасов Е.И., 1999] и зарубежными [Liu et al., 1997; Salvioli et al., 2002; Toilet et al., 2001; Gulbenkian et al., 1987] авторами в настоящее время используется широкий спектр гистохимических маркеров, таких как CGRP, SP, VIP, nNOS, NPY, В-III-тубулин, Syn, TG, PGP 9.5 и др., идентификация симпатических и парасимпатических нервных аппаратов все еще представляет определенные трудности. Это связано как с недостаточностью наших знаний о структурно-пространственной организации этих двух вегетативных отделов нервной системы внутри различных органов, так и со сложностью нервно-тканевых взаимоотношений. Ряд трудностей обусловлен особенностями клеточной гетероморфности ганглиев и смешанного внутриствольного состава нервных стволов, пучков и сплетений, нервных окончаний.
Как известно, нервные волокна нейронов экстраорганных симпатических и парасимпатических ганглиев образуют стволики и пучки постганглионарных нервных волокон соответствующей медиаторной принадлежности. Внутри органов они делятся и формируют сплетения из пучков смешанного типа. Определить, какие аксоны во внутриорганных пучках и сплетениях относятся к парасимпатическим, а какие к симпатическим, обычными классическими нейрофибриллярными методами невозможно.
Исключительно важно для качественной и количественной оценки степени вегетативной иннервации внутренних органов определение состояния ее симпатических и парасимпатических аппаратов не только в норме, но и при патологических, возрастных изменениях, а также различного рода заболеваниях у разных видов животных и человека.
Известно, что функции внутренних органов человека и животных регулируются двумя основными отделами вегетативной нервной системы - парасимпатическим и симпатическим. Как показал наш многолетний опыт исследований, белок PGP 9.5 является одним из многих перечисленных маркеров, обладающих широкой возможностью выявления многообразных нервных структур ВНС, причем он выявляет не только нервные элементы (интрамуральные ганглии, нервные стволы, пучки, проводниковые отделы миелиновых и безмиелиновых волокон, концевые нервные сплетения, локализованные в соединительной ткани и вокруг артериальных и венозных сосудов), но также эндокринные клетки островков поджелудочной железы и нейрогормональные хромаффинные клетки параганглиев и мозгового вещества надпочечников.
Несмотря на широкие возможности этого маркера, затруднительно ответить на вопрос, к какому отделу вегетативной нервной системы относятся те или иные нервные элементы, идентифицировать, какие из них афферентные, а какие эфферентные, преганглионарные или постганглионарные. Для этого необходимо подобрать такое сочетание маркеров, которое бы позволило дифференцировать структуры, принадлежащие к разным отделам вегетативной нервной системы, и определить их медиаторный статус в органе, ганглии, нерве и нервном сплетении.
Второй маркер, используемый нами, представляет собой основной фермент обмена катехоламинов (DOPA, NA, А) - тирозингидроксилазу (ТН). Данный маркер является высоко специфическим и селективно выявляет исключительно катехоламины, локализующиеся в симпатических нейронах и их постганглионарных аксонах, в синаптических перицеллюлярных аппаратах в ганглиях. Этот маркер позволяет избирательно выявлять хромаффинные клетки (ХК) параганглиев: и так называемые мелкие интенсивно флуоресцирующие клетки (SIF) симпатических ганглиев.
Третий маркер, используемый в наших исследованиях - синаптофизин (SYN). Он представляет собой мембранный белок транспортных везикул. Большое количество специализированных везикул, как известно, сосредоточено в синаптических аппаратах ЦНС и ПНС. В везикулах синапсов находятся нейромедиаторы или нейротрансмиттеры: АЦХ, серотонин, DOPA или норадреналин. Медиатором постганглионарных нервных волокон симпатической нервной системы, по общему мнению, считается норадреналин (НА). Молекулы его локализуются в синаптических везикулах с плотной гранулой. Большое количество синаптических везикул, по данным литературы, находится по ходу тонких четкообразных симпатических и парасимпатических аксонов, входящих в состав основного синаптического сплетения (СФПТ). Последнее было нами обнаружено на поверхности гладкомышечных клеток (ГМК) стенки артериальных и венозных сосудов, а также в составе перицеллюлярного нервного сплетения вокруг симпатических и парасимпатических нейронов ганглиев ВНС. Так как СФ является одним из белков, составляющих транспортные везикулы эндокриноцитов, данный иммуногистохимический метод избирательно выявляет также и островки Лангерганса поджелудочной железы.
Одним из ближайших аналогов нашего исследования является работа группы японских ученых, выполненная в 2014 году [(1) - Hinata et al., 2014]. С помощью иммуногистохимических маркеров NOS, VIP и ТН на аутопсийном материале изучали смешанные нервы тазовой области пожилых мужчин. ТН использовали как маркер симпатических структур, а NOS - для парасимпатических. Показано, что в изученных нервных проводниках преобладали NOS-иммунопозитивные волокна.
Сходное исследование выполнено также японскими учеными в 2015 году [(2) - Jang et al., 2015]. Оно посвящено изучению состава нервных волокон подчревных и тазовых чревных нервов. Аутопсийным материалом исследования служили нервы пожилых людей. Сначала было проведено гистологическое исследование, затем иммуногистохимическое с помощью NOS, VIP и ТН. Более 70% нервных волокон подчревного нерва были ТН+, VIP+ и NOS-. Авторы считают их симпатическими. Парасимпатическими считались VIP+ и NOS-. В тазовом нерве возле третьего крестцового нервного корешка доля положительных волокон для ТН+, VIP+, NOS+ были ниже 30%. Большинство волокон с точки зрения авторов в обоих нервах были ТН+.
Однако вышеописанные способы, принятые нами за прототип, не позволяют выявлять и анализировать композиционный состав нервов, а также идентифицировать медиаторный статус нейронов ганглиев, претерминальных и терминальных синаптических окончаний.
Задачей настоящего изобретения (техническим результатом) является разработка способа выявления и идентификации нервных структур симпатического и парасимпатического отделов вегетативной нервной системы (ганглиев, нервных стволов, нервных пучков, сплетений и синапсов, синаптических терминалей) на гистологических срезах тканей любого органа.
Технический результат достигается путем нетрадиционного сочетанного использования трех известных иммуногистохимических маркеров (антигенов), которые являются селективными только для нервной системы - ген-пептид продукта (PGP 9.5), тирозингидроксилазы (ТН) и синаптофизина (SYN).
Исследование проведено на 50 крысах-самцах Вистар разного возраста - новорожденных, половозрелых и стареющих. Работы выполняли с соблюдением требований, предусмотренных приказом Минздрава СССР от 12.08.1977 г. №755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных». Объектами исследования служили следующие органы: сердце и магистральные сосуды, поджелудочная железа, легкие. Образцы тканей фиксировали в растворе цинк-этанол-формальдегида [Коржевский и др., 2014]. Гистологический анализ проводили на парафиновых срезах толщиной 5-7 мкм.
Были проведены следующие гистологические и иммуно-гистохимические манипуляции. На предметном стекле монтировали по три серийно приготовленных парафиновых среза и проводили на них иммуногистохимические реакции, как описано ниже. Один срез окрашивали на PGP 9.5, другой на SYN, третий - на ТН, часть препаратов докрашивали толуидиновым синим по Нисслю. Затем приготавливали демонстрационные иллюстрации и проводили анализ полученных результатов на светооптическом уровне.
Иммуногистохимическую реакцию на PGP 9.5 использовали для выявления нервных структур вегетативной нервной системы (ганглиев, нервных стволов, нервных пучков, нервных сплетений, нервных окончаний) и нейроэндокринных клеток. Манипуляции производят по следующей схеме:
1. После удаления парафина и регидратирования срезов общепринятым способом, предметные стекла с препаратами промывают в дистиллированной воде в течение 5 минут и переносят в 3%-ный водный раствор перекиси водорода на 10 мин при комнатной температуре для блокирования эндогенной пероксидазы.
2. Смывают перекись водорода дистиллированной водой и помещают в 0,01 М PBS с pH 7,4 на 5 мин.
3. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов (для образования сухого поля), обводят срезы гидрофобным фломастером (DakoPen, Liquid Blocker, PAP Pen и др.) и наносят на срезы необходимое для их покрытия количество блокировочного раствора 5%-го BSA на 10 мин при комнатной температуре.
4. Сливают излишек блокировочного раствора и наносят необходимое количество первичных поликлональных кроличьих антител к PGP 9.5 (1:400). Помещают предметные стекла во влажную камеру и ставят в термостат с температурой 27°C на 24 ч.
5. Смывают антитела PBS и затем помещают препараты в сосуд с буфером на 5 мин.
6. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносят необходимое количество реагента, EnVision+/HRP-Anti-Rabbit (Dako, Дания) и ставят в термостат с температурой 27°C на 35 мин. Смывают антитела PBS в течение 5 мин.
7. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносят необходимое количество рабочего раствора 3,3-диаминобензедин-тетрагидрохлорида (DAB 2-Component, Spring Bioscience, США или DAB+, Dako, Дания). В течение 1-3 мин происходит образование окрашенного продукта гистохимической реакции. Этот процесс контролируют под микроскопом, чтобы остановить реакцию до появления неспецифического фона.
8. Смывают раствор хромогена и промывают препараты в 2-3 порциях дистиллированной воды по 3-5 мин в каждой.
9. Часть препаратов подкрашивают толуидиновым синим по Нисслю или астровым синим.
10. После обезвоживания в спиртах восходящей крепости препараты просветляют в ксилоле и заключают в полистирол.
В результате проведения реакции нервные структуры приобретают коричневый цвет.
Иммуногистохимическая реакция на синаптофизин использовалась для выявления синаптофизин-иммунопозитивных терминалей в различных органах и тканях (ПЖ, сердце, легкие, сосуды)
Манипуляции производят по следующей схеме:
1. Производят удаление парафина и регидратацию срезов обычным способом.
2. После 5-минутной промывки в дистиллированной воде переносят предметные стекла в 3%-ный водный раствор перекиси водорода на 10 мин при комнатной температуре для блокирования эндогенной пероксидазы.
3. Смывают перекись водорода дистиллированной, водой и помещают в 0,01 М PBS с pH 7,4 на 5 мин.
4. Обводят срезы гидрофобным фломастером (DakoPen, Liquid Blocker, PAP Pen и др.) и наносят блокировочный раствор 5%-го BSA на 10 мин при комнатной температуре.
5. Сливают блокировочный раствор и наносят необходимое количество первичных поликлональных кроличьих антител к синаптофизину (MONOSAN, Нидерланды). Помещают предметные стекла во влажную камеру и в термостат с температурой 27°C на 24 ч.
6. Смывают антитела PBS и затем помещают в сосуд с буфером на 5 мин.
7. В качестве вторичных реагентов применяют реактивы из набора Super Sensitive PolymerHRP Detection Kit HRP / Dab (BioGenex, США). Стекла помещают в термостат с температурой 27°C на 35 мин.
8. Наносят на срезы необходимое количество рабочего раствора 3,3-диаминобензедин-тетрагидрохлорида (DAB 2-Component, Spring Bioscience, США или DAB+, Dako, Дания). В течение 1-3 мин происходит образование окрашенного продукта гистохимической реакции. Этот процесс контролируют под микроскопом, чтобы остановить реакцию до появления неспецифического фона.
9. Промывают препараты в 2-3 порциях дистиллированной воды по 3-5 мин в каждой.
10. Подкрашивают препараты толуидиновым синим по Нисслю или астровым синим.
11. Обезвоживают препараты в спиртах восходящей крепости, просветляют в ксилоле обычным образом.
12. Заключают препараты в полистирол.
В результате проведения реакции выявляются только концевые синаптические терминали, которые приобретают коричневый цвет.
Иммуногистохимическую реакцию на тирозингидроксилазу использовали для выявления катехоламинов в структурах симпатического отдела вегетативной нервной системы.
Манипуляции производят по следующей схеме:
1. После удаления парафина и регидратирования срезов, предметные стекла промывают в дистиллированной воде в течение 5 минут и переносят в 3%-ный водный раствор перекиси водорода на 10 мин при комнатной температуре для блокирования эндогенной пероксидазы.
2. Смывают перекись водорода дистиллированной водой и помещают в 0,01 М PBS с pH 7,4 на 5 мин.
3. Обводят срезы гидрофобным фломастером (DakoPen, Liquid Blocker, PAP Pen и др.) и наносят на срезы блокировочный раствор 5%-го BSA на 10 мин при комнатной температуре.
4. Сливают блокировочный раствор и наносят необходимое количество первичных поликлональных кроличьих антител к тирозингидроксилазе (AbCam, разведение 1:1000). Предметные стекла помещают во влажную камеру на 24 ч при 27°C.
5. После промывки буфером (5 мин) наносят необходимое количество реагента из набора Reveal Polyvalent HRP DAB Detection System (Dako, Дания) при 27°C, в течение 35 мин.
6. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносят необходимое количество рабочего раствора 3,3-диаминобензедин-тетрагидрохлорида (DAB 2-Component, Spring Bioscience, США или DAB+, Dako, Дания). В течение 1-3 мин происходит образование окрашенного продукта гистохимической реакции. Этот процесс контролируют под микроскопом, чтобы остановить реакцию до появления неспецифического фона.
7. Смывают раствор хромогена и промывают препараты в 2-3 порциях дистиллированной воды по 3-5 мин в каждой.
8. Препараты подкрашивают толуидиновым синим по Нисслю или астровым синим.
9. После обезвоживания в спиртах восходящей крепости препараты просветляют в ксилоле и заключают в полистирол.
В результате проведения реакции нейроны и нервные волокна симпатической нервной системы, участвующие в иннервации стенок кровеносных сосудов ПЖ, сердца, легких окрашиваются в желто-коричневый цвет.
Примеры сочетанного применения представленных маркеров
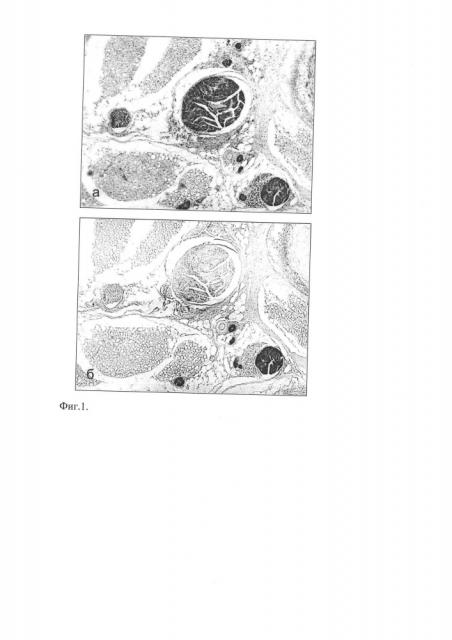
На фиг. 1. представлены микрофотографические изображения поперечных срезов нервных стволиков и пучков соединительной ткани аортально-пульмональной области сердца. На фрагменте (а) - препарат, окрашенный в результате иммуногистохимической реакции на PGP 9.5, а на фрагменте (б) - в результате иммуногистохимической реакции на ТН. Видно, что парасимпатические волокна преобладают над симпатическими в смешанных нервных пучках ткани аортально-пульмональной области сердца.
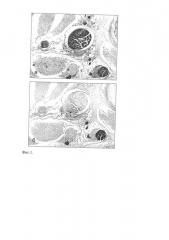
На фиг. 2. - микрофотографии, последовательных срезов с одного и того же блока поджелудочной железы крысы, позволяющие провести сравнение между иммуногистохимическими маркерами ТН и PGP 9.5. Фрагмент (а) - элементы парасиматической нервной системы и эндокриноциты островков Лангерганса (ОЛ); фрагмент (б) - ТН-позитивные симпатические волокна, ОЛ - ТН-негативны. Обозначения на микрофотографии: А - артерия; В - вена; стрелки - концевые отростки; ОЛ - островки Лангерганса.
На фиг. 3. представлены микрофотографические изображения пучков вегетативных нервных волокон смешанного состава в сердце крысы на границе правого предсердия и желудочка с разной плотностью распределения симпатических и парасимпатических аксонов. На фрагменте (а) окраска определяется иммуногистохимической реакцией на ТН, а на фрагменте (б) - иммуногистохимической реакцией на PGP 9.5. Обращает на себя внимание степень различий симпатического и парасимпатического звеньев в иннервации сердца.
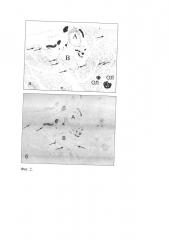
На фиг. 4. представлены микрофотографии сино-атриовентрикулярного пучка мышечных волокон проводящей системы сердца крысы (АВП). Фрагмент (а) - иммуногистохимическая реакция на PGP 9.5, фрагмент (б) - иммуногистохимическая реакция на ТН. Сравнительный морфологический анализ позволяет заключить, что в АВП представлены преимущественно парасимпатические холинергические аксоны, а катехоламинергические аксоны практически отсутствуют
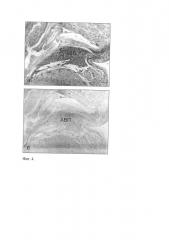
На фиг. 5. - микрофотографии среза быжеечного симпатического ганглия. Фрагмент (а) - иммуногистохимическая реакция на ТН, фрагмент (б) - иммуногистохимическая реакция на синаптофизин. Заключение: На фрагменте (а) видны ТН+ мультиполярные симпатические нейроны, а на фрагменте (б) - синаптические окончания (стрелки) вокруг перикарионов и на дендритах нейронов.
На фиг. 6. - микрофотографии перицеллюлярных синаптических нервных аппаратов на нейробластах и молодых нейронах в парасимпатическом ганглии поджелудочной железы новорожденной крысы. Фрагмент (а) - иммуногистохимическая реакция на синаптофизин, фрагмент (б) - иммуногистохимическая реакция на ТН.
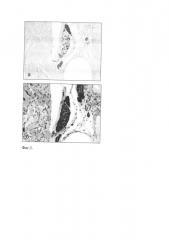
На фиг. 7. микрофотографии катехоламинергических перицеллюлярных нервные аппаратов вокруг парасимпатических нейронов («аксо-дендритные синапсы»). Препарат окрашен в результате иммуногистохимической реакции на тирозингидроксилазу. Обозначения: Н - нейроны; НС - нервный ствол; стрелки - концевые структуры. Заключение: Нейроны парасимпатического ганглия иммунонегативны.
Проведенные исследования показывают, что заявляемый иммуногистохимический способ обеспечивает надежное выявление и идентификацию нервных структур симпатического и парасимпатического отделов вегетативной нервной системы (ганглиев, нервных стволов, нервных пучков, сплетений и синапсов) на гистологических срезах в тканях любого органа.
Технический результат достигается путем сочетанного использования трех известных маркеров (антигенов), которые являются селективными только для нервной системы: ген-пептид продукта (PGP 9.5), тирозингидроксилазы (ТН) и синаптофизина (SYN), позволяющих дифференцировать симпатические и парасимпатические ганглии, нервные стволы и пучки безмякотных нервных волокон, варикозные аксоны основного терминального нервно-сосудистого сплетения различной медиаторной природы, а также перицелллюлярные синаптические аппараты в интрамуральных ганглиях с целью оценки степени иннервации и функционального состояния различных тканей и органов. Сочетанное использование иммуногистохимических маркеров PGP 9.5 и ТН обеспечивает надежную идентификацию парасимпатических структур.
Предложенный способ дает также возможность выявить и анализировать не только композиционный состав нервов и нейроны ганглиев, но и претерминальные и терминальные синаптические окончания, которые выявляются как на стенках кровеносных сосудов, так и на нейронах. Возможность оценки структурно-пространственной организации как нервной, так и соединительной ткани, включая воспалительные элементы и клетки крови, достигается за счет сочетанного применения классического метода окраски толуидиновым синим по Нисслю. Применение маркера SYN в сочетании с ТН обеспечивает выявление, синаптических терминалей в симпатических и парасимпатических ганглиях, а также позволяет дифференцировать симпатические терминали от других.
Литература
(1) Hinata N., Hieda К., Sasaki Н., Murakami G., Abe S., Matsubara A., Miyake H., Fujisawa M. Topohistology of sympathetic and parasympathetic nerve fibers in branches of the pelvic plexus: an immunohistochemical study using donated elderly cadavers // Anat. Cell Biol. 2014 Mar; 47(1): 55-65. doi: 10.5115/acb.2014.47.1.55.
(2) Jang H.S., Cho K.H., Hieda K., Kim J.H., Murakami G., Abe S., Matsubara A. Composite nerve fibers in the hypogastric and pelvic splanchnic nerves: an immunohistochemical study using elderly cadavers // Anat. Cell Biol. 2015. 48(2): 114-23. doi: 10.5115/acb.2015.48.2.114.
Иммуногистохимический способ выявления симпатических и парасимпатических структур на гистологических срезах различных органов, заключающийся в том, что на предметное стекло монтируют три последовательных серийных парафиновых среза толщиной 5-7 мкм, первый срез окрашивают маркером PGP 9.5, второй срез окрашивают маркером ТН, а третий срез окрашивают маркером Syn, затем все срезы докрашивают астровым или толуидиновым синими, а после заключения препарата в полистирол производят микрофотографирование и сравнение полученных изображений.