Комбинированная вакцина для иммунопрофилактики кори, эпидемического паротита и краснухи
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, и касается комбинированной вакцины для иммунопрофилактики кори, эпидемического паротита и краснухи. Вакцина содержит штамм вируса кори, штамм вируса эпидемического паротита, штамм вируса краснухи и стабилизирующий агент. При этом в качестве штамма вируса кори используется штамм Ленинград-16, в качестве штамма вируса паротита - штамм Ленинград-3, культивируемые на трипсинизированных первичных клетках эмбрионов японских перепелов, в качестве штамма вируса краснухи - штамм RA27/3, культивируемый на культуре диплоидных клеток человека MRC-5. Состав действующих веществ вакцины в расчете на одну прививочную дозу содержит: вирус кори - не менее 1000 (3,0 lg) тканевых цитопатогенных доз (ТЦД50); вирус краснухи - не менее 1000 (3,0 lg) ТЦД50; вирус паротита - не менее 10000 (4,0 lg) ТЦД50. Изобретение обеспечивает возможность создания стабильной комбинированной трехвалентной вакцины для иммунопрофилактики кори, эпидемического паротита и краснухи. 3 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к области биотехнологии и касается комбинированной вакцины для иммунопрофилактики кори, эпидемического паротита и краснухи.
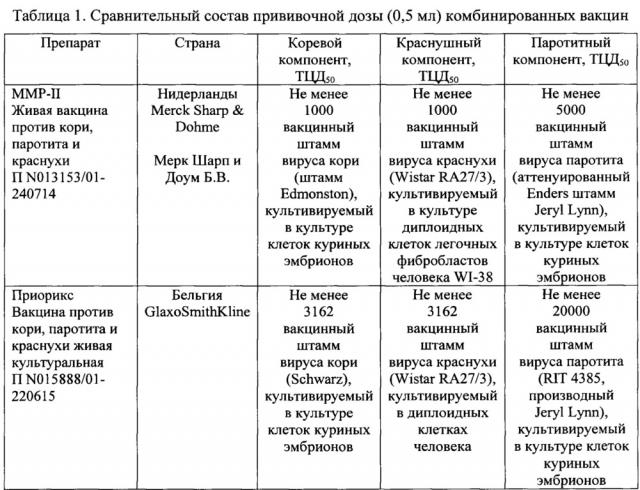
Значительные успехи в создании комбинированных вакцин достигнуты рядом зарубежных фирм. На рынке РФ имеются зарубежные аналоги комбинированной вакцины: производства компании Мерк Шарп и Доум Б.В., Нидерланды «М-М-Р II», производства компании «ГлаксоСмитКляйн Байолоджикалз а.с», Бельгия «Приорикс», производства компании Серум Инститьют оф Индия, Лтд «Вакцина против кори, паротита и краснухи живая аттенуированная», известна комбинированная вакцина производства компании Санофи Пастер, Франция «Trimovax».
Состав некоторых комбинированных вакцин, зарегистрированных в России и применяемых для иммунизации, указан в Таблице 1.
Ближайшим аналогом является композиция вакцины против кори, эпидимического паротита и краснухи, описанная в WO 9220375, опубл. 1992, содержащая, в расчете на прививочную дозу:
Вирус кори - по меньшей мере 1000 TCID50
Вирус краснухи - по меньшей мере 1000 TCID50
Вирус паротита - по меньшей мере 20000 TCID50, и стабилизатор.
Отечественные комбинированные трехкомпонентные вакцины для профилактики кори, краснухи и паротита в Российской Федерации не зарегистрированы.
Основная сложность разработки комбинированных вакцинных препаратов состоит в обеспечении полноценного иммунного ответа на все компоненты вакцины.
Трудности создания комбинированной вакцины связаны, прежде всего, с решением проблем совместимости ее компонентов, стабильности и сохранения достаточной иммуногенности препарата. Иммуногенная активность компонентов сложных вакцин может варьировать в зависимости от многих факторов: биологических свойств используемых в производстве штаммов; качества питательных сред, методов изготовления компонентов; качественных характеристик вспомогательных веществ, входящих в состав стабилизаторов.
Различные фирмы используют для производства как моно, так и комбинированных вакцин разные штаммы вирусов и клеточные субстраты для их культивирования.
В СССР с 1970 г. было начато производство коревой вакцины из штамма Ленинград-16 с использованием в качестве субстрата культуры клеток фибробластов эмбрионов японских перепелов (ФЭП).
Живая паротитная вакцина из штамма Ленинград-3 на культуре клеток ФЭП была рекомендована в практику здравоохранения Приказом МЗ СССР №109 от 01.02.1980 г.
С 2002 года в практику здравоохранения Российской Федерации введена дивакцина против кори и паротита (Патент РФ №2158134, 27.10.2000 г.).
В 70-ые годы XX века в г. Ленинграде под руководством академика А.А. Смородинцева был получен изолированный на территории Российской Федерации вакцинный штамм вируса краснухи «Орлов». (Мешалова В.Н. Опыт получения и аттенуации краснушного штамма «Орлов», «Респираторные вирусные инфекции», Труды ЛНИИЭМ им. Пастера, Л.: 1973, 137-143). В 1995 г. вакцинный штамм «Орлов» был восстановлен до исходных показателей биологической активности, сертифицирован в ГИСК им. Л.А. Тарасевича как вакцинный и получил наименование «Орлов-В» [Патент РФ №2081912, 1997 г.]. Штамм «Орлов-В» получен из штамма «Орлов» путем многократного пассирования в первичной культуре клеток почки кролика. Однако использование в качестве тканевого субстрата в производстве вакцины первичной культуры клеток почки кролика усложняет технологию получения вакцины, затрудняет стандартизацию качественных характеристик конечного продукта, повышает себестоимость препарата
В качестве продуцента краснушной вакцины также был предложен штамм вируса краснухи «Орлов-Д», полученный в результате адаптирования штамма «Орлов-В» к диплоидной клеточной культуре путем пассирования в клетках кожно-мышечных фрагментов эмбриона человека М-22 (Патент РФ №2173344, 2001 г.).
В Российской Федерации иммунизация против краснухи детей первого - второго года жизни введена в календарь профилактических прививок приказом МЗ РФ от 27.12.97 г. №375. В отсутствие на тот момент отечественного препарата вакцины против краснухи иммунизация проводилась зарубежными вакцинами, созданными на основе штамма RA-27/3.
Вакцинный штамм вируса краснухи RA27/3 получен в 1967 г. С. Плоткиным (Stanley Plotkin) на 26-м пассаже в культуре диплоидных клеток WI-38 (Plotkin S.A., Farquhar J.D., Katz M., Buser F. (1969) Attenuation of RA27/3 rubella virus in WI-38 human diploid cells. Am. J. Dis Child. 11: 178-185). Ему впервые удалось выделить вакцинный вирус, не вызывающий побочных реакций, которыми отличались ранее используемые при производстве вакцины против краснухи штаммы HPV-77 и Cendehill.
В 2011 г. в России была зарегистрирована отечественная «Вакцина против краснухи культуральная живая» (Регистрационное удостоверение № ЛП-000463 от 01.03.2011), разработанная на основе штамма RA-27/3, культивируемого на диплоидных клетках человека MRC-5. Клинические исследования показали, что препарат низко реактогенен, хорошо переносится детьми и безопасен, обладает выраженными иммуногенными свойствами. С 2013 г. начато применение коммерческих серий данной вакцины в практике здравоохранения. Российский опыт применения вакцины против краснухи из штамма RA27/3 доказал его безвредность и высокую иммунологическую эффективность.
Задачей изобретения является разработка комбинированной вакцины для иммунопрофилактики кори, эпидемического паротита и краснухи, обладающей высокой иммуногенностью и стабильностью.
Поставленная задача решается заявленной композицией комбинированной вакцины для иммунопрофилактики кори, эпидемического паротита и краснухи, содержащей в качестве штамма вируса кори - штамм Ленинград-16 (Л-16), в качестве штамма вируса эпидемического паротита - штамм Ленинград-3 (Л-3), культивируемые на трипсинизированных первичных клетках эмбрионов японских перепелов, и в качестве штамма вируса краснухи - штамм RA27/3, культивируемый на культуре диплоидных клеток человека MRC-5, со стабилизирующим агентом, представляющим собой фосфатно-солевой раствор, содержащий ионы кальция и магния, и дополнительно - моно и дисахариды и одну или несколько аминокислот, выбранных из группы, содержащей аргинин, пролин, глицин, натриевую или калиевую соль глутаминовой кислоты, гистидин, аланин, и частично гидролизованный желатин.
При этом содержание вирусов кори, паротита и краснухи в одной прививочной дозе комбинированной вакцины составляет:
- вирус кори - не менее 1000 тканевых цитопатогенных доз (ТЦД50);
- вирус краснухи - не менее 1000 ТЦД50;
- вирус паротита - не менее 10000 ТЦД50,
Отличие заявленной вакцины состоит в том, что она содержит в одной прививочной дозе, в качестве вируса кори - штамм Л-16, культивируемый на трипсинизированных первичных клетках эмбрионов японских перепелов, не менее 1000 (3,0 lg) ТЦД50, в качестве вируса паротита - штамм Л-3, культивируемый на трипсинизированных первичных клетках эмбрионов японских перепелов, не менее 10000 (4,0 lg) ТЦД50, в качестве вируса краснухи - штамм RA27/3, культивируемый на культуре диплоидных клеток человека MRC-5, не менее 1000 (3,0 lg) ТЦД50. Композиция содержит стабилизирующий агент - фосфатно-солевой раствор, содержащий ионы кальция и магния, и дополнительно - моно и дисахариды и одну или несколько аминокислот, выбранных из группы, содержащей аргинин, пролин, глицин, натриевую или калиевую соль глутаминовой кислоты, гистидин, аланин, и частично гидролизованный желатин.
Опыт многолетнего применения в СССР, а затем в России живых культуральных моновакцин против кори и паротита, паротитно-коревой вакцины из штаммов Ленинград-16 и Ленинград-3, а также многолетний международный и российский опыт применения вакцины против краснухи из штамма RA27/3 определил выбор этих штаммов для создания комбинированной вакцины.
Активные и вспомогательные вещества, входящие в состав комбинированной вакцины, хорошо изучены с точки зрения безопасности и применяются в производстве других живых культуральных вакцин.
Зависимость специфической активности вирусов кори и паротита от соотношения при их комбинировании хорошо известна на примере паротитно-коревой вакцины. Для изучения зависимости специфической активности коревого и краснушного, а также паротитного и краснушного компонентов при комбинировании их жидких полуфабрикатов были приготовлены экспериментальные серии соответствующих дивакцин в сравнении с тривакциной. Сохранение специфической активности отдельных вирусов при приготовлении комбинированной тривакцины было показано методом определения цитопатогенного действия вируса на чувствительные клетки Vero (для вируса кори и паротита) и клетки RK-13 (для вируса краснухи) с предварительной нейтрализацией двух из трех компонентов соответствующими иммунными сыворотками.
Результаты приведены в Таблице 2.
Как видно из Таблицы 2, специфическая активность монокомпонентов вирусов в составе дивакцин и тривакцины были практически одинаковыми, при этом полученные значения хорошо коррелировали с расчетными значениями специфической активности.
Это доказывает, что в процессе приготовления тривакцины отдельные вирусные компоненты хорошо сочетаются друг с другом и не происходит подавления вирусной активности ни одного из компонентов.
Композиция обеспечивает сохранение вирусов кори, паротита и краснухи в комбинированной вакцине на протяжении не менее 2-х лет.
Данные представлены в Таблице 3.
Комбинированную вакцину получают путем объединения в определенном соотношении стабилизированных жидких полуфабрикатов коревой, паротитной вакцин и вакцины против краснухи, приготовленных с использованием производственных штаммов и посевных вирусов, применяемых при производстве соответствующих моновакцин:
- вируса кори - Ленинград-16;
- вируса паротита - Ленинград-3;
- вируса краснухи - RA 2 7/3.
Безопасность и иммуногенность комбинированной вакцины для профилактики кори, краснухи и паротита была подтверждена в исследовании на лабораторных приматах - на макаках резусах (macaca mulatta).
В испытании использовали 12 обезьян в возрасте 1,5-2,0 года, с массой тела от 2,300 до 3,550 кг. В качестве препаратов сравнения использовали вакцину паротитно-коревую культуральную живую и вакцину против краснухи культуральную живую производства ФГУП «НПО «Микроген». Животным контрольной группы вводили физиологический раствор. Животных опытной группы и групп сравнения прививали одной дозой соответствующей вакцины (0,5 мл) однократно подкожно. Животным контрольной группы однократно подкожно вводили эквивалентный объем физиологического раствора (0,5 мл).
Результаты клинического наблюдения в течение 2-х месяцев, динамика показателей массы тела и данных термометрии обезьян показали безопасность исследуемой вакцины для профилактики кори, краснухи и паротита. Симптомов, характерных для инфекций вирусами кори, эпидемического паротита и краснухи, зарегистрировано не было.
Для изучения иммуногенности вакцины определяли уровень антител к вирусам кори, краснухи и паротита у обезьян до вакцинации, на 14, 30, 42 и 58 сутки после вакцинации при помощи коммерческих иммуноферментных тест-систем.
Полученные результаты доказывают, что иммунологическая активность коревого и паротитного компонентов в составе комбинированного препарата не ниже, чем в паротитно-коревой дивакцине, а краснушного компонента - не ниже, чем в монопрепарате вакцины против краснухи.
У животных контрольной группы, которым вводили физиологический раствор, образования антител к вирусам кори, краснухи и паротита не наблюдается, что свидетельствует об отсутствии распространения вакцинных штаммов вирусов серонегативным животным, т.е. об отсутствии их контагиозности.
Полученные результаты по иммуногенности представлены на Фиг. 1-3.
Фиг. 1 - Динамика уровня IgG антител к вирусу краснухи в сыворотках крови обезьян после вакцинации комбинированной вакциной против кори, паротита и краснухи и препаратами сравнения.
Фиг. 2 - Динамика уровня IgG антител к вирусу кори в сыворотках крови обезьян после вакцинации комбинированной вакциной против кори, паротита и краснухи и препаратами сравнения.
Фиг. 3 - Динамика уровня IgG антител к вирусу паротита в сыворотках крови обезьян после вакцинации комбинированной вакциной против кори, паротита и краснухи и препаратами сравнения.
Метод контроля специфической активности в комбинированной вакцине разработан на основании рекомендаций ВОЗ по контролю комбинированных вакцин против кори, эпидемического паротита и краснухи (1. Серия технических докладов ВОЗ, №840, 1994 г., 2. Manual of laboratory methods, Part II: Potency control of live viral vaccines. WHO/VSQ/97.04).
Специфическую активность в комбинированной вакцине определяют по цитопатогенному действию (ЦПД) каждого из вирусов на чувствительные клетки Vero (для вируса кори и паротита) и клетки RK-13 (для вируса краснухи), предварительно нейтрализовав два из трех компонентов соответствующими иммунными сыворотками.
Готовят суспензии клеток Vero и RK-13 на культуральной ростовой среде.
Клетки разливают в лунки планшетов для культур клеток и инкубируют до образования монослоя в термостате при температуре (36±1)°C в атмосфере с 5% углекислого газа.
Готовят образцы иммунных сывороток к кори, паротиту и краснухе в разведениях, позволяющих полностью нейтрализовать соответствующий компонент и не являющихся токсичными для клеток Vero и RK-13, и образцы вакцины в питательной среде в объеме, соответствующем прививочной дозе.
Готовят нейтрализованные смеси образцов вакцины и соответствующих образцов иммунных сывороток. Смеси выдерживают от 1,0 до 1,5 ч при комнатной температуре. По окончании контакта готовят последовательные десятикратные разведения образцов и вносят в лунки планшета с культурами клеток Vero и RK-13, соответственно.
Несколько лунок на каждом планшете оставляют для контроля культуры клеток, внося подходящую поддерживающую среду. Для контроля отсутствия цитотоксического действия сывороток на культуры клеток в несколько лунок с клеточным монослоем вносят исходные разведения иммунных сывороток.
При каждом проведении контроля специфической активности вакцины проводят титрование стандартных образцов активности живой коревой вакцины, живой паротитной вакцины и активности вируса краснухи (положительный контроль).
Инфицированные и контрольные культуры клеток инкубируют в атмосфере с 5% углекислого газа: культуры клеток Vero - 8-10 суток при температуре (36±1)°C, культуры клеток RK-13 - 10-12 суток при температуре (32±1)°С.
Учет результатов проводят с использованием инвертированного микроскопа по ЦПД.
Морфология клеток в контроле культур должна соответствовать морфологии популяции клеток исходных линий и состоять из фибробластоподобных клеток без признаков зернистости и дегенерации (клетки Vero) и эпителиоподобных клеток без признаков зернистости и дегенерации (клетки RK-13).
Морфология клеток в лунках с контролем культур клеток и контролем цитотоксического действия иммунных сывороток не должна отличаться.
В лунках планшетов с положительным контролем стандартными образцами активности вирусов должно быть выражено специфическое (корь/паротит/краснуха) цитопатогенное действие соответствующего вируса, при этом активность стандартного образца не должна выходить за пределы доверительных границ средней геометрической титра, установленного при его аттестации.
В лунках планшета с нейтрализованными паротитным и краснушным компонентами должны присутствовать специфические для вируса кори поражения культуры клеток.
В лунках планшета с нейтрализованными коревым и краснушным компонентами должны присутствовать специфические для вируса паротита поражения культуры клеток.
В лунках планшета с нейтрализованными коревым и паротитным компонентами должны присутствовать специфические для вируса краснухи поражения культуры клеток.
Учитывают наличие ЦПД вирусов в зараженных лунках, рассчитывают титр вируса в прививочной дозе по методу Рида и Менча или Спирмена-Кербера и выражают в lg ТНД50/0,5 мл.
На фоне выраженных коревых/паротитных/краснушных цитопатогенных изменений в лунках планшета с соответствующим положительным контролем в культуре, где этот компонент нейтрализован, специфические для данного вируса поражения клеток должны отсутствовать. Успешная нейтрализация отдельных компонентов вакцины при определении специфической активности служит подтверждением подлинности.
Прививочная доза (0,5 мл) должна содержать не менее 1000 ТЦД50 вируса кори (не менее 3,0 lg ТЦД50/0,5 мл), не менее 1000 ТЦД50 (не менее 3,0 lg ТЦД50/0,5 мл) вируса краснухи и не менее 10000 ТЦД50 вируса паротита (не менее 4,0 lg ТЦД50/0,5 мл).
Изобретение иллюстрируется следующим примером.
Пример.
Приготовление жидких полуфабрикатов кори, паротита и краснухи
Свежеприготовленную суспензию первичной культуры клеток эмбрионов перепелов в среде 199 разливают в одноразовые роллерные бутыли не менее 200 тыс. клеток на 1 см2 поверхности и заражают расчетным количеством вируса эпидемического паротита (штамм Л-3) или кори (штамм Л-16) во взвесь.
В каждую роллерную бутыль с клеточным монослоем диплоидной культуры клеток MRC-5 вносят расчетную заражающую дозу вируса краснухи (штамма RA 27/3) в среде F-12/MEM.
Культуры инкубируют в ростовой среде, содержащей до 10% сыворотки крупного рогатого скота или телячьей, или эмбриональной сыворотки, при температуре (35±1)°C для эпидемического паротита и кори, при температуре (30±1)°C - для краснухи.
По истечении 2-4 суток производят отмывание клеточного монослоя для каждого компонента. Затем зараженные клетки инкубируют в поддерживающей среде без сыворотки, контролируя состояние монослоя и развитие цитопатогенного действия вируса. Сбор вируссодержащей жидкости производят, начиная с 4-х суток от момента заражения для эпидемического паротита и краснухи, с 8-х суток для кори. Всего делают от 2-х до 3-х полезных сборов для вируса эпидемического паротита, от 3-х до 5 - для вируса кори и от 6 до 9 - для вируса краснухи до 50%-й деградации клеточного монослоя. Индивидуальные вирусные сборы каждого отдельного монокомпонента со специфической активностью не менее 4,7-5,0 lg ТЦД50/0,5 мл для вирусов кори и краснухи и не менее 5,7-6,0 lg ТЦД50/0,5 мл для вируса паротита объединяют и подвергают осветляющей фильтрации, затем добавляют стабилизирующий агент. Объединенные жидкие полуфабрикаты монокомпонентов замораживают при температуре не ниже 55±5°C.
Для приготовления комбинированной вакцины с заданными концентрациями компонентов кори, эпидемического паротита и краснухи полуфабрикаты каждого из монокомпонентов размораживают и перемешивают до однородного состояния, затем объединяют в пропорциях, соответствующих конечным прививочным дозам паротитного компонента - не ниже 10000 ТЦД50/0,5 мл, коревого и краснушного компонентов - не ниже 1000 ТЦД50/0,5 мл. При высоких титрах вируса кори, краснухи или паротита в жидких полуфабрикатах вакцины его содержание нивелируют добавлением в общую емкость расчетного количества подготовленного разбавителя - питательной среды, использовавшейся при культивировании одного из вирусов или сбалансированного фосфатно-солевого раствора со стабилизирующим агентом в тех же соотношениях, что и в исходном жидком полуфабрикате.
Исходные объемы компонентов определяют расчетным методом в соответствии с Методическими указаниями (В.М. Бойко, Т.В. Калашникова, «Основные принципы построения расчетов для конструирования ассоциированных препаратов», Москва, 1980 г.) по формуле:
Q=T2/T1N
где Q - объем каждого исходного компонента, в литрах;
T1 - исходная активность компонента, в ТЦД 50/0,5 мл;
Т2 - заданная активность компонента в ассоциированной вакцине, в ТЦД 50/0,5 мл;
N - заданный объем ассоциированного препарата, в литрах.
Для получения комбинированной тривакцины в объеме 10 л (N - здесь и далее -обозначение параметра согласно вышеприведенной формуле) с конечной активностью паротитного компонента (Т2п) - 100000 ТЦД 50/0,5 мл, коревого компонента (Т2к) и краснушного компонента (Т2кр) - 10000 ТЦД5 0/0,5 мл, рассчитывают объемы каждого компонента по формуле Q=T2/T1N, исходя из известной активности монопрепаратов.
Исходная активность паротитного компонента (T1п) - 235000 ТЦД 50/0,5 мл.
Исходная активность коревого компонента (Т1к) - 74000 ТЦД 50/0,5 мл.
Исходная активность краснушного компонента (Т1кр) - 110000 ТЦД 50/0,5 мл.
Подставляя в формулу известные значения, получаем необходимые для объединения объемы монопрепаратов:
Qп=(100000/235000)10=4.25 л;
Qк=(10000/74000)10=1,35 л;
Qкр=(10000/110000)10=0,9 л.
Таким образом, паротитного компонента необходимо 4,25 л, коревого - 1,35 л, краснушного - 0,9 л. Общий объем вируссодержащих компонентов - 6,5 л. В этом случае для получения конечного объема тривакцины 10 л необходимый объем разбавителя, содержащего стабилизирующий агент, составит 3,5 л.
Комбинированная вакцина для иммунопрофилактики кори, эпидемического паротита и краснухи, содержащая штамм вируса кори, штамм вируса эпидемического паротита, штамм вируса краснухи и стабилизирующий агент, отличающаяся тем, что вакцина содержит в качестве штамма вируса кори штамм Ленинград-16, в качестве штамма вируса паротита штамм Ленинград-3, культивируемые на трипсинизированных первичных клетках эмбрионов японских перепелов, в качестве штамма вируса краснухи штамм RA27/3, культивируемый на культуре диплоидных клеток человека MRC-5, и имеет следующий состав действующих веществ, в расчете на одну прививочную дозу:
вирус кори - не менее 1000 (3,0 lg) тканевых цитопатогенных доз (ТЦД50);
вирус краснухи - не менее 1000 (3,0 lg) ТЦД50;
вирус паротита - не менее 10000 (4,0 lg) ТЦД50.