Лабораторный способ выявления распространенных стадий лимфопролиферативных заболеваний
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способам интерпретации результатов лабораторных анализов, и может быть использовано при лимфопролиферативных заболеваниях, а именно неходжкинской лимфоме и лимфогранулематозе для уточнения стадии опухолевого процесса. Лабораторный способ выявления распространенных стадий лимфопролиферативных заболеваний, включающий результаты клинических исследований, лучевых, морфологических, иммуноморфологических, лабораторных методов исследования и анализ активности тимидинкиназы-1 (ТК-1), отличается тем, что в сыворотке крови больных до начала химиотерапии определяют иммуноферментным методом активность тимидинкиназы-1, и если активность ТК-1 более 2000,0 дЕд/л, но менее 3350,0 дЕд/л, то опухолевый процесс по распространенности относят к III-IV стадиям; активность ТК-1>3350,0 дЕд/л, то опухолевый процесс по распространенности относят к IV стадии. 3 пр., 1 табл., 1 ил.
Реферат
Изобретение относится к области медицины, а именно к способам интерпретации результатов лабораторных анализов, и может быть использовано при лимфопролиферативных заболеваниях (далее - ЛПЗ), а именно - неходжкинской лимфоме (далее - НХЛ) и лимфогранулематозе (далее - ЛГМ) для уточнения стадии опухолевого процесса.
Диагноз ЛПЗ устанавливается на основании морфологического исследования биопсийного или операционного материала. Морфологическое исследование проводится с использованием цитологических, гистологических и иммуногистохимических методов. Отдельные случаи ЛПЗ нуждаются в проведении молекулярно-биологических и генетических тестов.
Выбор тактики лечения ЛПЗ осуществляется в соответствии со стадией опухолевого процесса с учетом международного прогностического индекса (МПИ) в соответствии с действующей классификацией ВОЗ (TNM: Классификация злокачественных опухолей. Под ред. Л.Х. Собина, М.К. Господарович, К. Виттекинд, пер. с англ. - Москва: Логосфера; - 2011. - 304 с.), критериями классификации Ann Arbor в модификации Cotswold и Российскими рекомендациями на ее основе (Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством проф. И.В. Поддубной, проф. В.Г. Савченко. Москва: Медиа Медика, - 2013. - 104 с.: ил.).
При стадировании ЛПЗ компонентами обязательного обследования являются гистологические исследования трипанобиоптата костного мозга, желательно полученного при билатеральных пункциях, а также биоптатов из других предполагаемых очагов поражения (Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством проф. И.В. Поддубной, проф. В.Г. Савченко. М.: Медиа Медика, - 2013. - 104 с.: ил.). Ошибки в стадировании, связанные с этим компонентом диагностики обусловлены двумя причинами: 1) неинформативностью гистологического исследования в случаях, когда трипанобиоптат был получен из зоны костного мозга вне опухолевого поражения; 2) труднодоступностью для пункции ряда очагов предполагаемого поражения.
Таким образом, полная информация при первичной диагностике для стадирования опухолевого процесса может быть получена далеко не всегда.
Стадия ЛПЗ с учетом возраста и общего состояния больных (по международным критериям) полностью определяет тактику первичного лечения, а именно: назначение/неназначение префазы-1 введения винкаалколоидов, количество курсов химиотерапии (далее - XT) - 2-4/4-6/6-8, количество курсов полиХТ, схемы XT (ABVD/BEACOPP-эскалированная/ВЕАСОРР-14).
Таким образом, правильное стадирование обеспечивает адекватный объем лечебных мероприятий и, в конечном итоге, улучшение как непосредственных, так и отдаленных результатов лечения. Особенно важно при стадировании исключить возможность недооценки распространенности опухолевого процесса, и, как следствие, недостаточный объем лечебных мероприятий, как ошибок, существенно ухудшающих прогноз.
Из серологических анализов в рамках лабораторной диагностики ЛПЗ обязательным является исследование лактатдегидрогеназы (далее - ЛДГ) и β2-микроглобулина (β2-МГ). Однако в алгоритм стадирования они не включены и их учитывают, как правило, в мониторинге эффективности лечения больных с ЛПЗ.
Таким образом, расширение спектра обязательных обследований/анализов в алгоритме первичной диагностики ЛПЗ для более точного стадирования является актуальным.
Известно исследование при хроническом лимфолейкозе (далее - ХЛЛ) в сыворотке крови (далее - СК) тимидинкиназы (далее - ТК) (Загоскина Т.П., Зотина Е.Н., Крюкова М.Г., Шардаков В.И., Гришина И.В. Значение сывороточной тимидинкиназы в прогнозировании ответа на терапию у больных хроническим лимфолейкозом. // Бюллетень СО РАМН. - 2013. - Том 33. - №1 - С. 10-14). Авторы ссылаются на принципы стадирования ХЛЛ, заложенные J.L. Binet и K. Rai (Клиническая онкогематология: руководство для врачей. / Ред. М.А. Волкова. М.: Медицина, 2007: 1120 с.; Moreno С., Montserrat Е. New prognostic markers in chronic lymphocytic leukemia // Blood Rev. - 2008. - 22. (4). P. 211-219), постулируя, что стадия ХЛЛ (определяемая с учетом размера опухоли, степени распространенности опухолевого процесса и вовлечения в процесс костного мозга) является самым сильным предиктором безрецидивной и общей выживаемости. В соответствии с полученными результатами авторы предлагают использовать в качестве дополнительного прогностического фактора сывороточный уровень ТК до начала лечения.
Однако полученные данные лишь косвенно свидетельствуют о том, что ТК коррелирует со стадией ХЛЛ и авторами не были установлены граничные значения, характерные для разных стадий ХЛЛ.
Известен способ оценки распространенности НХЛ по уровню экскреции в мочу дофамина. Авторы установили, что концентрация дофамина в моче с 8.00 до 20.00 часов находится в обратной зависимости от стадии заболевания: при I стадии - от 495,0 до 6,0 нмоль/сут, при II и III стадиях - 177,0-387,0 нмоль/сутки, а при IV - 47,0-173,0 нмоль/сутки (RU 2319148 С1).
Однако представленная закономерность выявлена при исследовании суммарно мочи 12 больных, то есть в каждой группе по стадиям было лишь несколько больных (например, с IV стадией - 2 больных). Для подтверждения выявленных границ требуются расширенные исследования. Кроме того, концентрации многих компонентов мочи зависят от питьевого режима, что не учитывается в данном изобретении. Как правило, для снижения неспецифического влияния питьевого режима на результаты, их нормируют на уровень креатинина. Кроме того, сбор мочи в течение дня представляется для обследуемого некомфортным. Авторы не уточняют, входит ли в анализ ночная моча (сильно отличающаяся по ряду компонентов от дневной), полученная в 8.00.
Известен способ установления диагноза лимфомы с помощью компьютерной томографии (далее - КТ) наряду с другими традиционными методами исследования - рентгенологическим, радионуклидным, ультразвуковым, лимфографией (Аносов Н.А. Компьютерно-томографическая диагностика неходжкинских лимфом. дис. канд. мед. наук. Санкт-Петербург. 1996 г. Военно-медицинская академия - 195 с.).
Часть из этих методов входят в спектр обязательных при диагностике ЛПЗ. Необходимость их сочетания - косвенное доказательство того, что каждый из них имеет те или иные ограничения. Так, лимфография, обладающая высокой чувствительностью и точностью, информативна не более чем у 7% больных лимфомами в связи с часто имеющимися у них образованиями, препятствующими распространению контрастного вещества. При УЗИ-диагностике большая часть узлов таза и груди остается недоступной для распознавания. КТ имеет высокую информативность и в распознавании, и при стадировании данной патологии, прежде всего при массивном локальном распространении лимфом, но не в случае увеличения изолированных узлов. Однако именно их наличие, наряду с конгломератами лимфоузлов, может влиять на выбор первоочередной лечебной тактики. Кроме того, высокая стоимость КТ-обследования, а также недостаточная оснащенность ряда лечебных учреждений соответствующей аппаратурой часто ограничивают возможность его использования.
Известен способ дифференциальной диагностики и прогноза НХЛ (Райхлин Н.Т., Букаева И.А., Пробатова Н.А. Значение аргирофильных белков областей ядрышковых организаторов в формировании опухолевого фенотипа неходжкинских злокачественных лимфом, их дифференциальной диагностике и в определении прогноза. // Гематология и трансфузиология. - 2000. - 45 (3) С. 52-57), основанный на оценке содержания в ткани опухоли аргирофильных белков, ассоциированных с областью ядрышковых организаторов (Ag-ОЯОР-белков). Этим белкам принадлежит важная роль в регуляции клеточного цикла, они определяют его продолжительность, время удвоения клеточной популяции и скорость пролиферации. Концентрация Ag-ОЯОР-белков в различных опухолях повышена по сравнению с соответствующими нормальными тканями, дисплазиями и доброкачественными опухолями и возрастает по мере прогрессирования злокачественного процесса. Авторы исследовали НХЛ низкой и высокой степени злокачественности и установили достоверно более высокое содержание данного класса белков в лимфомах высокой степени злокачественности. Это дает возможность использовать определение Ag-ОЯОР-белков в качестве дополнительных дифференциально-диагностических и прогностических признаков НХЛ.
Однако анализ содержания в ткани опухоли Ag-ОЯОР-белков не был проведен для других видов ЛПЗ, а также не осуществлен при разных стадиях НХЛ, что не позволяет применять указанный способ при уточнении стадии опухолевого процесса для выбора наиболее адекватной лечебной тактики больных ЛПЗ.
Известен способ дифференциальной диагностики лимфаденопатий и ЛПЗ у подростков (RU 2599100 С1). С заявляемым изобретением цитируемое объединяет метод - исследование в СК тимидинкиназы первого типа (далее ТК-1): при низких (10,6-14,8 Е/л) уровнях авторы предлагают диагностировать лимфаденит, при более высоких (39,6-45,0 Е/л) - лимфому Ходжкина. Известный способ лишь подтверждает наши данные о том, что при ЛПЗ уровни ТК-1 повышаются. Исследования ТК-1 для стадирования ЛПЗ авторы не проводили.
Известен метод исследования концентрации сывороточного β2-микроглобулина (β2-МГ), лактатдегидрогеназы и ТК-1 у больных крупноклеточной лимфомой, где нормальный уровень всех показателей до лечения соответствует низкому риску (трехлетняя выживаемость - 91%), повышение концентрации одного или двух маркеров - среднему риску (трехлетняя выживаемость - 36%), а повышение концентрации указанных показателей - высокому риску (трехлетняя выживаемость - 0%) (Suki S., Swan F.Gr., Tucker S., Fritsche H.A., Redman J.R., Rodriguez M.A., McLaughlin P., Romaguera J., Hagemeister F.B., Velasquez W.S., et al. Risk classification for large cell lymphoma using lactate dehydrogenase, beta-2 microglobulin, and thymidine kinase. // Leuk. Lymphoma. - 1995 - 18 (1-2): P. 87-92).
Однако найденная авторами закономерность предложена только для крупноклеточной лимфомы, составляющей лишь небольшую часть ЛПЗ. Авторы прогнозируют не стадию ЛПЗ, а агрессивность заболевания, от которой также зависит выживаемость. Очевидно, что чем выше уровень маркеров до начала лечения, тем хуже прогноз, так как маркеры косвенно отражают стадию заболевания.
Известен способ прогнозирования чувствительности к XT у больных ЛПЗ (RU 2593020 С2), основанный на оценке сывороточных уровней ТК-1 и β2-МГ. Измеряя уровень ТК-1 на старте лечения, можно спрогнозировать чувствительность опухоли к XT у больного НХЛ или ЛГМ. И если уровень ТК-1 будет менее 150,0 дЕд/л, то в результате 6-8 курсов XT, будет достигнута полная ремиссия (ПР) или частичная (ЧР). Тот же прогноз можно сделать, измерив при данных видах ЛПЗ до начала XT уровень β2-МГ. И в случае, когда он окажется ниже 2200,0 дЕд/л после 6-8 курсов XT будет диагностирована ПР или ЧР. Также установлено, что возрастание уровня ТК-1 после 1-го курса более, чем в 4 раза от исходного значения, позволяет прогнозировать эффективность XT и достижения ПР или ЧР.
Описанный способ основан на определении активности ТК-1 и концентрации β2-МГ для прогнозирования чувствительности опухоли к XT у больного ЛПЗ (НХЛ или ЛГМ). Исследования ТК-1 для уточнения стадии ЛПЗ авторы не проводили.
Известен способ диагностики, прогноза течения опухолевого процесса и оценки ответа на лечение В-клеточных ЛПЗ, в частности, классической лимфомы Ходжкина и диффузной крупноклеточной лимфомы (WO 2014197936 (А1) - 2014-12-18). Способ основан на оценке экспрессии микро РНК - miRNA-1.973, miRNA-638 и miRNA-494. Авторы показали, что высокие уровни микро РНК ассоциированы с рядом В-клеточных ЛПЗ.
Однако, авторами не проводилось изучение зависимости уровней экспрессии изученных микроРНК от стадии опухолевого процесса. Кроме того, следует отметить, что в настоящее время метод определения микроРНК имеет высокую стоимость и не является общедоступным для многих медицинских учреждений.
Известен способ оценки экспрессии галектина-1 (Gall), (ЕР 3168232 (А1) - 2017-05-17), основанием для разработки которого стали данные, свидетельствующие о сверхэкспрессии этого белка вирусассоциированными лимфобластными клетками у пациентов с ЛПЗ, возникшими после трансплантации органов.
Авторами установлено, что уровень экспрессии Gall коррелирует с наличием вирус-ассоциированных посттрансплантационных лимфопролиферативных расстройств, являющихся потенциально фатальными. Авторы полагают, что данный способ в дальнейшем даст возможность для выявления, стадирования и оценки других характеристик вирусассоциированных посттрансплантационных лимфопролиферативных расстройств. Таким образом, изобретение является предпосылкой для развития будущих методов диагностики, стадирования и мониторинга больных с вирусассоциированными посттрансплантационными лимфопролиферативными заболеваниями.
Самым близким к заявляемому способу является исследование (Загоскина Т.П., Зотина Е.Н., Крюкова М.Г., Куликова М.М., Шардаков В.И. Содержание тимидинкиназы в сыворотке крови у больных хроническим лимфолейкозом // Практическая медицина. - 2012. - №5 (60). - С. 138-142) содержания ТК в СК при одном из ЛПЗ - ХЛЛ. Авторы установили, что уровень ТК не зависит от возраста больных, но достоверно выше при уровнях в периферической крови: тромбоцитов <100×109/л, гемоглобина <110 г/л, лейкоцитов ≥100×109/л, лимфоцитов ≥50×109/л, ЛДГ >480 ед./л, а также при наличии лимфоадненопатии и очаговой опухолевой инфильтрации костного мозга. При агрессивном течении ХЛЛ концентрация ТК была выше, чем при индолентном или «застывшем». Авторами был проведен анализ уровней ТК в зависимости от степени распространенности опухолевого процесса. Так у больных с «продвинутыми стадиями» (В и С по Binet) наблюдалось более достоверно значимое повышение маркера (среднее значение - 25,9; диапазон - 20,7-31,2 Ед/л) по сравнению с таковым у пациентов со стадией А (среднее значение - 14,0; диапазон - 12,3-15,8 Ед/л).
Однако авторы не предложили значимые для стадирования границы уровней данного фермента у больных ХЛЛ. Кроме того, в работе был использован радиоиммунологический метод определения ТК, который в настоящее время применяется ограниченно, в отличие от иммуноферментного метода определения ТК-1, не требующего сложных согласований как в случае с методиками на основе радиоактивных меток.
В заявляемом нами способе предлагаются границы уровней ТК-1, позволяющие уточнить стадию (согласно TNM-классификации) ЛПЗ разных гистологических подтипов. Активность ТК-1 определяется с помощью доступного иммуноферментного метода определения фермента, что подтверждается данными стадиезависимости сывороточной ТК-1 при ЛПЗ (НХЛ и ЛГМ). При этом стадиезависимость ТК-1, измеренного до начала лечения более выражена, чем у традиционно используемых сывороточных маркеров ЛПЗ - ЛДГ и β2-МГ. Оценка активности ТК-1 в СК больных ЛПЗ (НХЛ и ЛГМ) до начала лечения позволяет уточнить стадию опухолевого процесса, обеспечивая адекватный объем лечебных мероприятий и, в конечном итоге, улучшение как непосредственных, так и отдаленных результатов лечения.
Техническим результатом заявленного способа является разработка алгоритма уточнения стадии опухолевого процесса у больных ЛПЗ (НХЛ и ЛГМ).
Указанный технический результат при осуществлении изобретения достигается за счет того, что также как и в известном способе проводят анализ активности ТК.
Особенность заявляемого способа заключается в том, что в сыворотке крови больных ЛПЗ до начала химиотерапии определяют иммуноферментным методом активность тимидинкиназы-1, и если:
- активность ТК-1>2000,0 дЕд/л, то опухолевый процесс по распространенности относят к III-IV стадиям;
- активность ТК-1>3350,0 дЕд/л, то опухолевый процесс по распространенности относят к IV стадии.
Изобретение поясняется подробным описанием, клиническими примерами, таблицей и иллюстрацией, на которой изображено распределение больных ЛПЗ с разными стадиями процесса в зависимости от уровней ТК-1.
Способ уточнения стадии ЛПЗ осуществляется следующим образом.
Берут образец СК пациента с ЛПЗ (НХЛ или ЛГМ) до начала лечения. Определение активности ТК-1 в образцах СК проводят иммуноферментным методом на анализаторе LIAISON с соответствующими наборами для оценки ТК-1 («DiaSorin Deutschland GmbH», Германия) методом непрямого 2-ступенчатого конкурентного хемилюминесцентного иммуноанализа.
У пациента лимфопролиферативным заболеванием (НХЛ или ЛГМ) по совокупности полученных результатов уточняется стадия опухолевого процесса в зависимости от уровня ТК-1, и если:
- активность ТК-1>2000,0 дЕд/л, то опухолевый процесс по распространенности относят к III-IV стадиям;
- активность ТК-1>3350,0 дЕд/л, то опухолевый процесс по распространенности относят к IV стадии.
Реализация предлагаемого способа занимает около 2-х часов.
Преимущества данного способа демонстрируются представленными ниже данными.
Структура обследованных групп больных:
- больные ЛПЗ (НХЛ и ЛГМ) до лечения (n=100); среди них: 7 больных с I стадией, 32 - со II, 24 - с III и 37 пациентов - с IV стадией опухолевого процесса.
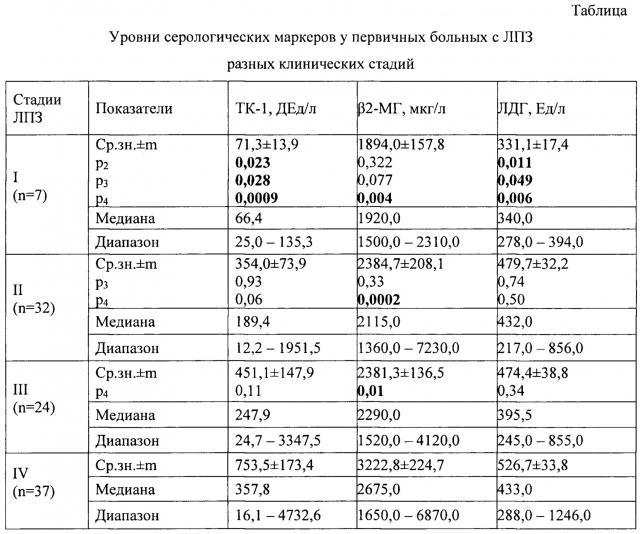
Исходные уровни активности ТК-1 у больных ЛПЗ (НХЛ и ЛГМ) возрастали с увеличением стадии процесса существенно более выражено, чем значения традиционно используемых серологических маркеров - β2-МГ и ЛДГ (см. Табл.).
Примечание:
р2, р3, р4 - достоверность различий по уровню ОМ между больными с II, III и IV стадией ЛПЗ соответственно (U-критерий Манна-Уитни).
Так, средние уровни ТК-1 быстро возрастали с увеличением стадии заболевания от 71,3±13,9 дЕд/л при I стадии до 753,5±173,4 дЕд/л при IV (р=0,009). То есть от I к IV стадии этот показатель увеличивался более чем в 10 раз. Сходным образом с ростом стадии возрастали и медианы: от 66,4 до 357,8 дЕд/л.
При рутинном использовании в клинической практике при ЛПЗ β2-МГ стадиозависимость оказалась существенно менее выраженной. Средние значения и медианы данного маркера также возрастали от I до IV стадии ЛПЗ, но менее чем в 2 раза, составляя при I стадии 1894,0±157,8 и 1920,0 мкг/л, а при IV - 3222,8±224,7 и 2675,0 мкг/л соответственно (р=0,004).
Близкой к β2-МГ оказалась стадиозависимость и у ЛДГ. Кратность возрастания уровней (средних значений и медиан) этого фермента от I к IV стадии не превышала двух раз (331,1±17,4 vs 526,7±33,8 и 340,0 vs 433,0 Ед/л, р=0,006).
Детальный анализ значений ТК-1 при разных стадиях ЛПЗ позволил выявить закономерность: ни у одного больного из всех с I стадией уровень ТК-1 не превышал 150,0 дЕд/л, со II стадией - 2000,0 дЕд/л и с III стадией - 3350,0 дЕд/л (см. фиг.). Сходных или иных закономерностей в отношении других опухолевых маркеров (β2-МГ и ЛДГ) выявлено не было. Следовательно, исходные уровни ТК-1 на диагностическом этапе ЛПЗ могут быть использованы для уточнения стадии опухолевого процесса. В частности, исходный уровень этого маркера, превышающий 2000,0 дЕд/л, свидетельствует о III-IV стадии ЛПЗ, а более 3350 дЕд/л - о IV стадии ЛПЗ.
Предлагаемый способ подтверждается конкретными примерами использования.
Пример 1. Больной Ш., 50 лет. После перенесенного ОРВИ врач обнаружил у пациента увеличение правой небной миндалины, шейных и паховых лимфоузлов. Проведена антибактериальная терапия, без клинического эффекта. В течение последующего месяца наблюдения выявлено увеличение подчелюстных и подмышечных лимфоузлов.
При обследовании в онкологической клинике: общий анализ крови: гемоглобин - 172 г/л, тромбоциты - 230×109/л, лейкоциты - 10,4×109/л, СОЭ 2 мм/ч; биохимический анализ крови: уровень ЛДГ 565 ед./л (норма - 225-450 ед./л), остальные показатели находились в пределах нормы. По данным УЗИ выявлено опухолевое поражение всех групп периферических лимфоузлов, средостения и забрюшинного пространства, гепатоспленомегалия. На основании гистологического и иммуногистохимического (ИГХ)-исследований биопсийного материала из измененного шейного лимфоузла диагностирована В-клеточная мелкокруглоклеточная лимфома, IV-Б ст.
Дополнительно установлено опухолевое поражение печени, селезенки, костного мозга. При госпитализации: в гемограмме - лейкоцитоз 27×109/л (нормобласты 13%), миелемия до бластных форм, глубокая тромбоцитопения, умеренная анемия; по биохимическому анализу - незначительная билирубинемия и гипоальбуминемия, повышение уровня трансаминаз и щелочной фосфатазы, ЛДГ - 829 ед./л, снижение уровня креатинина. При цитологическом исследовании костного мозга - гиперклеточность, недифференцированные бласты 72,5% (миелопероксидаза - отрицательно в 100%). Таким образом, по результатам проведенного комплексного обследования была диагностирована трансформация В-клеточной лимфомы в острый лейкоз.
Иммуноферментным методом в СК оценили активность ТК-1. Результат - 4732,6 дЕд/л, то есть показатель был выше 3350,0 дЕд/л, что соответствует IV стадии опухолевого процесса.
Пример 2. Больная К., 31 года. Обратилась к врачу по месту жительства по поводу увеличения лимфоузлов шеи слева. Проведение антибиотикотерапии было без эффекта. В МНИОИ им. П.А. Герцена, была проведена тотальная биопсия лимфоузлов нижней трети шеи справа. По данным морфологического и ИГХ-исследований шейных лимфоузлов - ЛГМ, лимфоидное истощение, ретикулярный вариант. Гистологическое исследование биоптата костного мозга не показало опухолевого поражения.
Таким образом, по результатам проведенного согласно стандартам рекомендованным для больных ЛПЗ комплексного обследования установлен диагноз ЛГМ, лимфоидное истощение, IIIБ стадия, с вовлечением периферических лимфоузлов (подчелюстных, шейных, надключичных, подключичных, подмышечных, затылочных слева), забрюшинных и внутрибрюшинных лимфоузлов.
Иммуноферментным методом оценили активность ТК-1, равную 3347,5 ДЕд/л, то есть показатель находился в диапазоне 2000,0 дЕд/л - 3350,0 дЕд/л, что соответствует III или IV стадии.
Пример 3. Больной П., 21 год. После санации полости рта длительно сохранялся отек верхней челюсти слева, периодически беспокоили парестезии в нижней губе и нижней челюсти (больше справа). При повторном обращении к стоматологу была выполнена экстракция 6-го зуба верхней челюсти слева, и через несколько дней, в связи с усилением парестезий и появлением болевого синдрома в нижней челюсти, выполнена экстракция 6-го зуба нижней челюсти справа. Через 2 недели в лунке удаленного 6-го зуба верхней челюсти слева и в прилежащих мягких тканях появилось быстрорастущее опухолевое образование. С диагнозом «рак верхней челюсти слева» больной был направлен в онкодиспансер, где была выполнена биопсия опухоли верхней челюсти. По данным морфологического исследования диагностирована НХЛ. По срочным показаниям больной госпитализирован в отделение высокодозной химиотерапии с блоком трансплантации костного мозга.
Дополнительно осуществлено ИГХ-исследование, по результатам которого было сделано заключение о лимфоме Беркитта. При цитогенетическом исследовании костного мозга обнаружен клон клеток с транслокацией t(8;14)(q24;q32). Молекулярно-генетическое исследование костного мозга показало повышенный уровень экспрессии мРНК гена c-myc.
По результатам комплексного обследования был поставлен диагноз: лимфома Беркитта, IVxES-Б ст. с поражением левой гайморовой пазухи, тела и альвеолярного отростка верхней челюсти слева (с их деструкцией) и прилежащих мягких тканей, периферических лимфоузлов (шейных справа, подчелюстных, над- и подключичных, подмышечных, паховых и бедренных с обеих сторон), парастернального справа, абдоминальных, забрюшинных (Bulky disease) и тазовых лимфоузлов, желудка, поджелудочной железы, петли тонкой кишки, левой доли печени, селезенки, почек, брюшины, малого и большого сальников, яичек, костного мозга, со следовой секрецией белка Бенс-Джонса λ. Осложнения основного заболевания: полиорганная недостаточность (печеночная, почечная, дыхательная). Двусторонний плеврит. Асцит.
Иммуноферментным методом оценили активность ТК-1, равную 3696,6, то есть показатель был выше 3350,0 дЕд/л, что соответствует IV стадии ЛПЗ.
Таким образом, заявленный способ направлен на уточнение стадии опухолевого процесса у больных ЛПЗ, что будет способствовать выбору оптимального метода лечения и может улучшить прогноз течения заболевания за счет рационализации терапии. Кроме социального и медицинского применения, изобретение имеет экономический эффект, так как позволяет уменьшить вероятность назначения малоэффективной терапии, сэкономив на закупке (для конкретного больного) дорогостоящих лекарственных препаратов.
Лабораторный способ выявления распространенных стадий лимфопролиферативных заболеваний, включающий результаты клинических исследований, лучевых, морфологических, иммуноморфологических, лабораторных методов исследования и анализ активности тимидинкиназы-1 (ТК-1), отличающийся тем, что в сыворотке крови больных до начала химиотерапии определяют иммуноферментным методом активность тимидинкиназы-1, и если:
- активность ТК-1 более 2000,0 дЕд/л, но менее 3350,0 дЕд/л, то опухолевый процесс по распространенности относят к III-IV стадиям;
- активность ТК-1>3350,0 дЕд/л, то опухолевый процесс по распространенности относят к IV стадии.