Способ подготовки эритроцитов для использования в флуоресцентной микроскопии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для подготовки эритроцитов при проведении метода флуоресцентной in situ гибридизации (FISH). Для этого полученную от пациента кровь трехкратно отмывают центрифугированием при 1000 об/мин в фосфатно-солевом буфере с рН 7,4 в течение 5 мин. Затем доводят до одномиллионной концентрации клеток в миллилитре. После чего пробу объемом 1 мл осаждают центрифугированием при 1000 об/мин в течение 5 мин. Ресуспендируют в 400 мкл 0,5% раствора глутарового альдегида и фиксируют в течение 30 мин при 25°С. Фиксированные эритроциты промывают фосфатно-солевым буфером с рН 7,4. Затем снова ресуспендируют в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С. Затем эритроциты снова промывают в фосфатно-солевом буфере с рН 7,4 центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 300 мкл дистиллированной воды. Изобретение позволяет выделить эритроциты из исследуемых образцов крови без изменения их размера и формы с сохранением четко выраженных границ клеток и центральной впадины диска и выявить бактерии на поверхности и внутри эритроцитов при проведении диагностики септических состояний пациентов. 4 ил., 2 пр., 1 табл.
Реферат
Изобретение относится к области медицины, а именно к лабораторной диагностике бактериологических лабораторий в лечебных учреждениях, НИИ и может быть использовано для изучения взаимодействия про- и эукариот методом флуоресцентной микроскопии для выявления микроорганизмов при развитии бактериемии и сепсиса.
На сегодняшний день актуальной остается проблема взаимодействия про- и эукариот. Разные виды микроорганизмов могут поражать различные типы клеток организма хозяина, в основном эпителиальные, дендритные клетки и макрофаги [Розов С.М., Дейнеко Е.В. Бактериальные внутриклеточные патогены: стратегии нападения и защиты // Успехи современной биологии. 2015, т. 135, №5, С. 464-479]. Но в последнее время все чаще можно встретить работы, где описывают нахождение микроорганизмов внутри эритроцитов [Potgieter М., Bester J., Douglas В. Kell, Pretorius E. The dormant blood microbiome in chronic, inflammatory diseases // Microbiology Reviews. 2015, fuv013, №39, P. 567-591], например, Bartonella bacilliformis [Dechio С. Infection-associated type IV secretion systems of Bartonella and their diverse roles in host cell interaction // Cell Microbiol. 2008, m. 10, №8, P. 1591-1598], Brucella melitensis [Vitry M.A, Hanot Mambres D., Deghelt M., Hack K., Machelart A., Lhomme F., et al. Brucella melitensis invades murine erythrocytes during infection // Infect Immun. 2014, №82, P. 3927-38], Streptococcus pneumoniae [Yamaguchi M., Terao Y, Mori-Yamaguchi Y, Domon H, Sakaue Y, Yagi T, et al. Streptococcus pneumoniae invades erythrocytes and utilizes them to evade human innate immunity // PLoS One. 2013, №8, P. 77282], Mycoplasma suis [Zhang Y, Zou Y, Ma P., Muhammad KM., Li Y, Jiang P. Identification of Mycoplasma suis MSG1 interaction
proteins on porcine erythrocytes // Arch Microbiol. 2014, №80, P. 7551-60], Staphylococcus epidermidis [Щуплова E.A., Стадников A.A., Фадеев С.Б. Роль биологических свойств Staphylococcus epidermidis во внутриэритроцитарной инвазии и изменении активности каталазы и супероксиддисмутазы эритроцитов при экспериментальной генерализованной инфекции // Бюллетень экспериментальной биологии и медицины. 2015, т. 159, №1, С. 79-82], часто приводящие к развитию бактериемии и сепсиса [Рудное В.А. Сепсис: современные подходы к диагностике и интенсивной терапии // Вестник анестизиологии и реанимотологии. 2010; т. 7 №1, С. 48-57]. Для изучения взаимодействия бактерий с эритроцитами используют разные методы и виды микроскопии: световую, электронную, атомно-силовую, люминесцентную, конфокальную лазерную сканирующую и другие. Известен метод флуоресцентной in situ гибридизации (fluorescent in situ hybridization, FISH), позволяющий одновременно обнаружить бактерии в кровотоке у септических больных и на молекулярно-генетическом уровне провести их идентификацию. При регистрации результатов FISH также необходима флуоресцентная микроскопия [Гаврилов С.Н, Скачкова Т.С., Шипулина О.Ю., Савочкина Ю.А., Шипулин Г.А., Малеев В.В. Современные молекулярно-генетические методы, используемые для этиологической диагностики сепсиса // Журнал микробиологии, эпидемиологии и иммунобиологии. 2016, №2, С. 91-99]. Для каждого вида микроскопии необходимы соответствующие способы подготовки эритроцитов, особенно если дальнейшие манипуляции подразумевают использование высокого температурного режима до 60°С и выше, например при FISH. Однако способы подготовки эритроцитов для исследования оказывают влияние на морфологические характеристики клетки, изменяя форму, размер и глубину центральной впадины диска. В доступных литературных источниках приводятся противоречивые данные о способах фиксации, концентрации фиксатора, длительности фиксации эритроцитов для флуоресцентной микроскопии.
Известны способы фиксации эритроцитов при использовании атомно-силовой микроскопии [Белоусова О.Д., Толмачев И.А., Гайдаш А.А., Левичев В.В. и др. Особенности подготовки проб крови для исследования морфологических параметров и структуры мембран эритроцитов методом атомно-силовой микроскопии // WWW.MEDLINE.RU, Судебная медицина. 2012, т. 13, С. 954-966]. Авторы использовали два способа приготовления мазков и различные варианты их фиксации. Один способ стандартный, при котором мазки из цельной крови готовили на обезжиренных стеклянных подложках (покровных стеклах) и высушивали на воздухе при температуре 24°С в течение 10 мин, далее часть мазков фиксировали на стеклянной подложке 96% этиловым спиртом, другую часть глутаровым альдегидом с различной концентрацией от 0,5 до 2,5% и различной экспозицией фиксатора (от 30 с до 90 мин). После фиксации раствором глутарового альдегида часть мазков была промыта в этиловом спирте в возрастающих концентрациях от 30 до 80%. На завершающем этапе химической фиксации мазки крови высушивали на воздухе при температуре окружающего воздуха 24°С.
Недостатком способа является низкая возрастающая концентрация раствора этилового спирта от 30 до 80%, при которой происходит недостаточная химическая фиксация для проведения дальнейших манипуляций, связанных с применением высоких температур до 60°С, например, метод флуоресцентной in situ гибридизации.
Другой недостаток заключается в том, что имеется дополнительный этап - фиксирование эритроцитов 96% этиловым спиртом к стеклянной подложке, что является лишним для подготовки эритроцитов при использовании флуоресцентной микроскопии. Время экспозиции фиксатора слишком «растянуто» от 30 с до 90 мин, что для подготовки эритроцитов к флуоресцентной микроскопии не подходит.
Другой способ - иммерсионный, при котором цельную кровь в количестве 20 мкл помещали в емкости с 2 мл фиксирующей жидкости. В качестве основной фиксирующей жидкости был использован водный раствор
глутарового альдегида в концентрациях от 0,5 до 2,5%. После экспозиции цельной крови в указанных растворах (от 30 с до 90 мин) готовили мазки и высушивали их на воздухе при 24°С в течение 10 мин.
В данном способе недостатком, как и в первом, является то, что авторы высушивали мазки на воздухе при 24°С в течение 10 мин, а для приготовления образцов крови для флуоресцентной микроскопии высушивание не подходит, так как у эритроцитов при дальнейших манипуляциях могут изменяться морфологические параметры клеток. Время экспозиции очень «размыто» (от 30 с до 90 мин), хотя достаточно 30 мин [Лобов И.А., Давлеткилъдеев Н.А. Влияние способа подготовки образца на морфофункционалъные характеристики эритроцитов при исследовании методом атомно-силовой микроскопии // Вестник Омского университета. 2013, №2, С. 129-132].
Известен способ подготовки эритроцитов для проведения реакции непрямой иммуннофлуоресценции с использованием конфокальной лазерной сканирующей микроскопии [Бухарин О.В., Усвяцов Б.Я., Щуплова Е.А. Антигемоглобиновая активность бактерий при взаимодействии с эритроцитами и ее роль в патогенезе анемии при инфекции // Гематол. и трансфузиол., 2011, т. 56, №1, С. 3-6]. В данном способе авторы использовали для фиксации 4% раствор параформальдегида и затем 96% раствор этанола.
Недостатком данного способа является то, что после фиксации 4% раствором параформальдегида сильно изменяются морфологические параметры эритроцитов, под люминесцентным микроскопом обнаруживаются размытые контуры клеток (фиг. 1).
Другим недостатком является то, что после добавления 96% раствора этанола эритроциты чаще приобретают звездчатую форму (астроциты) и становится трудно изучать взаимодействие бактерий с эритроцитами (фиг. 2).
Однако представленные способы недостаточно хорошо фиксируют мембрану эритроцитов для проведения методов, использующих высокий температурный диапазон. В связи с чем, актуальным является разработка способа подготовки эритроцитов для методов флуоресцентной микроскопии, а также
их использования в методах флуоресцентой in situ гибридизации, при проведении которых температура нагрева доходит до 60°С.
Задачей заявляемого технического решения является создание способа подготовки эритроцитов, исключающего изменений морфологических параметров (формы и размера) клеток, устойчивых к высоким температурным воздействиям во время проведения FISH, а также для использования эритроцитов при других методах флуоресцентной микроскопии.
Для решения указанной задачи в заявляемом способе полученную от пациента кровь, трехкратно отмывали центрифугированием при 1000 об/мин в фосфатно-солевом буфере с рН=7,4 в течение 5 мин, доводили до одномиллионной концентрации клеток в миллилитре, затем пробу объемом 1 мл осаждали центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 400 мкл 0,5% раствора глутарового альдегида, фиксировали в течение 30 мин при 25°С, фиксированные эритроциты промывали фосфатно-солевым буфером с рН=7,4, ресуспендировали в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С, затем эритроциты снова промывали в фосфатно-солевом буфере с рН=7,4 центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 300 мкл дистиллированной воды, далее опытные образцы обрабатывали для проведения метода флуоресцентной in situ гибридизации и регистрацию результатов проводили с помощью люминесцентной или конфокальной лазерной сканирующей микроскопии.
Технический результат от реализации изобретения выражается в создании способа подготовки эритроцитов для проведения метода флуоресцентной in situ гибридизации (FISH) с возможностью обнаружения эритроцитов соответствующего размера и формы, с четко выраженными границами клеток, глубиной центральной впадины диска. При таком способе подготовки эритроцитов возможно выявление бактерий на поверхности и внутри эритроцитов,
а также одновременная их идентификация при использовании методов флуоресцентной микроскопии.
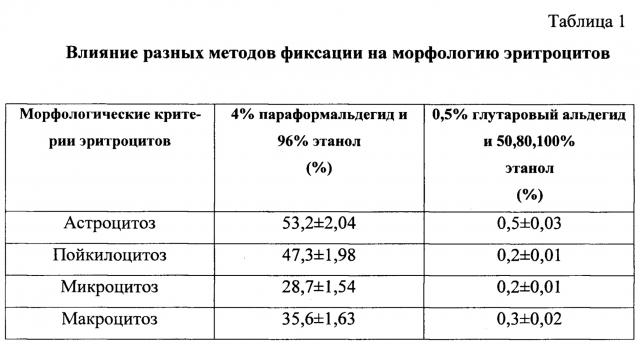
Авторы экспериментально разработали оптимальный протокол, обеспечивающий наиболее эффективные этапы подготовки эритроцитов, исключающий их лизис, к проведению дальнейших манипуляций для флуоресцентной микроскопии. Авторы подобрали условия необходимые при получении качественных образцов крови для выявления бактерий, локализованных на поверхности или внутри эритроцитов, используя метод FISH, и регистрируя с помощью люминесцентной или конфокальной лазерной сканирующей микроскопии. Авторы для работы брали только свежевыделенные эритроциты, так как эритроциты со сроком хранения несколько дней не выдерживали этапы фиксации и изменяли свою форму и размер. Далее авторы подобрали режим фиксации эритроцитов, для того чтобы они выдерживали температуру нагрева до 60°С и не лизировались. Для этого авторы использовали 0,5% раствор глутарового альдегида, время инкубации опытных образцов составило 30 мин при 25°С. Авторы установили, что при фиксации 0,5% раствором глутарового альдегида эритроциты оставались красно-розового цвета, сохраняли четко выраженные контуры и характерное двояковогнутое углубление в середине клетки (фиг. 3).
После обработки 0,5% раствором глутарового альдегида авторы использовали раствор этанола с последовательно увеличивающимися концентрациями: 50, 80 и 100% раствор. Время инкубации в каждом растворе составляло 10 мин при 4°С. Авторы установили, что комбинация, состоящая из 0,5% раствора глутарового альдегида с последующим добавлением раствора этанола с восходящими концентрациями 50, 80 и 100% способствует укреплению мембран эритроцитов и не приводит к образованию астроцитоза, микро-макроцитоза, а также пойкилоцитозу. Результаты исследования представлены в таблице 1.
В опытных образцах авторы наблюдали эритроциты с типичной для них формой и размером, а также с четко выраженным углублением в середине клетки. Авторы обнаружили адгезию бактерий (S. epidermidis 7) к эритроцитам и в некоторых образцах внутриэритроцитарно расположенные бактерии (фиг. 4).
Способ осуществляется следующим образом:
1) Кровь от пациента трехкратно отмывают центрифугированием при 1000 об/мин мин в фосфатно-солевом буфере с рН=7,4 в течение 5 и доводят до одномиллионной концентрации клеток в миллилитре.
2) Пробу объемом 1 мл осаждают центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 400 мкл 0,5% раствора глутарового альдегида, фиксируют в течение 30 мин при 25°С.
3) Фиксированные эритроциты промывают фосфатно-солевым буфером с рН=7,4 и ресуспендируют в растворах этанола с восходящей
концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С.
4) Эритроциты промывают в фосфатно-солевом буфере с рН=7,4 центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 300 мкл дистиллированной воде.
Примеры конкретного выполнения способа.
Пример 1. Больной Г., 1959 г.р. поступил в ООКБ №1 с диагнозом: «Апостематозный пиелонефрит, сепсис». Взяли кровь у больного и подготовили эритроциты по разработанному способу для дальнейшего проведения метода флуоресцентной in situ гибридизации (FISH). При таком способе подготовки эритроцитов возможно выявление бактерий на поверхности и внутри эритроцитов, а также одновременная их идентификация, что позволит подтвердить поставленный диагноз у больного. Для проведения исследования полученную от пациента кровь трехкратно отмывали центрифугированием при 1000 об/мин в фосфатно-солевом буфере с рН=7,4 в течение 5 мин, доводили до одномиллионной концентрации клеток в миллилитре, затем пробу объемом 1 мл осаждали центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 400 мкл 0,5% раствора глутарового альдегида, фиксировали в течение 30 мин при 25°С, фиксированные эритроциты промывали фосфатно-солевым буфером с рН=7,4, ресуспендировали в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С, затем эритроциты снова промывали в фосфатно-солевом буфере с рН=7,4 центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 300 мкл дистиллированной воды. С помощью разработанного способа эритроциты подготовили для проведения метода FISH. Для этого полученные аликвоты по 100 мкл фиксированных клеток осаждали центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 100 мкл буферного раствора для гибридизации (0,9 М NaCl и 20 mM Tris-HCl, рН=7), содержащего 500 нМ ДНК-зонд, меченный на
5'-конце флуоресцеина изотиоцианатом (FITC). Далее проводили гибридизацию при 56°С в течение 5 ч. После гибридизации клетки центрифугировали при 1000 об/мин в течение 5 мин и добавляли 500 мкл промывочного раствора для удаления ДНК-зонда, не связавшихся с ДНК бактериями в исследуемом образце крови, инкубировали в течение 30 мин при 56°С.После гибридизации клетки центрифугировали и ресуспендировали в 300 мкл дистиллированной воды. Эритроциты дополнительно окрашивали синим Эванса, обеспечивающего красное свечение клеток. Регистрацию результатов FISH проводили с помощью конфокального лазерного сканирующего микроскопа Olympus FV 1000 (Olympus Corporation, Япония) с использованием 100 х иммерсионного объектива (числовая апертура 1,4). В результате исследования в образце крови пациента с помощью разработанного способа наблюдали эритроциты с типичной для них формой и размером, а также с четко выраженным углублением в середине клетки, обнаружили адгезию бактерий к эритроцитам и их внутриэритроцитарное расположение. Было сделано заключение о том, что разработанный способ подготовки эритроцитов позволяет получить качественные эритроциты для их использования в методе флуоресцентной in situ гибридизации, что способствует подтверждению поставленного диагноза.
Пример 2. Больная Я., 1953 г.р. поступила в ООКБ №1 с предположительным диагнозом: «Сепсис». У больной была взята кровь для исследования. Образец крови пациентки обрабатывали согласно примеру 1. В результате исследования наблюдали эритроциты правильной формы и размером, а также с четкими границами клеток и характерному углублению в середине эритроцита. В исследуемом образце крови не обнаружили эритроциты с признаками астроцитоза, микро-, макроцитоза, пойкилоцитоза а также не наблюдали бактерий со специфическим свечением. Предполагаемый диагноз у больной не подтвердился. Было сделано заключение о том, что разработанный способ подготовки эритроцитов позволяет получить качественные эритроциты для использования в флуоресцентной in situ гибридизации.
Таким образом, заявляемый способ позволяет повысить качество подготовки эритроцитов в исследуемых образцах крови для проведения флуоресцентной in situ гибридизации, а также для других методов флуоресцентной микроскопии, что может способствовать точности диагностики при септических состояниях пациентов и может быть использован в клинических лабораториях лечебных учреждений, а также в НИИ при изучении взаимодействий про- и эукариот.
Способ подготовки эритроцитов для проведения метода флуоресцентной in situ гибридизации (FISH), заключающийся в том, что полученную от пациента кровь трехкратно отмывают центрифугированием при 1000 об/мин в фосфатно-солевом буфере с рН =7,4 в течение 5 мин, доводят до одномиллионной концентрации клеток в миллилитре, затем пробу объемом 1 мл осаждают центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 400 мкл 0,5% раствора глутарового альдегида, фиксируют в течение 30 мин при 25°С, фиксированные эритроциты промывают фосфатно-солевым буфером с рН =7,4, ресуспендируют в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С, затем эритроциты снова промывают в фосфатно-солевом буфере с рН =7,4 центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 300 мкл дистиллированной воды.