Тест-система на основе конъюгатов "полимерная микросфера-тиреоглобулин" для экспресс-диагностики аутоиммунных заболеваний щитовидной железы
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а также к аналитической и органической химии. Тест-система для экспрессного определения аутоиммунных антител к тиреоглобулину человека содержит фосфатный буфер и суспензионную композицию полимерных микросфер со средним размером от 1,0 до 5,0 мкм из поли(2-метил-5-винилпиридина), у которых к карбоксиметильным группам, связанным с поверхностью микросфер через атом азота пиридина, ковалентно присоединены молекулы тиреоглобулина. Также заявлен способ получения данной тест-системы и диагностический набор, включающий указанную тест-систему. Группа изобретений обеспечивает расширение арсенала средств аналогичного назначения и сокращение времени анализа без ухудшения качества определения в интервале содержаний аутоиммунных антител к тиреоглобулину от 10 до 2000 МЕ/мл. 3 н.п. ф-лы, 2 табл., 9 пр.
Реферат
Изобретение относится к области медицины, а также к аналитической и органической химии. Более конкретно, изобретение представляет собой тест-систему с ковалентно иммобилизованным тиреоглобулином, предназначенную для экспресс-диагностики аутоиммунных заболеваний щитовидной железы, на основе полимерных микросфер из поли(2-метил-5 винилпиридина), модифицированных тиреоглобулином, и способ ее получения.
В настоящее время для диагностики различных заболеваний, в том числе - аутоиммунных заболеваний щитовидной железы, таких как тиреоидит Хасимото, базедова болезнь и др., широко распространены методы иммуноферментного анализа (ИФА), основанные на реакциях «антиген-антитело». [Tijssen P. Practice and theory of enzyme immunoassays. - N.-Y: Elsevier. - 1985. - 502 p.; Егоров A.M, Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа. - М.: Высшая школа. - 1991. - 288 с]. Такие методы сравнительно редко дают ложноположительные или ложноотрицательные результаты, однако существенными недостатками являются сложность постановки и длительность проведения иммуноферментной реакции. Кроме того, многие реагенты ИФА недостаточно стабильны при хранении и применении, что ухудшает межлабораторную воспроизводимость, а также внутрилабораторную воспроизводимость на разных партиях. Также, зачастую, возникает проблема недостаточной специфичности и чувствительности метода.
В качестве альтернативы методам ИФА интерес представляют методы иммунодиагностики, основанные на реакции латексной агглютинации (РЛА) [Кедик С.А., Грицкова И.А., Прокопов Н.И., Станишевский Я.М., Панов А.В., Суслов В.В., Петрова Е.А. Высокочувствительные тест-системы на основе конъюгатов «полимерная микросфера - биолиганд» для экспресс-диагностики протеинопатий // Тонкие химические технологии. - 2013. - Т. 8, №4. - С.3-10. и Грицкова И.А., Прокопов Н.И., Быков В.А. Полимерные микросферы в диагностике. - М.: Научно-исследовательский и учебно-методический Центр БМТ ВИЛАР. - 2005. - 137 с], которые сравнительно недороги и экспрессны, характеризуются высокой чувствительностью, специфичностью и воспроизводимостью. Простота таких тестов и возможность их осуществления практически в любых условиях позволяют проводить диагностику заболеваний, как при одиночных, так и при скрининговых исследованиях.
Тест-системы для проведения РЛА представляют собой суспензию полимерных микросфер, на поверхности которых иммобилизованы специфические биолиганды, способные аффинно связываться с детектируемым компонентом объекта исследования. В результате такого взаимодействия образуются пространственные агломераты, видимые невооруженным глазом.
Тест-системы, основанные на РЛА, могут быть реализованы, например, в пробирках, на пластинах, 96-луночных микропланшетах, на фильтрах, а также как различные твердофазные иммуноферментные «сэндвич-тесты», что является их преимуществом. В качестве объектов исследования могут использоваться любые доступные биологические жидкости и объекты, содержащие антитела или антигены (сыворотка крови, слезная жидкость, слюна, моча, цереброспинальная жидкость).
Аналитические характеристики тест-систем в большой мере зависят от способа иммобилизации специфических биолигандов на их поверхности. Иммобилизацию биолигандов на поверхности полимерных микросфер можно осуществлять за счет физической адсорбции или формирования ковалентных связей между реакционноспособными функциональными группами, связанными с поверхностью микросферы, и реакционноспособными группами биолиганда. Но, безотносительно к способу иммобилизации биолиганда, полимерные микросферы по своим физико-химическим свойствам должны удовлетворять определенным жестким требованиям. В частности, средний диаметр микросфер должен составлять 0,2-5,0 мкм и иметь малый коэффициент вариации (1-3%), воспроизводимые от партии к партии. Кроме того, в материале микросфер должны отсутствовать остаточные мономеры, а сами микросферы должны сохранять устойчивость и индивидуальность в буферных системах электролитов, а также стабильность при хранении в течение не менее полугода. В поверхностном слое микросфер не должна наблюдаться неспецифическая адсорбция ПАВ из исследуемой биологической среды.
Физическая адсорбция биолигандов на поверхности полимерных микросфер зависит от температуры, рН [Грицкова И.А., Нусс П.В., Дорохова Е.А., Гусев С.А., Крашенинникова И.Г., Аль-Хаварин Д.И. Адсорбция белков на полистирольных микросферах и постановка реакции латекс-агглютинации // Коллоидный журнал. - 1994. - Т. 56, №4. - С.491-495; Грицкова И.А., Крашенинникова И.Г., Дорохова Е.А., Нусс П.В., Гусев С.А., Аль-Хаварин Д.И. Адсорбция белков на поверхности частиц полистиролметакрилатных суспензий // Коллоидный журнал. - 1994. - Т. 56, №4. - С.487-490], ионной силы среды, а также многих других факторов. Стабильность и чувствительность тест-систем на основе полимерных микросфер с физически адсорбированными биолигандами существенно зависит от концентрации адсорбированных биолигандов, количества активных центров на поверхности частиц и биолигандов и гидрофобности поверхности микросферы. Поэтому присутствие в исследуемой биологической среде поверхностно-активных веществ, способных избирательно сорбироваться на поверхности микросфер и мешать сорбции биолигандов, негативно влияет на чувствительность и специфичность таких тест-систем. Кроме того, в определенных условиях наблюдается десорбция биолиганда, что также снижает чувствительность и ухудшает воспроизводимость результатов анализа.
Более предпочтительны тест-системы на основе ковалентно конъюгированных биолигандов. Образование ковалентных связей между биолигандом и поверхностью полимерной микросферы возможно при наличии в поверхностном слое полимера активных или активируемых функциональных групп, способных химически взаимодействовать с аминными, карбоксильными или сульфгидрильными функциональными группами биолигандов. Непосредственно с ними могут реагировать локализованные на поверхности полимерной микросферы активные функциональные группы, такие как хлорметильные [Margel S., Nov Е., Fisher I. Polychloromethylstyrene microspheres - synthesis and characterization // J. Polymer Sc. - Polymer Chemistry Edition. - 1991. - Vol.29, Iss. 3. - P. 347-355; Okubo M, Ikegami K, Yamamoto Y. Preparation of micron-size monodisperse polymer microspheres having chloromethyl group // Colloid and Polymer Sc. - 1989. - Vol.267. - P. 193-200], альдегидные [Changhong Y, Zhang X, Sun Z, Kitano H., Ise N. Poly(styrene-co-acrolein) latex particles: copolymerization and characteristics // J. Appl. Polymer Sc. - 1990. - Vol.40. - P. 89-98; Margel S. Characterization and chemistry of polyaldehyde microspheres // J. Polymer Sc. - Polymer Chemistry Edition. - 1984. - V.22. - P.3521-3533], эпоксидные [Schlund В., Pith Т., Lambla M. Syntheses et caracteristiques structurelles de latex reactifs // Macromol. Chem. Suppl. - 1985. - No. 10/11. - P. 419-433.] и сульфгидрильные [Rembaum A., Chang M., Richards J., Li M. Synthesis and characterization hydrophilic microspheres // J. Polymer Sc. - Polymer Chemistry Edition. - 1984. - Vol.22. - P. 609-619].
Активируемые группы, такие как карбоксильные, аминные, амидные или гликолевые способны образовывать ковалентные связи с биолигандами только после переведения их в форму подходящих активных производных [US 3857931, МПК G01N 33/543, G01N 33/571, опубл. 31.12.1974; US 4046723, МПК C08G 81/02; G01N 33/545, опубл. 06.09. 1977], гидроксильные [FR 2378094, МПК G01N 33/543, опубл. 18.08.1978; Pichot С. Latex structures et functionalizes // Bull. Soc. Chim. Fr. - 1987. - No. 4. - P. 725-733; US 4045384, МПК A61K 39/44; C08G 81/02; G01N 33/76, опубл. 30.08.1977].
Чувствительность тест-систем на основе полимерных микросфер, ковалентно связанных с биолигандами, зависит от многих факторов, главными из которых являются природа и концентрация функциональных групп на поверхности полимерных микросфер и доступность активных центров (детерминант) биолигандов после их иммобилизации.
Налагаемые требования обусловливают многочисленные технические проблемы, которые следует решить при создании новых тест-систем с улучшенными характеристиками чувствительности, селективности, воспроизводимости и стабильности.
В патенте RU 2164919 (МПК C08F 2/22; C08F 112/08; C08F 118/08; C08F 120/10, заявка опубл. 10.11.1999) раскрыт способ получения монодисперсного синтетического полимерного латекса с карбоксилированной поверхностью частиц путем безэмульгаторной эмульсионной полимеризации винильного мономера в водно-щелочной среде в присутствии карбоксилсодержащего инициатора при нагревании, отличающийся тем, что в качестве винильного мономера используют один или смесь мономеров из ряда стирол, винилацетат, (мет)акрилаты и в исходную реакционную смесь дополнительно вводят соль со способностью создавать буферные растворы в области щелочных значений рН или смесь таких солей при концентрации соли в расчете на водную фазу 0,005-0,150 М. Примерами подтверждена возможность получения микросфер функционализированного латекса с размером 0,52- 2,50 мкм, коэффициентом дисперсности 1,002-1,019 и поверхностной концентрацией карбоксильных групп 1,0-5,7 мг-экв/м2. Активацию карбоксильных групп проводят раствором 1-этил-3-(3-диметиламинопропил) карбодиимида, сенсибилизацию выполняют раствором поликлональных антител к Neisseria meningitidis А при соотношении объемов растворов 1:1. Конечная концентрация латекса в диагностикумах составляет 0,25%.
В патенте RU 2459834 (МПК C08F 2/18; C08F 2/20; C08F 4/04; C08F 4/30; C08F 4/34; C08F 112/08; C08F 118/08; C08F 120/14; C08F 120/18; C08F 136/18, опубл. 27.08.2012) раскрыт способ получения монодисперсных карбоксилированных полимерных микросфер в виде водной суспензии, характеризующийся тем, что раствор в винильном мономере поверхностно-активного вещества - α,ω-бис-(10-карбоксидецил)полидиметилсилоксана, содержащего от 6 до 60 силоксановых звеньев и взятого в количестве 0,5-1,9%, интенсивно перемешивают в бидистиллированной воде в атмосфере инертного газа при нагревании смеси до 50-75°С и объемном соотношении мономер:вода в пределах 1:(2-9), с предварительным добавлением в реакционную массу 0,8-1,3% (от массы мономера) радикальных инициаторов полимеризации - смеси персульфата калия с динитрилом азо-бис-изомасляной кислоты или перекисью бензоила, для образования прямой эмульсии с последующей полимеризацией в течение 2-5 ч под действием инициатора капель мономера в полимерные частицы, при повышении температуры на 10°С за час до окончания процесса. Примеры подтверждают возможность получения микросфер функционализированного латекса с размером 0,13-0,65 мкм, коэффициентом дисперсности 1,009-1,020 и поверхностной концентрацией карбоксильных групп 17,2×10-3-138,1×10-3 мг-экв/м2, суспензия которых устойчива в солевых растворах с концентрацией 0,15-0,25 М. В описании обоих известных технических решений не содержится указаний или предположений о применимости предлагаемых латексов для целей настоящего изобретения.
В патенте RU 2054009 (МПК C08F 112/08; C08F 2/24; C08F 257/02, опубл. 10.02.1996) раскрыт способ получения монодисперсного латекса с частицами типа ядро-оболочка путем эмульсионной полимеризации стирола в водной среде в присутствии радикального инициатора и диспергатора при нагревании, добавления изопрена к полученному полистирольному латексу, выдерживания реакционной системы в присутствии радикального инициатора с последующей полимеризацией изопрена, отличающийся тем, что полимеризацию изопрена ведут в присутствии 2,4-4,8 мас.ч. на 100 мас.ч. полистирола окислительно-восстановительной инициирующей системы при массовом соотношении изопрен: полистирол (0,1-0,5):1 с последующей модификацией при 30-60°C полученного изопрен-стирольного латекса водным раствором серосодержащей аминокислоты при массовом соотношении полимер : аминокислота 1:(0,5-0,15) при рН 10-11. Экспериментально доказана возможность получения модифицированных микросфер с размером 0,05-1,5 мкм, относительной дисперсией 3,2-7,7% и концентрацией аминокислотных остатков на поверхности 60-250 мкмоль/г.
В патенте US 4045384 (МПК C08L 89/00, опубл. 30.08.1977) раскрыт способ сочетания карбоксилированного латекса с белком посредством образования амидной связи, включающий реакцию латекса с водорастворимым карбодиимидом и солюбилизированным в воде N-гидроксипроизводным с образованием активированного сложного эфира латекса, удаление непрореагировавших веществ из активированного сложного эфира латекса и сочетание очищенного активированного сложного эфира латекса с белком.
В предпочтительных вариантах осуществления изобретения латекс выбран из полимеров и сополимеров акриловой, метакриловой кислоты и стирола в виде монодисперсии однородных по размеру частиц, карбодиимид применяют в количестве, эквивалентном содержанию карбоксильных групп в латексе, N-гидроксипроизводным является N-гидроксибензотриазол, в качестве водорастворимого карбодиимида используют п-толуолсульфонат 1-циклогексил-3-(2-морфолиноэтил) карбодиимида, а белок представляет собой хориогонадотропин человека.
В патенте US 3857931 (G01N 31/06; G01N 33/16, опубл. 31.12.1974) заявлен водонерастворимый иммунологический диагностический реагент, имеющий удельный вес, близкий к удельному весу воды, включающий дискретные частицы серологически инертного латексного полимера, выбранного из группы, состоящей из карбоксилированного стиролбутадиена, карбоксилированного полистирола, карбоксилированного полистирола с аминогруппами, полимеров акриловой кислоты, полимеров метакриловой кислоты, сополимера акрилонитрила, бутадиена и стирола, поливинилацетатакрилата, поливинилпиридина и винилхлоридакрилата, с которыми действием водорастворимого карбодиимидного агента сочетания через амидную связь конденсировано приблизительно от 0,01 до 15,0 масс. % известного серологического аналитического агента, выбранного из хориогонадотропина человека или гамма-глобулина человека. В предпочтительных вариантах осуществления размер частиц составляет приблизительно от 0,01 до 0,9 мкм, а серологический аналитический агент является денатурированным гамма-глобулином человека.
В примерах 1-3 раскрыты наборы и методики проведения экспресс- анализов для определения пороговых уровней биоаналита в сыворотке.
Наборы включают два флакона по 1-2 мл, в одном из которых содержится водная суспензия 1,8 мг/мл аналитического реагента, иммобилизованного на носителе, а во втором находится должным образом разведенная антисыворотка. Аналитическим сигналом, наблюдаемым при уровне аналита (хориогонадотропина, альбумина или ревматоидного фактора), равном или превышающем пороговое значение, соответствующее болезненному состоянию, является визуально наблюдаемая агглютинация. Отсутствие агглютинации означает, что содержание аналита находится в пределах физиологической нормы.
Описания изобретений к обоим патентам не содержат прямых указаний на возможность его модификации с целью определения уровней тиреоглобулина или антител к нему, а также не предоставляют раскрытия общих подходов к такой модификации.
В заявке ЕР 0199367 (МПК G01N 33/545; G01N 33/546; G01N 33/76; G01N 33/78, опубл. 29.10.1986) раскрыт реагент для обнаружения реакции «антиген-антитело» латексной агглютинацией, в котором дисперсной фазой является фторсодержащий полимер с показателем преломления до 1,42, содержащий адсорбированный белок.
В предпочтительных вариантах осуществления изобретения белок представлен тиреоглобулином, показателем преломления не превышает 1,38, а фторсодержащий полимер является продуктом сополимеризации тетрафторэтилена с гексафторпропеном или перфторалкилвиниловым эфиром или винилиденфторида с гексафторпропеном или тетрафторэтиленом. Аналитический сигнал (светопоглощение А ~ 0,01-0,1), коррелирующий с концентрацией антител к тиреоглобулину, определяют турбидиметрически, что существенно снижает точность и воспроизводимость метода. Иммобилизация белкового реагента адсорбцией является недостатком, поскольку также ухудшает точность определения.
В международной заявке WO 96/025668 (МПК G01N 33/543; G01N 33/564, опубл. 22.08.1996) раскрыты два варианта способа определения аутоиммунного антитела против тиреоглубулина человека в жидкой пробе. Первый вариант способа включает: (а) объединение указанной пробы с первым реагентом, включающим поликлональные аутоиммунные антитела человека, и вторым реагентом, включающим препарат тиреоглобулина человека, где один из указанных первого и второго реагентов является меченым, а другой из указанных первого и второго реагентов иммобилизован связыванием с твердой фазой, в таких условиях, чтобы аутоиммунное антитело в пробе, если оно присутствует, связывалось с тиреоглобулином препарата, тем самым, снижая степень связывания антител первого реагента с тиреоглобулином препарата; (b) определение количества указанного меченого реагента, иммобилизованного на указанной твердой фазе с помощью указанного иммобилизованного реагента; (с) построение корреляции указанного меченого реагента, иммобилизованного на указанной твердой фазе с помощью указанного иммобилизованного реагента, если наблюдается, в присутствии указанной пробы с количеством указанного меченого реагента, иммобилизованного на указанной твердой фазе с помощью указанного иммобилизованного реагента, в тех же условиях, но в отсутствии указанной пробы, чем достигается определение аутоиммунного антитела к тиреоглобулину в указанной пробе, если оно присутствует.
Второй вариант на стадии (с) предусматривает построение корреляции в присутствии жидкого стандарта, содержащего известное количество указанного препарата тиреоглобулина человека, чем достигается определение аутоиммунного антитела к тиреоглобулину в указанной пробе, если оно присутствует.
Также раскрыт набор для определения аутоиммунных тел к тиреоглобулину человека, который включает первый реагент, включающий поликлональные аутоиммунные антитела человека, и второй реагент, включающий препарат тиреоглобулина человека, где один из указанных первого и второго реагентов является меченым, а другой из указанных первого и второго реагентов иммобилизован связыванием с твердой фазой.
Как следует из примеров, приведенных в описании изобретения, выполнение определения с помощью набора HENNINGtest® anti-Tg, принятого в качестве стандарта качества определения, требует достаточно длительного времени, включая 22 часа на подготовку пробирок с пробами, взятыми у пациентов, 4 часа на инкубирование после добавления в пробирки афинно-очищенньгх аутоиммунных антител к тиреоглобулину человека и 2 часа на инкубирование перед определением радиоактивности образцов.
Способ в соответствии с известным изобретением позволяет на порядок сократить продолжительность определения при незначительно худшей вероятности получения ложноположительных или ложноотрицательных результатов. Однако в примерах, приведенных в описании изобретения, указано, что иммобилизация второго реагента, содержащего тиреоглобулин человека, происходит за счет сорбции на модифицированных стенках пробирок, а метка является радиоактивной меткой, что обусловливает низкую специфичность и высокие пределы обнаружения и определения метода. Необходимость введения и определения радиоактивной метки также является недостатком.
Поэтому существует потребность в разработке усовершенствованных способов определения аутоиммунных антител к тиреоглобулину человека и тест-систем для их осуществления.
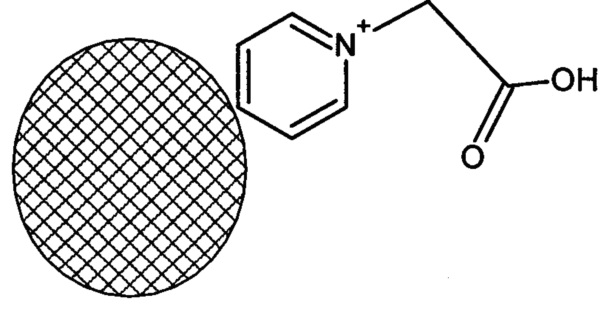
В результате обширных исследований авторы изобретения установили, что недостатки известного уровня техники могут быть в существенной мере преодолены созданием тест-системы для экспрессного определения аутоиммунных антител к тиреоглобулину человека на основе полимерных микросфер со средним размером от 1,0 до 5,0 мкм с молекулами тиреоглобулина, ковалентно конъюгированными вблизи поверхности микросфер, указанная тест-система содержит фосфатный буфер и суспензионную композицию полимерных микросфер из поли(2-метил-5-винилпиридина), у которых к карбоксиметильным группам, связанным с поверхностью микросфер через атом азота пиридина(-N+Н-СН2-COOH):
,
ковалентно присоединены молекулы тиреоглобулина:
.
Для целей настоящего изобретения природа полимера, образующего микросферы, имеет принципиальное значения и должна обеспечивать возможность введения на поверхность карбоксильных групп, способных к активации под действием активирующих агентов из класса карбодиимидов. Примером подходящего для этого полимера является 2-метил-5-винилпиридин. Примерами подходящих карбодиимидов являются 1-циклогексил-3-(2-морфолиноэтил)карбодиимида 4-толуолсульфонат и (N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид.
Тест-система может быть получена в соответствии соспособом получения, включающим следующие стадии:
а) на поверхность микросфер вводят карбоксиметильные группы посредством их обработки раствором калиевой или натриевой соли галогенуксусной кислоты, в присутствии карбоната натрия или калия, с последующей обработкой раствором кислоты.
б) свободные карбоксильные группы, связанные с поверхностью полимерных микросфер:
,
активируют водорастворимым карбодиимидом с получением модифицированных полимерных микросфер:
в) тиреоглобулин иммобилизуют на модифицированных полимерных микросферах с образованием ковалентного конъюгата:
г) полученный конъюгат выделяют из реакционной массы, очищают и объединяют с фосфатным буфером. Далее изобретение обеспечивает набор для определения уровней аутоантител к тиреоглобулину, в состав которого входят:
- планшет 96-луночный полистирольный;
- тест-система;
- буферный раствор;
- отрицательная контрольная сыворотка;
- положительная контрольная сыворотка;
- инструкция по применению;
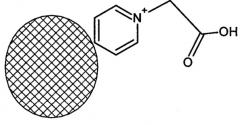
- упаковка, обеспечивающую его идентификацию и способствующую его сохранности в течение срока годности, при этом входящая в набор тест-система представляет тест-систему для экспрессного определения аутоиммунных антител к тиреоглобулину человека на основе полимерных микросфер со средним размером от 1,0 до 5,0 мкм с молекулами тиреоглобулина, ковалентно конъюгированными вблизи поверхности микросфер, которая является содержащей фосфатный буфер суспензионной композицией полимерных микросфер из поли(2-метил-5-винилпиридина), у которых карбоксиметильным группам, связанным с поверхностью микросфер через атом пиридина азота:
,
ковалентно присоединены молекулы тиреоглобулина:
.
Техническим результатом изобретения является расширение арсенала средств аналогичного назначения сокращение времени определения приблизительно в 2 раза без ухудшения качества определения в интервале содержаний аутоиммунных антител к тиреоглобулину от 10 до 2000 МЕ/мл.
Возможность достижения технических результатов изобретения будет подтверждена примерами его предпочтительных осуществлений.
Примеры 1-9. Иммобилизация тиреоглобулина человека на микросферах.
Пример 1. Приготовление поли(2-метил-5-винилпиридина) и микросфер на его основе:
В раствор 0,4 г поливинилового спирта (ММ 40 кДа) в 40 мл дистиллированной воды добавляют 0,096 г персульфата калия и растворяют при перемешивании на магнитной мешалке. Полученный раствор фильтруют и переносят в реактор, снабженный термостатируемой рубашкой и верхнеприводной мешалкой. В реактор добавляют 10 мл мономера 2-метил-5-винилпиридина и перемешивают в течение 30 минут. Затем включают нагрев до 67°С и проводят полимеризацию в течение 24 часов. Получают продукт с среднечисловой молекулярной массой 65 кДа. Полученный полимер отделяют фильтрованием, растворяют в хлористом метилене и готовят 18% раствор, который порциями смешивают с 10 объемами диэтилового эфира. Выпавший осадок полимера отфильтровывают, промывают эфиром, высушивают и используют для приготовления микросфер.
Раствор поли(2-метил-5-винилпиридина) в 5,0 мл хлористого метилена порциями при постоянном перемешивании (6500 об/мин) вводят в раствор поливинилового спирта с молекулярной массой 40 кДа в 250 мл дистиллированной воды. Дальнейшую обработку полученной эмульсии проводят на ультразвуковом диспергаторе в течение 10 минут. Затем эмульсию перемешивают в течение 15 часов при комнатной температуре на магнитной мешалке (200 об/мин) до получения суспензии микросфер.
Полученную суспензию концентрируют центрифугированием при 15000 об/мин в течение 10 минут, затем смешивают с дистиллированной водой и выдерживают при перемешивании (200 об/мин) в течение 1 часа.
Процесс центрифугирования полученной суспензии полимерных микросфер осуществляют при 15000 об/мин в течение 10 минут.
Пример 2. Приготовление полимерных микросфер осуществляют, как описано в примере 2, при условиях проведения процесса согласно таблице 1.
Пример 3. Введение карбоксиметильных групп на поверхность микросфер (вариант 7):
К раствору 1,38 г (0,1 моль) карбоната калия в 2,5 мл дистиллированной воды при перемешивании прибавляют предварительно охлажденный раствор 1,89 г (0,2 моль) хлоруксусной кислоты в 2,0 мл дистиллированной воды.
К 5 мл полимерной суспензии с концентрация 0,56% масс/об. (вариант 6) добавляют 0,048 мл полученного раствора и перемешивают с помощью шейкера в течение 24 ч при комнатной температуре. Затем смесь нагревают до 70°C в течение 4 часов, охлаждают до 15-20°C, разбавляют дистиллированной водой, суспензию центрифугируют, фугат промывают избытком воды, полимерные микросферы отделяют центрифугированием и подвергают лиофильной сушке.
Пример 4. Введение карбоксиметильных групп на поверхность микросфер (вариант 8):
К раствору 1,38 г (0,1 моль) карбоната калия в 2,5 мл дистиллированной воды при перемешивании прибавляют предварительно охлажденный раствор 1,89 г (0,2 моль) хлоруксусной кислоты в 2,0 мл дистиллированной воды.
К 5 мл полимерной суспензии с концентрация 0,94% масс/об. (вариант 5) добавляют 0,08 мл полученного раствора и перемешивают с помощью шейкера в течение 48 ч при комнатной температуре. Затем смесь нагревают до 70°C в течение 4 часов, охлаждают до 15-20°C, разбавляют дистиллированной водой, суспензию центрифугируют, фугат промывают избытком воды, полимерные микросферы отделяют центрифугированием и подвергают лиофильной сушке.
Пример 5. Введение карбоксиметильных групп на поверхность микросфер (вариант 9):
К раствору 1,38 г (0,1 моль) карбоната калия в 2,5 мл дистиллированной воды при перемешивании прибавляют предварительно охлажденный раствор 1,89 г (0,2 моль) хлоруксусной кислоты в 2,0 мл дистиллированной воды.
К 5 мл полимерной суспензии с концентрация 0,18% масс/об. (вариант 2) добавляют 0,046 мл полученного раствора карбоната калия и перемешивают с помощью шейкера в течение 24 ч при комнатной температуре. Затем смесь нагревают до 70°C в течение 4 часов, охлаждают до 15-20°C, разбавляют дистиллированной водой, суспензию центрифугируют, фугат промывают избытком воды, полимерные микросферы отделяют центрифугированием и сушат под вакуумом.
Пример 6. Введение карбоксиметильных групп на поверхность микросфер (вариант 10):
К раствору 1,38 г (0,1 моль) карбоната калия в 2,5 мл дистиллированной воды при перемешивании прибавляют предварительно охлажденный раствор 1,89 г (0,2 моль) хлоруксусной кислоты в 2,0 мл дистиллированной воды.
К 5 мл полимерной суспензии с концентрация 0,47% масс/об. (вариант 3) добавляют 0,12 мл полученного раствора и перемешивают с помощью шейкера в течение 48 ч при комнатной температуре. Затем смесь нагревают до 70°C в течение 4 часов, охлаждают до 15-20°C, разбавляют дистиллированной водой, суспензию центрифугируют, фугат промывают избытком воды, полимерные микросферы отделяют центрифугированием и подвергают лиофильной сушке.
Пример 7. Методика определения содержания карбоксиметильных групп на поверхности микросфер:
К 4 мл 0,1 М раствора гидроксида натрия добавляют 0,05 г полимерных микросфер и выдерживают в течение 14 часов. Смесь фильтруют. Полученный фильтрат оттитровывают 0,1 Н раствором серной кислоты.
Количество карбоксильных групп на 1 г полимерных микросфер рассчитывают по формуле:
;
V0 - объем титранта, израсходованный на титрование контрольного опыта, мл;
V1 - объем гидроксида натрия, добавленный к полимерным микро;
V2 - объем титранта, израсходованный на титрование анализируемого раствора, мл;
CNaOH - концентрация раствора щелочи, моль/мл;
NА - число Авогадро, моль-1;
m - масса полимерных микросфер, г.
Пример 8. Методика иммобилизации тиреоглобулина:
Карбоксильные группы полимерных микросфер активируют с помощью (N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлорида (КДИ), для чего суспензию микросфер, полученных по примеру 8 в фосфатном буферном растворе, центрифугируют 15 мин при 8000 об/мин, отделяют надосадочную жидкость, а фугат смешивают с фосфатно-солевым буферным раствором (рН 7,2-7,4) с получением полимерной суспензии с концентрации 0,5% масс/об.
Затем 1 мл полученной суспензии смешивают с 1 мл раствора карбодиимида (КДИ) с концентрацией 0,1 масс. %, полученную смесь выдерживают в течение 30 мин при комнатной температуре, трижды промывают фосфатным буферным раствором с последующим центрифугированием для удаления непрореагировавшего КДИ.
Полученную активированную суспензию смешивают с равным объемом раствора тиреоглобулина с концентрацией 0,005% масс/об. После инкубации в течение времени tи, равного 3-6 часам, при температуре +37°C несвязанный биолиганд удаляют трехкратным центрифугированием. Концентрацию суспензии устанавливают равной 0,3% масс/об. добавлением фосфатного буфера.
Эффективность иммобилизации составляет 8-13% по данным определения содержания тиреогобулина в объединенных промывных водах методом Лоури.
Получают тест-системы со следующими характеристиками (табл. 2)
Аликвоты полученной тест-системы помещают в герметично укупориваемые флаконы вместимостью 10 мл и хранят в холодильнике при температуре 2-4°C, защитив от воздействия света.
Пример 9. Оценка чувствительности тест-системы обнаружения аутоиммунных антител к тиреоглобулину человека:
В 96-луночном планшете готовят разведения сывороток с отрицательным и положительным контролями, для чего в лунку А1 вносят 50 мкл сыворотки с отрицательным контролем (ОК), в лунку А2 вносят 50 мкл сыворотки с положительным контролем (ПК). Концентрация аутоантител к тиреоглобулину щитовидной железы в ПК составляет 640 МЕ/мл. Затем в оставшиеся свободные лунки рядов 1 и 2 вносят по 25 мкм фосфатного буферного раствора и затем готовят серии последовательных 2-х-кратных разведений от 1:20 до 1:1280 контрольных сывороток.
При положительной РЛА на дне лунки формируется агглютинат в виде перевернутого зонтика, при отрицательной - точечный преципитат. Показано, что чувствительность тест-системы соответствует 10 МЕ/мл.
1. Тест-система для экспрессного определения аутоиммунных антител к тиреоглобулину человека на основе полимерных микросфер со средним размером от 1,0 до 5,0 мкм с молекулами тиреоглобулина, ковалентно конъюгированными вблизи поверхности микросфер, характеризующаяся тем, что она содержит фосфатный буфер и суспензионную композицию полимерных микросфер из поли(2-метил-5-винилпиридина), у которых к карбоксиметильным группам, связанным с поверхностью микросфер через атом азота пиридина, ковалентно присоединены молекулы тиреоглобулина.
2. Способ получения тест-системы для экспрессного определения аутоиммунных антител к тиреоглобулину человека на основе полимерных микросфер по п. 1, характеризующийся тем, что включает стадии:
а) на поверхность микросфер из поли(2-метил-5-винилпиридина) вводят карбоксиметильные группы посредством их обработки раствором калиевой или натриевой соли галогенуксусной кислоты, с последующей обработкой раствором кислоты;
б) свободные карбоксильние группы карбоксиметильных групп активируют водорастворимым карбодиимидом с получением модифицированных полимерных микросфер;
в) тиреоглобулин иммобилизуют на модифицированных полимерных микросферах с образованием ковалентного конъюгата;
г) полученный конъюгат выделяют из реакционной массы, очищают и объединяют с фосфатным буфером.
3. Набор для определения уровней аутоантител к тиреоглобулину, содержащий тест-систему по п. 1 и характеризующийся тем, что он дополнительно содержит планшет 96-луночный полистирольный, буферный раствор, отрицательную и положительную контрольные сыворотки.