Способ определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров
Иллюстрации
Показать всеИзобретение относится к аналитической химии органических веществ и раскрывает способ определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров. Способ включает приготовление растворов нитроксильных радикалов в растворителе с заданной концентрацией, регистрацию пиков по току вольтамперометрической кривой при потенциалах Еа равный от минус 630 до минус 640 мВ и Ес равный от 700 до 710 мВ относительно серебряного электрода сравнения, построение на основании полученных данных калибровочной зависимости в координатах: по оси ординат - концентрация (млн-1), по оси абсцисс - сумма токов (нА), и определение содержания нитроксильных радикалов в исследуемом образце путем регистрации пиков и расчета содержания по графику калибровочной зависимости. Изобретение позволяет создавать соответствующие средства контроля в различных производственных процессах, связанных с использованием нитроксильных радикалов в сырьевых нефтехимических потоках, главным образом непредельных мономеров - изопрена, дивинила, стирола, циклопентадиена, дициклопентадиена, альфа-олефинов. 10 пр., 1 табл.
Реферат
Изобретение относится к аналитической химии органических веществ и может быть использовано при создании соответствующих средств контроля в различных производственных процессах, связанных с использованием нитроксильных радикалов в сырьевых нефтехимических потоках, главным образом непредельных мономеров - изопрена, дивинила, стирола, циклопентадиена, дициклопентадиена, альфа-олефинов.
Способ определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров вольтамперометрическим методом является разновидностью электрохимического анализа количественного и качественного содержания органических веществ.
Известно, что нитроксильные радикалы - это стабильные органические радикалы с общей формулой , где неспаренный электрон делокализован между атомами кислорода и азота, при этом последний соседствует с тетра-замещенными атомами углерода (2,2,6,6-тетраметил)-пиперидинового углеводородного скелета. Подобные стабильные нитроксильные радикалы нашли достаточно широкое применение в различных областях науки и техники, например, используются в качестве спиновых меток и молекулярных зондов для изучения структуры и молекулярной подвижности различных физико-химических и биологических систем. Уникальные окислительно-восстановительные свойства нитроксильных групп позволяют использовать их в качестве окислителей в органическом синтезе. Способность нитроксильных радикалов взаимодействовать с активными свободными радикалами с образованием эфиров гидроксиламинов приводит к обрыву радикальных цепных процессов, что позволяет использовать их в качестве надежных ингибиторов полимеризации и термоокислительной деструкции органических полимеров.
Определение качественного и количественного содержания нитроксильных радикалов играет важную роль в производстве, очистке, транспортировке и хранении непредельных соединений, где последние нашли применение в качестве компонентов эффективных ингибиторов термополимеризации.
Таким образом, разработка нового способа определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров является весьма актуальной задачей на дату представления настоящей заявки не только в РФ, но и в мире. Актуальность разработанного заявителем способа заключается прежде всего в том, что заявленное техническое решение обеспечивает возможность повысить как точность, так и скорость проведения указанного анализа, от указанных факторов в конечном счете зависит качество получаемой товарной продукции, например, качество выпускаемого на рынок изопрена, дивинила, стирола, циклопентадиена, дициклопентадиена, альфа-олефинов.
Из исследованного заявителем уровня техники выявлено техническое решение «Способ определения нитроксильных радикалов методом электронного парамагнитного резонанса (ЭПР)».
Известный метод ЭПР основан на взаимодействии нитроксилов с магнитным полем и применяется для исследования парамагнитных частиц, имеющих магнитные моменты, создаваемые неспаренными электронами (Тихонов А.Н. Спиновые метки // Соросовский образовательный журнал. - 1998. - №1. - С. 8-15).
Данный метод так же, как и масс-спектрометрический, или метод ядерно-магнитного резонанса (ЯМР), требует наличия достаточно сложного и дорогостоящего приборного оснащения, что затрудняет применение указанного метода в промышленном производстве.
Из исследованного уровня техники заявителем выявлено изобретение «Способ определения концентрации нитроксильной группы в растворе» по пат. РФ №2308717, сущностью является способ определения концентрации нитроксильной группы в растворе путем обработки пробы в органическом растворителе раствором йодида калия или натрия и концентрированной уксусной кислотой, последующего титрования выделившегося йода раствором тиосульфата натрия и вычисления массовой доли нитроксильной группы в соответствии с принципом эквивалентности с учетом объема титранта, израсходованного на титрование в контрольном опыте на реактивы, отличающийся тем, что пробу в органическом растворителе объемом не более 10 см3, выбранном из класса алканов, циклоалканов, ароматических углеводородов, насыщенных алифатических спиртов или хлорпроизводных алканов, обрабатывают водным раствором йодида калия или натрия с молярной концентрацией 2 моль/дм3 и концентрированной уксусной кислотой при мольном соотношении нитроксильная группа: йодид калия или натрия: концентрированная уксусная кислота, равном (0,02-0,10):1:(40-45), при этом за молярную концентрацию эквивалента нитроксильной группы принимают среднее арифметическое минимального и максимального значений молярной концентрации эквивалента нитроксильной группы в предполагаемом диапазоне концентраций.
Известный способ нашел практическое применение в промышленности, а именно в лабораториях, осуществляющих аналитический контроль технологических производственных процессов, связанных с применением нитроксильной группы.
Одним из существенных недостатков данного способа является невозможность определять количества меньше 0,02 мас.%, в силу чего не представляется возможным получать полимеры надлежащего качества.
Кроме указанного, известный способ предполагает проведение титрования с предварительной подготовкой титранта и образца с выдержкой растворов не менее 30 мин при перемешивании в темноте перед анализом, что создает весьма серьезные затруднения для обеспечения контроля в режиме реального времени над технологическим процессом промышленного производства широкого спектра полимеров. Указанные недостатки существенно ограничивают возможности по контролю качества продукции.
Из исследованного уровня техники выявлено изобретение, выбранное заявителем в качестве прототипа, т.к. оно совпадает с заявленным техническим решением по совокупности признаков и назначению, а именно - способ количественного определения стабильных нитроксильных радикалов. Сущностью известного способа является амперометрический способ количественного определения стабильных нитроксильных радикалов путем титрования окислителем в кислой среде, отличающийся тем, что, с целью увеличения чувствительности и селективности определения, титрование проводят с использованием двух индикаторных электродов при разности потенциалов между этими электродами не менее 0,01 В и содержание радикала определяют по току образующейся в ходе титрования редокс-пары радикал - аммоний - катион. Время определения составляет 10-15 мин (авторское свидетельство СССР №1374118, опубл. 15.02.1988).
К недостаткам прототипа следует отнести:
- необходимость проведения процедуры титрования, подразумевающую подготовку титранта в виде разбавленных растворов окислителя с точной концентрацией;
- необходимость постоянного контроля титра;
- необходимость периодической очистки электродов, загрязняющихся продуктами разложения раствора титранта;
- недостаточно высокая чувствительность по определяемому веществу;
- высокий временной интервал проведения анализа, составляющий 10-15 мин, в силу чего возможен выход некачественной продукции;
- использование в качестве индикаторного электрода (катода) ртутного электрода, который, как известно, является токсичным.
Задачей заявленного технического решения является создание способа определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров, пригодного для производственных лабораторий промышленных предприятий, который (способ) устраняет недостатки прототипа, а именно:
- исключение необходимости проведения процедуры титрования;
- повышение чувствительности по определяемому веществу;
- снижение временного интервала проведения анализа до 5-7 мин;
- исключение необходимости использования токсичного ртутного электрода при выполнении анализа.
В результате реализации указанных целей в совокупности заявленное техническое решение обеспечивает возможность получения в конечном счете продукции более высокого качества.
Сущностью заявленного технического решения является способ определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров, включающий приготовление растворов нитроксильных радикалов в растворителе с заданной концентрацией, регистрацию пиков по току вольтамперометрической кривой при потенциалах Еа равном от минус 630 до минус 640 мВ и Ес равном от 700 до 710 мВ относительно серебряного электрода стравнения, построение на основании полученных данных калибровочной зависимости в координатах: по оси ординат - концентрация (млн-1), по оси абсцисс - сумма токов (нА), и определение содержания нитроксильных радикалов в исследуемом образце путем регистрации пиков и расчета содержания по графику калибровочной зависимости, при этом способ характеризуется тем, что растворы нитроксильного радикала готовят в диапазоне концентраций от 1 до 1000 млн-1, измерения проводят в органических растворителях в присутствии фоновых электролитов и при продувке инертным газом, в качестве фоновых электролитов используют перхлораты лития или натрия, тетраметиламмоний хлорид, тетрабутиламмоний бромид, в качестве инертных газов используют азот и/или аргон с чистотой не менее 99 мас.%, в качестве органических растворителей используют ацетонитрил, диметилформамид, ацетон и их смеси, в качестве исследуемого образца, в котором ведется определение содержания нитроксильных радикалов, выбирают изопрен, дивинил, стирол, циклопентадиен, дициклопентадиен, альфа-олефины.
Техническим результатом, реализуемым заявленным техническим решением, является создание нового, более эффективного способа определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров, таких как изопрен, дивинил, дициклопентадиен, стирол, альфа-олефины, обеспечивающего определение содержания нитроксильных радикалов, в структуре которых имеется фрагмент (I), представленный далее по тексту, в диапазоне концентраций от 1,0 до 1000 млн-1, с применением метода вольтамперометрии и с использованием в качестве рабочего электрода - платинового, в качестве электрода сравнения - серебряного, при этом заявленный способ характеризуется тем, что время выполнения анализа одной пробы не превышает 5-7 мин.
Далее заявителем приведена общая формула (I) структурного фрагмента определяемых по предлагаемому способу нитроксильных радикалов:
,
где X=СН2, CH-NH2, CH-NHC(O)Me, СН-ОН, С=O.
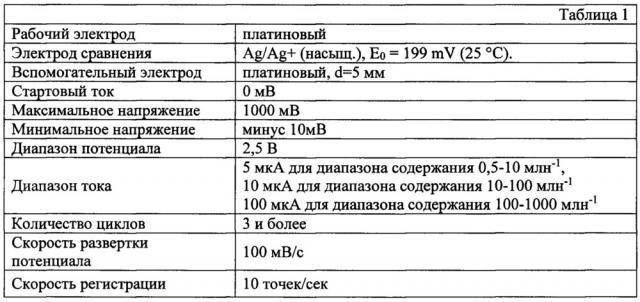
Поставленная задача и указанный(е) технический(е) результат(ы) в заявленном способе определения содержания нитроксильных радикалов в сырьевых потоках непредельных мономеров соответственно решается и достигается тем, что проводят циклическое вольтамперометрическое определение радикалов при следующих условиях:
При этом проводят регистрацию пиков величины тока, полученных при последовательном наложении на электрод, находящегося в исследуемом образце, развертки потенциала с постоянной скоростью с последующим реверсом потенциала до начального значения.
Для этого готовят образцы с различным содержанием нитроксильных радикалов в растворителе, регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еа равном от минус 630 до минус 640 мВ и Ес равном от 700 до 710 мВ.
На основании полученных данных строят график калибровочной зависимости в координатах: по оси ординат - концентрация (млн-1), по оси абсцисс - сумма токов Σ Ia и Iс (нА), с использованием программного обеспечения прибора или графически.
Определение содержания нитроксильных радикалов в исследуемом образце осуществляют путем регистрации пика и расчета содержания по графику калибровочной зависимости.
Измерения проводят в органических растворителях в присутствии фоновых электролитов и при продувке инертным газом.
В качестве мономерного сырья, в котором ведется определение содержания нитроксильных радикалов, выбирают: изопрен, дивинил, стирол, циклопентадиен, дициклопентадиен, альфа-олефины.
В качестве органических растворителей используют: ацетонитрил, диметилформамид, ацетон и их смеси в различных соотношениях.
В качестве фоновых электролитов используют: перхлораты лития или натрия, тетраметиламмоний хлорид, тетрабутиламмоний бромид.
В качестве инертных газов используют: азот и/или аргон с чистотой не менее 99 мас.%.
В качестве измерительного прибора используют потенциостаты Elins «P-8S», Elins «Р-20Х» фирмы ООО «Элине», Российская Федерация или аналогичный.
В качестве электродов используют: платиновый дисковый электрод, в частности электроды фирм ALC Со Ltd, Япония, Bioanalytical Systems, Inc., США, или аналогичные.
Время проведения измерений составляет от 5 до 7 мин.
Способ определения нитроксильных радикалов вольтамперометрическим методом поясняется и демонстрируется представленными ниже примерами.
Пример 1
Для приготовления фонового электролита - 0,1 М NaClO4 в ацетонитриле - взвешивают 3,0610 г перхлората натрия с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М NaClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еа равном от минус 630 до минус 640 мВ и Ес равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора изопрена, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 2
Для приготовления фонового электролита - 0,1 М NaClO4 в ацетонитриле - взвешивают 3,0610 г перхлората натрия с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М NaClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еа равном от минус 630 до минус 640 мВ и Ес равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора дивинила, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 3
Для приготовления фонового электролита - 0,1 М NaClO4 в ацетонитриле - взвешивают 3,0610 г перхлората натрия с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еа равном от минус 630 до минус 640 мВ и Ес равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Iс с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора стирола или альфаолефиновых мономеров продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 4
Для приготовления фонового электролита - 0,1 М LiClO4 в ацетонитриле - взвешивают 2,6693 г перхлората лития с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М LiClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc, равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Ia и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого образца стирола или альфаолефиновых мономеров, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 5
Для приготовления фонового электролита - 0,1 М Bu4NBr в ацетонитриле - взвешивают 8,0886 г тетрабутиламмоний бромида с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М Bu4NBr. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Ia и Iс с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора изопрена, продувают ячейку азотом 15 минут и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 6
Для приготовления фонового электролита - 0,1 М NaClO4 в диметилформамиде - взвешивают 3,0610 г перхлората натрия с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г диметилформамидом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3 доводят массу раствора до 100 г диметилформамидом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М NaClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого образца циклопентадиена, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 7
Для приготовления фонового электролита - 0,1 М LiClO4 в ацетонитриле - взвешивают 2,6693 г перхлората лития с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М LiClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора дивинила, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 8
Для приготовления фонового электролита - Me4NCl в ацетонитриле - взвешивают 2,7499 г тетраметиламмоний хлорида с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают.Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М Me4NCl. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Ic с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора дивинила, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 9
Для приготовления фонового электролита - 0,1 М LiClO4 в ацетонитриле - взвешивают 2,6693 г перхлората лития с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М LiClO4. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ Iа и Iс с помощью специального ПО или графически.
Для определения содержания нитроксильных радикалов в электролитическую ячейку помещают 10 мл фонового электролита и 3 мл исследуемого раствора дициклопендадиена, продувают ячейку азотом 15 мин и проводят измерение в соответствии с описанной ранее процедурой. При необходимости увеличения или уменьшения концентрации определяемых нитроксильных радикалов масса изначальной навески может быть изменена в сторону увеличения или уменьшения. Измерения повторяют не менее двух раз. Определяют содержание нитроксильных радикалов в исследуемом растворе по построенной калибровочной зависимости с учетом разбавления (концентрирования). Сравнивают результаты двух параллельных определений. Расхождение в 5% (отн.) и более считается недопустимым, и определения повторяют. Определяют среднее значение содержания нитроксильных радикалов (млн-1) для 2 параллельных определений.
Пример 10
Для приготовления фонового электролита - 0,1 М Me4NCl в ацетонитриле - взвешивают 2,7499 г тетраметиламмоний хлорида с точностью до 0,0001 г, количественно переносят в мерную колбу на 0,5 дм3, доводят массу раствора до 500 г ацетонитрилом и тщательно перемешивают. Для приготовления анализируемого раствора взвешивают 0,1 г анализируемого нитроксильного радикала с точностью до 0,0001 г количественно переносят в мерную колбу на 0,1 дм3, доводят массу раствора до 100 г ацетонитрилом и тщательно перемешивают. Готовят растворы с концентрацией нитроксильного радикала от 1 до 1000 млн-1 путем разбавления ранее полученного раствора.
Заявленный способ реализуется следующим образом: в стакан с индикаторным электродом вводят 10 мл фонового электролита. Затем приливают 3 мл анализируемого раствора. В стакан для электрода сравнения заливают 10-15 мл водного раствора 0,1 М Me4NCl. Продувают пробу в течение 15 мин азотом или подсоединяют к ячейке устройство для постоянной продувки. Запускают эксперимент. Регистрируют пики по току на вольтамперной кривой Imax и Imin при потенциалах Еa равном от минус 630 до минус 640 мВ и Еc равном от 700 до 710 мВ. Сливают анализируемый раствор. После тщательной очистки электрохимической ячейки повторяют эксперимент для всех приготовленных растворов с разной концентрацией нитроксильного радикала. Строят график калибровочной зависимости в координатах концентрация (млн-1) - Σ I